莲草直胸跳甲热激蛋白90基因的分子特征、表达模式及对温度胁迫的响应
2023-05-30梁晓翠武强靳继苏裴怡铭郭建英万方浩
梁晓翠 武强 靳继苏 裴怡铭 郭建英 万方浩


摘要 莲草直胸跳甲Agasicleshygrophila是世界性入侵杂草空心莲子草Alternanthera philoxeroides的专食性天敌,冬季低温和夏季高温会影响其种群数量从而降低防控效果。为进一步探讨莲草直胸跳甲对温度胁迫适应性的分子生态机制,本研究对其热激蛋白90(AhHSP90)进行了蛋白结构、磷酸化修饰及系统发育等生物信息学分析,并采用荧光定量PCR检测了AhHSP90基因的时空表达动态及不同温度胁迫后的表达。RT-qPCR结果显示,AhHSP90在莲草直胸跳甲整个生活史及雌成虫各组织中均有表达;高温(30、35和40℃)、低温(-5、0、5、10、15和20℃)胁迫2 h后,AhHSP90在高温40℃下表达显著升高,但在其他温度下无显著差异。根据对AhHSP90分子特征、表达模式以及对温度胁迫的响应等方面的综合分析,推测其可能在莲草直胸跳甲发育及抵抗高温过程中发挥着重要的作用。
关键词 莲草直胸跳甲; 空心莲子草; 热激蛋白90; 表达模式; 温度胁迫
中图分类号: S 476.9
文献标识码: A
DOI: 10.16688/j.zwbh.2021674
Abstract Agasicles hygrophila is the natural enemy of Alternanthera philoxeroides, a worldwide invasive weed. Low temperature in winter and high temperature in summer can affect the population number of A. hygrophila, thus reducing its control effect. In order to further explore the molecular mechanism of temperature stress resistance in A. hygrophila, the structure, phosphorylation and phylogeny of heat shock protein 90 (AhHSP90) were analyzed by bioinformation methods, and RT-qPCR was performed to detect the temporal and spatial expression dynamics of AhHSP90 and the expression of AhHSP90 after exposure to different temperatures for 2 h. RT-qPCR results showed that AhHSP90 was expressed with different levels in the whole life cycle of A.hygrophila and tissues-specific in the female adult of A.hygrophila. Analysis of temperature stress response showed that the expression of AhHSP90 could be induced by high and low temperatures. The relative expression level of AhHSP90 was significantly upregulated after exposure to 40℃ for 2 h in A.hygrophila, however, no significant difference was observed at other temperatures. According to the comprehensive analysis, it is deduced that AhHSP90 may play an important role in the development and resistance to high temperature of A.hygrophila.
Key words Agasicles hygrophila; Alternanthera philoxeroides; heat shock protein 90; expression pattern; temperature stress
空心蓮子草Alternanthera philoxeroides是一种适应性很强的水生型入侵杂草,原产于南美洲[1],20世纪30年代传入我国,对我国农林牧渔业造成巨大的威胁[2-4],2003年被列为中国首批需要特别防治的入侵物种[5]。莲草直胸跳甲Agasicles hygrophila属鞘翅目叶甲科,是空心莲子草的专食性天敌昆虫,其幼虫和成虫取食空心莲子草的叶片和嫩茎,老熟幼虫钻入茎秆内化蛹,自1986年引入我国后,对空心莲子草起到了明显的控制效果[1]。昆虫是变温动物,温度对其生长发育、种群数量及地理分布都会产生很大的影响,研究昆虫对高温和低温胁迫的应对,有利于分析其地理分布和对环境的适应力[6],尤其在利用引进的生防天敌控制入侵生物过程中发挥重要的作用,因此,研究莲草直胸跳甲对温度胁迫的响应机制对科学防控空心莲子草具有重要意义。
热激蛋白(heat shock proteins,HSPs)是一种抗逆蛋白,在细胞受到胁迫时表达量会增加,对细胞起到一种保护作用,帮助生物机体适应不利环境条件[7-8]。热激蛋白按分子量大小分为HSP90、HSP70、HSP60、HSP40和小分子热激蛋白[9-10]。HSP90最初是在果蝇 Drosophila中发现的,因其体内只有一个分子量为83 kD的HSP90家族蛋白,故又称HSP83家族[11]。目前热激蛋白的相关研究已在鞘翅目、鳞翅目、双翅目昆虫及线虫等多个物种中开展。例如,对沙棘木蠹蛾Eogystia hippophaecola进行-10、-5、0、5℃低温处理2 h后,其EhHSP90的表达水平相较于25℃对照有显著上升[12];同样地,草地贪夜蛾Spodoptera frugiperda雌雄成虫在36℃高温和4℃低温胁迫下SfHSP90表达量均显著提高[13]。
莲草直胸跳甲种群对温度适应力较弱,冬季低温影响其越冬使得种群数量在春季较低[14],夏季高温会使种群数量骤减[15-17],造成空心莲子草的暴发,降低对空心莲子草的防控效果。前期已有研究表明将莲草直胸跳甲成虫在32.5~42.5℃下处理1 h后,AhHSP70均被显著诱导表达,但其在37.5℃下相对表达量是最高的,超过40℃后其表达受到抑制,这说明AhHSP70对生物体的保护有一定范围[18];另外,对AhHSP90在莲草直胸跳甲卵中高温诱导表达的研究显示,其表达先缓慢升高,至37.5℃时急剧上升,之后开始下降,表明其在卵的高温耐受性中发挥一定作用[19],而AhHSP90在莲草直胸跳甲成虫应对温度胁迫中的作用有待进一步研究。
本研究利用生物信息学、RT-qPCR对AhHSP90蛋白的序列和结构特征进行了分析,检测了AhHSP90基因在莲草直胸跳甲不同发育时期、雌成虫不同组织及不同温度胁迫下的表达模式,初步探讨了AhHSP90在莲草直胸跳甲成虫应对温度胁迫中的作用,为阐明莲草直胸跳甲的温度适应性分子机制及对空心莲子草科学防控提供一定的理论依据。
1 材料与方法
1.1 材料
供试植物:空心莲子草根茎于2018年6月采集于福建省农业科学院植物保护研究所南通中试基地,携带至河北省廊坊市中国农业科学院植物保护研究所廊坊科研中试基地温室,栽培温度为(25±3)℃,采用扦插方式栽种于装有营养土(黑土∶蛭石=1∶1)的塑料盒(30 cm×30 cm×30 cm)中,并不断扩大种植规模用于试验, 待空心莲子草茎秆长至4~7节即可用于试验。
供试昆虫:莲草直胸跳甲成虫于2018年10月采自湖南省农业科学院附近,携带至中国农业科学院植物保护研究所廊坊科研中试基地进行室内饲养,饲养温度为(25±1)℃,相对湿度为(75±5)%,光周期为L∥D=12 h∥12 h,连续饲养3代以建立供试种群。
1.2 主要试剂
快速RNA小量提取试剂盒、快速RNA微量提取试剂盒,购自北京天漠科技开发有限公司;cDNA第一链合成试剂盒HifairⅢ 1st Stand cDNA Synthesis SuperMix for qPCR(gDNA digester plus),实时荧光定量PCR试剂盒Hieff qPCR SYBR Green Master Mix(Low Rox),均购自上海翊圣生物科技有限公司;TransStart Taq DNA Polymerase、10×TransStart Taq Buffer、dNTPs,均购自北京全式金生物技术有限公司;引物合成由生工生物工程(上海)股份有限公司完成。
1.3 试验方法
1.3.1 样品采集和温度胁迫处理
不同发育时期样品采集:随机选取莲草直胸跳甲卵块、1~3龄幼虫、蛹、雌、雄成虫。不同组织样品采集:选取羽化6 d莲草直胸跳甲雌成虫头、胸、消化道、卵巢、马氏管和脂肪体6个组织。应用高低温控温设备(K6-CC-NR,德国Huber)进行温度胁迫处理:将莲草直胸跳甲羽化当天雌成虫分别置于低温(-5、0、5、10、15℃和20℃)及高温(30、35℃和40℃)下处理2 h,以室温25℃作为对照。共设置3个生物学重复,处理结束后立即液氮冷冻,保存于-80℃冰箱备用。
1.3.2 总RNA提取与cDNA第一链合成
利用快速RNA小量、微量提取试剂盒分别提取莲草直胸跳甲不同发育阶段、不同组织样品及胁迫处理成虫样品总RNA,采用超微量紫外分光光度计(Nanophoto meter P330)和1%琼脂糖凝胶电泳鉴定RNA的纯度和完整性。cDNA第一链的合成按照HifairⅢ 1st Stand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)说明书进行,RNA定量为1 μg,反转录合成后的cDNA立即用于后续试验或-20℃冰箱保存备用。
1.3.3 AhHSP90基因生物信息学分析
在NCBI(https:∥www.ncbi.nlm.nih.gov/)网站下载已发表的AhHSP90核酸、氨基酸序列(MN685595.1)[19],根据序列信息采用不同的在线网站或相关软件对其结构与功能进行分析。利用在线软件预测AhHSP90编码蛋白质亲疏水性(ProtScale、ProtParam)[20-21]、信号肽(SignalP 5.0)[22]、跨膜结构域(TMHMM ver 2.0)[23]、磷酸化位点(NetPhos 3.1)[24]并进行分析。蛋白二級结构预测利用SOPMA软件采用自优化序列预测方法[25]获得。利用Phyre2 Server[26]进行蛋白三级结构预测,三级结构示意图通过PyMol Molecular Graphics System(ver 2.2.3)软件进行编辑和输出,并利用PROCHECK 3.5[27]在线软件获得Ramachandran图来评估蛋白质3D模型的立体化学质量和准确性。通过在线分析软件ProDom[28]对不同物种HSP90的保守结构域进行比对分析。AhHSP90氨基酸序列在NCBI中进行BLAST比对并通过Uniprot数据库(https:∥www.uniprot.org/)搜索获得不同目昆虫、植物、细菌等HSP90的氨基酸序列,并以艰难梭菌Clostridioides difficile作为外源种群,利用MEGA 7.0软件采用邻接法(neighbor-joining, NJ)进行聚类分析构建系统发育树。
1.3.4 实时荧光定量PCR
根据下载的AhHSP90基因序列(MN685595.1),并以莲草直胸跳甲β-actin作为内参基因,利用Primer Premier 5.0 软件设计荧光定量引物,具体见表1。将反转录的cDNA稀释10倍作为模板,反应体系(25 μL):HieffqPCR SYBR Green Master Mix(Low Rox)10 μL,模板1 μL,10 μmol/L上、下游引物各0.4 μL,ddH2O 8.2 μL。扩增程序采用两步法:95℃预变性5 min;95℃变性10 s,60℃退火/延伸34 s,共40个循环;熔解曲线为95℃变性15 s,60℃退火1 min,95℃变性30 s。以该基因表达量最低的时期或组织或25℃室温作为对照。利用2-ΔΔCt方法[29-30]来计算AhHSP90基因在不同发育时期、不同组织和温度胁迫下的相对表达量。 每个处理3个生物学重复。
1.4 数据统计分析
使用SPSS 26.0软件进行数据分析,AhHSP90基因在不同发育时期、不同组织和温度胁迫下的相对表达量差异采用单因素方差分析(One-way ANOVA)的Tukey法(P<0.05)。使用GraphPad Prism 8.0软件对结果进行作图,数据以平均值±标准误表示。
2 结果与分析
2.1 AhHSP90基因編码蛋白的结构和功能分析
2.1.1 AhHSP90的亲/疏水性、信号肽、跨膜结构域及磷酸化位点分析
Protscale预测结果显示,蛋白质的亲水氨基酸占总氨基酸的66.0%,疏水氨基酸占34.0%,AhHSP90为亲水性蛋白质。经SignalP 5.0 Server对AhHSP90的信号肽预测,结果显示AhHSP90无信号肽,推测其为非分泌蛋白。通过在线程序TMHMM分析AhHSP90的跨膜结构域,结果显示所有氨基酸均位于细胞膜表面,表明AhHSP90无跨膜结构域。通过NetPhos 3.1 Server对AhHSP90磷酸化位点进行预测,结果显示其可能被磷酸化的位点包括:34个丝氨酸位点,18个苏氨酸位点和8个络氨酸位点(图1)。
2.1.2 AhHSP90的二级结构预测
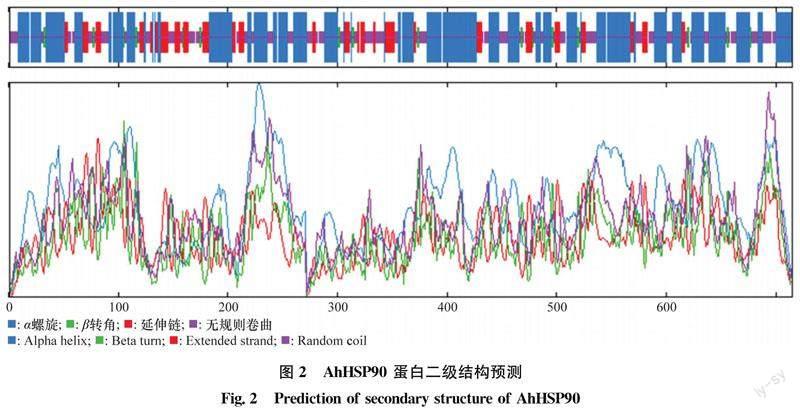
利用SOPMA在线软件预测AhHSP90的二级结构,结果显示AhHSP90二级结构中最丰富的构成元件是α-螺旋(alpha helix, Hh),占比52.59%,包括376个氨基酸;β-折叠(beta turn, Tt)占总氨基酸的数量最少,仅为3.92%,包括28个氨基酸;无规则卷曲(random coil, Cc)占比28.11%,包括201个氨基酸;随机延伸链(extended strand, Ee)占比15.38%,包括110个氨基酸(图2)。
2.1.3 AhHSP90三级结构预测
利用Phyre2 Server在线软件预测AhHSP90的三级结构,示意图由PyMol Molecular Graphics System(ver.2.2.3)在线输出(图3a)。预测的三维结构经在线软件PROCHECK 3.5评估,结果以拉氏图(Ramachandran plot)的形式呈现,拉氏图显示87.9%的主链二面角位于最佳合理区域,12.1%位于额外允许区域(图3b)。
2.2 AhHSP90系统发育分析及不同物种HSP90蛋白保守结构域分析
利用MEGA 7.0软件构建系统进化树,莲草直胸跳甲与赤拟谷盗Tribolium castaneum的HSP90氨基酸序列具有最高的同源性,其次是家蚕Bombyx mori,但其与艰难梭菌的HSP90分支距离最远,被排除在其他物种之外(图4a)。莲草直胸跳甲与蝶蛹金小蜂Pteromalus puparum、黑腹果蝇Drosophila melanogaster这两种不同目昆虫HSP90的距离较近,与斑马鱼Danio rerio、秀丽隐杆线虫Caenorhabditis elegans、拟南芥Arabidopsis thaliana、酿酒酵母Saccharomyces cerevisiae等4种不同物种的HSP90同源性距离不断增大(图4a),但仍归于一簇。利用ProDom网站对不同物种HSP90蛋白保守结构域进行预测,结果显示10条氨基酸序列具有相似的保守结构域,均含有HSP90典型的ATPase功能域(PD000898),另外,除CdHSP90外,其余序列仍含有PD615635和PD618622这两个单拷贝功能域(图4b)。上述分析结果反映了热激蛋白在核苷酸序列上高度同源及在蛋白结构和功能上相近的这一特性。
2.3 AhHSP90基因的表达特征
热激蛋白90基因在莲草直胸跳甲整个发育阶段均有表达,表达量存在显著差异(P<0.05),在卵期显著高表达,其次是在蛹中,而在1~3龄幼虫期、成虫中相对表达量较低且差异不显著,在雄成虫中表达量最低(图5a)。AhHSP90在雌成虫不同组织中表达量差异显著,在脂肪体中表达量最高,胸部的表达量次之,头部、卵巢中表达量较低且二者差异不显著,在马氏管和消化道中表达量均很低且无显著差异(图5b)。
2.4 AhHSP90基因对温度的响应分析
不同温度胁迫处理2 h后,以25℃为对照,分析莲草直胸跳甲雌成虫HSP90的相对表达量。RT-qPCR结果显示,雌成虫AhHSP90的相对表达量在40℃处理2 h后呈显著上调,为对照组的8.95倍。除40℃外,AhHSP90在其他高、低温下胁迫2 h的相对表达量发生一定程度的上调,但与对照相比均无显著差异(图6)。
3 结论与讨论
热激蛋白90的一个重要作用是参与多种信号转导途径,如与蛋白激酶和类固醇类激素受体等信号传导蛋白结合形成复合体,激活它们的生物活性,其中,蛋白质磷酸化调控着蛋白质复合物的组装,是调控蛋白质功能的普遍机制 [31-33]。由拉氏图显示的结果可以认为预测的AhHSP90结构模型是合理可信的。由系统进化树及保守结构域可见HSP90在进化上高度保守,而蛋白质折叠、构象的转换以及分子伴侣复合物的形成离不开ATPase功能域的参与[34];通过C-末端含有的保守特征基序MEEVD,表明AhHSP90为胞质型HSP90,而含有KDEL或HDEL特征基序表明其大多数为内质网型,这种保守基序同样存在于其他HSPs家族中[35-39],进一步说明热激蛋白家族具有高度保守的特性。
热激蛋白在昆虫的不同发育时期、不同组织中的表达模式具有多样性[40]。热激蛋白90基因在草地贪夜蛾幼虫期表达量随着发育时间增加逐渐降低,蛹期和成虫期又逐渐上升,在头(去除触角和复眼)、触角、复眼中的表达量显著高于其他组织[13];在苹果蠹蛾Cydia pomonella 5龄幼虫各组织中,CpHSP90在中肠和脂肪体中相对表达量显著高于表皮和血淋巴[41];在琥珀蚕Antheraea assamensis卵期先有较高表达后逐渐下降,幼虫期随龄期增加表达先上调后下降,在其5龄4日龄幼虫的不同组织中差异表达[42]。本研究中莲草直胸跳甲AhHSP90基因在不同发育时期表达的趋势和琥珀蚕AaHSP90基因相似,其可能对卵期发育具有重要的作用;AhHSP90在脂肪体中表达量最高,而在消化道中表达量最低,不同于上述其他物种,进一步说明热激蛋白90在不同物种的不同组织中表达具有特异性,在不同物种中所发挥的功能可能具有一定的差异性,后续应进一步探究其作用。
热激蛋白的产生不仅可通过热激诱导,当机体受到低温、干旱、紫外辐射等非生物因素及细菌干扰、病虫害等生物因素刺激都会使其表达[10,12]。HSP90最初因在热应激时丰度增加被发现 [7,31],目前,在许多昆虫中已有报道,如在琥珀蚕5龄幼虫应对低温胁迫时HSP90的表达量显著下降,在短时高温下又随温度升高呈先显著上调后下降的趋势[42],说明HSP90对机体的保護是有限的,热激蛋白的过量表达会消耗能量并伴随自身生理生化的变化[15,35,43]。马铃薯甲虫Leptinotarsa decemlineata在高温(38、44℃)下胁迫1 h后LdHSP90表达量均显著上升,在低温(0℃和-10℃)下胁迫1 h表达量稍有增加但均无显著差异[35],本研究中AhHSP90在高、低温下胁迫2 h后表达量的变化与LdHSP90在高、低温胁迫下的表达趋势相似,在高温下表达量呈上升趋势,但40℃并未达到其表达量下降的高温点,后续可通过设定更高的温度及不同的胁迫时长来进一步阐明AhHSP90在抵御环境胁迫中的生物学功能,为研究莲草直胸跳甲种群温度适应机制提供新思路。
参考文献
[1] BUCKINGHAM G R. Biological control of alligator weed, Alternanthera philoxeroides, the worlds first aquatic weed success story [J]. Castanea, 1996, 61(3): 232-243.
[2] 尹仁国. 蔬菜地空心莲子草的发生及危害[J]. 杂草科学, 1992, 10(1): 13.
[3] 马瑞燕, 王韧. 喜旱莲子草在中国的入侵机理及其生物防治[J]. 应用与环境生物学报, 2005, 11(2): 246-250.
[4] 刘亦然, 张虹, 靳继苏, 等. 莲草直胸跳甲Halloween基因家族鉴定及表达分析[J]. 中国农业科学, 2020, 53(10): 2009-2019.
[5] 中华人民共和国生态环境部. 中华人民共和国生态环境部[2003]11号:关于发布中国第一批外来入侵物种名单的通知[EB/OL]. (2003-01-10) [2021-11-30]. http:∥www.mee.gov.cn/gkml/zj/wj/200910/t20091022_172155.htm.
[6] YU Hao, WAN Fanghao, GUO Jianying. cDNA cloning of heat shock protein genes and their expression in an indigenous cryptic species of the whitefly Bemisia tabaci complex from China [J]. Journal of Integrative Agriculture, 2012, 11(2): 293-302.
[7] 唐斌, 林青青, 邬梦静, 等. 抗寒类蛋白与冷驯化诱发昆虫耐寒的生理调节研究[J]. 环境昆虫学报, 2014, 36(5): 805-813.
[8] 张珂, 翁群芳, 付昊昊. 昆虫热激蛋白90的研究进展[J]. 生物技术通报, 2014, 30(2): 15-23.
[9] FEDER M E, HOFMANN G E. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology [J]. Annual Review of Physiology, 1999, 61(1): 243-282.
[10]SRENSEN J G, KRISTENSEN T N, LOESCHCKE V. The evolutionary and ecological role of heat shock proteins [J]. Ecology Letters, 2003, 6(11): 1025-1037.
[11]DING D, PARKHURST S M, HALSELL S R, et al. Dynamic Hsp83 RNA localization during Drosophila oogenesis and embryogenesis [J]. Molecular and Cellular Biology, 1993, 13(6): 3773-3781.
[12]王倩倩. 沙棘木蠹蛾幼虫EhHsp90-1和EhHsp90-2基因的克隆表达及EhHsp90-1基因RNA干扰体系的构建[D]. 北京:北京林业大学, 2020.
[13]周吕, 孟建玉, 杨昌利, 等. 草地贪夜蛾热激蛋白基因SfHsp90的克隆及在高低温和UV-A胁迫下的表达分析[J]. 昆虫学报, 2020, 63(5): 533-544.
[14]马瑞燕. 空心莲子草天敌——莲草直胸跳甲引进中国后的生态适应性研究[D]. 北京:中国农业科学院, 2001.
[15]李彦宁, 傅建炜, 郭建英, 等. 莲草直胸跳甲释放量对其种群构建的影响[J]. 生物安全学报, 2011, 20(4): 275-280.
[16]JIN Jisu, ZHAO Meiting, WANG Yao, et al. Induced thermotolerance and expression of three key Hsp genes (Hsp70, Hsp21, and sHsp21) and their roles in the high temperature tolerance of Agasicles hygrophila [J/OL]. Frontiers in Physiology, 2020, 11(10): 1593. DOI: 10.3389/fphys.2019.01593.
[17]靳繼苏. 热激转录因子(Hsf)与热激蛋白基因(Hsp70、Hsp21、sHsp21)在莲草直胸跳甲高温耐受性中的作用[D]. 北京:中国农业科学院, 2017.
[18]贾栋, 刘艳红, 韩政, 等. 莲草直胸跳甲Hsp70基因克隆及高温表达分析[J]. 核农学报, 2014, 28(6): 970-977.
[19]贾栋. 莲草直胸跳甲热激蛋白基因对高温胁迫的响应及功能分析[D]. 太原:山西农业大学, 2015.
[20]WALKER J M. The proteomics handbook [M]. Totowa: Humana Press, 2005: 571-607.
[21]WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASy server [J]. Methods in Molecular Biology, 1999, 16(112): 531-552.
[22]ALMAGRO ARMENTEROS J J, TSIRIGOS K D, SONDERBY C K, et al. SignalP 5.0 improves signal peptide predictions using deep neural networks [J]. Nature Biotechnology, 2019, 37(4): 420-423.
[23]MLLER S, CRONING M D, APWEILER R. Evaluation of methods for the prediction of membrane spanning regions [J]. Bioinformatics, 2001, 17(7): 646-653.
[24]BLOM N, SICHERITZ-PONTN T, GUPTA R, et al. Prediction of post-translational glycosylation and phosphorylation of proteins from the amino acid sequence [J]. Proteomics, 2004, 4(6): 1633-1649.
[25]GEOURJON C, DELEAGE G. SOPMA: significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments [J]. Computer Applications in the Biosciences, 1995, 11(6): 681-684.
[26]KELLEY L, STERNBERG M. Protein structure prediction on the Web: a case study using the Phyre server [J]. Nature Protocols, 2009, 4(3): 363-371.
[27]LASKOWSKI R A, HUTCHINSON E G, MICHIE A D, et al. PDBsum: a web-based database of summaries and analyses of all PDB structures [J]. Trends in Biochemical Sciences, 1997, 22(12): 488-490.
[28]BRU C, COURCELLE E, CARRRE S, et al. The ProDom database of protein domain families: more emphasis on 3D [J]. Nucleic Acids Research, 2005, 33(1): D212-D215.
[29]PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR [J/OL]. Nucleic Acids Research, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45.
[30]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-ΔΔCT) method [J]. Methods, 2001, 25(4): 402-408.
[31]王海鸿, 雷仲仁. 昆虫热休克蛋白的研究进展[J]. 中国农业科学, 2005, 46(10): 2023-2034.
[32]GUPTA R, BRUNAK S. Prediction of glycosylation across the human proteome and the correlation to protein function [J]. Pacific Symposium on Biocomputing, 2002, 7(3): 310-322.
[33]CHANDRASEKHAR K, DILEEP A, ESTER D, et al. A short review on proteomics and its applications [J]. International Letters of Natural Sciences, 2014, 17(6): 77-84.
[34]郑海霞, 高玉林, 张方梅, 等. 马铃薯甲虫热激蛋白基因LdHSP70的克隆及温度胁迫下的表达特性[J]. 中国农业科学, 2021, 54(6): 1163-1175.
[35]蒋健, 李祥瑞, 张云慧, 等. 马铃薯甲虫热激蛋白基因LdHSP90的克隆及温度胁迫下的表达[J]. 植物保护学报, 2013, 40(5): 399-406.
[36]CHEN Bin, ZHONG Daibin, MONTEIRO A. Comparative genomics and evolution of the HSP90 family of genes across all kingdoms of organisms [J/OL]. BMC Genomics, 2006, 20(7): 156. DOI: 10.1186/1471-2164-7-156.
[37]GUPTA R S. Phylogenetic analysis of the 90 kD heat shock family of protein sequences and an examination of the relationship among animals, plants, and fungi species [J]. Molecular Biology and Evolution, 1995, 12(6): 1063-1073.
[38]GUPTA R S, AITKEN K, FALAH M, et al. Cloning of Giardia lamblia heat shock protein HSP70 homologs: implications regarding origin of eukaryotic cells and of endoplasmic reticulum [J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(8):2895-2899.
[39]BOORSTEIN W R, ZIEGELHOFFER T, CRAIG E A. Molecular evolution of the HSP70 multigene family [J]. Journal of Molecular Evolution, 1994, 18(38): 1-17.
[40]CHEN Lizhen, MA Weihua, WANG Xiaoping, et al. Analysis of pupal head proteome and its alteration in diapausing pupae of Helicoverpa armigera [J]. Journal of Insect Physiology, 2010, 56(3): 247-252.
[41]申建茹, 李明福, 陈乃中, 等. 苹果蠹蛾热激蛋白Hsp90基因的克隆及热胁迫下的表达分析[J]. 昆虫学报, 2011, 54(11): 1236-1248.
[42]刘增虎, 钟健, 杨伟克, 等. 琥珀蚕热激蛋白基因Hsp90的克隆和高低温胁迫下的表达分析[J]. 蚕业科学, 2020, 46(1): 59-66.
[43]PICARD D. Heat-shock protein 90, a chaperone for folding and regulation [J]. Cellular and Molecular Life Sciences, 2002, 17(59): 1640-1648.
(責任编辑:田 喆)
