二甲基二硫与氯化苦联合熏蒸防治山药土传病害效果及生物安全性评价
2023-05-30曾荣方文生孙杨华菊玲曹坳程李信申
曾荣 方文生 孙杨 华菊玲 曹坳程 李信申
摘要 为明确二甲基二硫(dimethyl disulfide,DMDS)与氯化苦(chloropicrin,CP)联合熏蒸对江西黏重土壤条件下山药土传病害的防控效果及生物安全性,选择土质黏重的连作红壤旱地进行熏蒸试验。结果表明,DMDS和CP联合熏蒸对枯萎病和立枯病的防效为90.56%,对根系生长旺盛期吸收根根结线虫病的防效为99.61%,对收获期块茎根结线虫、根腐线虫病的防效为88.70%。解除胁迫后20~120 d,熏蒸处理山药根际土壤微生物总量与空白对照(CK)差异不显著,但真菌/细菌、真菌/放线菌比值显著低于CK(P<0.05),芽胞杆菌数量顯著高于CK(P<0.05)。熏蒸处理山药出苗率与CK没有显著差异;山药齐苗期蔓基直径和藤蔓鲜重分别为3.40 mm和76.08 g,甩蔓盛期叶片叶绿素相对含量(SPAD)为52.56,均显著高于CK(P<0.05);收获期商品薯产量为21 292.86 kg/hm2,显著高于CK。综上,DMDS和CP联合熏蒸对江西黏重土壤条件下山药土传病害均具有良好的防病效果,对山药和土壤微生物安全,增产效果显著。
关键词 二甲基二硫联合氯化苦熏蒸; 山药土传病害; 防控效果; 生物安全性
中图分类号: S 482.5
文献标识码: A
DOI: 10.16688/j.zwbh.2021652
Abstract To evaluate the control efficacy of soil fumigation with dimethyl disulfide (DMDS) and chloropicrin (CP) against the soil-borne diseases of yam in the heavy clay soils of Jiangxi province and its biological safety, a continuously cropped upland red soil field with heavy clay was selected for fumigation experiment. The results showed that the control efficacy of DMDS combined with CP against Fusarium wilt and Rhizoctonia wilt of yam was 90.56%, and its control efficacies against root knot nematode disease of the absorbing roots during the period of vigorous root growth, root knot nematode disease and root rot nematode disease of the tubers during harvest period were 99.61% and 88.70%, respectively. There was no significant difference in the total amount of microorganisms in the rhizosphere soil of yam between fumigation treatment and the control group 20 to 120 days after fumigation. However, the number of bacillus was significantly higher than that of the control (P<0.05), and the ratios of fungi to bacteria and fungi to actinomycete in the rhizosphere soil treated by fumigation were significantly lower compared to the control (P<0.05). There was no significant difference of the emergence rate of yam between fumigation treatment group of DMDS + CP and the control group. The diameter of vine base and vine fresh weight at the seedling emergence stage were 3.40 mm and 76.08 g, respectively. The relative chlorophyll content (SPAD) in leaves during yam jilt tendril period was 52.56, which was significantly higher than that of the control (P<0.05). The yield of marketable tubers at the harvesting stage was 21 292.86 kg/hm2, which was significantly higher than that of the control. These results indicated that the combined fumigation of DMDS and CP had good control efficacy against yam soil-borne diseases in heavy clay soils of Jiangxi province. It was safe for yam tubers and the soil microbial community, and had a significant yield-increasing effect on yam tubers.
Key words fumigation of DMDS and CP; soil-borne diseases of yam; control efficacy; biosafety
山药Dioscorea polystachyaThunb.,又名薯蓣,为薯蓣科Dioscoreaceae薯蓣属藤本植物,系我国首批批准的“药食同源”食品[1]。我国是山药的重要原产地和驯化中心,已有近3 000年的栽培历史,拥有温县铁棍山药、武穴佛手山药、瑞昌山药等一大批国家地理标志保护产品。近年來,我国山药产业已发展壮大为千亿级产业,成为各主产区产业致富的重要渠道。然而,由Meloidogyne spp.引起的根结线虫病[2],Pratylenchus spp.引起的根腐线虫病[2-3],Fusarium spp.引起的枯萎病[4]和Rhizoctonia solani引起的立枯病[5]等土传病害在我国危害普遍,尤以线虫病发生最为严重。苏莱曼[2]对江西、山东山药线虫发生与分布情况的调查显示,根际土壤和块茎中根腐线虫、根结线虫检出率分别高达69%、65%。本项目组调查发现,江西山药线虫病田间发病率一般为30%~50%,重病田块发病率高达100%。线虫危害不仅导致山药产量和品质下降,其造成的伤口也为其他土传病菌的侵染创造了有利条件[6]。江西山药枯萎病和立枯病往往混合发生,造成的病株率一般为15%~30%,严重田块可达60%以上。各地因病弃收的现象每年都有发生,山药土传病害已成为山药连作障碍的最主要因素。山药品种繁育研究相对滞后,品种抗病性普遍低下[7]。上述4种山药土传病害病原寄主范围广泛。山药与其他谷类作物的生长模式不同,对养分的需求敏感,对土壤理化性状要求严格[8],适宜栽培区域不大,长期轮作难度大。因此,药剂防治仍然是山药土传病害有效的防治方法。
目前,山药线虫病、枯萎病、立枯病等土传病害防控主要包括新垦荒地种植或进行6~8年以上的轮作以及药剂防治。受山药生长特性影响,新垦荒地及可供轮作区域面积日益缩小。播种前应用噻唑膦、阿维菌素、氟吡菌酰胺、噁霉灵等药剂进行土壤处理是山药土传病害最常用的药剂防治方法。山药生育期较长,在江西种植区域,出于用工成本考虑,山药种植时间大多集中在春节前后,药剂持效期有限,播种前用上述药剂进行土壤处理不足以将病原数量持续控制在较低水平[9-11]。
作物种植前进行土壤熏蒸被认为是防治作物土传病害的一种最有效的措施[12]。熏蒸剂分子量小,降解快,无残留风险,对食品安全[13]。采用威百亩、氯化苦(CP)、二甲基二硫(DMDS)等熏蒸剂进行土壤消毒,是欧美、日本等国家综合防治技术体系的一部分,广泛应用于果树再植、草莓、草坪、蔬菜、观赏植物[14]。我国土壤熏蒸在设施作物和高附加值作物土传病害防控中的应用亦日趋广泛[14]。熏蒸不仅能使药剂在土壤中均匀分布,并且深度可达60 cm以上[14],这对于块茎深扎地下40~100 cm的山药的土传病害防控尤为重要。国内外关于土壤熏蒸防治山药土传病害的研究报道不多,董文芳[15]测定了威百亩和氯化苦土壤熏蒸对河北山药根腐线虫的田间防效,分别为91.75%、77.37%;李皓[16]分析了氯化苦熏蒸对河北山药“糊头”病的防治效果及对土壤环境的影响,结果表明,氯化苦防病效果为84.61%~97.56%,对土壤环境安全。与北方山药种植区域土壤特性不同,江西山药种植区域土质大多黏重,而熏蒸剂在土壤中分布的均匀度与土壤特性密切相关[17]。至今尚未见土壤熏蒸一站式防控江西山药根结线虫、根腐线虫、枯萎病和立枯病等4种主要土传病害的报道,以及土壤熏蒸对山药生物学性状、产量和土壤根际微生物组成影响的系统分析报道。氯化苦能够高效防控土传真菌和细菌[18],二甲基二硫对线虫的防控效果显著[19]。为此,本研究选择土质黏重、土传病害发生严重的连作红壤旱地进行熏蒸试验,测定二甲基二硫与氯化苦联合防控上述4种土传病害的效果,分析土壤熏蒸对山药生长相关生物学指标以及对土壤微生物菌群结构的影响,以期为江西山药土传病害高效防控提供技术支撑。
1 材料与方法
1.1 试验地点
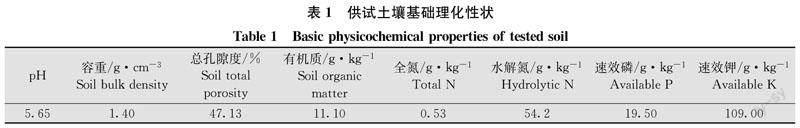
试验于2020年在瑞昌山药核心种植区范镇盛家村连作地块进行。该地块为红壤旱地,土壤质地黏重,基础养分较低。供试土壤基础理化性状见表1。上年度根结线虫病、根腐线虫病、枯萎病、立枯病发生较重。
1.2 试验材料
山药品种:获国家地理标志保护品种‘瑞山药,由瑞昌市农业农村局山药种质保存中心提供。
土壤熏蒸剂:99%二甲基二硫乳油(EC),临海市建新化工有限公司;99.5%氯化苦水剂(AS),辽宁省大连绿峰化学股份有限公司。
种薯处理剂:39%精甲·嘧菌酯悬浮剂(SC),山东禾宜生物科技有限公司;5%阿维菌素乳油(EC),河北三农农用化工有限公司;48%复合肥(N、P2O5、K2O各含16%),贵州西洋实业有限公司。
培养基:牛肉膏蛋白胨培养基(牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15 g,蒸馏水1 000 mL,pH 7.4~7.6)、链霉素—马丁氏孟加拉红培养基(蛋白胨5 g,葡萄糖10 g, KH2PO4 1 g, MgSO4 0.5 g,琼脂15 g,孟加拉红0.03 g,链霉素0.03 g,蒸馏水1 000 mL,pH 7.0~7.4),放线菌酮高氏一号培养基(可溶性淀粉20 g,KNO3 1 g,K2HPO4 0.5 g,MgSO4· 7H2O 0.5 g,NaCl 0.5 g,FeSO4· 7H2O 0.01 g,琼脂20 g,放线菌酮0.02 g,蒸馏水1 000 mL,pH 7.2~7.4)、酵母浸膏蛋白胨培养基(蛋白胨20 g,酵母浸膏10 g,葡萄糖20 g,琼脂15 g,蒸馏水1000 mL,自然pH)。
仪器:恒美HM-YA便携式植物叶绿素测定仪,美耐特MNT-150数显卡尺。
1.3 试验方法
1.3.1 试验设计
试验共设2个处理:1)99%二甲基二硫EC 600 kg/hm2+99.5%氯化苦AS 400 kg/hm2(DMDS+CP);2)空白对照(CK)。每处理重复3次,小区面积28 m2。土壤熏蒸方法按照NY/T2725-2015 氯化苦土壤消毒技术规范要求进行[20]。土壤熏蒸时间:2019年11月22日,揭膜时间:2019年12月12日。山药播种时间:2020年1月1日。播种前,用39%精甲·嘧菌酯SC 1 500倍+5%阿维菌素EC 1 000倍液浸种30 min,阴干后播种。播种方法为开沟条播,种植密度约72 750株/hm2。山药萌动前(2020年4月10日),熏蒸处理和空白对照均施用48%复合肥1 200 kg/hm2,之后不施用任何肥料,其余按大田常规管理方法进行人工除草、水分管理和炭疽病防控,整个试验期间不再施用防治线虫病、枯萎病、立枯病药剂。
1.3.2 山药土传病害调查方法
山药枯萎病、立枯病植株发病情况调查时间为2020年6月1日-9月15日,每隔15 d左右调查1次。调查方法为全小区调查。这两种病害常混合发生,合并调查病株数,统计病株率,按病株率计算防效。吸收根根结线虫病发生情况调查于根系生长旺盛期(2020年7月30日)进行。调查方法为对角线5点取样,每点取样5株,按照李信申等[9]的病情分级标准进行调查。块茎根结线虫和根腐线虫病发生情况调查于山药采收时(2020年10月14日-15日)进行。调查方法为对角线5点取样,每点取25个薯块。这两种病害常在薯块上混合发生,合并进行分级,并按病情指数计算防效。病情分级标准参照李信申等[9]。
病株率=病株数/调查总株数×100%;
病情指数=∑(各级病株数×相应级数值)/(调查总株数×9)×100;
枯萎病、立枯病防效=(对照组病株率-处理组病株率)/对照组病株率×100%;
线虫病防效=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.3.3 土壤微生物测定
于揭膜后10 d(2019年12月22日)、20 d(2020年1月1日)和120 d(2020年4月10日)采用对角线5点取样法取样。应用取土钻取0~40 cm土样200 g以上。每小区的5份土样混合均匀后,称取25 g加入225 mL无菌水,200 r/min振荡60 min制成土壤悬浮液(0.1 g/mL),按10倍梯度依次稀释,每个梯度稀释液取0.1 mL涂布于相应培养基,3个重复。
真菌、细菌、放线菌分别用链霉素—马丁氏孟加拉红培养基、牛肉膏蛋白胨培养基、放线菌酮高氏一号培养基平板培养[21]。芽胞杆菌分离方法:先将土样悬浮液80℃恒温水浴10 min,后用酵母浸膏蛋白胨培养基平板培养[21]。细菌30℃培养2 d后计数统计,真菌28℃培养3 d后计数统计,放线菌28℃培养5 d后计数统计。同时测定供试土壤的含水量,土壤微生物数量以每克干土中含菌数表示。
每克干土中含菌数=平板菌落数平均值 ×稀释倍数×10/干土重量。
1.3.4 山药生物学性状测定
山药齐苗后(2020年5月27日),采用全小区调查法调查各小区出苗情况。同时,对角线5点取样,每点取3株,测定山药蔓基直径和藤蔓鲜重。山药甩蔓盛期(2020年7月30日),每小区对角线5点取样,每点取3株,每株取上、中、下各3片叶,测定叶绿素相对含量(SPAD)。山药收获时(2020年10月14日-15日),每小区对角线5点取样,每点取3 m2,测定商品薯(重量大于0.15 kg的健康薯块)产量,统计健康薯块比率。
增产率=(处理组商品薯产量-对照组商品薯产量)/对照组商品薯产量×100%;
健康薯块比率=健康薯块数量/调查薯块数量×100%。
1.4 数据分析
采用DPS 2.00 软件对数据进行统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 二甲基二硫与氯化苦联合熏蒸对山药土传病害防控效果
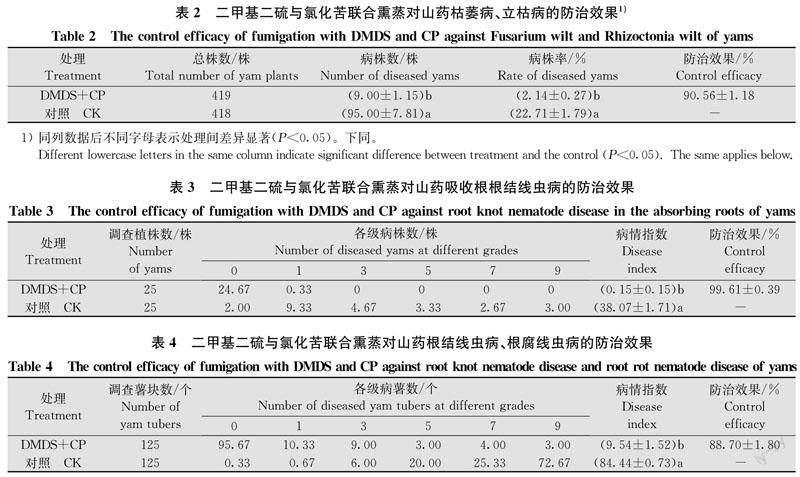
山药齐苗后至收获前全小区定期调查结果(表2)表明,土壤熏蒸后,山药枯萎病、立枯病发病率显著下降,防效高达90.56%。吸收根生长旺盛期根结线虫病发生情况调查结果(表3)表明,土壤熏蒸处理后仅零星发病,防效高达99.61%。山药收获期取样调查结果(表4)显示,山药块茎根结线虫病、根腐线虫病发生程度亦明显降低,防效达88.70%。对比分析发现,土壤熏蒸处理健康薯块比率达76.54%,而对照健康薯块比率仅为0.26%;土壤熏蒸处理5级、7级、9级病薯率分别为2.40%、3.20%、2.40%,而对照5级、7级、9级病薯率分别高达16.00%、20.26%、58.14%。
2.2 二甲基二硫与氯化苦联合熏蒸对山药根际土壤微生物的影响
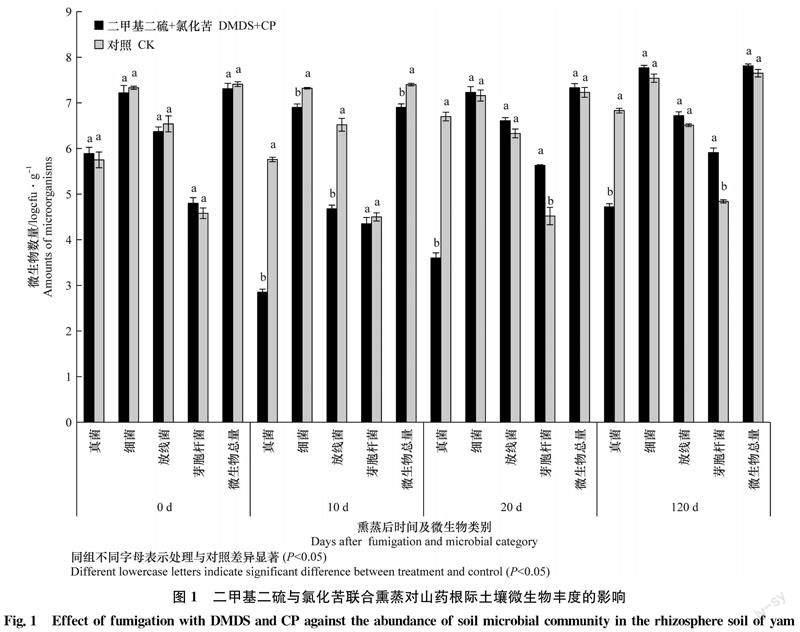
平板纯培养测定结果(图1)显示,熏蒸处理前,DMDS+CP联合熏蒸处理区山药根际土壤真菌数量、细菌数量、放线菌数量、芽胞杆菌数量及微生物总量与空白对照区没有显著差异(P>0.05)。揭膜后10 d,空白对照区山药根际土壤真菌数量、细菌数量、放线菌数量及微生物总量分别为联合熏蒸处理区的798、2、72倍和3倍(P<0.05),芽胞杆菌数量则与联合熏蒸处理区差异不显著。揭膜后20 d(山药播种期),空白对照区山药根际土壤真菌数量为DMDS+CP联合熏蒸处理区的1 236倍(P<0.05),芽胞杆菌数量约为联合熏蒸处理区的9%(P<0.05),而细菌数量、放线菌数量及微生物总量均与联合熏蒸处理区没有显著差异。揭膜后120 d(山药萌动前),空白对照区山药根际土壤真菌数量为DMDS+CP联合熏蒸处理区的128倍(P<0.05),芽胞杆菌数量约为联合熏蒸处理区的7.7%(P<0.05),细菌数量、放线菌数量及微生物总量均与联合熏蒸处理区没有显著差异。对DMDS+CP聯合熏蒸处理对山药根际土壤微生物菌群结构的影响进行分析后发现,解除胁迫后10~120 d,真菌/细菌、真菌/放线菌比值均显著低于空白对照(表5,P<0.05)。综上所述,解除处理胁迫后,山药根际土壤微生物丰度短期内即能恢复到正常水平,并且与空白对照相比,芽胞杆菌种群数量丰度显著增加,真菌/细菌、真菌/放线菌比率显著降低。
2.3 二甲基二硫与氯化苦联合熏蒸对山药生物学性状及产量的影响
山药齐苗时调查结果(表6)表明,土壤熏蒸处理和空白对照山药出苗率均达95%以上,两者没有显著差异;但土壤熏蒸处理的山药蔓基直径和藤蔓鲜重均显著高于空白对照(P<0.05)。山药甩蔓盛期测定结果显示,土壤熏蒸处理山药叶片叶绿素相对含量显著高于空白对照(P<0.05)。山药收获期测产结果表明,在空白对照商品薯几乎绝产的情况下,土壤熏蒸处理商品薯产量达21 292.86 kg/hm2,比空白对照增产11 000%以上。说明DMDS+CP联合土壤熏蒸对山药出苗安全,提高了山药幼苗生长指标,增强了植株叶片光合能力,显著增加了商品薯产量。
3 结论与讨论
DMDS作为自然界存在的物质,低剂量下可以作为食品添加剂,且对臭氧层无破坏作用,具有高效和环境安全兼备的特性,现已被联合国溴甲烷技术选择委员会提为最有潜力的新型溴甲烷替代品[22]。张大琪等[23]报道,DMDS对根结线虫的生物活性非常高,LD50为4.743 mg/kg;对镰刀菌属Fusarium真菌也有较高活性,LD50为1.513 mg/kg。氯化苦对丝核菌属Rhizoctonia、镰刀菌属Fusarium等真菌的活性高,对线虫也有一定的活性[24-25]。因此二者联合熏蒸可实现对枯萎病、立枯病、根结线虫病和根腐线虫病的协同增效。DMDS和CP的亨利常数(Henrys law constants, KH)分别为0.054和0.100[26],具有高KH(>10﹣4)的化合物通常迁移扩散速度快,因此在黏性重的土壤中也能均匀分布。DMDS和CP比重分别为1.690 g/mL和1.063 g/mL,施药深度30 cm,通过下沉扩散作用,药剂能达到50~60 cm的深度[14]。因而,尽管山药块茎深扎地下,上述两种药剂仍能对其土传病害起到很好的防控效果。这一研究结果也为土壤药剂熏蒸在江西设施栽培及高附加值作物的推广应用提供了依据。后期将开展DMDS与棉隆、辣根素、乙蒜素等药剂对山药土传病害的协同防控效果研究,为土壤熏蒸剂在江西山药及其他高附加值作物上应用奠定基础。
土壤微生物是土壤中活的有机体,细菌、放线菌和真菌是土壤微生物的三大类群,构成了土壤微生物的主要生物量,它们的区系组成和数量变化常反映出土壤生物活性水平。由于熏蒸剂的广谱性, 施入土壤后在杀死有害生物的同时, 也会对非靶标土壤微生物产生影响。王方艳[27]报道,氯化苦熏蒸胁迫解除后,土壤中真菌、细菌、放线菌数量呈现先被抑制后恢复的趋势;Li等[28]测定显示,氯化苦熏蒸后,土壤中芽胞杆菌丰度提高;Stromberger等[29]报道,DMDS熏蒸土壤后, 大幅减少了可培养真菌数量。范琳娟等[30]报道,氯化苦熏蒸后,草莓缓苗期和幼果期,土壤中细菌和真菌数量均显著降低,放线菌数量则表现为抑制—恢复的趋势。本研究测定表明,解除熏蒸胁迫后,山药根际土壤真菌、细菌和放线菌数量均呈现先抑制后恢复的趋势。但与空白对照相比,真菌丰度显著降低,真菌/细菌、真菌/放线菌比值亦均显著下降,这往往是土壤的生物活性高的标志。值得注意的是,解除熏蒸胁迫后,芽胞杆菌数量显著提高,这一研究结论与Chen等[31]的研究报道一致。芽胞杆菌中的很多种类可以产生多种微生物酶制剂和抗病虫物质,在土壤改良和病虫害防治中具有重要作用。
DMDS、CP在有氧环境土壤中降解迅速,半衰期分别为1~5 d、0.2~4.5 d[14]。因而,揭膜敞气后播种对山药出苗安全。土壤氮库中的营养元素主要以有机态或螯合态的形式存在,而植物所吸收的营养元素几乎都是无机态,所以, 土壤营养库中的营养元素需通过矿化作用转化为植物可吸收的有效态。微生物是土壤营养元素循环转化的主体,熏蒸处理显著影响土壤微生物数量、群落结构及活性,对土壤营养元素循环也必然产生巨大影响[32]。本项目组前期研究发现,DMDS土壤熏蒸增加了氮转化过程相关细菌的数量,抑制了氨氧化过程相关细菌的数量[33],显著提高了土壤中植物可吸收态氮素水平、有机质含量和电导率[23]。氯化苦熏蒸抑制了土壤中硝化作用相关菌株数量、促进反硝化作用相关菌株数量[34-36],改变了土壤中编码碱性磷酸酶phoD基因微生物群落的组成[37];参与氮、磷循环细菌群落结构的改变提高了土壤中植物可吸收态氮素、磷素含量[35];此外,氯化苦熏蒸还能显著增加土壤中有效锰、钴等微量元素的含量[38]。二甲基二硫与氯化苦联合熏蒸提高了土壤中可利用营养元素含量,改善了土壤肥力,因而显著增强了山药幼苗生长。叶绿素含量直接反映了叶片的光合能力。本研究首次报道二甲基二硫与氯化苦联合熏蒸后,山药植株叶片的叶绿素含量显著提高。山药商品薯产量的大幅增加是熏蒸对土传病害的高效防控、根际土壤微生物区系正向调控、土壤可利用营养元素增加以及叶片光合能力增强的综合体现。氯化苦与二甲基二硫联合熏蒸能显著促进作物生长和提高产量的结论与Mao等[39]报道的氯化苦熏蒸后生姜产量提高3.12 kg/m2以上,Yan等[40]报道的熏蒸大幅提高了草莓产量的结论一致。田间调查还发现,尽管山药整个生产季节仅于山药出苗前按常规用量施用了一次基肥,且供试田块土壤基础养分较低,山药甩蔓期熏蒸处理区山药藤蔓生长仍非常旺盛,暗示二甲基二硫与氯化苦联合熏蒸存在化肥减施的空间。后续将开展基于土壤熏蒸的化学肥料减施高产高效配套技术研究。
综上所述,二甲基二硫与氯化苦联合熏蒸对江西山药根结线虫病、根腐线虫病、枯萎病、立枯病等4种土传病害防控效果达85%以上,能正向调控土壤微生物菌群结构,显著促进山药生长,增产效果显著。
參考文献
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2015: 28-29.
[2] 苏莱曼. 谷物和山药相关的植物寄生线虫的多样性和鉴定[D]. 北京: 中国农业科学院, 2021.
[3] 贺哲, 黄婷, 李俊科, 等. 瑞昌山药根腐线虫病病原鉴定[J]. 江西农业大学学报, 2016, 38(5): 879-883.
[4] WANG Mengmeng, CHEN Qian, DIAO Yongzhao, et al. Fusarium incarnatum-equiseti complex from China [J]. Persoonia: Molecular Phylogeny and Evolution of Fungi, 2019, 43: 70-89.
[5] 黄婷, 蒋军喜, 余国庆, 等. 山药病害最新研究进展[J]. 生物灾害科学, 2014, 37(1): 74-78.
[6] 刘晓宇, 陈立杰, 邢志富, 等. 4种生物源杀线剂对番茄根结线虫的田间防效[J]. 植物保护, 2020, 46(6): 228-232.
[7] 李明军, 刘世宇, 刘雯, 等. 怀山药微型块茎形成过程中的生理生化变化[J]. 植物生理学报, 2017, 53(5): 807-814.
[8] 王雪, 苗泽兰, 孙志梅, 等. 冀中平原主栽山药品种的生长发育和养分累积特征[J]. 植物营养与肥料学报, 2019, 25(3): 510-518.
[9] 李信申, 曾荣, 方文生, 等. 山药根结线虫病发生动态及根层施药防治技术研究[J]. 农药学学报, 2022, 24(2): 332-340.
[10]CHILAKA C A, BOEVRE M D, ATANDA O O, et al. Prevalence of Fusarium mycotoxins in cassava and yam products from some selected Nigerian markets [J]. Food Control, 2018, 84: 226-231.
[11]許念芳, 宋计平, 刘少军, 等. 不同药剂对重茬山药线虫病防治效果[J]. 生物灾害科学, 2021, 44(2): 168-171.
[12]ABOU Z N M, NOHERR A M. Efficacy of DMDS as methyl bromide alternative in controlling soil borne diseases, root-knot nematode and weeds on pepper, cucumber and tomato in Egypt [C]∥Ⅷ International Symposium on Chemical and Non-Chemical Soil and Substrate Disinfestation, 2014: E10035.
[13]QIN Ruijun, GAO Suduan, AJWA H, et al. Effect of application rate on fumigant degradation in five agricultural soils [J]. Science of the Total Environment, 2016, 541: 528-534.
[14]王秋霞, 颜冬冬, 王献礼,等. 土壤熏蒸剂研究进展[J]. 植物保护学报, 2017, 44(4): 529-543.
[15]董文芳. 山药短体线虫病病原种类鉴定、田间发生动态及其化学防治研究[D]. 保定: 河北农业大学, 2015.
[16]李皓. 土壤消毒对山药“糊头”病的防治效果及其对土壤环境的影响[D]. 保定: 河北农业大学, 2019.
[17]FANG Wensheng, WANG Xianli, HUANG Bin, et al. Comparative analysis of the effects of five soil fumigants on the abundance of denitrifying microbes and changes in bacterial community composition [J/OL]. Ecotoxicology and Environmental Safety, 2019, 187: 109850. DOI: 10.1016/j.ecoenv.2019.109850.
[18]GULLINO M L, MINUTO A, GILARDI G, et al. Efficacy of preplant soil fumigation with chloropicrin for tomato production in Italy [J]. Crop Protection, 2002, 21(9): 741-749.
[19]LEOCATA S, PIRRUCCIO G, MEDICO E, et al. Dimethyl disulfide (DMDS): a new soil fumigant to control root-knot nematodes, Meloidogyne spp., in protected crops in Sicily, Italy [J]. ActaHorticulturae, 2014, 1044: 415-420.
[20]曹坳程, 王秋霞, 李园, 等. 氯化苦土壤消毒技术规范: NY/T2725-2015 [S]. 北京: 中国农业出版社, 2015.
[21]方中达. 植病研究法[M]. 3版. 北京: 中国农业出版社, 1988: 122-184.
[22]MCAVOY T P, FREEMAN J H. Retention of the soil fumigant dimethyl disulfide by virtually and totally impermeable film mulches [J].HortScience, 2013, 48(9): 1154-1158.
[23]张大琪, 颜冬冬, 李青杰, 等. 二甲基二硫的生物活性评价及对土壤养分的影响[J]. 植物保护, 2020, 49(1): 151-156.
[24]MINUTO A, GULLINON M L, LAMBERTI F, et al. Application of an emulsifiable mixture of 1,3-dichloropropene and chloropicrin against root knot nematodes and soilborne fungi for greenhouse tomatoes in Italy [J]. Crop Protection, 2006, 25(12): 1244-1252.
[25]RUTH M M, BRIAN C, TOIT L D, et al. Soil amendments and fumigation for the management of Fusarium wilt of bunching spinach in Ontario, Canada [J/OL]. Crop Protection, 2021, 145(1): 105646. DOI: 10.1016/j.cropro.2021.105646.
[26]RUZO L O. Physical, chemical and environmental properties of selected chemical alternatives for the pre-plant use of methyl bromide as soil fumigant [J]. Pest Management Science, 2006, 62(2): 99-113.
[27]王方艳. 二甲基二硫与氯化苦混用对连作土壤微生物群落结构的影响及其恢复动态研究[D]. 北京: 中国农业科学院, 2011.
[28]LI Qingjie, ZHANG Daqi, CHENG Hongyan, et al. Chloropicrin alternated with dazomet improved the soils physicochemical properties, changed microbial communities and increased strawberry yield [J/OL]. Ecotoxicology and Environmental Safety, 2021, 220: 112362. DOI: 10.1016/j.ecoenv.2021.112362.
[29]STROMBERGER M E, KLOSE S, AJWA H, et al. Microbial populations and enzyme activities in soils fumigated with methyl bromide alternatives [J]. Soil Science Society of America Journal, 2005, 69(6): 1987-1999.
[30]范琳娟, 劉奇志, 宋兆欣, 等. 氯化苦对重茬草莓土壤生物和非生物因子的影响[J]. 农药, 2017, 56(2): 131-134.
[31]CHEN Huijie, ZHAO Shuang, ZHAO Jiamiao, et al. Deep tillage combined with biofertilizer following soil fumigation improved chrysanthemum growth by regulating the soil microbiome [J/OL]. Microbiology Open, 2020, 9: e1045. DOI: 10.1002/mbo3.1045.
[32]颜冬冬, 王秋霞, 郭美霞, 等. 4种熏蒸剂对土壤氮素转化的影响[J]. 中国生态农业学报, 2010, 18(5): 934-938.
[33]FANG Wensheng, YAN Dongdong, HUANG Bin, et al. Biochemical pathways used by microorganisms to produce nitrous oxide emissions from soils fumigated with dimethyl disulfide or allylisothiocyanate [J]. Soil Biology and Biochemistry, 2019, 132: 1-13.
[34]LI Jun, HUANG Bin, WANG Qiuxia, et al. Effect of fumigation with chloropicrin on soil bacterial communities and genes encoding key enzymes involved in nitrogen cycling [J]. Environmental Pollution, 2017, 227: 534-542.
[35]ZHANG Daqi, YAN Dongdong, FANG Wensheng, et al. Chloropicrin alternated with biofumigation increases crop yield and modifies soil bacterial and fungal communities in strawberry production [J]. Science of The Total Environment, 2019, 675: 615-622.
[36]方文生. 土壤熏蒸对氮矿化功能微生物及N2O生成的影响与机制[D]. 北京: 中国农业科学院, 2019.
[37]HUANG Bin, YAN Dongdong, OUYANG Canbin, et al. Chloropicrin fumigation alters the soil phosphorus and the composition of the encoding alkaline phosphatase PhoD gene microbial community [J/OL]. Science of The Total Environment, 2020, 711: 135080. DOI: 10.1016/j.scitotenv.2019.135080.
[38]王前, 黄斌, 颜冬冬, 等.氯化苦熏蒸处理对土壤氮素和微量元素转化的影响[J]. 植物保护, 2018, 44(6): 73-77.
[39]MAO Liangang, JIANG Hongyun, ZHANG Lan, et al. Assessment of the potential of a reduced dose of dimethyl disulfide plus metham sodium on soilborne pests and cucumber growth [J/OL]. Scientific Reports, 2019, 9(1): 19806. DOI: 10.1038/s41598-019-56450-7.
[40]YAN Dongdong,WANG Qiuxia, MAO Liangang, et al. Evaluation of chloropicrin gelatin capsule formulation as a soil fumigant for greenhouse strawberry in China [J]. Journal of Agricultural and Food Chemistry, 2019, 60(20): 5023-5027.
(责任编辑:杨明丽)
