TiO2对磁控溅射Ti-TiO2纳米复合涂层抗茵性能的影响
2023-05-30季震宇马迅刘平王静静马凤仓张柯陈小红刘剑楠李伟
季震宇 马迅 刘平 王静静 马凤仓 张柯 陈小红 刘剑楠 李伟
摘要:为预防种植体周围炎,采用反应磁控溅射法在纯Ti片表面制备了Ti-TiO2纳米复合涂层,改变Ti靶材与TiO2靶材的拼接比例,研究纳米TiO2体积分数对涂层微观结构和抗菌性能的影响。采用扫描电子显微镜、能谱仪、X射线衍射仪、原子力显微镜、接触角测量仪对样品进行微观组织的表征以及表面粗糙度和润湿性能的测量,采用CCK-8法(cell counting kit-8,CCK-8)对涂层进行细胞毒性测试,采用平板涂布计数法对涂层进行抗菌性能评价。结果表明,当Ti靶材与TiO2靶材的拼接比例为95:5时,Ti-TiO2涂层含纳米TiO2量最多,涂层的表面粗糙度以及与液相接触角达到最大值,分别为1.28 nm和100.42°,涂层无细胞毒性,符合生物安全性材料的标准,涂层的抗菌性能最佳,涂层的抑菌率达到了90.94%。
关键词:Ti-TiO2涂层;纯Ti;微观组织;润湿性能;细胞毒性;抗菌性能
中图分类号:TG 174.4 文献标志码:A
纯Ti因具有理想的机械强度、加丁性能以及良好的生物相容性,已经成为临床中比较常用的种植体材料。Ti种植体的耐腐蚀性良好且力学性能佳,同时也具有比较好的生物相容性,因此许多国内外学者对其在基础研究以及实际应用领域进行了许多探讨[1-3]。种植体种植失败的原因有很多,其中比较常见的是犹豫种植体周围产生炎症。因为种植体是长期植入在人体,人体内的细菌会粘附在种植体表面并形成细菌生物膜,它很容易使种植体附近产生炎症。目前为了预防该问题,采取了如下几种措施:(1)植入种植体时在其植入的部位使用抗生素来减少炎症对其的影响[4];(2)使用抗菌的药物以抑制炎症[5];(3)形成细菌生物膜需要在其初期吸附蛋白质,减少它的吸附可以有效抑制其生长从而减少炎症[6];(4)使用纳米抗菌涂层负载在种植体的表面来抑制细菌产生的炎症[7]。研究发现这几种方法当中,使用纳米抗菌涂层负载的方法具有可控性好,抗菌性能佳的优点,且产生的副作用较少,具有较高的研究价值。TiO2是一种半导体晶体材料,TiO2,不仅具有良好的化学稳定性与生物相容性,它还具有一定的抗菌性能与生物相容性,它还具有一定的抗菌性能[8]。Ti0,的抗菌机制主要是TiO2在受到紫外光或可见光激活后会产生光生电子与光生空穴,光生电子能够与氧气反应生成超氧阴离子,光生空穴能够与水分子或氢氧根离子反应生成氢氧自由基,它们会破坏细菌生物膜进入细菌体内,从而发挥抗菌作用[9]。相比微米级TiO2,纳米级TiO2,的颗粒尺寸更小,微观量子效應显著,在抗菌性能和应用方面均表现出显著的优越性,所以纳米TiO2,可以考虑作为种植体表面纳米抗菌涂层。
制备纳米TiO2涂层的常用方法有:物理气相沉积法和化学气相沉积法。不同技术获得的纳米涂层的微观结构、表面粗糙度以及比表面积等各不相同,这些微观结构的差异对其解决种植体周围炎症问题的关键是筛选这些纳米涂层的制备工艺并调节其微观结构以优化抗菌涂层的表面。磁控溅射设备操作简单、易于控制、涂层面积大,对环境无污染,磁控溅射是一种典型的物理气相沉积技术[10-13]。通过该技术制备的涂层在基体和涂层间具有高的结合强度,涂层有优异的耐磨性和耐腐蚀性。磁控溅射技术可以在医疗器械表面制备出具有良好生物相容性的涂层,使医疗器械具有良好的溶血、抗菌等性能[14-15]。
本研究在经过抛光的纯Ti基底表面,采用磁控溅射技术,通过改变TiO2靶材与Ti靶材拼接时的体积比,制备出一组含纳米TiO2量不同的Ti-TiO2纳米复合涂层。对涂层采用扫描电子显微镜(scanning electron mlcroscope,SEM)和原子力显微镜(atomic force mlcroscope,AFM)表征微观形貌、能谱仪(energy dispersive spectrometer,EDS)测试其成分、X射线衍射仪(X-ray diffraction,XRD)测试其物相,以及体外细胞毒性试验,最后评估了涂层对具核梭杆菌菌落的抗菌作用,揭示涂层的微观形貌与涂层抗菌性能之间的关系。
1 试验材料和方法
1.1 涂层的制备
采用JGP-450型多靶磁控溅射仪制备Ti-TiO2纳米复合涂层。试验中使用的Ti靶材和纯TiO2靶材直径为50 mm、厚度为3 mm、质量分数为gg.gg%。基地采用规格为φ10 mmxl mm的纯Ti片。对于纯Ti基底,分别用800、1000、1200、2000、3000号金相砂纸进行打磨至表面光滑、没有划痕,而后使用抛光剂将纯Ti基底抛光至镜面。抛光后的纯Ti基底制复合靶材。图1是复合靶材的示意图。通过改变Ti靶材与TiO2靶材的体积比例进行反应溅射,以获得含不同量TiO2的Ti-TiO2涂层。当溅射室内的真空度低于1.5X101 Pa后,向溅射室内通人流量为40 mL/min的Ar进行反应溅射,将溅射室内的工作气压设置为0.8 Pa,溅射功率为l20 W。表l是试验分组及其工艺参数。试验过程中通过控制卡盘的白转获得均匀的Ti—TiO,涂层,其中卡盘的白转速度为1 r/s,Ti基底的溅射时间为10 min,沉积厚度约为100~200 nm。TiO,的抗菌机制是紫外光激活后产生活性氧从而发挥抗菌作用,所以在对Ti—TiO,涂层进行表征测试之前,会用ZF一7型暗箱三用紫外分析仪(上海勤科分析仪器有限公司)对负载涂层的样品进行紫外光照射预处理,所选用的紫外光波长为365 nm,照射时间为30 min,照射完成之后立即对样品进行相关表征测试。
1.2 涂层的结构与性能表征
采用D8 Advance型XRD对涂层进行物相分析,测量范围为20-- 80。。采用Quanta FEG450型场发射环境扫描电子显微镜对涂层的微观形貌结构进行了观察。采用Dimension Icon AFM来测试涂层的表面粗糙度。采用上海中晨数字技术设备有限公司的JC2000CI型接触角测量仪测试涂层的润湿性能,通过测量涂层表面与液相的接触角来反映涂层的润湿性,选用超纯水作为润湿性能测试过程中用到的水性测试剂。
1.3 涂层的体外细胞毒性试验
本试验采用CCK-8法检测L929细胞(小鼠成纤维细胞)与样品共培养24、48、72 h时细胞的活力变化。试验前使用蒸汽灭菌器(121℃,15 min)对各组材料进行灭菌消毒。先将试件放入无菌离心管内,然后将细胞完全培养基与样品表面积按照10 mL:1 cm2的比例加入样品表面,再将加了完全培养基的样品放入37℃的CO2恒温细胞培养箱72 h,制备成浸提液。本试验的分组为:空白对照组、阴性对照组(聚乙烯)、阳性对照组(苯酚)、纯Ti组、TiO2一l组、TiO2-2组、TiO2-3组、TiO2-4组、Ti0,一5组。其中空白对照组添加100 μL/孑L完全培養基,其它试验组添加100 μL/孔的对应样品工作液.每个浓度设置6个复孔。取对数生长期的L929细胞进行细胞计数,调整细胞浓度,按照6x103个/孔接种到96孔板中,再将其放入37℃的CO2恒温细胞培养箱中(5% CO2、95%湿度)培养过夜。按照上述分组处理,培养24、48、72 h,之后移除培养基,使用磷酸盐缓冲溶液(phosphate buffer saline,PBS)对各个孔进行清洗,清洗次数为3次。再将样品处于避光条件下,按照100 μL/孔加入含l0%CCK-8的培养基,放人37℃的C0,恒温细胞培养箱中培养2 h。采用酶标仪检测450 nm波长处96孔板内溶液的吸光度值(A),并通过以下公式计算细胞相对活力(relative growth rate,RGR) [16]:式中:RGR是待测样品的细胞相对活力;A待测样品是待测样品的吸光度值;A空白对照是空白对照组的吸光度值;A阴性对照是阴性对照组的吸光度值。根据表2判断试件的毒性等级和安全标准。将测得的数据结果通过SPSS22.0软件进行统计学分析,分别对纯Ti组和试验组的A进行单因素分析,以P<0.05表示差异具有统计学意义。
1.4 涂层的抗菌性能试验
采用平板涂布计数法评价试样对具核梭杆菌的抗菌性能。在样品的表面滴加10 μL浓度为1x103 CFU/mL的细菌悬浮液,再在样品的表面覆盖上无菌滤膜,之后将样品放人37℃恒温细胞培养箱中培养2h,之后把样品放入细菌培养管中,再在培养管中加入3 mL的无菌水,然后充分震荡,目的是为了对样品进行洗涤。震荡完成之后,从培养基中取适量洗涤液并将其均匀涂布于培养基上,再将培养基放入37℃恒温细胞培养箱内培养24 h,培养完成之将其取出,再进行平板菌落计数。通过统计菌落数可以计算处样品的抗菌率,而抗菌率代表了样品的抗菌性能,抗菌率的计算公式为[17]:
(2)式中:R代表抗菌率;X代表试验组试件平均回收菌落数;y代表空白对照组试件平均同收菌落数。
参照国家《HG/T 3950-2007》关于抗菌涂料的抗菌标准:如果R≥99,表示样品的抗菌性为I级,表示样品具有强抗菌作用;如果90≤R<99,表示样品的抗菌性为Ⅱ级,表示样品具有抗菌作用;如果R<90,则样品没有抗菌作用。上述试验过程重复3次,统计后取平均值。
2 结果与讨论
2.1 涂层的微观结构
图2(a)~(e)是在纯Ti基底表面制得的Ti-TiO2涂层的表面形貌。从图2(a)~(e)可知,样品表面整体平整光滑,无缺陷,薄膜的晶粒之间间距很小,排布紧密。图2(e)可以明显看出尺寸不同的两种颗粒,对图2(e)中所选的红框区域进行EDS元素定性分析,图2(f)是EDS元素定性分析结果。从图2(f)可知,所选的区域中存在Ti元素与O元素,证实了图2(e)中粒径较大的颗粒为纳米TiO2颗粒。Ti颗粒与TiO2颗粒的粒径均为纳米级,纳米TiO2颗粒的粒径明显大于纳米Ti颗粒的粒径,随着拼接靶材中TiO2靶材的拼接比例增加,TiO2的含量逐渐增加,纳米TiO2颗粒逐渐增多。
图3为Ti-TiO2涂层的XRD谱图。图3中出现了TiO2(101)晶面的衍射峰和Ti(101)晶面的衍射峰。样品衍射峰尖锐,没有杂峰,说明制得的纳米TiO2、纳米Ti结晶度好,纯度高,样品在36。左右出现TiO2(101)晶面衍射峰,说明制得的纳米TiO2是金红石晶型,金红石晶型的纳米TiO2具有较好的光催化活性[IS]。纳米TiO2在生长过程中沿单- (101)取向生长。
图4是在纯Ti基底上制得的各组样品表面涂层的AFM图,其对应的表面粗糙度见表3。由AFM结果可见,各组样品表面涂层形貌均有较多的纳米颗粒均匀分布,纳米Ti颗粒与纳米TiO2颗粒完全覆盖在Ti基底表面,呈薄膜状,涂层表面起伏较小。从图4中可以看出,每组样品表面的纳米颗粒排布平整致密。相比图4(a)和图4(b)中涂层表面的颗粒尺寸,图4(c)~(e)中涂层表面的颗粒更小,且涂层表面更加致密。这可能是TiO2所占体积比例增多从而细化了晶粒所致。表3为各组样品涂层的表面粗糙度。从表3中结果可知,制得的各组样品表面的Ti-TiO2涂层都是平整光滑的,随着TiO2体积比例的逐渐增加,Ti-TiO2涂层的表面粗糙度逐渐增大,样品TiO2-5组的表面粗糙度最大,该组的轮廓算术平均偏差值为1.28 nm。
2.2 涂层的润湿性能
图5是纯Ti基底以及在纯Ti基底上制得各组样品表面与液相接触角的分析。细菌容易粘附聚集在种植体表面从而形成细菌生物膜,而细菌生物膜是导致种植体周围炎的主要原因,当涂层表面具有较好的疏水性时,细菌便不容易黏附在种植体表面,而细菌形成生物膜也就得到了抑制[19]。图5中未加涂层的纯Ti基底表面的接触角小于90°,表明纯Ti基底的表面是亲水性的,而所有的涂层组表面的接触角均大于90°,这表明这些涂层都具有较好的疏水性,TiO2-5组的涂层表面接触角达到了100.42°,该组的疏水性最好。当表面接触角大于90°时,表面接触角会随着表面粗糙度的增加而逐渐增大,材料表面会变得更加疏水[20]。
2.3 涂層的细胞毒性
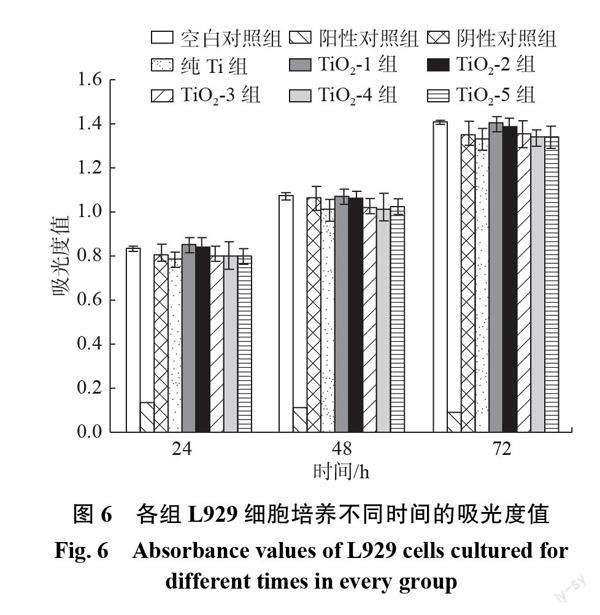
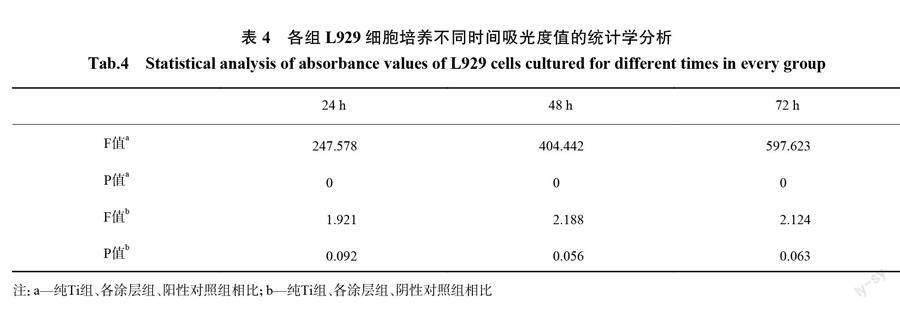
图6是空白对照组、阳性对照组、阴性对照组、纯Ti组以及不同TiO2含量的各涂层组中的L929细胞培养不同时间的吸光度值,如图所示,阴性对照组、纯Ti组以及空白对照组这3组在同时间相应的吸光度值几乎一样。表4是各组L929细胞培养不同时间的吸光度值的统计学分析。从表中可以得出,阴性对照组、空白对照组和纯Ti组相比较,涂层组的吸光度值差异均没有统计学意义(P>0.05),各涂层组之间的吸光度值差异也没有统计学意义(P>0.051。阴性对照组、空白对照组、纯Ti组及涂层组与阳性对照组相比,差异均具有显著的统计学意义(P<0.01)。表5为各组L929细胞培养不同时间的细胞相对活力,从表中可以得出,除了阳性对照组、其余各组的细胞相对活力均大于90%,且无毒性反应。根据表2可以判断这几组均属于安全性材料。由此可知,从TiO2-I组到TiO2-5组,虽然纳米TiO2的含量增高,但L929细胞相对活力仍大于90%,纯Ti组和各涂层组均无细胞毒性,符合生物安全性材料的标准。
2.4涂层的抗菌性能
图7是不同样品组具核梭杆菌的平板菌落照片。从图7中可以看出,随着样品表面涂层中纳米TiO2含量的逐渐增加,样品组中的具核梭杆菌的菌落数相比没有涂层的纯Ti对照组中的菌落数是逐渐减少的,其中,TiO2-5组的具核梭杆菌菌落数相比纯Ti对照组的菌落数明显减少。这可能是更多数量的纳米TiO2受到紫外光的激发而产生了更多的活性氧,活性氧会破坏细菌生物膜进入细菌体内,从而发挥抗菌作用[9]。图8是不同样品组对具核梭杆菌的抑菌效率的百分比。从图8中可以看出,随着样品表面涂层中纳米TiO2含量的逐渐增加,样品的抑菌率是逐渐上升的,TiO2-1组的纳米TiO2的含量很少,即只有少量的纳米TiO2受到紫外光的激发产生活性氧 ,所以抑菌率为 62.73%, TiO2-2 组至TiO2-5 组的抑菌率均大于 70%,其中 TiO2-5 组的抑菌率达到了 90.94%,表示该组的样品抗菌性为Ⅱ级,该组样品具有抗菌作用。
3 结 论
(1)磁控溅射技术制备出的 Ti-TiO2 纳米复合涂层的表面平整光滑,纳米 TiO2 颗粒的粒径大于纳米 Ti 颗粒的粒径,随着拼接靶材 TiO2 靶材的体积比例增加,涂层中的 TiO2 含量逐渐增加。制得的纳米 TiO2 是金红石晶型,纳米 TiO2 在生长过程中沿单一 (101) 取向生长。
(2)样品的表面粗糙度随着复合拼接靶材中TiO2 靶材的体积比的逐渐增加而增大。在 Ti 靶材与 TiO2 靶材体积比比为 95∶5 时,样品的表面粗糙度最大,算术平均偏差值为 1.28?nm。
(3)纯 Ti 基底表面在未负载涂层时具有亲水性。所有样品在负载了 Ti-TiO2 涂层之后,表面的接触角均大于 90°,这表明 Ti-TiO2 涂层具有较好的疏水性。当表面接触角大于 90°时,表面接触角会随着表面粗糙度的增加而增大。当 Ti 靶材与 TiO2 靶材体积比为 95∶5 时,样品的疏水性能最佳。
(4)TiO2-1 组至 TiO2-5 组的 L929 细胞相对活力均大于 90%,说明制得的各涂层组均无细胞毒性,符合生物安全性材料的标准。
(5)随着拼接靶材中 TiO2 靶材体积比的增加,样品的抑菌率逐渐上升,在 Ti 靶材与 TiO2 靶材体积比为 95∶5 时,样品的抑菌率最高,达到 90.94%,,此时认为其抗菌性能最佳 。
参考文献:
[1] ZHANG E L. ZHAO X T. HU J L. et al. Antibacterialmetals and alloys for potential biomedical implants[J].Bioactive Materials. 2021. 6(8): 2569-2612.
[2] MOKABBER T. ZHOU Q, VAKIS A I. et al.Mechanical and biological properties of electrodepositedcalcium phosphate coatings[J]. Materials Science andEngineering:C, 2019. 100: 475-484.
[3] BASOVA T V. VIKULOVA E S. DOROVSKIKH S I.et al. The use of noble metal coatings and nanoparticlesfor the modification of medical implant materials[J].Materials & Design, 2021, 204: 109672.
[4]CHA J K. LEE J S. KIM C S. Surgical therapy of Peri-Implantitis with local minocycline: a 6-monthrandomized controlled clinical trial[J]. Joumal of DentalResearch. 2019, 98(3): 288-295.
[5] TOMASI C. SOLDINI C. WENNSTRM J L. Treatmentof periodontal patients-current clinical concepts[J].Shanghai Journal of Stomatology, 2007. 16(2): 1 13-122.
[6] CHEN W L. ZHI M. FENG Z J. et al. Sustained co-delivery of ibuprofen and basic fibroblast growth factorby thermosensitive nanoparticle hydrogel as early localtreatment of peri-implantitis[J]. International Joumal ofNanomedicine. 2019. 14: 1347-1358.
[7]FLORES C Y. DIAZ C. RUBERT A, et al. Spontaneousadsorption of silver nanoparticles on Ti/Ti02 surfaces.Antibacterial effect on Pseudomonas aeruginosa[J]. Joumal of Colloid and Interface Science. 2010. 350(2):402-408 .
[8] CHIDAMBARANATHAN A S. MOHANDOSS K,BALASUBRAMANIAM M K. Comparative evaluationof antifungal effect of titanium. zirconium andAlumimum nanoparticles coated titanium plates AgainstC. albicans[J]. Joumal of Clinical and DiagnosticResearch. 2016. 10(1): ZC56-ZC59.
[9l贾璐,高旭.葛少华.光催化纳米-氧化钛材料的抗菌及 机制其影响因素 [J].口腔医学, 2017. 37(1): 81-84.
[10] CHUNG J L. CHEN J C. TSENG C J. Preparation ofTi02-doped Zno films by radio frequency magnetronsputtering in ambient hydrogen -argon gas[J]. AppliedSurface Science. 2008. 255(5): 2494-2499.
[11] LU Y M. CHANG C M. TSAI S I, et al. Improving theconductance of Zno thin films by doping with Ti[J].Thin Solid Films. 2004. 447-448: 56-60.
[12] LIN S S. HUANG J L. SAJGALIK P. The properties ofTi-doped Zno films deposited by simultaneous RF andDC magnetron sputtermg[J] Surface and CoatingsTechn0109y,2005,19l(2/3):286—292
[13] WU S J,HAN H W,TAI Q D,et al Improvement indye—SenSitized SOlar Ce11S With a Zn0一COated Ti02electrode by rf magnetron sputtering[J]Applied PhysicsLetters,2008,92(121:122106
[14] 白曉明,郑伟涛,安涛.超硬纳米多层膜和复合膜的研究综述[J].自然科学进展,2005,15(1):21—28
[15] REN P,ZHANG K,WEN M,et al The r01es of AglayerS in regUlating Stl'engthening—tOUghening behaViOrand tribOChemiStry Of the Ag/TaC nanO—mUltilayernlms[J]Applied Surface Science,20 1 8,445:4 1 5—423
[16]姜久仰,刘宏宇,徐吉林,等.医用Ti一6A1—4V合金表面氟硅烷超疏水涂层的制备及生物学性能[J]稀有金属材料与工程,2019,48(6):1884—1891
[17]王帅,杨春光,徐大可,等热处理对3Crl3MoCu马氏1453-1460.
[18] GUILLARD C. BUI T H. FELIX C. et al.Microbiological disinfection of water and air byphotocatalysis[J]. Comptes Rendus Chimie. 2008.11(1/2): 107-113.
[19] GOEL S. DUBEY P. RAY S. et al. Co-sputteredantibacterial and biocompatible Nanocomposite Titania-Zinc oxide thin films on Si substrates for dental implantapplications[J]. Materials Technology, 2019, 34(1):32-42.
[20] WEI Y J. SILIKAS N. ZHANG Z T. et al. Therelationship between cyclic hygroscopic dimensionalchanges and water sorption/desorption of self-adheringand new resm-matrix composites[J]. Dental Materials.2013. 29(9): e218-e226.
