基线18F-FDG PET/CT代谢参数对伴有转移的食管鳞状细胞癌放化疗患者预后的预测价值
2023-05-29夏连爽王洋洋董娴宁杨光杰李晓旭高宅崧张驹王振光
夏连爽王洋洋董娴宁 杨光杰李晓旭高宅崧张驹王振光
1青岛大学附属医院核医学科PET 中心,青岛 266100;2 青岛大学附属医院病理科,青岛 266100
目前,食管癌位居全球恶性肿瘤死亡原因的第6位[1],其中东亚地区发病率最高。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)占食管癌的90%以上[2],预后较差,且由于发现不及时,50%以上的患者发现时已为中晚期,无法进行手术,放疗和化疗为其主要的治疗方式。美国癌症联合委员会(American Joint Comm ittee on Cancer,AJCC)食管癌TNM分期对接受放化疗的ESCC患者的指导意义和预测价值有限[3-4],其预后评估主要依靠影像学方法。18F-FDG PET/CT 检查作为一种有前景的影像学检查方法而备受关注[5-8],但之前的研究多局限于原发病灶,对淋巴结及远处器官转移灶的研究较少,尤其是对于部分食管癌原发灶肿瘤负荷小,而转移灶肿瘤负荷大的患者,原发灶的代谢参数无法完全反映整体肿瘤负荷。本研究提出了3个比值参数即治疗前转移灶与原发灶的SUVmax、肿瘤代谢体积(metabolic tumor volume,MTV)以及病灶糖酵解总量(total lesion glycolysis,TLG)的比值(the ratio of SUVmax,R-SUVmax)、(the ratio of MTV,R-MTV)、(the ratio of TLG,R-TLG)。本研究回顾性分析放化疗前基线18F-FDG PET/CT代谢参数对ESCC患者预后的预测价值。
1 资料与方法
1.1 研究对象
回顾性分析2013年11月至2021年4月于青岛大学附属医院PET中心行18F-FDG PET/CT 检查的食管癌患者的临床资料。纳入标准:(1)Karnofsky(KPS)评分≥70分,无严重心、肺、肝、肾功能障碍;(2)组织病理学检查确诊为ESCC;(3)伴有淋巴结转移或远处器官转移;(4)18F-FDG PET/CT检查前未接受放化疗等肿瘤相关治疗;(5)检查后2周内开始接受放化疗等相关治疗。排除标准:(1)接受食管癌相关手术;(2)合并其他肿瘤;(3)影像资料及随访资料不完整。本研究共纳入106例患者,其中男性98例、女性8例,年龄(63.9±8.8)岁。本研究已获得青岛大学附属医院伦理委员会批准(批准号:QYFYWZLL 27217)。所有患者均于检查前签署了知情同意书。
1.2 仪器与方法
使用美国GE Discovery VCT型PET/CT扫描仪进行扫描。18F-FDG 由日本Sum itomo公司回旋加速器及自动合成模块生成,放射化学纯度>95%。所有患者行PET/CT 检查前禁食6 h 以上,血糖水平均<11.1mmol/L。按体重静脉注射3.7~5.5MBq/kg剂量的18F-FDG,患者静卧约60m in 进行PET/CT扫描,扫描范围自颅骨顶点至股骨中段,获得全身CT 图像。扫描参数:探测器覆盖范围40mm、覆盖速度29.46mm/s、机架旋转时间0.7 s、管电压120 kV、管电流110 mA、螺距0.516、视野70 cm、矩阵512×512、层厚3.75mm。CT 扫描后进行PET 扫描,扫描条件为每个床位采集3min,共采集7~9个床位(轴位视野70 cm)。PET 图像重建采用20个子集、2次迭代的三维有序子集期望最大化算法。增加屏气胸部CT扫描,轴位胸部图像以层厚1.25mm、间隔1.25 mm 进行重建。PET 图像经CT数据进行衰减校正,最终得到PET/CT融合图像。
1.3 图像分析
采用美国GE 公司Advantage Workstation 4.7软件,参考横断面、矢状面及冠状面上的病灶图像,以40% SUVmax[9]作为阈值,自动勾画治疗前食管癌原发灶及转移灶的ROI,对于自动勾画不准确的区域由有8年以上工作经验的核医学科医师采用手动勾画的方式进行校正,获得相应的食管癌原发灶的SUVmax,原发灶的MTV (MTV of primary lesion,MTVp),原 发 灶 的TLG(TLG of primary lesion,TLGp)和全身病灶的MTV(MTV of whole body,MTVwb),全身病灶的TLG(TLG of whole body,TLGwb),转移灶与原发灶SUVmax,MTV,TLG 的比值(R-SUVmax、R-MTV、R-TLG)。所有数据由同一名核医学科医师测量和记录。转移性淋巴结的诊断标准为SUVmax>2.5[10],若其存在明显的CT 良性征象,如整体高密度(CT值>71 HU)、伴有成熟钙化、淋巴结门结构清晰等,则无论18F-FDG 摄取如何,均认为是良性淋巴结[11-12]。
1.4 随访
对患者进行定期门诊或电话随访。随访安排在治疗结束后1个月,初始2年内3个月复查1次,2~5年每半年复查1次,5年以后每年复查1次,直至随访结束或研究结束。复查随访方案包括体格检查、实验室检查、胸部增强CT、上消化道钡剂造影、颈部及腹部超声,必要时进行胃镜及PET/CT检查。随访时间至少6个月。评价预后的指标选用无进展生存(progression-free survival,PFS)期及总生存(overall survival,OS)期。PFS期为患者行PET/CT 检查之日起,至第一次疾病进展、死亡或随访截止时间;OS期为患者行PET/CT 检查之日起,至因任何原因引起死亡或随访截止时间。随访截止日期为2021年11月30日。
1.5 统计学分析
采用SPSS 25.0软件对数据进行统计学分析。符合正态分布的计量资料以表示,非正态分布的计量资料以M(Q1,Q3)表示。应用X-tile软件获得原发灶SUVmax、MTVp、TLGp、MTVwb、TLGwb、R-SUVmax、R-MTV、R-TLG 的最佳临界值。采用Kaplan-Meier 法进行单因素分析,以Log-Rank 检验进行显著性检验。通过多重共线性分析去除有影响的因素后采用Cox 比例风险模型进行多因素分析。联合独立危险因素进行进一步亚组分析。P<0.05为差异有统计学意义。
2 结果
2.1 随访结果
中位随访时间为11个月。至随访结束时,84例(79.2%)患者疾病进展,其中76例(71.7%)死亡,中位PFS期为9个月(1~63个月),中位OS期为11个月(1~63个月)。
2.2 18F-FDG PET/CT 代谢参数预测ESCC患者PFS期和OS期的最佳临界值
18F-FDG PET/CT代谢参数预测106例ESCC患者PFS期和OS期的最佳临界值如表1所示。
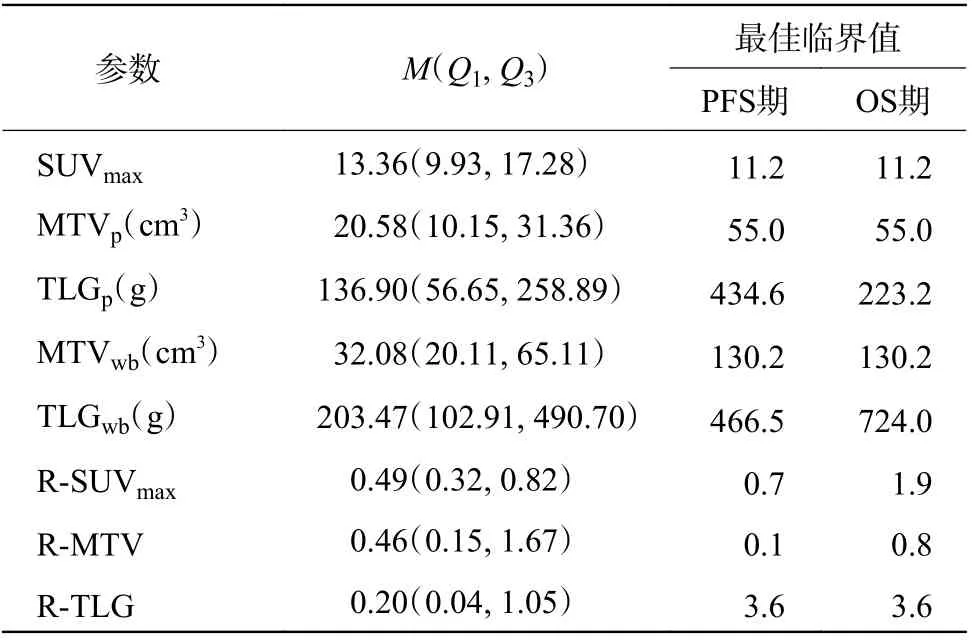
表1 18F-FDG PET/CT 代谢参数预测106例食管鳞状细胞癌患者PFS期和OS期的最佳临界值Tab le 1 The optimal cut-off values of 18F-FDG PET/CT metabolic parameters for predicting progression-free survival and overall survival in 106 patients w ith esophageal squamous cell carcinoma
2.3 生存分析
单因素分析结果显示,T分期、MTVp、TLGp、MTVwb、TLGwb、R-TLG 是影响接受放化疗ESCC患者PFS期及OS期(均P<0.05)的危险因素(表2,表3);多因素分析结果显示,T分期、R-TLG 是影响ESCC患者PFS期(HR=2.210,95%CI:1.307~3.737,P=0.003;HR=3.118,95%CI:1.414~6.875,P=0.005)及OS期(HR=1.885,95%CI:1.072~3.317,P=0.028;HR=2.584,95%CI:1.186~5.629,P=0.017)的独立危险因素(表4)。

表2 106例食管鳞状细胞癌患者的临床特征及单因素分析Tab le 2 Clinical features and univariate analysis of 106 patientsw ith esophageal squamous cell carcinoma

表3 18F-FDG PET/CT 代谢参数预测106 例食管鳞状细胞癌患者PFS期和OS期的单因素分析Table 3 Univariate analysis of 18F-FDG PET/CT metabolic parameters for predicting progression-free survival and overall survival in 106 patientsw ith esophageal squamous cell carcinoma
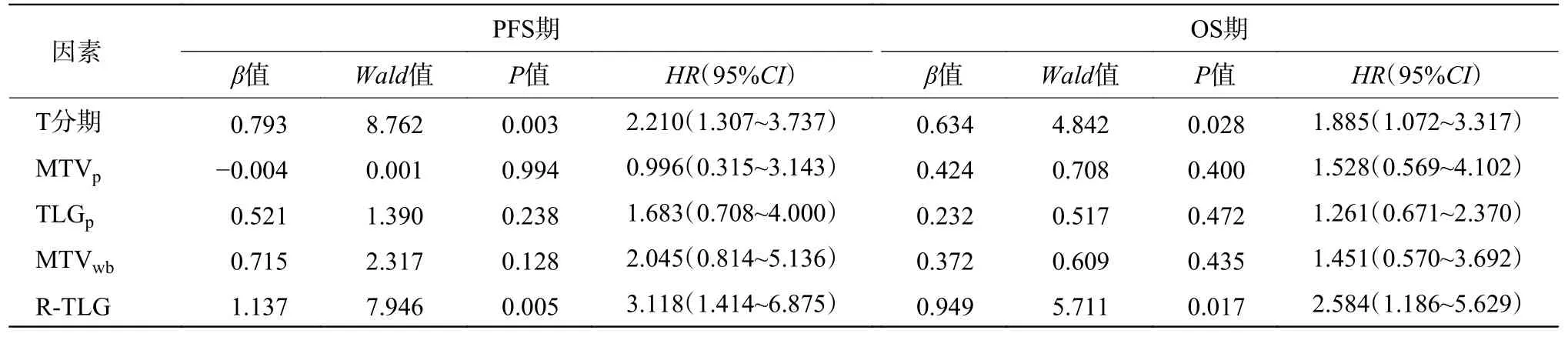
表4 106例食管鳞状细胞癌患者PFS期和OS期的多因素分析Table 4 Multivariate analysis for predicting progression-free survival and overall survival in 106 patients w ith esophageal squamous cell carcinoma
联合T 分期及R-TLG 将患者分为3组:低R-TLG 且T1~2期为低危组(n=34)、高R-TLG 或T3~4期为中危组(n=68)、高R-TLG且T3~4期为高危组(n=4),结果显示,各组患者间PFS期及OS期的差异均有统计学意义(χ2=38.392、19.857,均P<0.001)(图1)。T分期越高、R-TLG越大,ESCC 患者生存期越短,预后越差。典型病例见图2~3。

图1 18F-FDG PET/CT 代谢参数R-TLG 联合T 分期预测106例食管鳞状细胞癌患者PFS期(A)和OS期(B)预后的Kaplan-Meier 生存曲线FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;R-TLG 为转移灶与原发灶病灶糖酵解总量的比值;PFS为无进展生存;OS为总生存Figure 1 Kaplan-Meier survival curves for progression-free survival and overall survival of 106 patients w ith esophageal squamous cell carcinoma according to 18F-FDG PET/CT metabolic parameter R-TLG combined w ith T stage

图2 低R-TLG 食管鳞状细胞癌患者(男性,55岁)的18F-FDG PET/CT 显像图A~C分别为全身M IP图、病灶部位冠状面、矢状面软组织窗PET/CT 融合图像;D~F为病灶部位横断面软组织窗PET/CT 融合图像 图中可见食管上段管壁增厚,代谢增高,SUVmax 约为13.6;D~F 图中箭头所示依次为纵隔内气管前腔静脉后、左侧锁骨上及右侧锁骨上淋巴结转移灶代谢增高,代谢最高者病灶的SUVmax 约为3.4;MTVp、TLGp、MTVwb、TLGwb、R-TLG 分别为54.87 cm3、433.69 g、62.40 cm3、450.22 g、0.038。患者接受放化疗,至随访截止时间,患者生存,OS期为44 个月。R-TLG 为转移灶与原发灶糖酵解总量的比值;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;M IP 为最大密度投影;SUVmax 为最大标准化摄取值;MTVp 为原发灶肿瘤代谢体积;TLGp 为原发灶病灶糖酵解总量;MTVwb为全身肿瘤代谢体积;TLGwb为全身病灶糖酵解总量;OS为总生存Figure 2 18F-FDG PET/CT images of a patient (male,55 yearsold) w ith esophageal squamouscell carcinoma w ith low R-TLG

图3 高R-TLG 食管鳞状细胞癌患者(男性,72岁)的18F-FDG PET/CT 显像图A~D 分别为全身M IP图、病灶部位横断面、冠状面、矢状面软组织窗PET/CT 融合图像,图中可见食管下段管壁增厚,代谢增高,SUVmax 约为8.8;B~D图中箭头所示为肝胃间隙淋巴结转移,代谢增高,SUVmax 约为16.0;MTVp、TLGp、MTVwb、TLGwb、R-TLG 分别为5.58 cm3、21.38 g、154.58 cm3、1152.11 g、52.89。患者接受放化疗,于随访期间死亡,OS期为1个月。R-TLG 为转移灶与原发灶病灶糖酵解总量的比值;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;M IP 为最大密度投影;SUVmax 为最大标准化摄取值;MTVp为原发灶肿瘤代谢体积;TLGp 为原发灶病灶糖酵解总量;MTVwb为全身肿瘤代谢体积;TLGwb为全身病灶糖酵解总量;OS为总生存Figure 3 18F-FDG PET/CT imagesof a patient (male,72 yearsold)w ith esophageal squamous cell carcinoma w ith high R-TLG
3讨论
食管癌预后较差,尤其对于无法接受手术治疗的中晚期患者[13],其治疗方式主要为放疗和化疗。由于无法取得组织病理学分期,其预后评估主要依靠影像学方法。传统影像学方法对于水肿、坏死、瘢痕或残存肿瘤组织无法准确区分,不能充分反映肿瘤负荷。而18F-FDG PET/CT检查通过糖代谢的变化来评估全身肿瘤负荷,不仅能够提供解剖学信息,还能反应肿瘤的生物学信息。
SUVmax为应用最广泛的代谢参数之一,但目前关于SUVmax在食管癌预后中的意义仍有争议[14-16]。本研究结果表明,SUVmax对预测接受放化疗的ESCC患者预后无参考价值,而MTV 及TLG 相关参数对预后有参考价值,这与其他研究结果一致[17-19]。本研究的重点为代谢参数比值对于接受放化疗的ESCC患者预后的影响,结果表明,R-TLG对其具有独立预后意义。之前的研究大多基于原发灶本身,而忽视了淋巴结及远处器官转移对预后的影响[5-8]。如Li等[5]对86例接受非手术治疗的ESCC 患者进行研究,结果证实治疗前MTVp和TLGp是预测ESCC患者预后的良好指标;Shen等[7]的研究结果表明,原发灶SUVmax、MTVp、TLGp和血清鳞状细胞癌抗原(SCC-Ag)为预测ESCC 患者OS期的独立预后因素;这些研究均只探讨了原发灶的相关参数。也有研究除TLGp外还分析了TLGwb,结果证实TLGwb是手术治疗ESCC 患者OS期和PFS期的重要预后因素[20-21]。汤泊等[22]研究结果表明,食管癌放化疗前的TLGwb为影响食管癌患者预后的独立危险因素。邱云亮等[23]研究了73例老年ESCC患者,结果也表明治疗前TLGwb是老年ESCC患者预后的独立危险因素。根据我们的研究结果,在单因素分析中TLGp及TLGwb与预后相关,但多因素分析结果显示,R-TLG 而非TLGp或TLGwb为ESCC患者的独立预后因素,这可能与比值参数的参数校正作用有关,R-TLG能够减少示踪剂剂量和患者体重的不确定性、减少采集时间、图像重建及机器校准等因素所带来的影响[24],对预测患者的预后意义更大。
迄今为止,转移灶与原发灶代谢参数比值在食管癌中的研究较少。之前有关于SUVmax比值参数的相关研究,如Lin 等[25]分析根治性放化疗前ESCC患者转移淋巴结SUVmax与原发肿瘤SUVmax比值(SUVLN/SUVTumor)的预后价值,结果表明,该比值是患者无远处转移生存率和OS期的独立预后因素;Chen 等[26]对于非手术治疗食管癌的研究也得到类似结果。在本研究中,我们不局限于转移淋巴结,远处器官转移也是我们的研究范围,这样更加能够反映患者的整体情况。此外,本研究不仅关注转移灶与原发灶SUVmax的比值,R-MTV 和R-TLG比值参数也被纳入研究。本研究结果表明,R-TLG 可以从糖代谢负荷方面反映肿瘤的侵袭性,与R-TLG较高的ESCC患者相比,R-TLG较低的患者OS期更长,结果证实了转移灶与原发灶相对代谢负荷的重要性,表明R-TLG 在放化疗ESCC 患者预后分层中的重要意义。
本研究采用第8版美国癌症联合委员会食管癌TNM 分期标准[4],结果表明,T 分期为影响接受放化疗ESCC患者生存的重要因素。我们联合T分期及R-TLG将患者分为3个亚组进行分析,结果显示各组之间OS期存在差异,进一步表明二者在接受放化疗ESCC患者中的预后价值,可以很好地对患者进行危险分层。
本研究存在一定的局限性:(1)本研究为回顾性研究,存在选择偏倚;(2)本研究为单中心研究且样本量较少;(3)本研究对象为接受放化疗的ESCC患者,结果是否适用于其他患者尚未可知。
综上所述,ESCC患者放化疗前T 分期及18F-FDG PET/CT 代谢参数R-TLG为PFS期及OS期的独立预后因素,可以指导临床对患者进行危险度的分层,从而制定个体化的治疗方案,使患者获益。
利益冲突所有作者声明无利益冲突
作者贡献声明夏连爽负责文献的检索、数据的收集、统计与分析、论文的撰写与修改;王洋洋、董娴宁负责文献的检索与分析;杨光杰负责命题的提出与设计;李晓旭、高宅崧、张驹负责数据的收集、统计与分析;王振光负责命题的提出与设计、论文的修改与审阅
