腹泻型肠易激综合征患者的血清IL-10、CCL16水平及其临床意义
2023-05-28陈树松
陈 成 陈树松
肠易激综合征(IBS)是一种常见的功能性肠病,以腹痛或腹部不适伴排便次数和粪便性状改变为特征,无器质性病变,其发病率较高,以中青年居多,且多见于女性,其中以腹泻型IBS(IBS-D)较为常见[1]。IBS 症状的反复发作,目前其发病机制尚未明确,近年来研究发现肠道微生态失衡和肠黏膜免疫激活是IBS(尤其是IBS-D)发病的重要因素[2-3]。探究免疫调节相关因子与患者的IBS-D症状及肠道菌群的关系,对于IBS-D 发病机制的研究和临床用药指导具有重要意义。血清学标志物检测具有取样便捷、操作简单、无创性、价格低廉等优势。既往研究发现,免疫调节相关因子IL-10、CC 趋化因子配体16(CCL16)在IBS 患者中表达异常,但两者的的表达变化尚存在争议[4-7]。本研究检测了IBS-D 患者的血清IL-10、CCL16 水平,并分析了其与IBS-D 症状严重程度及粪便菌群的相关性,以期为临床诊治IBS-D 提供参考。
1 研究对象与方法
1.1 研究对象
选择2019 年1 月至2022 年12 月在来安家宁医院就诊的65 例IBS-D 患者设为IBS-D 组,另选择67 名同期健康体检者设为对照组。IBS-D 组患者的纳入标准:(1)符合IBS-D 罗马Ⅳ诊断标准[8],即松散(糊状)粪便或水样粪便≥25%,硬质粪便或干球状粪便<25%;(2)年龄20~59 岁;(3)近2 个月内未服用抗生素、益生菌等;(4)腹部超声、结肠镜等检查无异常,排除器质性疾病;(5)临床资料完整。对照组的纳入标准为年龄20~59 岁,无肠道疾病,无自身免疫病,无感染病史,近2 个月内未使用抗生素、益生菌等药物。排除标准:(1)合并其他系统严重疾病,恶性肿瘤者;(2)有乙醇、药物滥用史者;(3)智力精神障碍,不能配合研究者;(4)处于妊娠期、哺乳期或月经期的女性;(5)有腹部手术史者。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 血清IL-10、CCL16 水平检测
所有受试者均于清晨抽取空腹静脉血6 mL,离心分离血清,应用ELISA 法检测血清IL-10、CCL16 水平,检测步骤参照IL-10 ELISA 试剂盒(购自南京森贝伽生物科技有限公司)、CCL16 ELISA试剂盒(购自上海西格生物科技有限公司)说明书进行,用Infinite F50 酶标仪(购自瑞士Tecan 公司)测定吸光度(OD)值,通过制作标准曲线计算血清IL-10、CCL16 水平。所有操作均由同一位检验科医生完成。
1.3 粪便菌群检测
采集所有受试者的新鲜粪便,采用细菌三级鉴定法对粪便菌群(双歧杆菌、乳杆菌、拟杆菌和肠杆菌)进行鉴别,并计算每克粪便中的菌群数量。
1.4 IBS-D 症状严重程度评估
采用Francis 等[9]的IBS 严重程度评分量表评估患者的IBS-D 症状严重程度,该量表从腹痛发作次数、腹痛不适程度、当天腹胀不适程度、肠道症状对生活的干扰程度、对排便情况的满意度共5 个方面对IBS-D 症状进行量化评价,每个方面均有5 个选项,程度从轻到重依次递进20 分,满分为100 分。计算IBS 症状严重程度总评分(5 项评分之和),根据总评分将IBS-D 患者分为轻中度组和重度组(75~175 分为轻度;176~300 分为中度;>300 分为重度)。
1.5 统计学分析
采用SPSS 25 软件对数据进行统计学分析。计量资料经K-S检验均符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例(%)表示,组间比较采用χ2检验。采用Pearson 或Spearman 相关性分析探究IBS-D 患者的血清IL-10、CCL16 水平与肠道菌群、IBS-D症状严重程度评分的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组的一般资料比较
2 组的性别、年龄、BMI 相比较,差异均无统计学意义(P>0.05)。见表1。

表1 2 组的一般资料比较
2.2 2 组的血清IL-10、CCL16 水平比较
如表2 所示,IBS-D 组的血清IL-10、CCL16 水平均显著高于对照组(P均<0.05)。
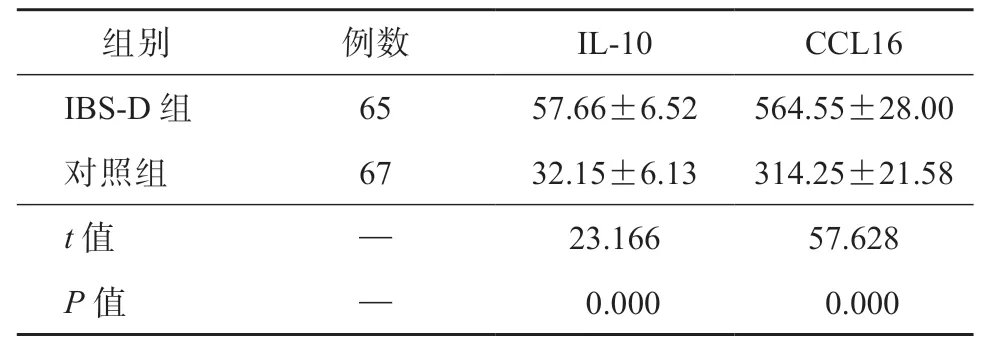
表2 2 组的血清IL-10、CCL16 表达水平比较/pg·mL-1
2.3 2 组的粪便菌群数量比较
如表3 所示,与对照组相比,IBS-D 组的粪便中双歧杆菌、乳杆菌数量均显著减少(P均<0.05),肠杆菌数量显著增多(P<0.05)。2 组的粪便中拟杆菌数量差异无统计学意义(P>0.05)。

表3 2 组的粪便菌群数量比较/log CFU·g-1
2.4 IBS-D 症状严重程度评分
IBS-D 症状严重程度评分中,腹痛发作次数评分最高[(70.00±9.56)分],其余依次为肠道症状对生活的干扰程度评分[(56.00±13.27)分]、对排便情况的满意度评分[(52.00±12.31)分]、腹痛不适程度评分[(48.00±12.31)分],当天腹胀不适程度评分最低[(36.00±9.12)分]。IBS-D 症状严重程度总评分为(262.00±41.25)分。
2.5 不同IBS-D 症状严重程度患者的血清IL-10、CCL16 水平及粪便菌群数量比较
根据IBS 症状严重程度总评分将65 例IBS-D患者分为轻中度组(51 例,其中轻度5 例,中度46例)和重度组(14 例)。如表4 所示,与中轻度组相比,重度组的血清IL-10、CCL16 水平均升高(P均<0.05),粪便中肠杆菌数量显著增多(P<0.05),双歧杆菌、乳杆菌数量均显著减少(P均<0.05)。重度组与轻中度组的粪便中拟杆菌数量差异无统 计学意义(P>0.05)。
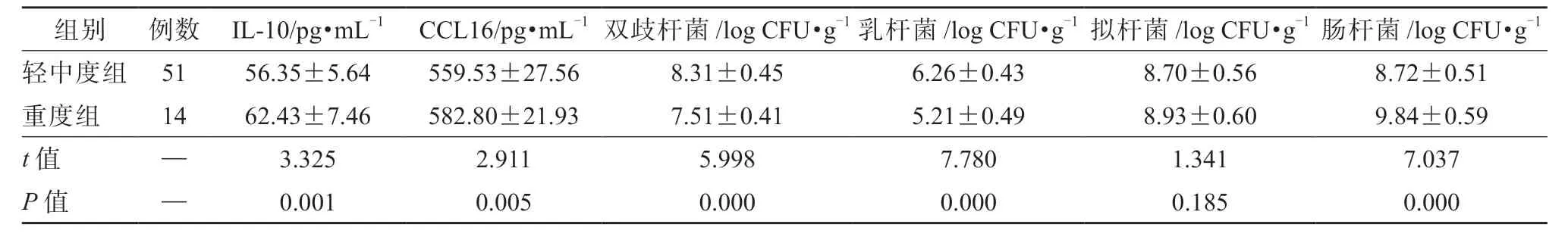
表4 不同IBS-D 症状严重程度患者的血清IL-10、CCL16 水平及粪便菌群数量比较
2.6 IBS-D 患者的血清IL-10、CCL16 水平与粪便菌群、IBS-D 症状严重程度评分的相关性
Pearson 相关性分析结果显示,IBS-D 患者的血清IL-10 水平与血清CCL16 水平呈正相关(r=0.390,P=0.001),见图1。Pearson 相关性分析结果显示,血清IL-10、CCL16 水平与双歧杆菌、乳杆菌数量均呈负相关(P均<0.05),与肠杆菌数量呈正相关(P<0.05),与拟杆菌数量不相关(P>0.05);Spearman 相关性分析结果显示,血清IL-10、CCL16 水平与IBS-D 症状严重程度各项评分及总评分均呈正相关(P均<0.05);见表5。
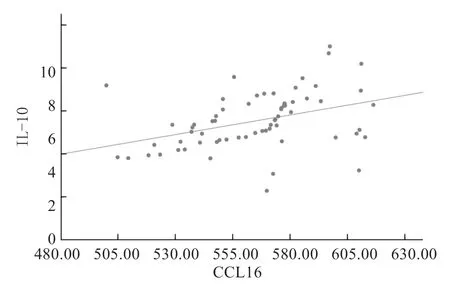
图1 IBS-D 患者的血清IL-10 水平与血清CCL16 水平的相关性分析散点图
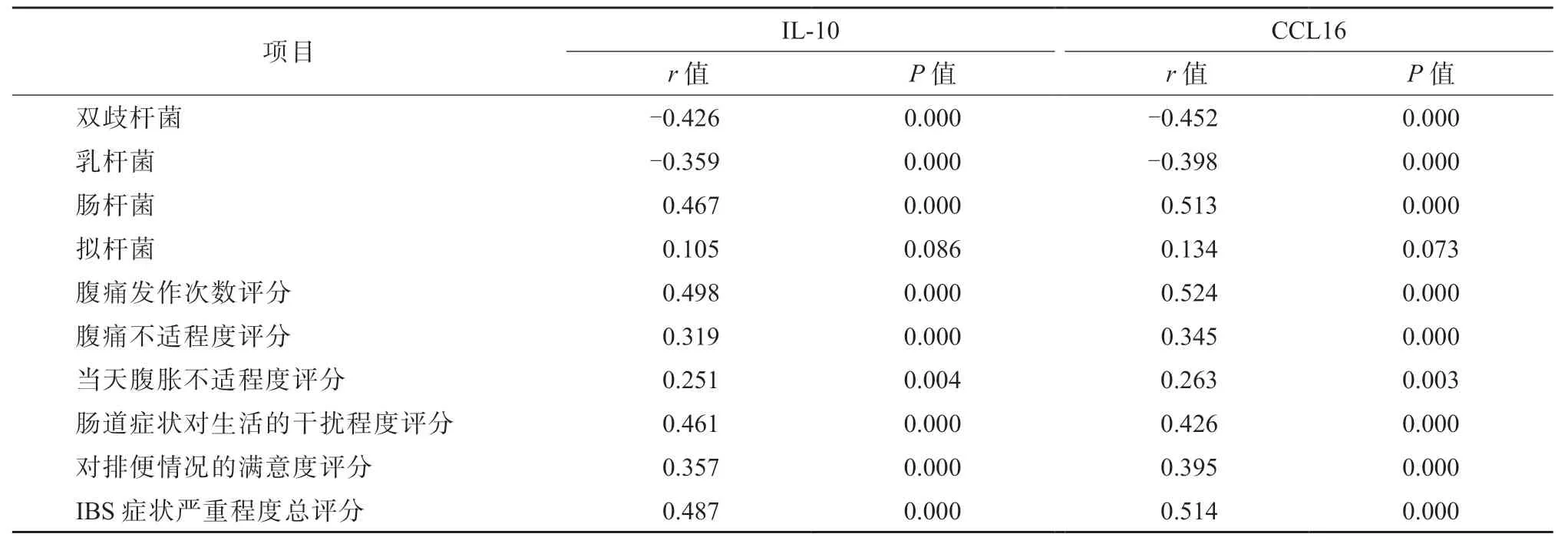
表5 IBS-D 患者的血清IL-10、CCL16 水平与粪便菌群、IBS-D 症状严重程度评分的相关性
3 讨论
IBS 是一组根据症状进行分类的临床症候群,发病机制尚不清楚,目前研究认为其由炎性反应、免疫、肠道菌群失调及脑-肠轴异常等多种机制共同作用导致,具有反复发作,迁延难愈的特点[10-11]。根据患者粪便的性状,IBS 可分为便秘型IBS(IBS-C)、IBS-D、混合型IBS(IBS-M)和不确定型IBS(IBS-U)[12],其中IBS-D 为较常见类型,严重影响着患者的生活质量,其诊断和治疗面临诸多挑战[13]。因此,积极寻找与IBS-D 发生、发展相关的生物标志物对于IBS-D 的临床诊治有重要的意义。
IL-10 是一种主要由Th2 细胞、B 细胞及单核巨噬细胞等免疫细胞分泌的抑炎细胞因子,具有抑制抗体产生和促炎细胞因子释放及活化等作用,研究表明其在胃肠道疾病的发生、发展中起着调节作用[14]。本研究发现,IBS-D 患者的血清IL-10水平显著高于健康者,表明IL-10 在IBS-D 的发生中可能发挥了重要的调控作用,该结果与曾明曦等[4]的研究结果一致。然而,雍海江等[5]的研究结果显示 IBS 组患者IL-10 水平明显低于对照组,Abbas 等[6]的研究结果显示IBS 组患者与对照组的血清IL-10 水平差异无统计学意义,上述研究结果均与本研究结果不符。造成研究结果差异的原因可能是当IBS-D 患者处于炎性反应活动期时,免疫系统被激活,TNF-α、IL-18 等促炎因子大量分泌,使得抑炎细胞因子IL-10 水平代偿性升高;而当IBS-D 患者处于炎性反应缓解期时,促炎因子分泌减少,故IL-10 水平降低[15]。
本研究中,进一步分析发现,重度IBS-D 患者的血清IL-10 水平显著高于轻中度IBS-D 患者,且IBS-D 患者的血清IL-10 水平与IBS-D 症状严重程度各项评分及总评分均呈正相关,表明血清IL-10水平与IBS-D 症状严重程度密切相关。分析其原因可能是,重度IBS-D 患者体内的炎性反应及免疫应答均较轻中度IBS-D 患者更强,活化的Th2 细胞、B 细胞等免疫细胞分泌更多的抑炎因子,但总体上重度IBS-D 患者体内促炎因子占优势,故即使其血清IL-10 水平升高也不能有效缓解IBS-D 症状。
趋化因子CCL16 由肝脏、胸腺和脾脏的实质细胞产生,存在于人体血液中,其对单核细胞和淋巴细胞有趋化特性,参与肺炎等炎性疾病的发生、发展,是一种促炎趋化因子[16-17]。Del Valle-Pinero等[18]的研究发现,IBS 患者的CCL16 基因表达显著升高。但Hayatbakhsh 等[7]的研究发现IBS 患者的血清CCL16 水平显著降低,且IBS-D 患者的血清CCL16 水平显著高于IBS-M 患者,血清CCL16可作为区分这2 种亚型的标志物。本研究结果显示,IBS-D 患者的血清CCL16 水平较健康者升高,且其与血清IL-10 水平及IBS-D 症状严重程度评分均呈正相关,表明CCL16 可能与IL-10 共同参与了IBS-D 的发生、发展,两者有潜力作为诊断IBS-D及评估IBS 症状严重程度的血清学标志物。多项研究结果显示,CCL16 作为促炎因子在炎性疾病中呈高表达[7,18],该结果与本研究结果一致,推测IBS-D 发生、发展过程中机体免疫应答被激活,IL-10 等抑炎因子水平升高的同时伴随着CCL16 等促炎因子水平升高,两者共同调控疾病的进展。本研究结果与Hayatbakhsh 等[7]的研究结果存在差异的原因可能是研究对象的种族、地域及疾病阶段存在差异。
研究表明IBS 患者体内肠道菌群失调,IBS 的发生可能是由于肠道菌群失衡使肠道功能发生紊乱导致,且不同分型的IBS 患者的肠道菌群变化可能存在差异[2,19]。本研究中,IBS-D 组的粪便中双歧杆菌、乳杆菌数量均显著少于对照组,肠杆菌数量显著多于对照组,但2 组的拟杆菌数量差异无统计学意义,表明IBS-D 患者存在肠道菌群失衡。进一步分析发现,双歧杆菌、乳杆菌和肠杆菌数量在重度IBS-D 患者中的变化更为显著,并且均与IBS-D 患者的血清IL-10、CCL16 水平显著相关,提示双歧杆菌、乳杆菌、肠杆菌可能与IL-10、CCL16 共同参与了IBS-D 的发生、发展。既往研究认为,肠道菌群不仅可通过自身的特殊结构、代谢产物及脑-肠轴调节引发相关的肠道症状,而且可通过激活肠道免疫系统导致IBS 发生和发展[20-21]。
综上所述,血清IL-10、CCL16 在IBS-D 患者中均呈高表达,两者呈正相关,并且均与粪便菌群(双歧杆菌、乳杆菌和肠杆菌)、IBS-D 症状严重程度显著相关,检测血清IL-10、CCL16 水平可能有助于诊断IBS-D 及评估病情严重程度,进而指导临床治疗。本研究样本量较小且为单中心研究,未动态监测血清IL-10、CCL16 水平,这些可能使研究结果发生偏倚。IBS-D 的病因较多,发病机制较复杂,可能还存在其他影响血清IL-10、CCL16水平的因素,有待进一步探究。仅研究粪便菌群可能无法全面反映肠道微生态的变化[22],今后将进一步探究血清IL-10、CCL16 水平与肠黏膜菌群的相关性,为其作为IBS-D 诊断的标志物提供充分的证据。
