紫色马铃薯StCHI基因的克隆与表达分析
2023-05-26马心萍贺苗苗
马心萍,朱 迪,贺苗苗,2,3
(1.青海大学/青海省农林科学院,青海 西宁 810016;2.青藏高原生物技术教育部重点实验室,青海 西宁 810016;3.青海省马铃薯育种重点实验室/西北马铃薯教育部工程研究中心,青海 西宁 810016))
马铃薯是世界四大主粮作物之一,作为人类的重要膳食来源,其富含淀粉、蛋白质、VC、VB以及各种矿物质元素[1]。除了黄色、白色的马铃薯品种以外,还有粉红色、红色、蓝色、黑色、紫色等多种色彩皮肉的马铃薯,这些马铃薯被称为彩薯或特色马铃薯[2]。彩色马铃薯除了具有普通马铃薯含有的营养物质外,还富含类黄酮物质,如儿茶素、表儿茶素及花青素等多种有功效的物质[3]。花青素在很多行业中均具有很重要的应用价值,在食品行业中被当作天然色素广泛应用;在医疗、保健品行业,因其具备抗氧化、抗病毒等诸多功能而使其应用前景十分广阔[4]。花青素赋予了马铃薯丰富的色彩,彩色马铃薯中富含的花青素不仅能够抑制炎症,增强血管的弹性和关节的柔韧性,而且还可以提高肝脏的抗氧化酶活性,防止因高脂而导致氧化损伤,并且能够降低人体内的胆固醇含量[5]。此外,花青素还能明显抑制人体的肿瘤细胞,延缓人体衰老、降低血糖含量、抵抗癌细胞的产生等[6-8],对人体具有良好的保健作用。
花青素是可溶于水的天然色素,它广泛存在于高等植物中,是植物次生代谢的一类产物,属于黄酮类化合物,通常通过糖苷键而形成花色苷[9-10]。植物中最常见的花青素主要有6种:天竺葵色素、矢车菊色素、飞燕草色素、芍药花色素、牵牛花色素和锦葵色素。花青素在合成的过程中会受到2种基因的影响,一类是调节基因,通过所编码的转录因子MYB、bHLH和WD40调控结构基因,进而影响花青素的生物合成[11];另一类为结构基因,该基因主要编码花青素生物合成途径中所需要的酶,主要有PAL、C4H、CHS、CHI、F3H、DFR、UF3GT和ANS等基因。
查尔酮异构酶(CHI)在花青素的合成过程中起着非常关键的限速作用,它能使查尔酮异构化为柚皮素,再经过其他酶的催化,促使花色素及相关黄酮类物质的积累[12]。经过研究得出,CHI的基因结构具有家族特异性,可分为2种类型:Ⅰ型CHI,通常是指在非豆类中发现的CHI仅将6′-羟基查尔酮催化形成5′-羟基黄酮醇;Ⅱ型CHI,它是迄今发现的大多数豆科植物的CHI催化6′-脱氧查尔酮和6′-羟基查尔酮分别产生异黄酮和类黄酮[13]。CHI最早是在大豆中被发现的,随后从法国豌豆中克隆得到该基因[14-15]。迄今为止,已从许多高等植物中克隆出编码CHI的cDNA序列,如矮牵牛[16]、玉米[17]、水母雪莲[18]和花生[19]等。CHI在含有丰富类黄酮或花青素的植物组织中表现出高的表达水平,如在番茄和突变水稻中过表达CHI基因,在转基因番茄果实和突变水稻外壳中类黄酮的积累有所增加[20-22]。在白色矮牵牛中过表达CHI基因,使白色花瓣颜色加深而呈现浅粉红色[23]。相反,在烟草中通过RNAi技术对CHI的抑制使得花瓣色素沉着降低并改变了花瓣中的类黄酮成分[24]。降低翠菊、康乃馨、仙客来的CHI酶活性,将导致植物体内的查尔酮不能进一步催化形成柚皮素,从而积累大量的查尔酮而使花朵颜色变黄[25-27]。尽管CHI基因在许多作物中已有研究,但有关马铃薯CHI基因的研究未见报道。本研究根据紫色马铃薯品系“15-12-16”和白色马铃薯品种“下寨65”转录组的数据,筛选出在薯肉中表达量显著的基因,即StCHI,以马铃薯品系“15-12-16”为材料,将该基因予以克隆并使用生物信息学的方法,对合成花青素时查尔酮异构酶基因所发挥的作用进行分析,为培育出多色马铃薯以及多种天然色素的研究提供参考。
1 材料与方法
1.1 试验材料
马铃薯“15-12-16”由青海省农林科学院生物技术研究所提供;植物总 RNA 提取试剂盒、反转录试剂盒、试验所需的荧光定量试剂等均购买自TaKaRa公司;根据NCBI 网站下载 StCHI(XM_0063 65267.2)基因CDS序列,利用Primer 3在线网站设计特异性引物(StCHI-F:5′-AAAAAGCAGGCTTC ATGGTAAAGAATGAAGTGATGGT-3′;StCHI-R:5′-AGAAAGCTGGGTCTTATTTAGACAATTCAA CACAA-3′),并由生工生物工程(上海)股份有限公司合成。
1.2 马铃薯总RNA的提取与cDNA的合成
采用天根生化科技(北京)有限公司的多糖多酚植物总RNA提取试剂盒提取马铃薯“15-12-16”块茎中的总RNA,利用超微量分光光度计(Thermo scientific)检测RNA浓度,以无菌水为空白对照。并通过2%琼脂糖凝胶电泳检测其完整性,电压为160 V、电泳时间8 min。以提取的RNA为模板,按照PrimeScript™1st Strand cDNA Synthesis Kit 试剂盒反转录为 cDNA。
1.3 StCHI基因的克隆
将马铃薯品系“15-12-16”中提取到的RNA进行反转录后,可得到cDNA模板,并以此扩增PCR。扩增反应体系20 μL:cDNA 1.0 μL,StCHIF、R各0.5 μL,Premix Taq™10. 0 μL,ddH2O 8.0 μL。PCR反应程序为:98 ℃ 10 s;60 ℃ 30 s;72 ℃40 s,4 ℃,共32个循环。2%琼脂糖凝胶电泳检测 PCR产物,目的条带与预期条带符合后切胶回收,然后将胶回收产物与pDONR207载体连接,将其转化至大肠杆菌E. coli DH5α感受态细胞中,涂布于含庆大霉素(Gen)的 LB平板上,倒置于37℃恒温箱中暗培养12 h,从中选出单克隆菌,使用PCR技术对其进行筛选,并将阳性菌送到基因检测有限公司进行测序。
1.4 StCHI基因的生物信息学分析
利用DNAMAN软件对StCHI基因所编码的氨基酸序列进行分析研究;利用Expasy网站(https://web.expasy.org/protscale、https://web.expasy.org/prot-param)分析StCHI蛋白的理化性质。利用互联网站PtedichProtihoy (https://PtedichProtihoy.ohy)预测基因亚细胞定位。利用Ongoing maintenance(https://services.healthtech.dtu.dk/service.php?SignalP-4.1)和DeepTMHMM (https://dtu.biolib.com/DeepTMHMM)在线软件预测蛋白信号肽及跨膜结构。通过SOPMA网站(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析StCHI蛋白的二级结构;通过NCBI分析该基因的保守结构域,查找StCHI蛋白与其他物种同源蛋白质序列进行多重比对,通过MEGA 11.0软件的邻近法构建蛋白系统进化树。
1.5 StCHI基因表达分析
分别提取马铃薯“15-12-16”的根、茎、叶、花瓣、薯皮、薯肉的总RNA,并以荧光反转录后的cDNA为模板,设计荧光定量引物:StCHI-F:5′-GCCAT ACGCGATCGCTTAGC-3′;StCHI-R:5′-CTTTGC ACTCCCAGAAGTAGCTG-3′,以马铃薯X83206为内参基因:StActin-F:5′-AGATGCTTACGCTGGA TGGAATGC-3′;StActin-R:5′-TTCCGGTGTGGT TGGATTCTGTTC-3′。参考TB Green®Premix Ex Taq™Ⅱ(Tli RNaseH Plus)荧光定量试剂盒说明书,反应体系(20 μL)为TB Green premix Ex Taq™Ⅱ 10 μL、F/R各0.2 μL、cDNA 2 μL、ddH2O 7.6 μL;反应程序:95 ℃ 30 s;95 ℃ 10 s,58.9 ℃ 32 s,共40个循环;95 ℃ 60 s;58.9 ℃ 60 s;55 ℃ 10 s。使用2-ΔΔCt方式处理和分析试验所得数据。
2 结果与分析
2.1 StCHI基因的克隆
以马铃薯“15-12-16”块茎RNA(图1A)反转录后的cDNA为模板进行PCR扩增,得到目的基因片段(图1B)。将目的片段回收纯化,经连接转化、测序,结果表明:StCHI的CDS长度为633 bp。

图1 马铃薯“15-12-16”块茎总RNA和StCHI基因扩增
2.2 StCHI基因的生物信息学分析
2.2.1 StCHI蛋白的理化性质分析 通过Expasy在线分析得到,该基因共编码210个氨基酸,其中谷氨酸(Glu)、缬氨酸(Val)、异亮氨酸(Ile)的含量较高,分别占12.4%、9.5%、8.6%(图2)。该蛋白分子量为23.852 kDa,为不稳定的亲水性蛋白,理论等电点(pI)为4.75,脂溶性指数为91.81(图3)。通过在线网站PredictProtein预测StCHI亚细胞定位在叶绿体中。

图2 StCHI基因的核苷酸序列与蛋白序列

图3 StCHI蛋白的亲疏水性
2.2.2 StCHI蛋白信号肽和跨膜结构预测分析 利用在线预测蛋白信号肽网站对StCHI蛋白的信号肽进行分析,结果发现:该蛋白无信号肽,无切割位点,为非分泌蛋白(图4)。之后,又利用跨膜区域预测网站分析该蛋白的跨膜结构,发现该蛋白均在膜内,无跨膜螺旋区结构。由以上结果推断出该蛋白不属于信号蛋白(图5)。
图4 StCHI蛋白信号肽

图5 StCHI蛋白跨膜区域
2.2.3 StCHI蛋白二三级结构预测分析 通过SOP MA在线预测分析得到StCHI蛋白的二级结构主要由α-螺旋、β-折叠、延伸链、无规则卷曲组成。其中,α-螺旋所占比例最高,为43.81%,无规则卷曲、延伸链、β-折叠分别占25.24%、23.33%、7.62%(图6)。无规则卷曲能够决定蛋白质的功能,其所含的α-螺旋还能使蛋白质骨架更加稳定,酶的功能部位常常位于这种区域中[28]。StCHI蛋白的无规则卷曲结构占比次之,这表明该基因可能会促进花青素的生物合成。
图6 StCHI蛋白的二级结构
StCHI 蛋白三级结构以AtCHIL(Arabidopsis thaliana chalcone-isomerase like protein At5g05270)为模板,GMQE (Global model quality estimation)为0.87,两者相似度为64.71%,说明该结构模型质量较高,可进行后续分析(图7)。
图7 StCHI蛋白的三级结构
2.2.4 StCHI蛋白保守域及进化树分析 通过NCBI Conserved DomainSearch分析,发现StCHI基因编码的蛋白属于Chalcone 3超家族,具有一个查尔酮异构酶特异位点(PLN02804),保守结构域分布在第19~209位氨基酸之间,这表明该基因属于查尔酮异构酶家族(图8)。

图8 StCHI蛋白的保守结构域
通过NCBI获得了不同物种中StCHI基因编码的蛋白序列并进行了多重比对,结果发现:StCHI蛋白分别与风铃辣椒(Capsicum baccatum)、黄辣椒(Capsicum chinense)、黄果枸杞(Lycium barbarum var.auranticarpum)、黑果枸杞(Lycium ruthenicum)、枸杞(Lycium chinense)的CHI蛋白质具有92.31%、91.83%、90.43%、89.47%、89.05%的同一性。利用MEGA 11.0软件中的Neighbor-Joining法构建了StCHI蛋白与其他10种物种的CHI蛋白系统进化树,分析进化树发现StCHI与同一茄科的风铃辣椒、黄辣椒、黄果枸杞、黑果枸杞、枸杞亲缘关系较近属于同一个分支,与其他科的亲缘关系较远(图9)。
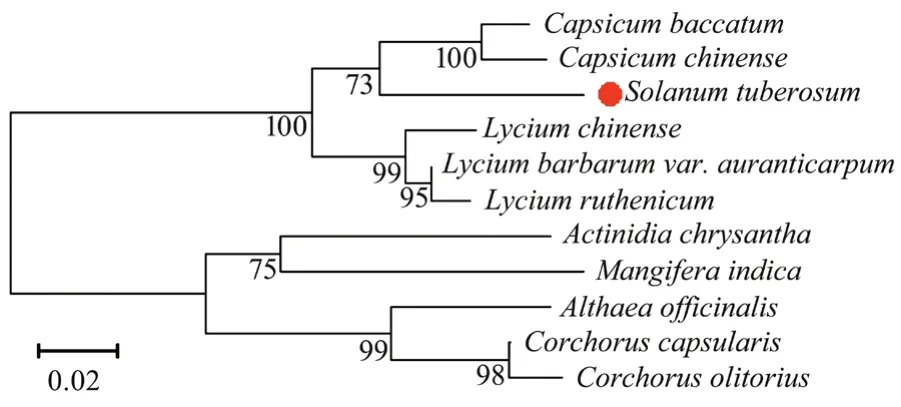
图9 马铃薯StCHI蛋白的系统进化树分析
2.3 StCHI基因表达模式分析
利用qRT-PCR技术对StCHI在马铃薯“15-12-16”的根、茎、叶、花瓣、薯皮、薯肉中进行了相对表达量的测定(图10)。试验结果表明,StCHI基因在“15-12-16”的各组织中都有所表达,说明StCHI基因具有组织特异性。并且在花瓣中含量最多,其次为叶和茎,在根中表达水平最低,各组织间表达量存在显著差异。这可能与CHI基因主要在花冠及花药中表达[29]有关。
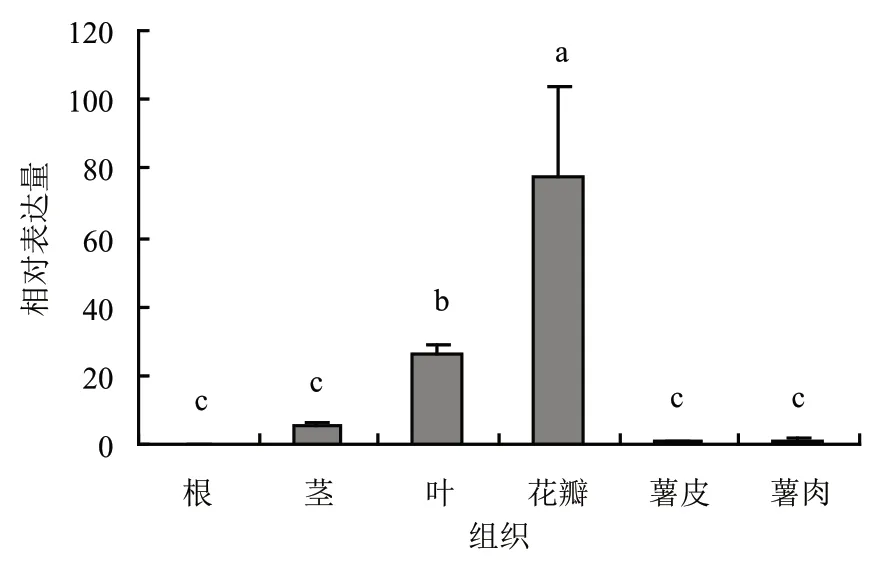
图10 StCHI基因在“15-12-16”不同组织中的表达量
3 结论与讨论
CHI是植物花青素生物合成途径第2阶段中所需的关键酶,因此,CHI基因的克隆及其功能的挖掘,在研究彩色马铃薯花青素的合成及调控机制的方面具有重要的意义。通过对一系列结构基因的克隆,不断深入研究花青素生物合成的调节机制,以及如何培育出多种彩色马铃薯。本研究克隆了紫色马铃薯“15-12-16”中的StCHI基因,该基因的CDS长度为633 bp并编码210个氨基酸。对该基因编码中存在的蛋白质进行研究,发现在该序列中存在CHI基因,并且家族结构特征区域位于第19~209位氨基酸之间,表明该基因编码的蛋白是具有生物功能的蛋白。
紫色马铃薯的CHI基因是独特的,由于它没有内含子。而来自其他植物的CHI基因,如日本莲[13]、矮牵牛[16]、玉米[17]、水稻和大麦[30],每个都有2个或3个内含子。由于内含子可能在基因表达中具有一些调节功能,并且能够影响植物的生长,但CHI基因是否具有内含子仍有待研究。通过对基因序列进行比对可以发现,StCHI与辣椒、枸杞等的同源性较高,根据CHI基因在物种进化上的高度保守性,推断其编码的蛋白也能使查尔酮转化为有生物活性的黄烷酮,与其他物种已明确的CHI基因的功能具有相似之处[13]。张水明等[31-32]研究发现,查尔酮异构酶处于类黄酮化合物生物合成途径的上游,且在生命活动较旺盛的器官中该基因的表达量相对较高,使它在黄酮类化合物进行合成时发挥作用。通过对基因的表达量进行分析,可以发现在花器官中该基因的表达量最多,说明CHI基因对植物成色可以进行调控,该结论同周兴文等[33]的研究结论相符。本研究克隆和分析了StCHI基因相关的理化性质及表达模式,为进一步研究该基因在马铃薯花青素合成途径的调控以及在表达机制方面的研究提供理论依据与基础,后续将对该基因的功能展开更深入的探究。
