基于U-Net的短轴心脏CTA左心室心肌自动分割系统的开发
2023-05-25姜乐临陈彦晗金梦佳宋湘芬冷晓畅向建平朱思品姜文兵
姜乐临 陈彦晗 金梦佳 宋湘芬 冷晓畅 向建平 朱思品 姜文兵
据统计,2016年有1 790 万人死于心血管疾病(cardiovascular disease,CVD),到2030年,预计死亡人数超过2 220 万人[1]。牛眼图是左心室在短轴切面上的周向横断面图,通常用于显示舒张末期与收缩末期室壁厚度变化、心肌灌注等心脏功能异常情况。射血分数是反映左心室收缩功能的可靠指标,有助于心力衰竭的诊断[2-4]。除室壁厚度和射血分数外,其他功能指标(如心肌质量等)也可用于心脏功能的分析。左心室体积可以估算这些心功能指标,临床上通常通过左心室分割来量化左心室体积,进而诊断CVD。手工分割左心室的步骤繁琐且受观察者主观影响较大,因此自动左心室分割在计算机辅助诊断中受到广泛应用。在获取心脏解剖信息的成像技术方面,与心脏MRI 相比,心脏计算机断层血管造影(computed tomography angiography,CTA)具有检查时间短、成本低、图像质量较高等优点[5]。然而,由于形状和大小的变化、组织对比度差等,左心室自动分割仍具有挑战性。传统的左心室自动分割方法主要包括地图集和变形模型。Yang 等[6]提出了一种三步多图集分割方法,但该性能依赖于配准算法和融合策略。Medina 等[7]提出了一种基于水平集变形轮廓的两阶段分割技术,但该性能极易受初始形状和不同类型参数的影响,而且计算量较大。基于卷积神经网络(convolutional neural network,CNN)的深度学习是一种更准确、更有效的方法,近年来在医学图像分析中展现出广阔的应用前景。U-Net 作为医学图像分割最经典的CNN,在有限的训练数据下可以获得精确的分割,因此得到了广泛的应用[8]。但是由于其结构简单,可能无法应付形状、大小等变化较大的情况。Isensee 等[9]开发了一个级联的UNet,一个模型首先提取全局信息来定位感兴趣区(region of interest,ROI),另一个模型对该ROI 进行密集预测。Guo 等[10]将集成注意力机制应用到U-Net,以逐步抑制不相关区域的特征响应,而不需要额外的ROI 定位模型。Wu 等[11]引入深监督机制对中间特征映射进行监督,以缓解优化挑战,同时提高边界的区域判别等。Jun 等[12]将注意力与深监督机制进行结合,重点关注左心室边界结构。参考上述文献,本研究开发了一种基于U-Net 的短轴心脏CTA 左心室心肌(left ventricular myocardium,LVM)自动分割系统,并与原型UNet 方法的左心室分割性能进行比较,现将结果报道如下。
1 对象和方法
1.1 对象 选取2022年2 至10月在温州市中心医院就诊的50 例疑似或确诊CVD 患者为研究对象,其中男29 例,女21 例;年龄37~85(67±9)岁。纳入标准:(1)年龄>18 岁;(2)行舒张末期或收缩末期的心脏CTA检查;(3)CTA 图像质量优,无明显运动及呼吸伪影。排除标准:(1)存在对比剂过敏或硝酸甘油禁忌证;(2)孕妇或哺乳期妇女;(3)合并严重的心律不齐;(4)失代偿性心功能不全;(5)合并严重的肝肾功能不全;(6)冠状动脉旁路移植术后或冠状动脉支架置入术后;(7)患有复杂的先天性心脏病;(8)行CTA 检查时BMI>35 kg/m2;(9)最近1 个月发生过急性冠状动脉综合征,包括急性心肌梗死、不稳定心绞痛等。本研究经温州市中心医院医学伦理委员会批准(K2021-04-007),所有患者均知情同意。
1.2 基于U-Net 的短轴心脏CTA LVM 自动分割系统的开发
1.2.1 短轴切面获取 使用德国西门子SOMATOM Force CT 扫描仪进行心脏CTA 检查,并以DICOM 格式进行存储,图像分辨率0.25~0.37 mm,切片厚度0.50~0.75 mm。每幅图像最初是在轴向视图中获得的,为了更好地分析心脏功能,需要在心脏CTA 检查时从轴向切面重新定位到短轴切面。(1)在轴向切面中选择一幅参考图像绘制长轴,见图1A;通过切割平行于长轴和垂直于参考图像的轴向图像获得新的断层图像。(2)从新的断层图像中选择一个参考图像,并以同样的方式绘制长轴,见图1B;三维长轴的取向由轴向和新的断层参考图像中的两个长轴决定。(3)通过切割垂直于三维长轴的轴向图像,并调整到512×512 像素,得到短轴切面,见图1C。
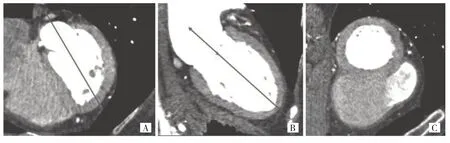
图1 心脏计算机断层血管造影检查从轴向切面到短轴切面的重新定位(A:绘制长轴;B:切割获得新的断层图像;C:调整像素获得短轴切面)
1.2.2 训练数据处理 从每例患者的短轴切面中选择20 个具有代表性的图像,包括左心室出现前的2 幅图像和左心室消失后的2 幅图像,共1 000 幅图像。然后在Graph Cut 半自动分割工具协助完成分割工作[13],医师随后检查并根据需要交互校正分割(半自动分割结果首先交由2 位具有5年以上经验的医师进行单独校正标注后,再交由10年以上经验的医师审核并最终确认)。将具有标签的数据分成训练数据(随机抽取80%的数据)和测试数据(其余20%的数据)。另外,在训练中进行数据在线增强(旋转、缩放和剪切变换),以扩大训练数据的多样性。
1.2.3 模型结构优化 该方法基于U-Net 深度神经网络的模型结构,由包括收缩路径和扩张路径的8 层组成,见图2。每层有两组卷积核为3×3 像素的卷积、批量归一化和修正线性单元激活函数。残差连接被合并到每一层,每层的输入通过1×1 卷积与第二个3×3卷积的输出进行加操作。收缩路径中每层的输出通过最大池化操作将分辨率降低一半。扩张路径中的每层输入通过卷积核为2×2 像素和步长为2 像素的反卷积操作,以逐层恢复分辨率,其后使用跳跃连接与收缩路径相应层的输出进行叠操作形式的连接。在收缩路径中,第一层的输入通道从1 增加到8,其他层的输入通道增加1 倍。在扩张路径中,每一层的输入通道减半,最后一层的输出通道使用1×1 卷积从8减少到1。从这里开始的分支作为主要的输出分支。扩张路径中的7 条辅助输出分支作为深监督从前7 层延伸出,每条分支由1 到7 个连续的2×2 个反卷积和1×1 个卷积组成,以恢复与主输出分支相同的分辨率。注意力机制在7 条辅助输出分支和主输出分支之后添加。平均池化操作用于执行全局下采样,然后通过一组1×1 卷积和Sigmoid 激活获得当前分支的权重。将来自不同分支的特征映射乘以不同的权重,以增强关键分支的注意力。再次添加一组1×1 卷积和Sigmoid 激活,以获得当前分支的空间权重。将来自不同空间位置的特征映射乘以不同的权重,以提高关键区域的注意力。最后通过Sigmoid 激活,以获得属于前景(>0.5)或背景(≤0.5)的像素概率。
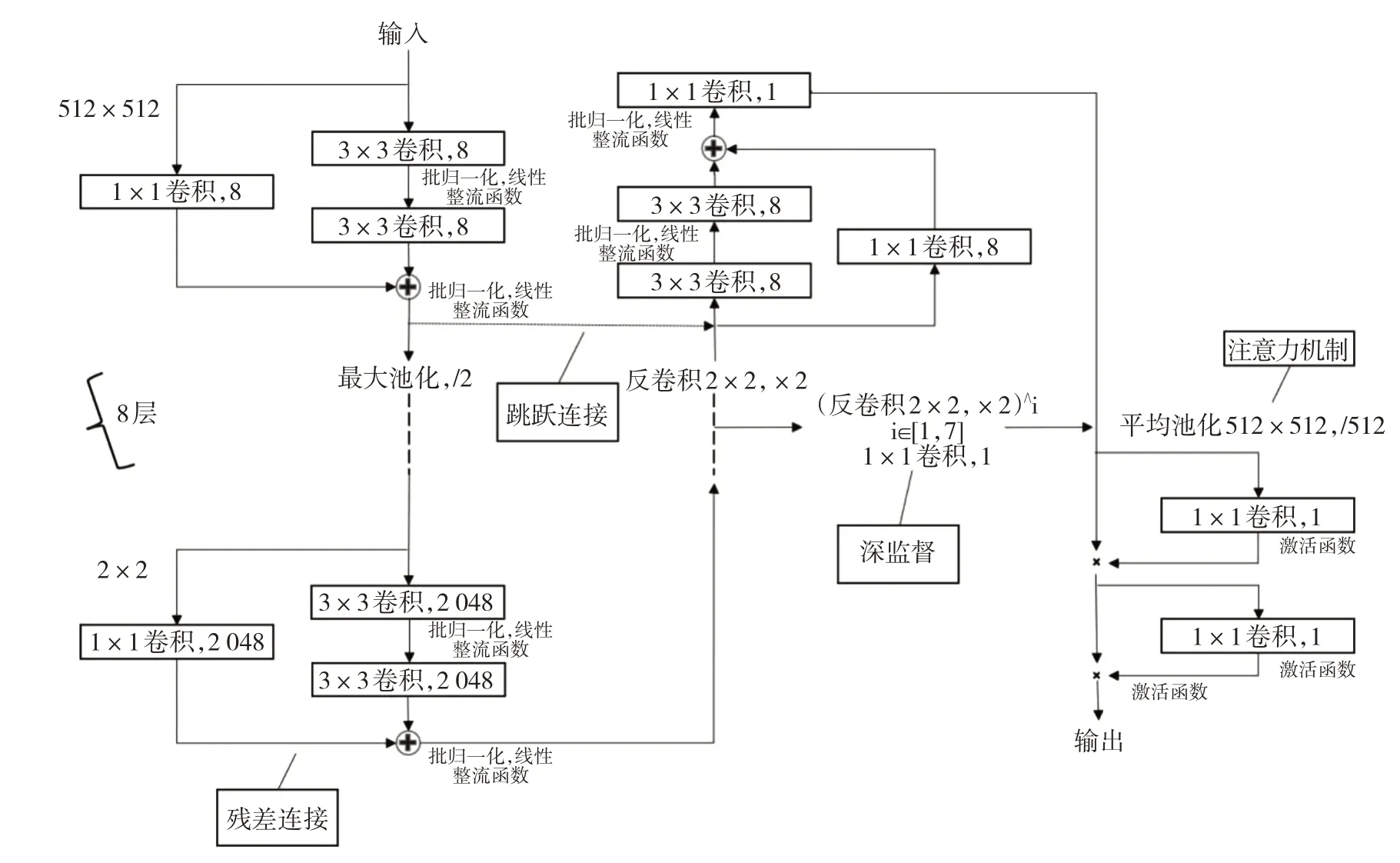
图2 基于U-Net 的心脏计算机断层血管造影短轴切面左心室分割方法的模型结构
1.3 训练策略 训练数据以零均值和单位方差进行归一化操作,并以8 的批量大小输入模型中。利用二值交叉熵的损失函数,将模型输出与标签进行比较。采用学习速率为2e-4 的自适应矩估计(Adam)优化器对模型参数进行更新,使得损失最小化[14]。使用Pytorch 框架,在配备美国Nvidia 11 GB NVIDIA GeForce GTX1080Ti GPU 和3 585 个CUDA 核的Linux 系统下进行200 轮训练[15]。
1.4 模型评估 采用Dice 相似系数(Dice similarity coefficient,DSC)、精度和灵敏度3 个指标进行量化评估模型输出与标签之间像素级的相似性程度,其中DSC 度量模型输出与标签之间的空间重叠度,DSC=2×(模型输出∩标签)/(模型输出+标签);精度是真阳性与DSC 的比值,精度=(模型输出∩标签)/模型输出;灵敏度是真阳性与标签的比值,灵敏度=(模型输出∩标签)/标签。以上3个指标的值越大表示模型性能越高。
2 结果
2.1 分割结果可视化比较 本研究新开发方法从心脏CTA 短轴切面分割左心室的结果与原型U-Net 方法的可视化比较发现,无论分割小区域的左心室或分割组织对比度较差的图像,与原型U-Net 方法相比,本研究新开发方法与标签具有更高的一致性;在可视化比较中,原型U-Net 方法展现出欠分割、过分割等问题,见图3(封三)。

图3 测试数据的6 个样本图像可视化比较
2.2 分割量化结果比较 本研究新开发方法的DSC、精度、灵敏度分别为0.964±0.033、0.960±0.043、0.970±0.040,原型U-Net 方法的DSC、精度、灵敏度分别为0.938±0.144、0.941±0.144、0.961±0.058,提示本研究新开发方法具有更高的分割精度和鲁棒性。从综合角度来看,两种方法均存在一些异常值,但原型U-Net 方法的异常值跨度很大,如在DSC、精度的箱式图中明显可见,与上述分割量化结果一致;在原型UNet 方法的DSC、精度的箱式图中,有一些离群点非常接近于零,见图4。这提示原型U-Net 方法存在一定的过分割问题,如一些没有左心室的图像被分割出了左心室,见图5。使用本研究新开发方法分割的3 例患者左心室表面三维视图显示平均分割时间为13 s(即处理速度约为0.037 s/幅),提示该方法整体上实现了较高的分割质量和分割效率,见图6。

图4 本研究新开发方法与原型U-Net 方法关于DSC、精度和灵敏度的箱图比较结果(A:DSC;B:精度;C:灵敏度)
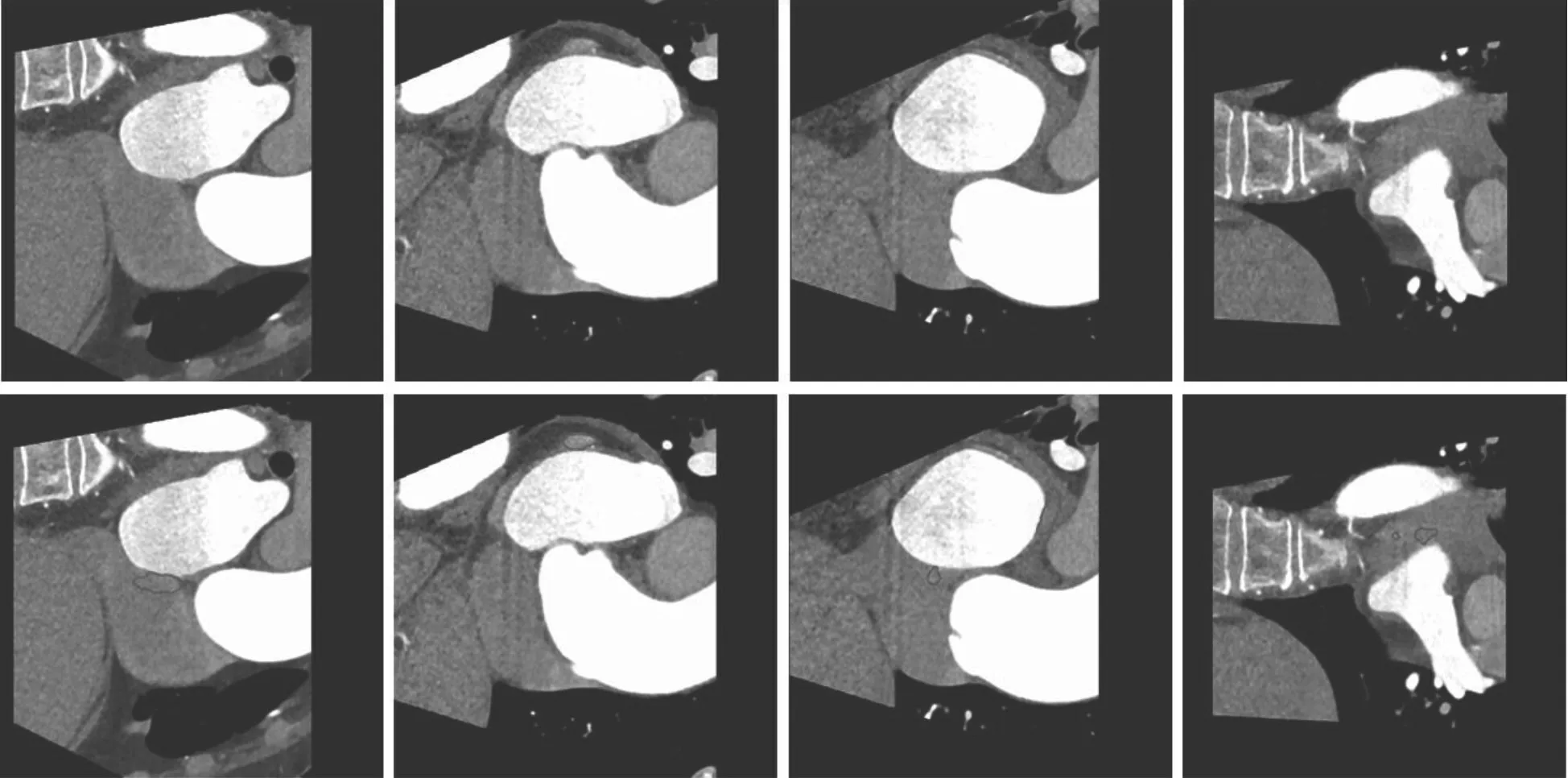
图5 使用原型U-Net 方法分割失败的样本图像

图6 本研究新开发方法分割的3 例患者(连续短轴图像)左心室表面三维视图
3 讨论
左心室分割的准确性对于后续心脏功能定量分析和CVD 的诊断至关重要。本研究开发了一种基于U-Net 的短轴心脏CTA LVM 自动分割系统,该方法将模型加深至8 层,同时结合深度学习中的几种最先进技术(注意力机制、深监督机制、残差连接等)。注意力机制的模型通过隐式学习权重,以关注更多关键特征,同时逐步控制无关区域,从而很好地代替显式ROI定位。深监督机制的辅助作用是监督和驱动中间特征在中间层进行鉴别,提高边界处的最终鉴别能力,以应对不良的组织对比度。而模型加深至8层,有利于提取足够的复杂特征,以学习左心室的各种形状和大小。在Khan 等[16]的启发下,本研究将残差连接并入U-Net,期望以更平滑的梯度流来实现更好的反向传播。
本研究新开发方法与原型U-Net 方法的分割性能比较,发现新开发方法左心室分割性能明显提高,得益于加深的8 层,以及引入的注意力机制和深监督机制,同时结合残差连接的综合效应。分割量化结果比较显示,与原型U-Net 方法(0.938±0.144、0.941±0.144、0.961±0.058)相比,本研究新开发方法的DSC、精度、灵敏度分别为0.964±0.033、0.960±0.043、0.970±0.040,提示分割精度和鲁棒性更高。对于不同形状和大小的左心室,新开发方法能获得更好的分割结果。此外,新开发方法对组织对比度差的左心室也能作较好的识别;而原型U-Net 方法展现出过分割、欠分割等问题,不能很好地控制无关区域,也不能很好地突出关键特性,同时在组织对比度差的情况下表现不佳。整体而言,原型U-Net 方法的简单结构更适用于分割形状和大小变化不大且有明显边界的物体,但对于变化较大和对比度较低的情况不是那么有效。而本研究所开发的自动分割左心室的方法,在处理变化较大、对比度较低的CTA 图像时仍表现出较好的分割性能,这有利于图像识别的深度学习方法在临床实践中的进一步应用。
以下文献报道了基于CNN 的深度学习方法分割心脏CTA 中的左心室。Zreik 等[17]采用CNN 对心脏CTA 中的左心室进行分割,左心室的ROI 由3 个CNN组合定位,分别用于轴向、冠状和矢状面。一个特定的CNN 对ROI 进行体素分类,得到平均DSC 为0.850的分割结果。Koo 等[18]通过将全连接层改为全卷积层来实现对CTA 中左心室的语义分割,结果显示平均DSC 为0.883。Wang 等[19]开发了一种基于视觉显著性和Transformer 的双输入深度学习网络以用于心脏结构的分割,结果分割左心室的DSC 达到了0.940。Jun等[12]将注意力机制和深监督机制集成到U-Net 中,结果显示DSC 达到0.916。本研究新开发方法的DSC 均高于上述研究结果,说明该方法在现有的心脏CTA 短轴切面分割方法中是具有竞争优势。但需要注意以下两点:(1)本研究数据来自单一CTA 检查仪器,缺乏多样性,这可能是该方法分割心脏CTA 的评估结果优于其他现有方法的原因之一。因此,多中心和多扫描数据验证该方法的鲁棒性和泛化性至关重要。(2)目前基于2D 分割的研究缺失图像之间的空间相关性,使得部分二维图像之间的连续性表现欠佳。因此,在后续工作中应收集多中心和多扫描仪的扩增数据,并深入基于三维分割的研究。
综上所述,本研究开发了一种基于U-Net 的短轴心脏CTA LVM 自动分割系统,该方法将注意力机制、深监督机制和残差连接集成到8 层U-Net 中,具有较高的分割精度、分割质量和分割效率,有望成为诊断CVD 的一种有效辅助工具。
