多模态MRI参数检测在前列腺疾病中的应用价值⋆
2023-05-25孔凡武李健康闫玉玲
孔凡武 李健康 闫玉玲
1.河南省商丘市中医院磁共振室(河南 商丘 476000)
2.河南省商丘市中医院CT室 (河南 商丘 476000)
3.河南省商丘市中医院病理科(河南 商丘 476000)
前列腺癌为男性群体高发恶性肿瘤类型,其发病率仅低于肺癌,但近来来其发病率一直呈逐年上升趋势,由于其早期症状尚不明显,患者病情确诊已经进展到中晚期,导致患者丧失根治最佳时机[1]。研究显示无症状或者处于早期前列腺癌患者术后5年生存率可以达到99%,而中晚期前列腺癌患者5年(变)生存率甚至不超过50%[2],可见前列腺疾病准确诊断、评估病理分级对患者治疗及预后改善意义重大。CT、超声、磁共振成像(magnetic resonance imaging,MRI)是前列腺疾病诊断常见影像学手段,但是CT与超声用于前列腺疾病诊断特异性不佳,MRI由于其优异软组织分辨率逐渐成为前列腺疾病诊断首选影像学手段,尤其是近期多模态MRI应用使其在前列腺疾病诊断上优势更加明显[3]。多模态MRI有效结合可常规MRI扫描、扩散加权成像(diffusion weighted imaging,DWI)、动态增强MRI(dynamic enhanced MRI,DCE-MRI)等多种MRI扫描技术,可以有效反映器官结构功能变化及代谢异常,有助于进一步提高前列腺疾病诊断价值[4]。基于此,本研究多模态MRI参数检测在前列腺疾病诊断及病理分级中应用价值,为后期多模态MRI参数检测在前列腺疾病诊断上应用提供更多参考依据。
1 资料和方法
1.1 一般资料对2019年8月至2022年8月医院收治82例前列腺疾病患者相关资料予以回顾性分析。
纳入标准:患者存在明显排尿不畅及尿潴留表现,血清前列腺特异性抗原>10ng/L;患者在接受多模态MRI检查前尚未接受治疗;经由手术或者穿刺活检证实患者病情;患者各项资料完整。排除标准:身体重要脏器功能障碍者;伴其他肿瘤者;MRI检查影像质量差或者多模态MRI检查不全者;资料不全者。82例患者年龄49~78岁,平均(62.11±11.95)岁;前列腺特异性抗原10~218.65ng/L,平均(82.53±16.92)ng/L。
1.2 方法
1.2.1 多模态MRI检查 检查应用GE SIGNA Pioneer 3.0T扫描仪(美国GE公司),线圈选择体部相控阵线圈。常规MRI扫描:轴位T1加权薄层扫描参数:重复时间、回波时间、翻转角、层厚、层间距、视野、激励次数、矩阵分别为700ms、11ms、150°、3mm、0.3mm、230mm×230mm、1、256×192;轴位T2加权薄层扫描:重复时间、回波时间、层厚、层间距、视野、激励次数、矩阵分别为3500ms、101ms、3mm、0.3mm、230mm×230mm、1、320×320。DWI:扫描参数:重复时间、回波时间、层厚、层间距、视野、激励次数、矩阵分别为2900ms、86ms、3mm、0.3mm、224mm×260mm、4、111×172,扩散敏感系数分别设置为0和1000s/mm2,依据扫描结果获得表观扩散系数(Apparent diffusion coefficient,ADC)图。DCE-MRI:轴位动态增强扫描选择VIBE序列,相关参数:重复时间、回波时间、层厚、层间距、翻转角、视野、时间分辨率、矩阵分别为4.0ms、1.4ms、2mm、0mm、9°、317mm×350mm、10s、203×320,扫描应用脂肪抑制技术;对比剂扎喷酸葡胺选择高压注射器以1.5mL/s速度由肘静脉注射,其注射剂量为0.2mmol/kg,进行2期扫描后行对比剂注射,每期扫描时间均为13s,一共需要进行30期扫描,扫描持续时间为6min,解剖定位选择第1个序列轴位T1加权,需要与参数图融合。获得所有MRI图像后由两位影像科医师应用双盲法进行数据分析,影像科医师均需要是副主任及以上医师,图片审阅意见不一致需要经过协商获得统一意见。应用仪器附加图像处理软件在MRI常规扫描、DWI以及DCE-MRI扫描获得图像上划定病灶最显著部位作为感兴趣区,需要尽可能避免囊变、坏死、出血以及钙化部位,随机选择3次测定结果计算其均值。在ADC图上明显低信号部位划定感兴趣区,以自动形成ADC值。DCE-MRI扫描获得时间-信号强度曲线,依据曲线获得最快强化率(Rmax)、达峰时间(Tmax)、最大强化程度(SImax)。
1.2.2 穿刺活检及病理检查 应用Bard Magnum活检仪器(美国Bard公司)及穿刺针在超声帮助下进行经直肠前列腺穿刺活检,每位患者均需要收集12条前列腺组织,如果患者存在感染及出血高风险,收集前列腺组织应该一定程度减少。将切片切为3~5mm行病理检查,确诊为前列腺癌患者依据Gleason分级标准[5]获得病理分级,其中评分≤6分、7分及≥8分分别纳入低级别、中级别与高级别病变。
1.3 观察指标分析前列腺疾病患者影像学表现,比较前列腺癌与前列腺良性病变多模态MRI参数,分析多模态MRI参数对前列腺疾病诊断价值,比较不同病理分级前列腺癌多模态MRI参数,分析多模态MRI参数与前列腺癌病理分级相关性。
1.4 统计学方法本研究中数据通过SPSS 20.0软件予以分析处理,计量资料与计数资料分别表示为(χ-±s)与例(%),计量资料比较应用t检验与方差分析,计数资料采用χ2检验进行差异比较,诊断价值应用受试者操作特征(er operating characteristic,ROC)曲线,相关性分析采用Spearman相关性进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 前列腺疾病患者影像学表现分析病理检查结果显示82例前列腺疾病患者中前列腺良性病变29例,前列腺癌53例。前列腺良性病变:边界清晰,T2加权扫描可以观察到弥漫稍低或者低信号;DWI:ADC图上显示为稍低信号,ADC值轻微减低;DCE-MRI曲线主要为Ⅱ型曲线,显示为病灶早期强化,但对比剂未发现廓清。
前列腺癌:部分患者边界模糊,T2加权扫描可以观察到不规则或者结节状低信号影(图1A);DWI:可见弥漫性片状、结节状或者不规则状超高信号(图1B),ADC值下降(图1C);DCE-MRI曲线主要为Ⅲ期曲线,显示为病灶早期迅速强化并可见对比剂廓清(图1D)。
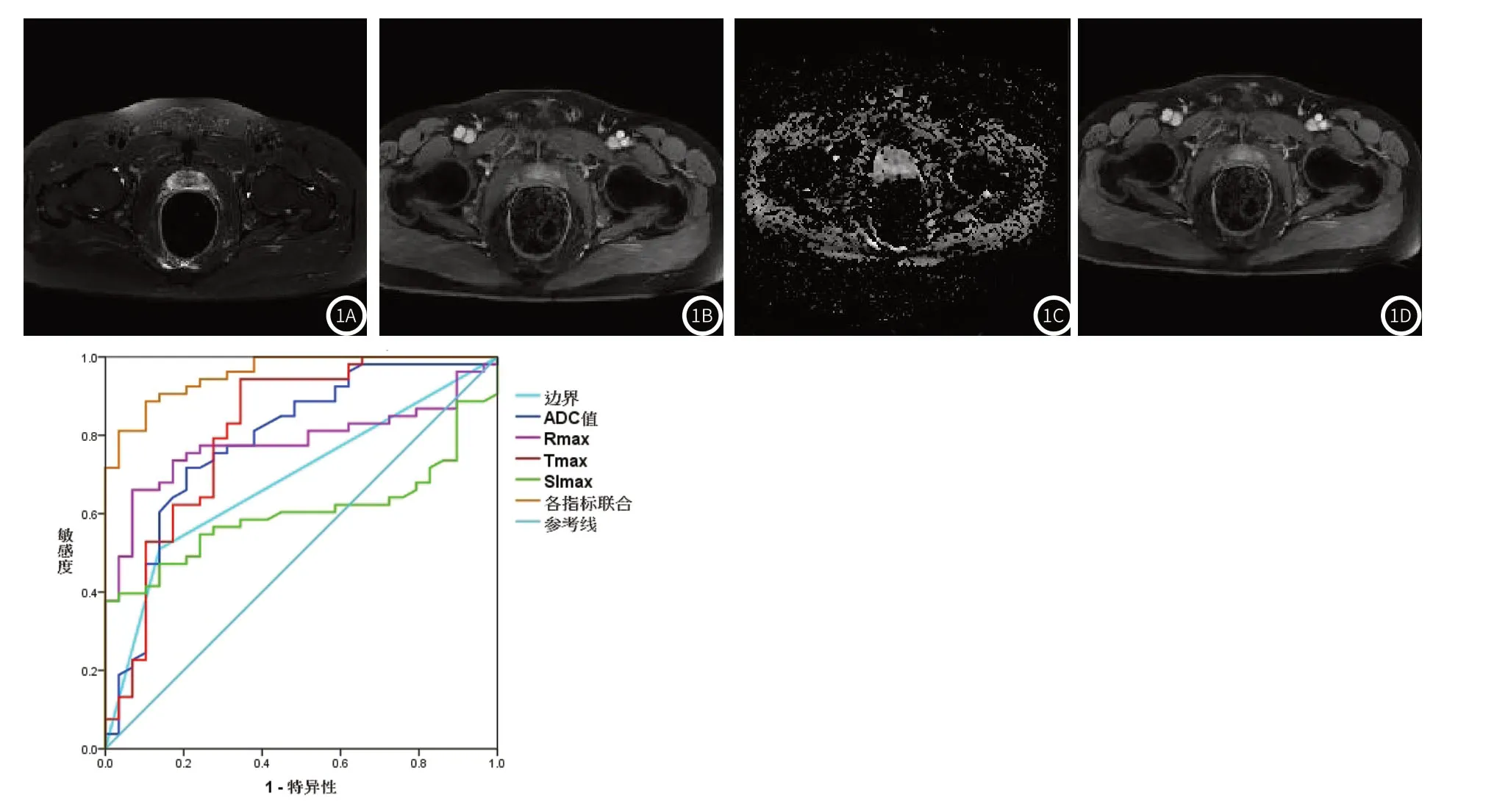
图1 前列腺癌患者MRI影像学表现,图1A:常规T2加权扫描影像学表现;图1B:DWI扫描影像学表现;图1C:DWI扫描获得ADC图;图1D:DCE-MRI扫描影像学表现。图2 多模态MRI参数对前列腺癌诊断价值分析ROC曲线
2.2 前列腺癌与前列腺良性病变多模态MRI参数比较前列腺癌患者边界清晰比例低于前列腺良性病变,ADC值与Tmax低于前列腺良性病变,Rmax、SImax高于前列腺良性病变,差异比较存在统计学意义(P<0.05),前列腺癌患者与前列腺良性病变T2信号强度比较没有统计学意义(P>0.05),见表1。

表1 前列腺癌与前列腺良性病变多模态MRI参数比较
2.3 多模态MRI参数对前列腺癌诊断价值分析ROC曲线显示多模态MRI参数边界、ADC值、Rmax、Tmax、SImax用于前列腺癌诊断曲线下面积(area under curve,AUC)分别为0.686、0.788、0.782、0.811、0.602,各指标联合AUC为0.958,见表2与图2。

表2 多模态MRI参数对前列腺癌诊断价值分析
2.4 不同病理分级前列腺癌多模态MRI参数比较Gleason分级结果显示低级别、中级别与高级别前列腺癌患者分别15例、26例、12例,不同病理分级前列腺癌患者边界及T2信号情况比较没有统计学意义(P>0.05),而随着患者病理分级上升,前列腺癌患者ADC、Tmax逐渐减小,而Rmax及SImax逐渐增大,不同病理分级患者比较存在统计学意义(P<0.05),见表3。
表3 不同病理分级前列腺癌多模态MRI参数比较
2.5 多模态MRI参数与前列腺癌病理分级相关性Spearman相关性分析显示,边界及T2信号情况与前列腺癌病理分级不相关(r=0.106,0.183;P>0.05),ADC、Tmax与前列腺癌病理分级负相关(r=-0.463,-0.376;P<0.05),Rmax、SImax与前列腺癌病理分级正相关(r=0.519,0.487;P<0.05)。
3 讨论
多模态MRI作为非侵入式影像学检查方式,其检查多方位与参数成像、优异对比度及高分辨率特点使其在前列腺疾病诊断上具有独有优势。相对于常规MRI,DWI有助于弥补T1与T2加权扫描不足,同时其可以敏感性反映机体组织中水分子运动[6-7]。DCE-MRI经由Rmax、Tmax、SImax等定量参数反映病灶组织信号强度、微循环血流灌注以及血管渗透性情况[8]。本研究结果显示前列腺癌患者ADC值与Tmax低于前列腺良性病变,Rmax、SImax高于前列腺良性病变,分析认为ADC值显示水分子运动情况,肿瘤细胞增殖时会因为细胞外间隙逐渐减小,因此水分子在其中运动受限,ADC值随之减小;而随着恶性肿瘤增殖,组织灌注能力逐渐增强,因此DCE-MRI测定Tmax减小,Rmax、SImax变大[9]。另一项研究显示前列腺癌患者ADC值及Tmax低于良性前列腺增生患者,而SImax及Rmax高于良性前列腺增生患者[10],与本研究中相关结论一致。除上述因素外,前列腺癌患者边界清晰比例低于前列腺良性病变,影像学上可以明显观察到良性病变边界光滑完整,而恶性病变边界模糊,且显示为浸润性生长。本研究中将多模态MRI参数用于前列腺疾病诊断,结果显示边界、ADC值、Rmax、Tmax、SImax用于前列腺癌诊断AUC分别为0.686、0.788、0.782、0.811、0.602,各指标联合AUC为0.958,显示多模态MRI参数用于前列腺癌诊断有一定价值,而多模态参数联合有助于进一步提高前列腺癌诊断价值。罗瑛译等[11]研究也显示ADC值、SImax及miR-301a指标用于前列腺癌中危及高危鉴别ADC值分别为0.659、0.771、0.747,而三指标联合AUC值为0.839,显示多指标联合有助于提高中危、高危前列腺癌鉴别。
前列腺癌病理分级是患者病理诊断中重要组成部分,可以有效反映病灶生物学行为,不仅是患者治疗方案选择参考依据,还与患者预后关系密切[12-13]。本研究结果显示而随着患者病理分级上升,前列腺癌患者ADC、Tmax逐渐减小,而Rmax及SImax逐渐增大,显示前列腺癌患者多模态MRI参数与患者病理分级关系密切,分析认为病理分级越高,细胞分化越差,组织中腺体结构减少,细胞间隙缩小,水分子运动受到限制,因此ADC值下降,同时肿瘤细胞增殖及代谢速度加快,新生血管变多,内皮细胞间隙变大,因此其通透性增加,组织灌注能力增加[14-15]。另一项研究也显示多模态MRI测定前列腺癌病灶ADC值与DCE-MRI参数与病理Gleason评分存在明显相关性,该研究认为Gleason评分高前列腺癌病灶组织中遍布分化不成熟新生血管,这些血管中细胞由于异常增殖,血管间隙减少,水分子运动受到限制,因此ADC值减小,血管壁通透性增加,导致对比剂更易通过[16]。张俊等[17]研究显示前列腺癌患者病灶组织中微血管密度明显增加,高危患者Tmax较短,而SImax及Rmax较高,显示病理分级越高,病灶组织血管生成越丰富,血供量越大。
综上所述,前列腺疾病可以应用多模态MRI参数予以鉴别诊断,多模态MRI参数联合有助于提高对于前列腺癌诊断价值,同时还与前列腺癌组织病理分级存在明显关系,可以为患者病情诊断及评估提供合适影像学参考依据。
