乳腺癌患者MRI成像ADC值与病理参数及血清肿瘤标志物关系⋆
2023-05-25张海莲
韩 龙 张海莲 马 琼
青海大学附属医院放射科 (青海 西宁 810001)
乳腺癌是女性最多发的疾病,其中70%为浸润性导管癌,近年发病逐渐年轻化,影响女性身心健康,早期诊断十分重要[1]。MRI能够多角度扫描,清晰显示病变位置、范围以及肿瘤向周围侵犯程度,获得临床医师青睐[2]。而扩散加权成像(DWI)是乳腺疾病检查的新手段,利用水分子布朗运动生物学特性[3],对于微小病灶的检出具有优势,能提高MRI诊断的准确度[4]。而血清血清腺癌相关抗原(CA153)、卵巢癌相关抗原(CA125)、癌胚抗原(CEA)均为糖蛋白范畴,能全面反映肿瘤发生、转移以及后期恢复效果等,对于临床乳腺癌及乳腺良性疾病的早期鉴别十分重要[5]。基于此,本研究旨在探究乳腺癌患者MRI成像表观弥散系数(ADC)值与病理参数及血清肿瘤标志物关系,以期为临床诊治乳腺癌提供参考,报告入下。
1 资料与方法
1.1 研究对象选择2019年5月至2022年5月来我院就诊的乳腺癌患者108例作为恶性组。
纳入标准:均经病理或手术确诊为乳腺癌[6],且均行MRI及DWI诊断,且图像清晰;患者意识清醒;均为女性,且均为初次确诊。排除标准:入组前进行放化疗治疗患者;治疗期间死亡患者;合并血栓性疾病患者;孕妇。选择同期来我院就诊的乳腺良性病变患者60例作为良性组。恶性组年龄为26~68岁,平均年龄(43.72±5.49)岁,文化程度:初中及以下23例,高中57例,本科及以上28例,病理类型:浸润性导管癌(IDC)77例,导管原位癌21例,其他10例。良性组年龄为27~69岁,平均年龄(44.03±5.17)岁,文化程度:初中及以下14例,高中29例,本科及以上17例。两组受试者一般资料比较,差异均无统计学意义(P>0.05)。本研究经医学伦理委员会同意。
1.2 方法采用GE Signa 1.5T MR进行检测MRI及DWI检查,患者取俯卧位,扫描双侧乳腺及腋窝软组织,先进行MRI平扫,包括横断面T1WI、T2WI序列。对比剂采用钆喷酸葡胺(0.1mmol/kg),速率2mL/s,注射完毕后注入生理盐水20mL,再扫描5次。记录病灶与周围血管联系、形态特征等。DWI应用回波序列,b=1000s/mm2,扫描参数:TR为3000ms,TE为85ms,矩阵128×128,层厚1.0mm。在弥散图像上选择感兴趣区,测得时间-信号强度曲线(TIC),并计算ADC值。
1.3 组织病理学分级取患者的癌组织标本,进行石蜡包埋、切片及HE染色,根据Bloome Richardson按照病变程度分为Ⅰ级~Ⅲ级。
1.4 观察指标(1)两组一般资料收集:收集两组患者年龄、文化程度、疾病类型及组织学分级。(2)两组患者TIC类型及ADC值比较:根据获得MRI数据分析两组TIC类型及ADC值。(3)两组患者血清肿瘤标志物比较:采用全自动化学发光仪(Centaur XP,德国西门子)检测血清CA153、CA125和CEA的水平,临界值分别为:28 U/mL、35 kU/mL、10 ng/mL。
1.5 统计学方法采用SPSS 20.0统计学软件进行统计分析,计量资料以()表示,采用t检验,多组间的比较,正态分布采用单因素方差分析(F);计数资料以率(%)表示,采用χ2检验,恶性组患者ADC值与CA153、CA115、CEA水平的相关性采用Pearson相关性分析,恶性组患者ADC值与组织学分级的相关性采用Spesrman相关性分析,ADC值与CA153、CA115、CEA水平对乳腺恶性病变的诊断价值做ROC曲线分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组TIC类型分布比较两组TIC类型比较,差异有统计学意义(P<0.05),恶性组以Ⅲ型为主,良性组以I型为主,见表1。

表1 两组TIC类型分布比较(n,%)
2.2 两组ADC、CA153、CA125、CEA水平比较比较恶性组的ADC值低于良性组,恶性组的CA153、CA125、CEA水平均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组临床疗效比较(n,%)
2.3 不同病理类型乳腺癌ADC值、IDC不同组织学分级ADC值比较恶性组中,不同病理类型乳腺癌的ADC值比较,差异有统计学意义(P<0.05),IDC的ADC值低于导管原位癌及其他类型(P<0.05);浸润性导管癌中,组织学分级不同患者的ADC值比较,差异有统计学意义(P<0.05),Ⅲ级患者的ADC值低于Ⅰ级、Ⅱ级(P<0.05),见表3。

表3 不同病理类型乳腺癌ADC值、IDC不同组织学分级ADC值比较
2.4 恶性组患者ADC值与CA153、CA125、CEA及组织学分级的相关性ADC值与CA153、CA125、CEA及组织学分级均成负相关(P<0.05),见表4。

表4 恶性组患者ADC值与CA153、CA125、CEA的相关性
2.5 ADC值与CA153、CA125、CEA对乳腺恶性病变的诊断价值采用ROC曲线分析发现,ADC值与CA153、CA125、CEA联合诊断乳腺恶性病变的AUC为0.986,高于单一的ADC值、CA153、CA125及CEA的0.803、0.868、0.844、0.860,见表5,图1。


图1 ADC、CA153、CA125、CEA诊断乳腺恶性病变的价值。图2 乳腺癌患者MRI图片,图2A:乳腺肿块程高灌注改变;图2B:乳腺肿块周围皮肤增厚、牵拉;图2C:乳腺肿块血供丰富;图2D:ADC值增加;图2E:DWI低信号;图2F:肿块T2WI呈高信号周围可见毛刺,期内信号不均匀与皮肤宽基地相连。
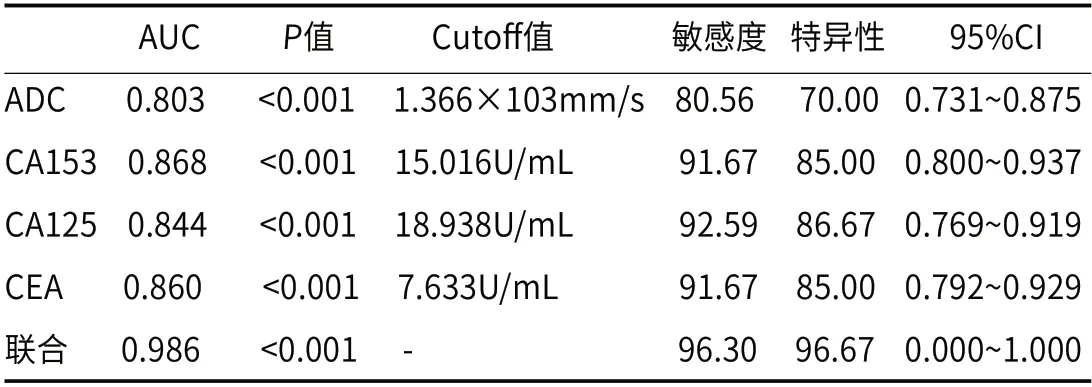
表5 ADC值与CA153、CA125、CEA对乳腺恶性病变的诊断价值分析
2.6 典型病例典型病例分析见图2。
3 讨论
乳腺癌严重威胁女性健康,采用MRI检查,能够准确显示患者病变部位、形态结构、侵及范围等情况,具有较高软组织分辨率,能够对良、恶性病变进行鉴别[7]。DWI是近年来能够观察活体水分子布朗运动的新兴技术,通过ADC定量分析病变性质,对于乳腺癌的早期检出具有重要意义[8]。
TIC曲线能够反映病灶血管通透性及组织血液灌注情况,可为良、恶性病变的鉴别提供参考。本研究显示两组TIC类型存在显著差异,恶性组TIC类型以Ⅲ型为主,良性以I型为主,这主要是由于恶性肿瘤表现出快进快出,强化达到峰值后出现下降(Ⅲ型)或保持在峰值平台(Ⅱ型)的状态,而良性病变则表现为持续上升型(I型)[9]。本研究中,恶性组的ADC值低于良性组,这主要是由于机体内水分子扩散及吸附速率受生物膜结构及水分子物质影响,乳腺癌细胞繁殖速度较快,导致水分子扩散运动受到限制,使得DWI采集信号强度发生变化,恶性病灶DWI信号增高,ADC值较良性病灶降低[10]。邹璇等[11]研究表明采用MRI/DWI诊断恶性肿瘤的ADC值低于良性肿瘤,其检测的敏感度及特异度分别为92.86%、90.00%,与本研究具有一致性。
本研究发现恶性组中,IDC的ADC值低于其他类型。IDC具有更高的侵袭性,组织学上来看,其癌细胞中多形性较为常见,同时有致密纤维组织增生,因此组织间隙水分子扩散受限,ADC值更低[12]。而进一步比较IDC不同组织学分级患者的ADC值发现,Ⅲ级患者的ADC值低于Ⅰ级、Ⅱ级,这说明ADC值与疾病的进展相关。分析这是由于随着乳腺癌患者恶性程度的增加,癌细胞数目增多,正常乳腺组织腺管数量减少,细胞之间间隙变窄,影响水分子扩散速率;同时组织学分级升高会增大异形肿瘤细胞核浆的比例,细胞内间隙也变窄,因而ADC值更低[13]。
乳腺癌临床易转移,因此存在多种肿瘤标志物的升高。CA153是特异性乳腺癌肿瘤标志物,于乳腺癌上皮细胞中发现,与乳腺癌分期、淋巴结转移等相关[14]。CA125是光谱标志物,用于评估妇科恶性肿瘤,CEA在乳腺导管原位癌中高表达,逐渐作为乳腺癌辅助诊断方式[15]。研究表明[16]单一的血清肿瘤标志物诊断价值不高,常多个联合进行检测。本研究中,恶性组的CA153、CA125、CEA水平均高于对照组,提示CA153、CA125、CEA水平能在一定程度上区分良、恶性病变。进一步研究发现,ADC值与CA153、CA125、CEA及组织学分级均成负相关,说明ADC值与血清肿瘤标志物水平及患者疾病进展相关。同时采用ROC曲线分析发现,ADC值与CA153、CA125、CEA联合诊断乳腺恶性病变的AUC高于任一单一指标,提示四项指标联合检测诊断价值最高。当然本研究也存在一定不足,本研究为回顾性研究,所选样本存在一定偏颇,因此还需联合多中心扩大样量,对于不同病理分级患者例数尽可能均衡后再细化分析。
综上所述,乳腺癌患者MRI成像ADC值低于乳腺良性病变患者,其与病理参数及血清肿瘤标志物均存在一定关系,临床可将MRI检查与血清肿瘤标志物结合来提高乳腺癌的检出。
