基于UPLC MS/MS 对盐酸表阿霉素中14-溴-4'-表柔红霉素的质量控制
2023-05-24周雪飞和燕玲雒文军李春燕段光玉卢静静丁安平吴春艳张辉邵伍军
周雪飞,和燕玲,雒文军,李春燕,段光玉,卢静静,丁安平,吴春艳,张辉,邵伍军*
(1.浙江海正药业股份有限公司,浙江 台州 318000;2.台州科技职业学院,浙江 台州 318000)
表阿霉素又名表柔比星,是临床上重要的蒽环类广谱抗肿瘤药物,已广泛应用于多种肿瘤的治疗[1-2]。临床主要用于治疗肺癌、肝癌、乳腺癌、胃癌、恶性淋巴瘤等,其作用机制是直接作用于DNA 核碱对,干扰mRNA 的形成,抑制DNA 的合成和RNA的合成[3]。
14-溴-4'-表柔红霉素为盐酸表阿霉素合成工艺中脱羧酮反应产物,其结构与盐酸表阿霉素相似,含有基因毒性警示结构,根据ICH M7[4],其TTC 为1.5 µg/day,而盐酸表阿霉素的最大日剂量为270 mg,因此14-溴-4'-表柔红霉素的限度为5.6 mg/ kg。由于表阿霉素为发酵类药物,其所含杂质较多[5],而14-溴-4'-表柔红霉素的限度要求较低,普通高效液相色谱法专属性及限度很难达到要求,而液相色谱-质谱联用技术具有灵敏度高、专属性强、分析速度快、结果准确等特点,能够满足痕量毒性杂质测定的要求[6]。本文采用超高效液相色谱-三重四级杆质谱仪(UPLC MS/MS),首次建立盐酸表阿霉素中14-溴-4'-表柔红霉素的质量控制方法,报告限度为0.50 mg/kg,可以快速、简便、灵敏、准确地用来定量测定盐酸表阿霉素中14-溴-4'-表柔红霉素含量[7]。
1 实验部分
1.1 仪器与试剂
ACQUITY I UPLC Class-TQ-S micro 超高效液相色谱-三重四级杆质谱仪(美国Waters 公司)。乙腈、甲醇均为市售色谱纯;甲酸为市售质谱纯;Milli-Q Advantage A10 超纯水仪(美国Merck 公司);盐酸表阿霉素(浙江海正药业股份有限公司)。
1.2 对照品及样品配制
样品溶液:称取盐酸表阿霉素样品25 mg 于25 mL 容量瓶中,用稀释剂溶解并稀释至刻度,混匀。
14-溴-4'-表柔红霉素线性储备液:称取14-溴-4'-表柔红霉素对照品17.96 mg(含量76.2%)置于100 mL 容量瓶中,用稀释剂溶解并稀释至刻度,混匀;移取上述溶液1.0 mL 于100 mL 容量瓶中,用稀释剂稀释至刻度,混匀;移取上述溶液2.0 mL 于100 mL 容量瓶中,用稀释剂稀释至刻度,混匀。
14-溴-4'-表柔红霉素线性溶液配制:移取14-溴-4'-表柔红霉素线性储备液0.5 mL、1.0 mL、5.0 mL、7.0 mL、10.0 mL 于5 个25 mL 容量瓶中,用稀释剂稀释至刻度,混匀。
定量限:分别移取14-溴-4'-表柔红霉素线性储备液0.5 mL 6 份于6 个25 mL 容量瓶中,用稀释剂稀释至刻度,混匀。
检测限:取第一份定量限溶液,移取3.0 mL 于10 mL 容量瓶中,用稀释剂稀释至刻度,混匀。
1.3 色谱-质谱条件
色谱条件:采用Waters ACQUITY UPLC®BEH C182.1×100 mm,1.7 µm 色谱柱;流速0.3 mL/min;柱温40 ℃;进样量3 µL;流动相A 为0.1%甲酸水溶液,流动相B 为乙腈,梯度洗脱程序:0~ 4.0 min,20%~ 80% B;4.0~ 5.0 min,80% B;5.0~ 5.1 min,80%~ 20% B;5.1~ 7.0 min,20% B。
质谱条件:采用ESI+电喷雾离子源;离子源温度150 ℃;脱溶剂气温度350 ℃;脱溶剂气流速1 000 L/hr;毛细管电压3 kV;锥孔电压 35 V;采集模式MRM。质谱参数见表1。
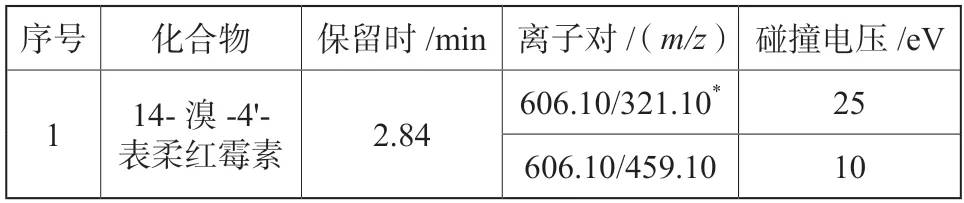
表1 14-溴-4'-表柔红霉素多反应监测参数Tab.1 Multiple reaction monitorning(MRM)parameters for detection of 4'-epi-14-bromo daunorubicin
2 结果与讨论
2.1 流动相的选择
实验中考察了甲酸铵-甲醇、甲酸-甲醇、氨水-甲醇、甲酸铵-乙腈、甲酸-乙腈、氨水-乙腈等流动相体系,结果表明,使用乙腈作有机相时,14-溴-4'-表柔红霉素色谱峰峰型对称性较好,峰更尖锐,且洗脱能力高于甲醇;使用甲酸溶液作无机相时,14-溴-4'-表柔红霉素灵敏度高于氨水体系;使用甲酸铵缓冲盐作无机相时,14-溴-4'-表柔红霉素灵敏度与甲酸作无机相时相似。考虑到甲酸铵缓冲盐作无机相,对仪器的污染高于甲酸流动相体系,本实验最终选择0.1%甲酸水溶液和乙腈做流动相,进行梯度洗脱测定。
2.2 色谱柱选择
14-溴-4'-表柔红霉素结构与盐酸表阿霉素结构相似,盐酸表阿霉素USP 和EP 药典推荐使用C1 色谱柱,本实验选择粒径更小、柱长更短,分离度、柱效更高的超高效液相色谱柱Waters ACQUITY UPLC®BEH C182.1×100 mm,1.7 µm,梯度洗脱,总运行时间为7 min,14-溴-4'-表柔红霉素保留时间约2.8 min。
2.3 质谱条件优化
配制500 ng/mL 的14-溴-4'-表柔红霉素溶液通过蠕动泵直接注入质谱仪,在全扫描模式(Scan)下选择母离子606.10,优化毛细管电压、锥孔电压、脱溶剂气温度、脱溶剂气流速等,使m/z606.10 的响应值最高;在MRM 模式下选定母离子m/z606.10,优化合适的碰撞能量(Collision energy,CE)选取606.10/320.10、606.10/459.10 两个强度最大的子离子色谱峰,响应最高的子离子606.10/320.10 作为定量离子,响应次强的子离子606.10/459.10 作为定性离子。基于UPLC-MS/MS 分析的14-溴-4'-表柔红霉素的MRM 图谱见图1。

图1 14-溴-4'-表柔红霉素定量离子质谱图Fig.1 Quantitative ion chromatograms of 4'-epi-14-bromo daunorubicin
2.4 方法专属性
采用本实验方法,对空白溶剂、样品溶液、定量限溶液及检测限溶液进行检测,由图2 可知,样品溶液及空白溶液对14-溴-4'-表柔红霉素检测无干扰,专属性良好。
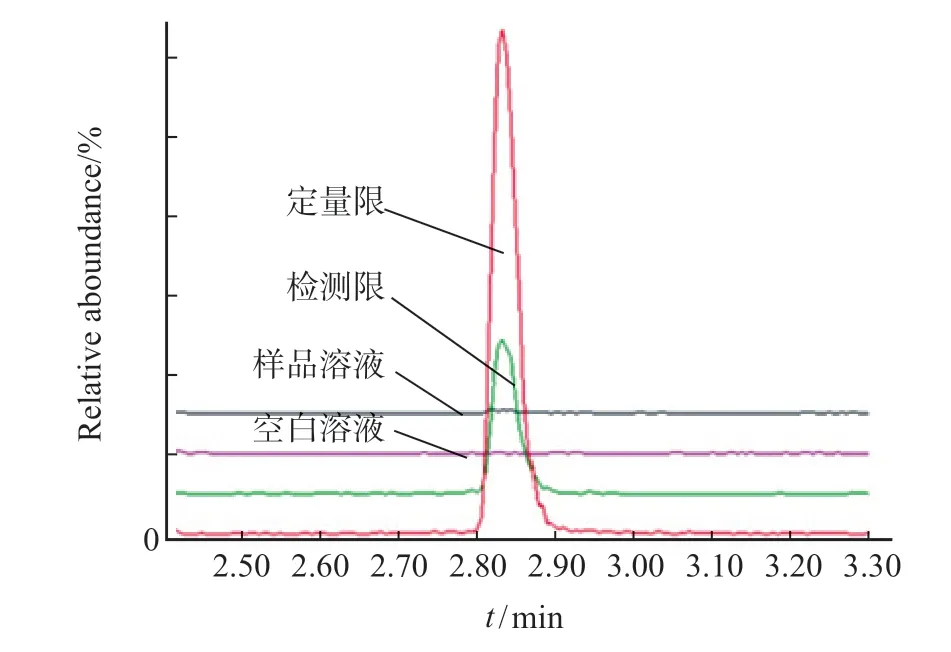
图2 专属性叠加图Fig.2 Overlay mass chromatograms of specifity
2.5 方法的线性、定量限及检测限
采用本实验方法对各线性溶液、定量限溶液、检测限溶液进行检测,以14-溴-4'-表柔红霉素浓度(ng/mL)和其对应的平均峰面积做线性回归曲线,得到浓度与峰面积的线性回归方程和相关系数。实验结果(表2)表明,本方法条件下14-溴-4'-表柔红霉素的线性关系良好,线性相关系数r=0.9999;定量限溶液信噪比(S/N)均≥10,定量限浓度为1.002 2 ng/mL;检测限溶液信噪比(S/N)均≥3,定量限浓度为0.300 7 ng/mL。

表2 14-溴-4'-表柔红霉素线性范围、回归方程、相关系数、检出限及定量限Tab.2 Linear ranges,regression equations,correlation coeffients(r),limit of detection(LOD)and limit of quantitation(LOQ) of 4'-epi-14-bromo daunorubicin
2.6 精密度和准确度
在0.56 µg/g、5.60 µg/g、7.84 µg/g 的添加浓度下,盐酸表阿霉素样品中精密度溶液做6 个平行实验,准确度溶液做3 个平行实验。实验结果(表3)表明,14-溴-4'-表柔红霉素的回收率均在99.0%~ 101.3%,相对标准偏差RSD<2%,该方法精密度和准确度良好。
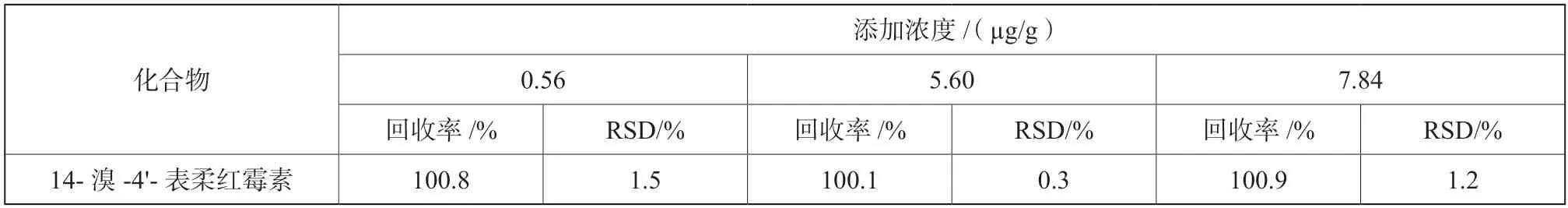
表3 盐酸表阿霉素中14-溴-4'-表柔红霉素精密度和准确度Tab.3 Sample precision and accuracy of 4'-epi-14-bromo daunorubicin in epirubicin hydrochloride
2.7 样品检测
采用本研究建立的分析方法,对盐酸表阿霉素3批原料药样品1060-D190701、1060-D190702、1060-D190703 进行检测,三批样品中均未检测到14-溴-4'-表柔红霉素,即小于检测限限度0.16 µg/g。
3 结论
本研究首次建立了超高效液相色谱-四级杆质谱联用技术对盐酸表阿霉素中14-溴-4'-表柔红霉素质量进行研究的方法,该方法采用Waters ACQUITY UPLC®BEH C18(2.1×100 mm,1.7 µm)色谱柱进行分离,以0.1%甲酸水溶液为流动相A,乙腈为流动相B,梯度洗脱,质谱采用正离子MRM 模式采集数据,流速为0.3 mL/min。经验证14-溴-4'-表柔红霉素的线性范围为0.547 4~ 10.948 4 ng/mL,相关系数r=0.999 9,方法检出限浓度为0.164 2 ng/ mL,定量限浓度为0.547 4 ng/mL,样品加标回收率在99.0%~ 101.3%。以上结果表明,该方法快速、简便、灵敏,可以准确地测定盐酸表阿霉素中14-溴-4'-表柔红霉素的含量,同时为控制盐酸表阿霉素中14-溴-4'-表柔红霉素杂质提供技术支撑。
