基于网络药理学及分子对接探讨怀牛膝治疗高血压的物质基础和作用机制*
2023-05-23黄莉谭辉孙宇洁李慧董昌武
黄莉 谭辉 孙宇洁 李慧 董昌武**
(1.安徽中医药大学,安徽 合肥 230012;2.安徽省中医药科学院中医基础理论研究所,安徽 合肥 230038)
牛膝为苋科植物牛膝(AchyranthesbidentataBlume)的干燥根,该药始载于《神农本草经》,又称怀牛膝、山苋菜、百倍、牛茎等。《本草品汇精要·草部上品之上》言:“怀州者为佳。”怀州即是今天的河南焦作、济源地域,道地药材怀牛膝历史悠久、质量优良、精耕细作、疗效显著,《药品化义·卷七·肾药》中有关于其性味归经的描述:“性凉,能沉,力滋阴活血……入肾、肝二经。”现代药理学研究发现,牛膝含有糖类、皂苷类、生物碱类、植物甾醇类、黄酮类等多种化学成分,药理作用主要有降血压、抗炎、镇痛、调节免疫、抗肿瘤、抗衰老等[1]。
高血压(hypertension)以动脉血压升高为基本特征,是一种遗传与环境两种因素交互作用所导致的心血管综合征,是心血管疾病最主要的危险因素。从中医角度分析,高血压的症状表现可归于“厥证”“头痛”“眩晕”等范畴,高血压发病的病机可总归于本虚标实,虚者多因年老体弱、病后体虚、劳倦过度等致气血亏虚、髓海亏虚、肝肾不足,甚而阴阳两虚;实者多责于风、火、痰、湿、瘀上扰清窍,或肝郁化火,或痰浊中阻,或瘀血阻络等[2]。流行病学调查显示,随着我国老龄化人口比重逐渐增大,生活习惯、饮食结构等因素的变化,而阴虚阳亢型在各类高血压中所占比例最高[3]。虽然临床西药降压效果显著,但遗留副作用仍高居不下,寻求中医药整体调治成为临床的优先选择趋势。数据挖掘发现,怀牛膝在治疗高血压的核心药物中属于高频用药[4],是常用的活血化瘀中药,具有明确的降压效果且对靶器官具有一定的保护作用[5]。以镇肝息风汤一方降压作用为例,该方重用怀牛膝为君药,取其补肝肾、活血通经、引血下行之功,现代实验研究发现,牛膝所含的牛膝总皂苷可明显降低卒中型自发性高血压大鼠血压,在抑制去甲肾上腺素引起的血管收缩的同时还能舒张血管平滑肌[6]。本文拟运用网络药理学技术初步探究怀牛膝降血压的生物学过程,从靶点、信号通路的角度揭示其降压机制,为实验研究提供参考。
1 资料与方法
1.1怀牛膝活性成分筛选 在中药系统药理学分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://lsp.nwsuaf.edu.cn/tcmsp.php)检索怀牛膝的化学成分,以口服生物利用度(oral bioavailability,OB)≥30%和药物相似性(drug likeness,DL)≥0.18作为筛选条件,筛选出活性成分较高的化合物,并从该网站获取活性成分对应蛋白作用靶点,检索时间截止至2021年3月27日,建立怀牛膝活性成分及靶点数据库。
1.2高血压相关靶点的筛选 将“Hypertension”作为关键词,分别在GeneCards数据库(https://www.genecards.org/)、OMIM数据库(http://www.omim.org/)进行检索,将检索结果合并去除重复,作为疾病靶点数据库备用。
1.3怀牛膝-高血压靶点网络构建 利用Venn在线软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)将怀牛膝活性成分对应靶点和高血压靶点取交集。通过上文搜集的活性和靶点之间相互作用的关系建立“化合物-靶点-疾病”网络,并运用Cytoscape3.7.2(http://www.cytoscape.org/)软件对该网络进行可视化分析及图像的处理。
1.4蛋白互作网络(PPI网络)的构建 将筛选得到的药物-疾病交集靶点上传至String(https://string-db.org/)在线平台数据库,建立蛋白质相互作用(protein-protein interaction,PPI)网络,限定研究物种为“人”(“Homo sapiens”),参数保持默认设置,获得PPI网络。
1.5GO功能分析和KEGG通路富集分析 为了进一步分析怀牛膝作用于高血压的相关机制,将怀牛膝的关键靶点上传至David 6.8(Database for Annotation,Visualization and Integrated Discovery)数据库(https://david.ncifcrf.gov/,Version 6.8),设定研究对象为人(Homo sapiens),进行基因功能(GO,gene ontology)分析以了解靶点生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)三方面的作用过程。利用R语言3.6.3中的“clusterProfiler”包对关键靶点进行KEGG(Kyoto Encyclopedia of Genes and Genomes,https://www.kegg.jp/)富集分析,clusterProfiler优势在于可以实时抓取KEGG最新版本注释得到更具时效性的富集注释结果。以P<0.01进行靶基因筛选,得到怀牛膝靶点主要的生物过程和药理作用机制中可能性较大的通路。
1.6关键靶点的分子对接 从RSCB数据库中下载相关蛋白晶体结构,使用AutoDockTools 1.5.6软件将晶体结构中的水分子删除,进行加氢处理,并且进行电荷计算,输出为pdbqt格式文件保存。从PubChem数据库中下载筛选出的怀牛膝活性成分3D结构,保存为SDF格式文件,利用Chem3D 17.0软件和PyMOL进行蛋白小分子结构处理,再上传化合物文件使其能量最小化,最后运用AutoDock vina软件进行分子对接,再使用PyMOL软件对对接结果进行三维结构可视化分析。
2 结果
2.1怀牛膝活性成分的筛选 在TCMSP数据库共检索到176个怀牛膝潜在活性成分,以OB≥30%和DL≥0.18为筛选条件,并筛去无对应靶点的成分,最终获得16个潜在的有效成分(表1)。

表1 怀牛膝潜在有效成分
2.2怀牛膝活性成分-高血压靶点预测 从DrugBank数据库整合后得到16种活性成分靶点363个,通过Unipot数据库进行标准化处理,汇总去重后得到183个靶点。设置relevance score≥7,由GeneCards、OMIN数据库检索整合去重后得到高血压靶点1010个,将活性成分对应靶点及疾病靶点取交集,得到活性成分-疾病靶点76个,绘制的韦恩图,见图1。
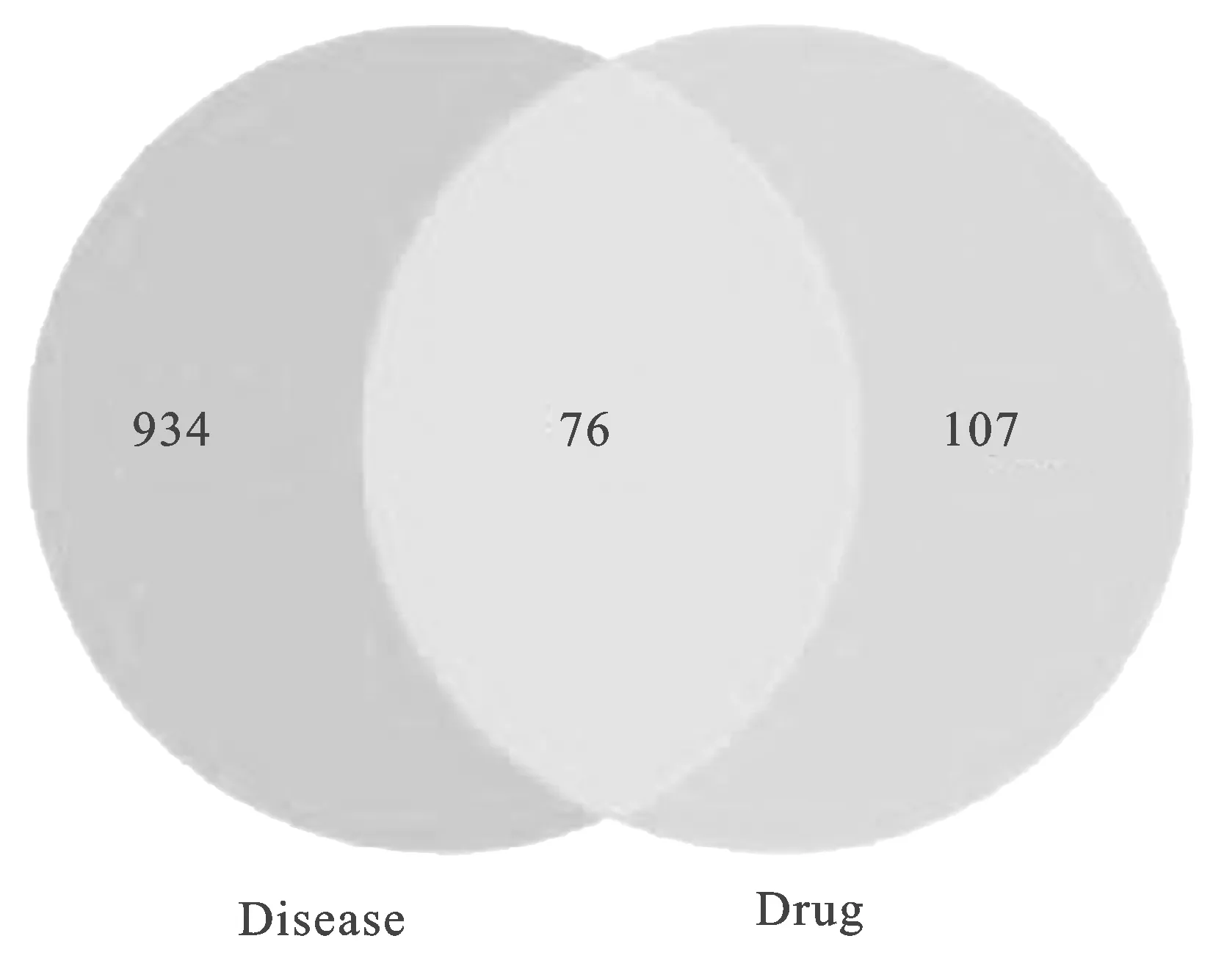
图1 药物与疾病共有作用靶点韦恩图
2.3“化合物-靶点-疾病”的网络构建及可视化分析 将76个共同靶点通过Cytoscape 3.7.2软件构建怀牛膝、高血压“化合物-靶点-疾病”的可视化网络图(图2),结果显示,怀牛膝发挥降压作用的潜在活性成分主要有槲皮素(quercetin)、山奈酚(kaempferol)、豆甾醇(Stigmasterol)、汉黄芩素(wogonin)等,协同作用于PTGS2、PTGS1、PPARG、ADRB2、AR、CASP3、AKT1、ESR1、NOS2等靶点。
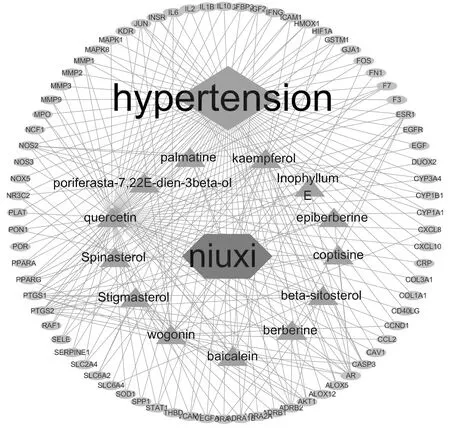
绿色椭圆形节点代表作用靶点,紫色三角形节点代表药对有效成分化合物,红色菱形代表高血压,蓝色平行六边形代表牛膝,灰色线条代表相互作用关系。
2.4怀牛膝治疗高血压的PPI网络 设置置信度大于0.4,将Venn图获得的76个药物-疾病共同靶点上传至STRING在线数据库平台得到PPI网络(图3)。据Count值筛选列举出怀牛膝治疗高血压排名前30的关键靶点蛋白(图4),主要包括IL-6、AKT1、VEGFA、CCL2、MMP9、NOS3、IL-1B等。

图3 怀牛膝治疗高血压相关靶点的PPI网络

图4 怀牛膝治疗高血压的关键靶点

图5 怀牛膝活性成分治疗高血压靶点的GO富集分析柱状图
2.5GO功能富集分析 利用DAVID 6.8平台进行GO功能富集分析,设定P<0.05,对筛选得到的76个关键靶点进行分析,这些靶点主要涉及reactive oxygen species metabolic process、response to lipopolysaccharide、response to molecule of bacterial origin等307条生物过程。CC分析可以看出靶点主要涉及membrane raft、membrane microdomain、membrane region等35条细胞组分。MF分析中可以看出,靶点主要涉及heme binding、tetrapyrrole binding、oxidoreductase activity等54条分子功能。
2.6怀牛膝治疗高血压KEGG通路富集分析 使用clusterprofiler R包对76个靶点进行KEGG富集分析,以P<0.01为筛选标准,得到的60条KEGG通路富集,前20条通路富集见表2、图6,主要是AGE-RAGE信号通路、TNF信号通路、IL-17信号通路、松弛素信号通路、HIF-1信号通路、内分泌抵抗、Toll样受体信号通路等。
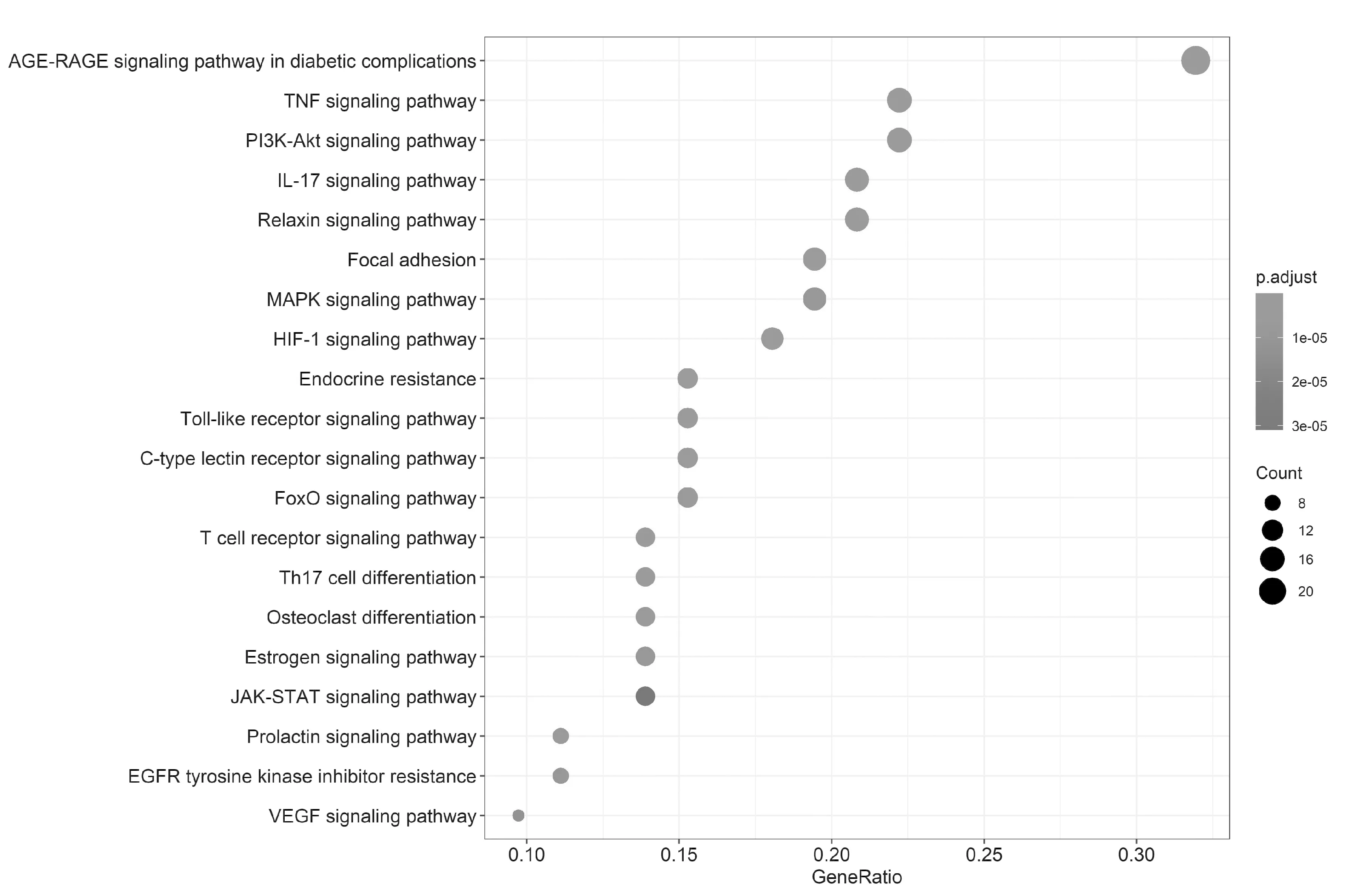
图6 KEGG通路富集分析气泡图

表2 KEGG通路富集分析
2.7关键靶点的分子对接分析 分析化合物-靶点-高血压的网络图,从16种活性化合物中选取连接靶点数较多、综合评分较高的的槲皮素、山奈酚、豆甾醇以及汉黄芩素,并选择靶点PTGS1(PDB ID:6y3c)、PTGS2(PDB ID:5f19)、NOS2(PDB ID:6jwm)、ADRB2(PDB ID:6kr8)、PPARG(PDB ID:3e00)、AR(PDB ID:3btr)、CASP3(PDB ID:2dko)、AKTI(PDB ID:1unq)、ESR1(PDB ID:1hcq)、JUN(PDB ID:1s9k)与上述4种活性化合物分别进行分子对接,结果见表3。结合能小于0提示配体与受体可自发结合,且结合构象越稳定结合能越低,发生作用的可能性越大[7]。结果显示,槲皮素与PTGS2,山奈酚与PTGS1、ESR1、JUN,豆甾醇与PTGS2、CASP3、ESR1,汉黄芩素与CASP3、AR的结合能较低。选取部分结合较好的对接结果,进行三维对接情况分析,见图7。

图7 怀牛膝活性成分与PTGS2、ESR1、JUN、CASP3分子对接三维图
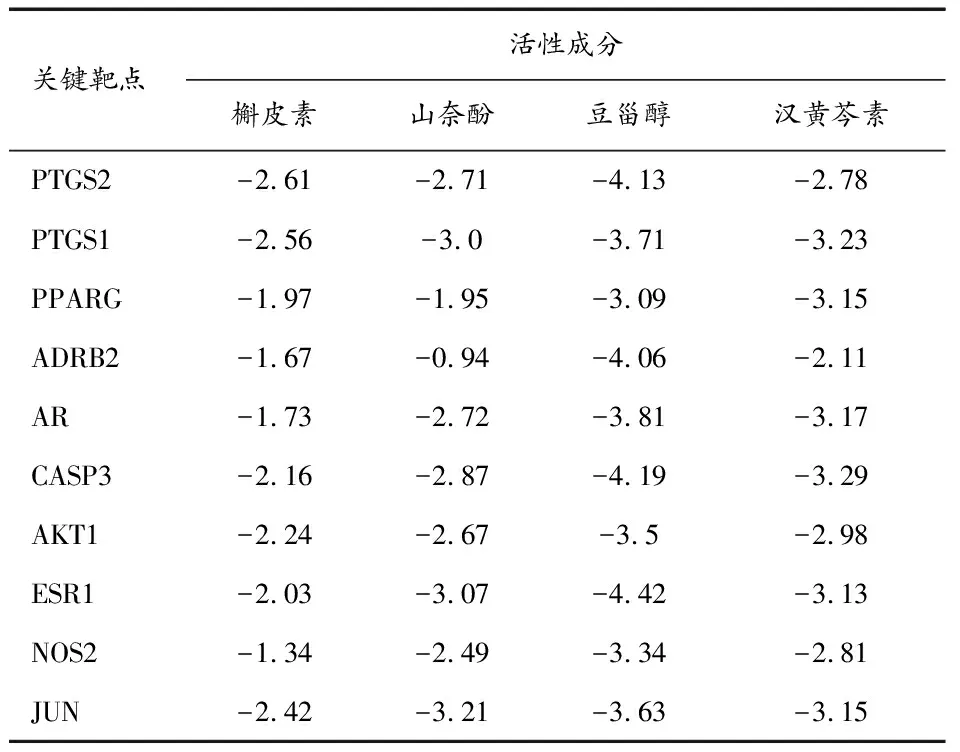
表3 怀牛膝活性成分与关键靶点的结合能(kcal/mol)
3 讨论
本研究运用网络药理学,通过建立怀牛膝治疗高血压的作用网络分析其潜在机制,综合分析表1及图2结果,怀牛膝主要有效化合物有16个,其治疗高血压的可能关键成分有6个,为槲皮素、山奈酚、豆甾醇、汉黄芩素、黄芩素、β-谷甾醇。槲皮素可减少氧化应激反应,亦可干扰RAAS,改善血管内皮素-1(ET-1)和NO平衡,从而改善血管内皮功能,降低血压[8]。山奈酚可通过内皮依赖性舒张血管,以此机制抑制血管紧张素Ⅱ导致的血管重构,还可通过抑制IKK/NF-κB炎症损伤IRS-1改善Ⅱ型糖尿病大鼠的胰岛素抵抗,并对其具有调血脂作用[9]。黄芩素可通过抑制左心室胶原蛋白和12-脂氧合酶的表达,下调MMP-9和ERK的活性[10],缓解自发性高血压小鼠的心肌纤维化。汉黄芩素可抑制甘油二酯在胞内的积聚和蛋白激酶C的磷酸化,从而抑制血管平滑肌细胞的凋亡,缓解动脉粥样硬化[11]。豆甾醇、β-谷甾醇可作用β1AR、β2AR靶点,影响钙离子转运[12],还能改善脂质代谢过程,预防动脉粥样硬化。
研究表明,高血压的发病主要与RAAS激活、交感神经活动亢进、水钠潴留、胰岛素抵抗、膜离子转运异常及血管内皮功能紊乱等有关[13],血压受自主神经系统和NO、ET-1等体液机制双重调控。结合图1、2、3、4可知,怀牛膝对应有效作用靶点183个,高血压靶点1010个,交集靶点76个,其中关键作用靶点有IL6、AKT1、VEGFA、CCL2、MMP9、NOS2、NOS3、PTGS1、PTGS2、PPARG、ADRB2、AR、CASP3、ESR1、JUN、IL-1B等,这些靶点涉及到活性氧代谢过程、对细菌来源分子的反应、对脂多糖的反应、氧化应激反应、循环系统中的血管过程、管径调节等生物学过程。IL-6、IL-1B在心血管疾病发生上主要介导血管内炎性反应[14],IL-6可使血管平滑肌细胞与成纤维细胞增殖,产生大量血小板衍生因子,促进血小板数量增多,循环阻力增加而使血压升高。IL-1B也可刺激并增殖血管平滑肌细胞,改变细胞膜上的Ca2+渗透性,使血管收缩而致血压升高。AKT1参与糖脂代谢,而糖代谢异常与高血压前期病变互为因果。此外,还能促进炎症反应调节成纤维细胞的转分化,在高血压导致的心肌纤维化中发挥重要作用[15]。CCL2是最广泛的趋化因子之一,高血压时因血流动力学因素、血管紧张素Ⅱ(AngⅡ)等作用CCL2的表达会随之增加[16]。VEGFA是促进血管内皮细胞增殖的因子,与血管损伤、动脉粥样硬化密切相关,与血压升高呈正相关[17]。MMP-9属于基质金属蛋白酶家族,其增高会引起细胞外基质胶原蛋白的重构,使Ⅰ/Ⅲ型胶原蛋白含量升高,在高血压动脉重塑过程中发挥重要作用[18]。NOS是一种同工酶,NOS2和NOS3是其亚型,NOS2变异表达异常,通过氟他胺代谢导致高血压的发生,NOS3变异含量改变,可能通过影响异丙酚的代谢而影响血压[19]。ADRB2调节骨骼肌肌糖原分解及血管平滑肌松弛,与NOS2、NOS3同是调节血管舒缩功能的重要介质。ESR1能促进NOS的表达,从而增加血管内一氧化氮的释放,舒张血管。PTGS有组成型(PTGS1)和诱导型(PTGS2)两种同工酶,它们可与前列环素受体G蛋白耦联受体结合,从而激活G蛋白,升高环磷酸腺苷水平,进而抑制血小板聚集,降低血液粘稠度抗血管收缩[20]。PPARG属于核激素受体超家族,可与相关的配体结合激活转录因子,调节脂类的分解代谢、能量的代谢[21]。Caspase家族大部分参与细胞凋亡起始、执行,其中CASP3直接参与DNA断裂、染色质凝聚和凋亡小体的形成。
富集的分子功能主要包括血红素结合、四吡咯结合、氧化还原酶活性、细胞因子活性、整合素结合、肾上腺素能受体活性、受体配体活性、类固醇激素受体、G蛋白偶联胺受体活性等方面。KEGG通路富集分析显示,这些靶点参与了AGE-RAGE信号通路、TNF信号通路、IL-17信号通路、HIF-1信号通路、松弛素信号通路、Toll样受体信号通路等的调控。AGE-RAGE信号通路与心脏血管发挥作用密切相关,AGE主要通过修饰蛋白结合受体RAGE,激活信号转导通路参与高血压的发生发展[22]。TNF、IL-17信号通路与炎症反应有关,TNF信号通路异常调节会导致血管内皮细胞受损,平滑肌细胞增生,血管外周阻力增加而引起高血压,IL-17信号通路可诱导多种组织和细胞中促炎细胞因子、趋化因子和金属蛋白酶的表达[23]。松弛素信号通路不仅对机体的血流动力学和心肌肥大有调节作用,还可参与心肌修复和再生,逆转心脏纤维化[24]。HIF-1信号通路能调节肾脏髓质功能、水盐平衡,HIF-1α可激活HO-1(血红素氧合酶1)、COX-2(环氧化酶2)和NOS等基因表达,促进尿钠排泄[25]。此外,还可通过调节凋亡减轻缺血再灌注损伤,保护心肌功能。Toll样受体信号通路中TLR4介导先天及适应性免疫反应,参与高血压慢性血管炎性反应过程,主要因为TLR4介导内皮细胞炎性损伤,增强血管反应性[26]。
综上,本文以网络药理学为依托,通过建立网络从整体上分析怀牛膝成分、靶点、信号通路之间的相互作用关系,推测中药怀牛膝通过槲皮素、山奈酚、汉黄芩素、黄芩素、豆甾醇、β-谷甾醇等黄酮类、甾醇类潜在药效成分协同作用于IL6、AKT1、VEGFA、CCL2、MMP9、NOS2、NOS3、PTGS1、PTGS2、PPARG、ADRB2等多个靶点,通过AGE-RAGE信号通路等多个通路,参与血管舒缩、钙钠离子转运、血管内皮功能、炎症反应、糖脂代谢、氧化应激等发挥治疗高血压的作用,初步揭示了怀牛膝通过多成分、多靶点、多通路发挥降压作用的机制。为进一步探讨其发挥作用的药效物质基础和作用机制研究提供方向,其后续尚需体内外实验进一步证实其功效网络的内在关联和作用靶点。
