微量残留病监测在ETV6/RUNX1阴性和阳性急性B淋巴细胞白血病患儿预后中的意义
2023-05-22刘俊闪郭明发史利欢段勇涛
刘俊闪 郭明发 孙 佳 史利欢 刘 炜 段勇涛
(1. 郑州大学附属儿童医院河南省小儿血液医学重点实验室,河南 郑州 450000;2. 郑州大学附属儿童医院血液肿瘤科,河南 郑州 450000)
急性B淋巴细胞白血病(acute B-lymphoblastic leukemia,B-ALL)是一种常见的儿童白血病,严重威胁患儿健康和生命[1]。目前,儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)的治疗方案以化疗和造血干细胞移植为主,复发是治疗失败的最主要原因。微量残留病(minimal residual disease,MRD)是指恶性血液系统疾病经治疗后虽然达到临床缓解,但血液中仍残存微小比例白血病细胞的状态[2-3],随着治疗的持续进行,残留的细胞可能会逐步减少,直至完全消失。MRD是疾病复发的隐患,持续监测MRD是评估恶性血液系统疾病患者预后的重要措施。由于MRD呈动态变化,不同时间点的MRD数值反映的预后意义不同[4-5]。有研究发现,对于不同融合基因背景的ALL患儿,MRD状态及其代表的预后意义有一定差异[6],但相关研究报道较少,结论不明。本研究拟探讨ETV6/RUNX1融合基因阳性和阴性的B-ALL患儿各时间点MRD的差异和临床意义,以期为不同融合基因背景B-ALL患儿的预后评估提供参考。
1 材料和方法
1.1 研究对象
选取2018年1月—2021年6月郑州大学附属儿童医院收治的B-ALL患儿234例,其中ETV6/RUNX1融合基因阳性78例(阳性组),阴性156例(阴性组)。纳入标准:1)年龄<18岁;2)经法美英分型标准和流式细胞术免疫分型确诊为B淋巴细胞白血病的初诊患儿;3)初诊时接受46种融合基因检测,确认为ETV6/RUNX1融合基因阳性或无融合基因背景(常见融合基因检测均为阴性);4)在郑州大学附属儿童医院接受化疗,并随化疗进程接受MRD监测;5)患儿随访资料完整。排除标准:1)混合系白血病患儿;2)未完成化疗或化疗开始3个月内死亡患儿。
1.2 方法
收集所有患儿入院时的一般资料,包括年龄、性别、初诊白细胞计数、临床危险度[7],根据患儿的随访记录统计其生存情况,无复发生存期(relapse-free survival,RFS)定义为从第1次完全缓解至疾病复发的时间。记录患儿诱导化疗第15天、第33天和巩固治疗开始前(第12周)的MRD检测结果,分别记为MRD1、MRD2和MRD3。检测方法:通过骨髓穿刺抽取患儿骨髓液2 mL,乙二胺四乙酸抗凝,2 h内送检流式细胞术免疫分型检测,检测仪器为美国BD公司FACS canto型流式细胞仪。按照初诊时的免疫分型结果制定个体化MRD检测方案,检测患儿有核细胞≥5×105个;采用CD45、CD19、CD38、CD20、CD10、CD34、CD58、CD123、CD13、CD33等抗体组合。首先根据CD45/CD19和CD19/SSC对CD19+细胞进行设门,然后对CD19+细胞进行其他抗体分析,以残存细胞比例作为MRD值,MRD1和MRD2均以>1×10-3为阳性标准,MRD3以>1×10-4为阳性标准。典型MRD阳性结果见图1。
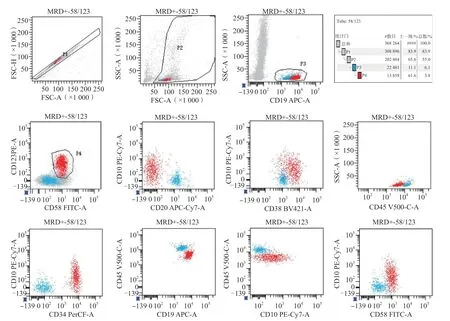
图1 典型MRD阳性流式细胞术检测结果
1.3 统计学方法
采用SPSS 19.0软件进行统计学分析。呈正态分布的计量资料以±s表示,组间比较采用独立样本t检验;计数资料以例或率表示,组间比较采用χ2检验。采用Kaplan-Meier生存曲线分析ETV6/RUNX1融合基因与B-ALL患儿生存率之间的关系。采用多因素Cox回归分析评价B-ALL患儿预后的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 阳性组和阴性组一般资料比较
阳性组和阴性组年龄、性别、初诊白细胞计数、临床危险度、3次MRD阳性率差异均无统计学意义(P>0.05)。见表1。
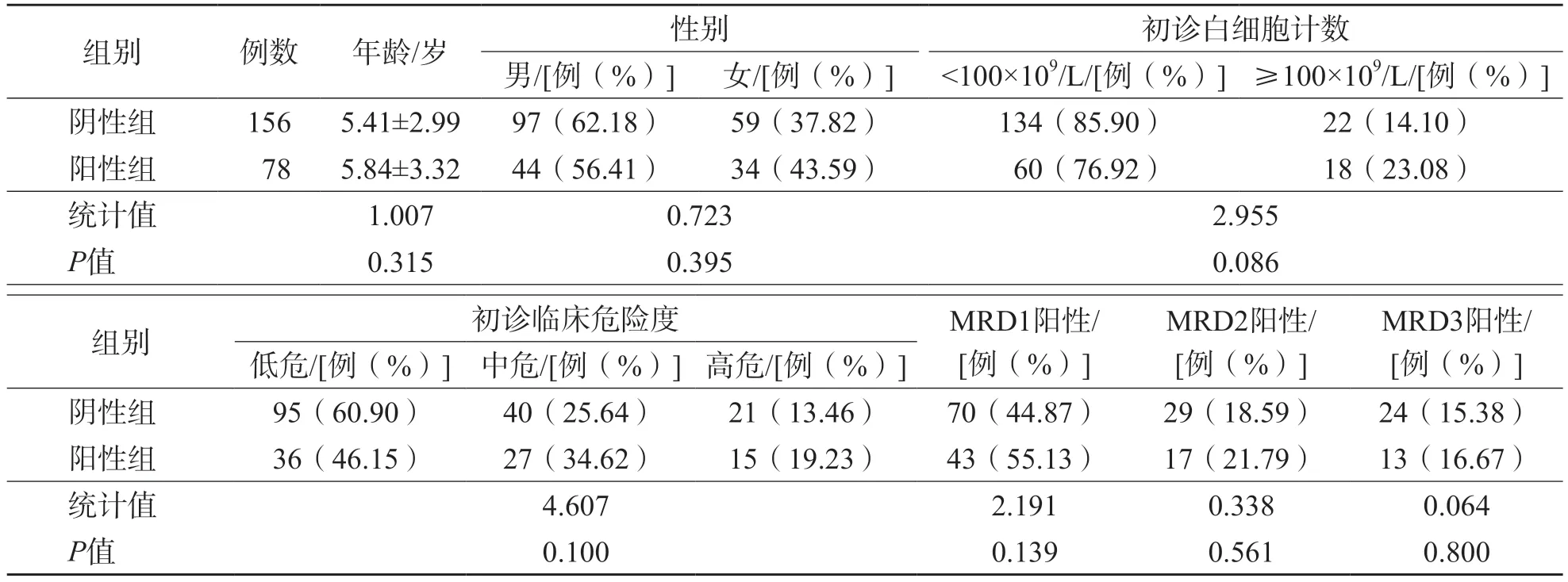
表1 阳性组和阴性组一般资料比较
2.2 阳性组和阴性组患儿预后比较
234例患儿随访时间为4~46个月,中位随访时间为26个月,有18例(7.69%)患儿复发,5例(2.14%)患儿死亡。Kaplan-Meier生存曲线分析结果显示,与阴性组比较,阳性组整体RFS较长(χ2=4.745,P=0.029),即复发率更低。见图2。

图2 ETV6/RUNX1融合基因与B-ALL患儿RFS的关系
2.3 MRD对ETV6/RUNX1融合基因阴性患儿预后的影响
在阴性组内,MRD1阳性患儿平均RFS为40个月,与阴性患儿(42个月)比较,差异无统计学意义(χ2=0.772,P>0.05)。MRD2和MRD3阳性患儿的平均RFS均为33个月,均短于MRD2和MRD3阴性患儿(均为43个月)(χ2值分别为9.747、11.697,P<0.05)。见图3。
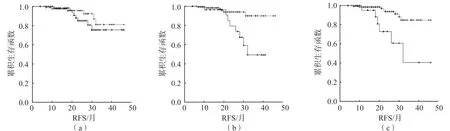
图3 阴性组内各时间点MRD与患儿RFS的关系
以各时间点MRD、患儿年龄、性别、初诊白细胞计数和临床危险度(低危和中/高危)为自变量,采用Cox回归分析B-ALL患儿预后的影响因素,方法为“条件(向前)”逐步回归,结果显示,年龄(≥10岁)、临床危险度(中/高危)和MRD3阳性是阴性组患儿预后的独立影响因素(P<0.05)。见表2。

表2 ETV6/RUNX1融合基因阴性患儿预后影响因素分析
2.4 MRD对ETV6/RUNX1融合基因阳性患儿预后的影响
在阳性组内,MRD1阳性患儿平均RFS为44个月,与阴性患儿(42个月)比较,差异无统计学意义(χ2=0.128,P>0.05)。MRD2和MRD3阳性患儿的平均RFS均为39、34个月,均短于MRD2和MRD3阴性患儿(均为45个月)(χ2值分别为1.567、4.266,P<0.05)。见图4。
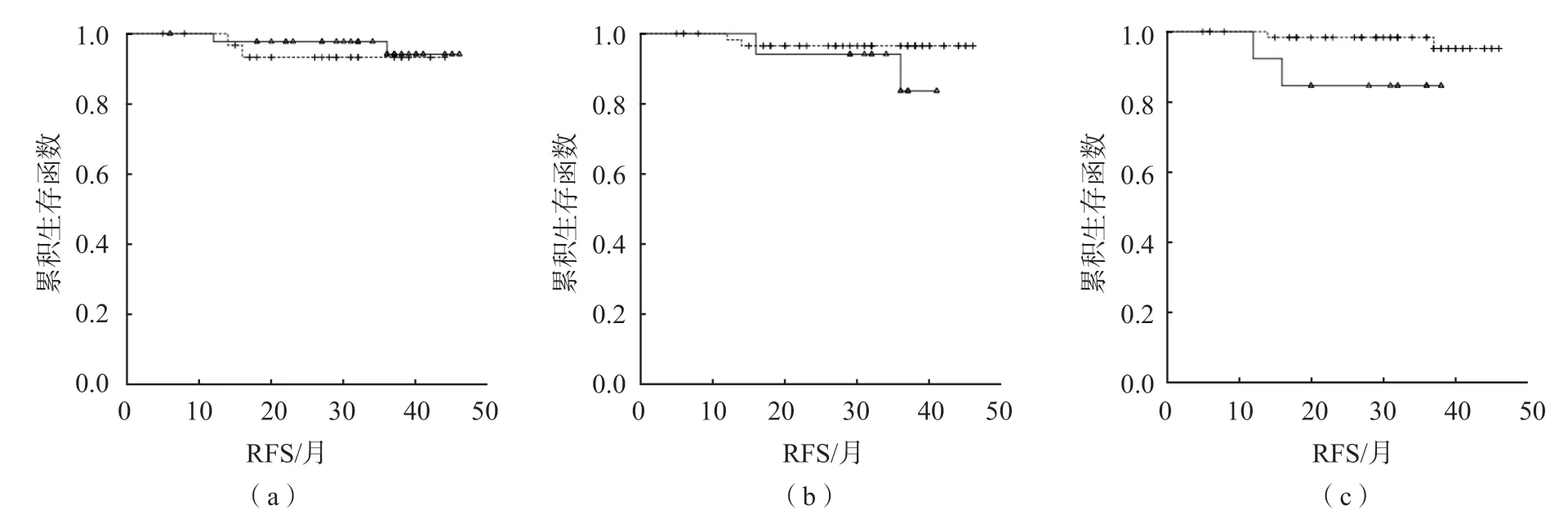
图4 ETV6/RUNX1融合基因阳性组内各时间点MRD与患儿RFS的关系
进一步纳入各时间点MRD和患儿一般资料进行多因素Cox回归分析,结果显示,年龄≥10岁和初诊白细胞计数≥100×109/L是ETV6/RUNX1融合基因阳性患儿预后的独立影响因素(P<0.05)。见表3。
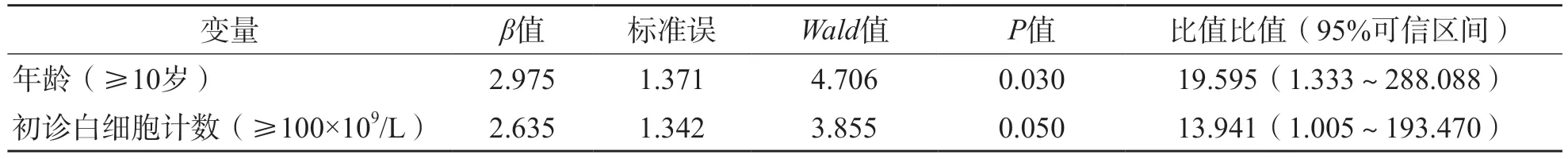
表3 ETV6/RUNX1融合基因阳性患儿RFS影响因素分析
3 讨论
随着临床诊疗技术的进步,B-ALL患儿的整体生存率已逐步提高,但仍有20%~30%患儿化疗失败[8]。除环境因素外,遗传因素也是患儿发病的重要原因。近年来,儿童白血病融合基因相关研究成果在临床诊断上的应用也逐渐普及。ETV6/RUNX1融合基因是一种常见的融合基因类型,由位于12号染色体上的ETV6基因与位于21号染色体上的RUNX1基因剪切重组后形成,可影响造血干细胞的复制、分化等生物学过程,参与白血病的发生和发展[9]。有研究发现,约25%的B-ALL患儿ETV6/RUNX1融合基因阳性,占有融合基因背景B-ALL患儿的40%[10]。关于ETV6/RUNX1融合基因与B-ALL患儿预后的关系,相关研究报道其5年无病生存率显著高于其他亚型[11],但不同研究对这一结论存在争议,有学者认为其有促癌作用,有学者认为其可致病情进展,也有学者认为其与患者预后无相关性。MONTAÑO等[12]发现,敲除淋巴细胞ETV6/RUNX1融合基因,可以抑制淋巴细胞恶性增殖、凋亡抗性和体内成瘤能力,提示该基因发挥促癌作用。AMPATZIDOU等[13]发现,ETV6/RUNX1融合基因阳性ALL患者中存在淋巴细胞克隆异质性和MRD清除功能受损,最终导致疾病的复发和不良预后。BHOJWANI等[14]发现,ALL患儿ETV6/RUNX1阳性表达与年龄<10岁、低风险分级和治疗第19天的MRD水平相关,ETV6/RUNX1阳性患儿的无事件生存率明显更高(P<0.05)。WANG等[15]发现,ETV6/RUNX1融合基因阳性ALL患儿风险分层治疗完全缓解率高、远期疗效好。相关研究结果显示,ETV6/RUNX1在白血病中的临床意义与其作用机制有关,一方面,ETV6/RUNX1可以激活PI3K/Akt/mTOR等致癌通路,促进细胞增殖、细胞黏附和DNA损伤反应;另一方面,ETV6/RUNX1高表达也会提高治疗反应性,利于疾病预后,争议可能与研究对象和目的的差异有关[12,16]。本研究结果显示,与阴性组比较,阳性组患儿的RFS显著延长(P=0.029),提示ETV6/RUNX1融合基因阳性是患儿无复发生存的保护因素,与WANG等[15]的研究结论一致。
复发是威胁B-ALL患儿生存的最主要原因,及早诊断和调整治疗方案是改善患儿预后的关键。随着流式细胞术诊疗技术水平的逐步提高,MRD检测也在白血病患儿化疗疗效监测中广泛开展。尽管MRD是观察疗效最直观的指标,但目前关于MRD监测的时间点和阈值设定仍未达成共识[17-18]。这是因为肿瘤细胞是在治疗过程中被逐步消灭的,MRD阳性,尤其是化疗早期阳性并不意味着患儿一定会复发;同时,因MRD阈值和检测精度的原因,MRD阴性也不等同于癌细胞的绝对清除。目前的研究多以患儿诱导化疗第15天、第28~33天和巩固治疗开始前(第12~13周)为监测点,即多数研究认为这几个时间点的MRD与预后相关性较好[19]。目前,关于MRD与ETV6/RUNX1融合基因相关性的研究尚不多见,不同融合基因背景患儿MRD检测的临床意义是否存在差异尚无明确结论[20-21]。危彤等[6]发现,MRD监测仅对无融合基因背景的B-ALL患儿的预后有意义,而对于ETV6-RUNX1或E2A-PBX1阳性的患儿无显著预测价值。本研究结果显示,阴性组中,治疗第15天MRD阴性和阳性患儿RFS差异无统计学意义(P>0.05),而治疗第33天和第12周时MRD阳性患儿RFS显著短于阴性患儿(P<0.05),MRD3阳性是此类患儿预后的独立影响因素;而阳性组中,治疗第15天和第33天MRD阴性、阳性患儿RFS差异无统计学意义(P>0.05),治疗第12周时MRD阳性患儿RFS显著短于阴性患儿(P<0.05),但多因素分析结果显示,MRD3并非此类患儿预后的独立影响因素。由此可以看出,不同融合基因背景下各时点MRD意义存在差异。分析其原因,可能在于白血病是一种遗传因素占主导地位的恶性疾病,在存在融合基因的情况下,患儿病情的进展主要受遗传特征、基因导向等因素影响,MRD的预后提示价值相对较弱;在无融合基因背景的情况下,患儿的治疗反应性是决定预后的根本因素,而MRD是直接反映治疗反应的指标,因此对预后的提示意义相对较大。临床在制定患儿化疗和疗效监测方案时,可综合考虑患儿的融合基因背景,以合理决策,使患儿受益。
综上所述,ETV6/RUNX1融合基因阳性的B-ALL患儿整体预后优于该融合基因阴性的患儿,其中诱导化疗第12周时的MRD水平是ETV6/RUNX1融合基因阴性患儿预后的独立影响因素,但各时间点MRD对于ETV6/RUNX1融合基因阳性患儿预后无显著影响,临床可参考患儿融合基因背景制定个性化MRD监测方案,从而在保证预后的前提下,减少患儿穿刺操作,改善患儿诊疗体验,降低医疗成本。
