中药天然产物治疗炎症性肠病的研究进展
2023-05-20侯晓婷张华敏王旭德
孟 欢,侯晓婷,张华敏,王旭德*
中药天然产物治疗炎症性肠病的研究进展
孟 欢1,侯晓婷1,张华敏2,王旭德1*
1. 大连大学 慢性病研究中心大连市重点实验室,辽宁 大连 116622 2. 延边大学药学院,吉林 延边 133002
炎症性肠病(inflammatory bowel disease,IBD)是原因尚不明确的非特异性的肠道炎症性疾病。遗传、环境因素、免疫功能障碍、肠道菌群失调及肠道屏障功能受损都是其发生和发展的主要原因。临床上常用的治疗药物有氨基水杨酸类、抗生素类、皮质类固醇类等,但治愈率较低且不良反应明显。研究表明,中药天然产物具有免疫调节、调节肠道菌群组成和改善肠黏膜屏障功能等作用,可以有效治疗IBD。通过对常见的中药天然产物治疗IBD的研究进展进行综述,为中药天然产物的进一步开发及IBD的治疗提供一定的理论指导。
炎症性肠病;中药天然产物;免疫调节;肠道菌群;肠黏膜屏障功能;小檗碱;姜黄素;黄芩苷;芍药苷;大黄酸;人参皂苷;黄芪多糖
炎症性肠病(inflammatory bowel disease,IBD)是一类原因尚不明确的非特异性的肠道炎症性疾病,主要的临床表现为腹泻、腹痛、便血、体质量减轻等,严重时会伴有消化道出血、肠梗阻、癌变等并发症,呈反复发作的慢性病程[1]。IBD包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)2种常见的类型。其中,UC主要发生在结肠黏膜和黏膜下层,病变通常从直肠开始,可以连续性地向近端延伸至整个结肠,血性腹泻是其主要特征;CD的病变可累及胃肠道的任何部位,属于不连续的透壁性炎症,多发生于右半结肠及末端回肠,并且容易出现肠穿孔、瘘管、脓肿等并发症[2]。
近年来,IBD的全球发病率和流行率明显上升,但其病因和发病机制尚不清楚,严重影响患者的日常生活[3]。目前普遍认为,遗传的易感性、环境因素、机体免疫功能障碍、肠道菌群的改变及肠黏膜屏障功能受损是IBD发生发展的主要原因[4]。临床上常用于治疗IBD的药物主要有氨基水杨酸类、糖皮质激素类、免疫抑制剂、生物制剂等,但停药后容易复发、且不良反应多[5]。因此,深入研究IBD的发病机制,寻找IBD治疗的新靶点,开发安全有效的治疗方法具有重要意义。
中药作为我国传统的优势资源,因其具有多靶点、安全系数高等优点,在预防和治疗多种慢性疾病方面应用广泛[6]。近年来,在寻找IBD新疗法的过程中,中药天然产物受到广泛关注。许多学者从不同角度对多种类型的中药天然产物治疗IBD进行了一系列的基础研究,发现中药天然产物具有调节免疫细胞分化、减轻炎症反应及氧化应激损伤、调节肠道菌群、恢复肠黏膜屏障功能等多种作用,在减少不良反应、预防复发等方面具有显著优势,能够有效地控制IBD的发生和发展[7]。因此,从中药天然产物出发寻找有效的IBD治疗药物具有良好的应用前景。本文拟对用于治疗IBD的几种常见的中药天然产物,包括生物碱类、多酚类、黄酮类、萜类、醌类、皂苷类、多糖类进行综述,为中药天然产物治疗IBD的临床应用提供一定的参考。
1 生物碱类
生物碱是一类存在于各种生物中的含氮有机化合物,具有多种生物学活性,通常可分为吲哚类、异喹啉类和吡啶类生物碱[8]。现有的动物和细胞实验的结果表明,不同生物碱对于IBD的共同调节机制在于通过调节核因子-κB(nuclear factor-κB,NF-κB)等信号通路,调节肠道菌群的组成,恢复肠上皮的紧密连接,进而改善受损的肠黏膜屏障。
1.1 小檗碱
小檗碱是从黄连中提取的一种异喹啉生物碱,小檗碱治疗通过下调信号转导及转录激活蛋白1(signal transducer and activator of transcription 1,STAT1)和STAT3的磷酸化,抑制NF-κB信号通路,降低2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)诱导的结肠炎中辅助性T细胞1(T helper cell 1,Th1)/Th17的值及相关的促炎因子和转录因子的表达水平,增加结肠中分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)表达,在调节免疫反应平衡中具有重要作用[9]。小檗碱可以激活蛋白激酶B1(protein kinase B1,Akt1)/细胞因子信号抑制物1(suppressor of cytokine signaling 1,SOCS1)信号通路,抑制p65的磷酸化,减少促炎性M1巨噬细胞的极化,调节M1、M2型巨噬细胞的比率,进而减轻葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的UC小鼠的炎症反应[10]。小檗碱可以通过调节吲哚乙酸、乙酸等色氨酸代谢物(tryptophan catabolites,TC),激活芳香羟受体(arylhydrocarbon receptor,AhR)信号途径,进而促进咬合蛋白(occludin)、闭合小环蛋白-1(zonula occluden-1,ZO-1)的表达,改善受损的肠道上皮功能[11]。小檗碱可以通过增加瘤胃球菌、脱硫弧菌、乳酸杆菌和嗜黏蛋白-阿克曼氏菌的丰度,降低变形杆菌、颤螺菌等致病菌的丰度,恢复碳水化合物的消化和吸收、糖酵解、糖异生和氨基酸代谢[12]。此外,小檗碱也可以通过激活核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)途径,诱导P-糖蛋白(P-glycoprotein,P-gp)的表达,进而起到治疗结肠炎的作用[13]。
1.2 苦参碱
苦参碱是一种天然的哌啶类生物碱,是苦参等多种豆科植物的主要活性成分,具有抗癌、抗病毒和抗炎等多种药理活性[14]。苦参碱可以通过激活Nrf2途径的抗氧化反应,抑制Janus激酶2(Janus kinase 2,JAK2)/STAT3通路,下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6的表达,调节细胞凋亡相关因子的水平,抑制结肠上皮细胞凋亡[15-17]。苦参碱治疗能够增加ZO-1、闭合蛋白-1(claudin-1)、claudin-2、occludin等紧密连接蛋白的表达,并增加产生黏蛋白的细胞和黏蛋白-2的表达,保护肠道屏障免受DSS的破坏,这可能涉及到过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)信号通路的激活[17]。Li等[18]研究表明苦参碱可以有效调节小鼠肠道菌群的多样性,具体表现为显著增加了β变形菌、拟杆菌和柔膜菌在纲水平中的比例,并在科水平上显著提高消化链球菌、甲基杆菌、赤杆菌和双歧杆菌的相对丰度,这可能与NF-κB上游信号Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)的表达被抑制有关。
1.3 氧化苦参碱(oxymatrine,OMT)
OMT是一种从苦参根中提取出来的生物碱,可用于治疗各种急性或慢性炎症[19]。在DSS诱导的UC小鼠模型中,OMT可以通过阻断Rho蛋白(Ras homolog gene family member A,RhoA)/Rho激酶(Rho associated kinase,ROCK)信号通路,下调Th1/Th17的值,促进调节性T细胞(regulatory cells,Treg)的分化[20]。OMT能够增加结肠和血清中谷胱甘肽、超氧化物歧化酶(superoxide dismutase,SOD)的水平,抑制髓过氧化物酶(myeloperoxidase,MPO)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)的活性及活性氧的产生,有效减少氧化应激反应[21]。此外,OMT可以通过阻断磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt信号通路,降低DSS诱导的结肠组织中B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)、Bcl-2基因相关启动子(Bcl-2 asociated death promoter,Bad)的和半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-9表达,抑制细胞凋亡[22]。OMT可以通过阻断TLR9/MyD88/NF-κB通路及下游TNF-α、IL-1β和IL-6的蛋白表达,恢复紧密连接蛋白的表达,减弱TNBS诱导的结肠炎症状[23]。
1.4 胡椒碱
胡椒碱是胡椒属草本植物的活性成分之一,具有抗炎、抗抑郁、抗胃溃疡等药理作用[24]。胡椒碱治疗可以通过阻断丝裂原活化蛋白激酶(mitogen- activated protein kinase,MAPK)信号转导途径,进而抑制IL-8的表达,减弱人结肠癌SW480和HT-29细胞中的炎症反应[25]。胡椒碱治疗通过阻断核因子抑制蛋白(inhibitor κB-α,IκB-α)/NF-κB信号通路,抑制ILs、TNF-α、COX-2和iNOS的过度表达,并下调Caspase-1的表达,并可以改善TNBS诱导的ZO-1、claudin-1、occludin表达的降低,抑制细胞凋亡,保护肠上皮细胞,进而缓解结肠炎[24]。Hu等[26]研究发现胡椒碱可能是孕激素X受体(pregnane X receptor,PXR)的潜在激动剂和诱导剂,可以在mRNA和蛋白质水平上诱导细胞色素酶P450(cytochrome P450 enzyme system,CYP450)的基因表达,进而预防或减轻结肠炎症。
2 多酚类
多酚类物质主要分为类黄酮、酚酸、鞣质、木酚素和二苯乙烯类,具有抗氧化、免疫调节和抗癌活性[27-28]。大量研究表明,多酚类化合物对肠道菌群具有调节作用,可以通过减少炎性相关因子的分泌等多种途径,增加益生菌的数量,降低致病菌的相对丰度,有效缓解结肠炎症状,改善疾病引起的肠道微生态失调。
2.1 姜黄素
姜黄素是从姜黄的干燥根茎中提取的多酚类物质,具有抗炎、抗病毒、抗菌等生物学活性[29]。姜黄素通过抑制TLR4/MyD88/NF-κB以及p38 MAPK信号通路,下调TNF-α、IL-6、IL-17、IL-23,减少中性粒细胞(neutrophils,NEUT)的浸润,改变Th1/Th2的值,促进树突状细胞(dendritic cell,DC)产生IL-10,并诱导分化群4+(cluster of differentiation 4+,CD4+)CD25+叉状头转录因子(forkhead box,Fox)p3+Treg的分化,调节Treg/Th17平衡,在UC治疗中发挥作用[30-32]。姜黄素可以通过下调小鼠含生长因子样模体黏液样激素样受体(mouse EGF-like module-containing mucin-like hormone receptor-like 1,F4/80)+CD11b+iNOS+巨噬细胞的比例并增加CD163+、CD206+巨噬细胞的百分比,有效调节结肠炎小鼠M1和M2巨噬细胞的极化平衡[33]。姜黄素可以阻断DSS诱导的K+外流、抑制活性氧的产生和组织蛋白酶B的释放,减少Caspase-1、IL-1β及凋亡相关微粒蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain foci,ASC)表达,进而抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide‑binding oligomerisation domain-like receptor protein 3,NLRP3)炎性小体的激活,减轻NLRP3炎性小体介导的结肠损伤[34]。此外,姜黄素对自噬过程具有显著的调节作用,可以通过调节DSS刺激后结肠上皮中自噬体的数量,改善内质网的状况,进一步调节细胞因子的水平[35]。
2.2 白藜芦醇
白藜芦醇广泛存在于葡萄、虎杖和浆果等多种植物中,具有抗癌、抗氧化、抗心血管疾病等多种药理作用[36]。在人结直肠腺癌Caco-2细胞中,白藜芦醇可以通过减少IL-1β和增加IL-11的表达改善TNF-α诱导的炎症[37]。在DSS诱导的UC模型小鼠中,白藜芦醇可以抑制PI3K/Akt信号途径,减少血管内皮生长因子A(vascular endothelial growth factor A,)基因表达,下调TNF-α、γ-干扰素和IL-6等促炎因子水平,减轻结肠炎症[38]。白藜芦醇的治疗可以下调微小RNA-31(microRNA-31,miR-31),增加Foxp3+T细胞的数量,降低IL-17+T细胞的比例,启动潜在的Treg抗炎反应,显著减轻TNBS诱导的结肠炎症[39-40]。白藜芦醇可以通过Wnt信号途径调节肠上皮细胞小泛素样修饰蛋白1(small ubiquitin-like modifier protein 1,SUMO1)和β-连环蛋白(β-catenin)的表达[41]。在肠道菌群调节方面,白藜芦醇可以减少酸性拟杆菌的数量,促进短链脂肪酸(short chain fatty acids,SCFAs)的代谢,增加丁酸的水平,使肠道菌群恢复到稳态水平[40]。在肠黏膜屏障功能上,白藜芦醇可以通过增加自噬体的形成及自噬关键调控蛋白复合物Beclin 1和微管相关蛋白轻链3B(microtubule-associatedprotein light chain 3B,LC3B)的数量,增强肠上皮细胞自噬,改善内质网和线粒体的状况,进而增加ZO-1、occludin的表达,减轻肠黏膜上皮的损伤[42]。
2.3 丹皮酚
丹皮酚又称芍药醇,是从牡丹皮、白芍根中提取的多酚类成分,具有多种生物学效应,可用于多种疾病的治疗[43]。丹皮酚能够通过阻断MAPK/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/p38信号通路,促进UC小鼠结肠组织中Fox表达,降低维甲酸受体相关孤儿受体γt(retinoic acid receptor-related orphan receptor γt,RORγt)的表达,诱导Treg的分化,同时抑制Th17的增殖,维持机体免疫平衡,并减少IL-17等炎性因子的分泌,减轻肠道的炎症反应[43-44]。在TNF-α诱导的人结肠腺癌CW-2细胞中,丹皮酚可以降低TNF-α诱导的NF-κB及γ-干扰素诱导的STAT1的反式激活,降低iNOS的表达,发挥抗炎作用[45]。此外,丹皮酚还可以通过C型凝集素受体Dectin-1/ NF-κB途径与TLR2、TLR4发挥协同作用,改善白色念珠菌感染对结肠炎症造成的不利影响,减轻局部和全身的炎症反应[46]。
2.4 绿原酸
绿原酸是一种存在于各种植物、蔬果中的酚酸类化合物,由奎宁酸与咖啡酸经酯化反应合成,具有抗炎、抗病毒、抗氧化和抗癌特性[47]。绿原酸可以通过抑制TLR4介导的PI3K/Akt和NF-κB途径,下调MPO的表达水平,进而减少DSS诱导的结肠炎及脂多糖诱导的RAW264.7细胞中NEUT的浸润和促炎因子的表达[47-49]。绿原酸可以增加SOD1、过氧化氢酶(catalase,CAT)的表达,减少丙二醛的含量及活性氧的生成,减轻氧化应激损伤[50]。此外,绿原酸能通过抑制血红素加氧酶-1(heme oxygenase-1,HO-1)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、Caspase-8和Caspase-9的表达,以剂量相关性的方式减弱细胞凋亡的发生[51]。绿原酸通过调节SD大鼠的氨基酸和脂质代谢,降低萨特氏菌属、布劳特氏菌属的丰度,提高瘤胃球菌属、乳酸杆菌属的相对比例,从而降低血清中脂多糖的水平,促进SCFAs的生成,增加丁酸的水平,减轻结肠的黏膜损伤[49,52]。
2.5 没食子酸
没食子酸是一种酚酸类的有机化合物,广泛存在于多种水果和植物中,具有抗炎、抗氧化、抗病毒等作用[53]。没食子酸可以有效抑制TNBS诱导的UC中p-IκBα和p-NF-κB的表达,显著增加IL-4和IL-10的水平,同时下调IL-6、IL-12、IL-17、IL-23、转化生长因子-β(transforming growth factor-β,TGF-β)和TNF-α表达,缓解UC的炎症反应[53-54]。没食子酸还可以作为一种有效的抗氧化剂,显著上调DSS诱导小鼠中Nrf2及其下游靶点尿苷二磷酸-葡萄糖醛酸转移酶(uridine diphosphate- glucuronosyl transferase,UDP-GT)和醌氧化还原酶NADH 1(NADH quinone oxidoreductase 1,NQO1)的表达水平,降低结肠组织中MPO以及iNOS、COX-2的活性和表达,减轻肠道上皮的黏膜损伤[55]。从肠道菌群的角度来看,没食子酸治疗能够通过增加碳水化合物代谢和胆汁酸代谢,降低氨基酸代谢,减少DSS诱导的变形杆菌门(肠杆菌科等)和厚壁杆菌门(链球菌科、梭状芽胞杆菌科)等致病菌的相对丰度,在UC的治疗中发挥着重要作用[56]。
2.6 儿茶素
儿茶素是一种天然存在于多种食物和药用植物中的多酚,表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是儿茶素的主要成分,具有抗氧化、抗炎、抗癌活性,可有效缓解IBD[57]。EGCG可以通过抑制小鼠结肠组织中IL-6、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、IL-1β、IL-8和TNF-α的产生并降低MPO的活性,减轻T细胞和巨噬细胞的浸润程度,缓解肠道炎症[58]。EGCG能够改善小鼠结肠的总抗氧化能力(total antioxidant capacity,T-AOC)及血清总SOD(total-SOD,T-SOD)、CAT的表达,降低丙二醛的水平,减轻DSS诱导的肠黏膜氧化应激反应,同时减少结肠黏膜中凋亡细胞的比例,调节结肠上皮细胞的凋亡[59]。EGCG可以通过抑制TLR4、MyD88和NF-κB表达,降低UC大鼠血清中的IL-2和γ-干扰素,增加IL-4和IL-10水平的表达,阻止γ-干扰素诱导的CD4+T细胞分化为Th1细胞,调节肠黏膜的Th1/Th2平衡,促进肠黏膜的自我修复[60]。此外,EGCG可以增加产SCFAs的细菌数量,特别是阿克曼菌,促进乙酸盐、丁酸盐和丙酸盐的产生,保护结肠黏膜[59]。
3 黄酮类
黄酮类是一种在植物中含量丰富且具有不同酚类结构的化合物,具有抗氧化应激、抗肿瘤、抗菌和血管扩张等多种药理作用[61]。研究表明,多种黄酮类化合物能够抑制NF-κB等炎症信号通路的活化,并通过Nrf2介导的抗氧化应激途径,增加SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的表达,减少氧化应激损伤和炎症介质的产生,从而恢复肠道黏膜的完整性。
3.1 黄芩苷
黄芩苷是从传统中药黄芩的干燥根中提取的有效成分[62]。黄芩苷通过阻断NF-κB和PI3K/Akt信号通路,减少IL-6、IL-1β和TNF-α的释放,增加IL-10的水平,显著提高UC的结肠组织中CAT、SOD和GSH-Px的活性,抑制TNBS诱导的活性氧、丙二醛水平的增加,控制炎症反应并减轻氧化应激损伤[63-64]。黄芩苷能够有效抑制巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)的表达,调节巨噬细胞的功能,促进CD4+、CD29+细胞的增殖,调节Th17/Treg平衡,并通过上调干扰素调节因子4(interferon regulatory factor 4,IRF4)的表达水平,诱导巨噬细胞分化为具有抗炎作用的M2型巨噬细胞,缓解结肠炎症[65-67]。黄芩苷可以通过下调Caspase-3、Caspase-9、Bax和凋亡相关因子配体(factor related apoptosis ligand,FasL)的表达水平,促进Bcl-2的表达,抑制细胞的凋亡[63]。在改善肠黏膜屏障功能方面,黄芩苷可以通过下调miR-191a的水平,增加occludin、ZO-1和黏蛋白-2的表达,减少TNF-α诱导的大鼠小肠上皮IEC-6细胞迁移,维持肠道机械屏障和化学屏障的完整性[66,68]。Zhu等[66]研究发现黄芩苷可以通过降低厚壁菌门和拟杆菌门的比率,减少含内毒素的变形杆菌门的丰度,同时上调丁酸蓖麻单胞菌属、罗氏菌属和真杆菌属的相对比例,增加丁酸的水平,调节SCFAs代谢,改善TNBS诱导的UC肠道菌群失调。
3.2 木犀草素
木犀草素是一种黄酮类化合物,存在于多种植物中,具有抗炎、抗肿瘤、抗菌、抗氧化应激等作用[69]。木犀草素可以通过激活Nrf2信号通路,增加结肠组织中HO-1、NQO1、SOD、CAT的表达,下调丙二醛的水平,增强抗氧化应激的能力,抑制p-STAT1、p-JAK1的表达,进而阻断NF-κB途径的转导,显著降低COX-2、iNOS、IL-8的含量及减缓一氧化氮,从而改善DSS诱导的实验性结肠炎[70-71]。木犀草素通过阻断Src同源区2蛋白酪氨酸磷酸酶(Src homology 2 domain-containing protein tyrosine phosphatase 1,SHP-1)的STAT3信号通路,增加阻力值及ZO-1、claudin-1、密封蛋白(polyclonal antibody to occludin,OCLN)的表达水平,恢复肠上皮屏障的功能[72]。木犀草素能够抑制DSS诱导的结肠炎模型中MAPK激酶(MAPK kinase,MEK)和ERK磷酸化,降低5-羟色胺(5-hydroxytryptamine,5-HT)和色氨酸羟化酶(tryptophan hydroxylase,TPH-1)的表达[73]。Li等[74]研究表明木犀草素可以改变UC大鼠肠道微生物群的多样性和组成,具体表现在拟杆菌、罗氏菌和丁酸梭菌的比例增加,厚壁菌和变形菌的丰度减少,这主要与DNA修复、核糖体、嘌呤和嘧啶的代谢有关。
3.3 小豆蔻素
小豆蔻素是一种天然黄酮,能够抑制一氧化氮释放以及过度生成,具有抗肿瘤、抗血小板聚集等作用[75]。在脂多糖诱导的RAW264.7炎症细胞中,小豆蔻素可以通过抑制TLR4和MyD88的上调,减少TNF-α和IL-6的表达发挥抗炎作用[75-76]。在人急性白血病THP-1细胞和小鼠骨髓巨噬细胞中,小豆蔻素可以通过激活AhR,促进Nrf2/NQO1信号途径的激活,抑制NLRP3炎性小体的活化,从而减少相关促炎因子的产生[77]。此外,小豆蔻素可以降低Caspase-3、MPO、iNOS、COX-2和丙二醛的水平,抑制TNF诱导的细胞凋亡并减少氧化应激,改善乙酸诱导的UC症状[78]。
3.4 杨梅素
杨梅素是从杨梅等药用植物中提取的黄酮类化合物,具有抗细胞增殖、抗氧化、抗炎和抗癌等作用[79]。在DSS诱导的小鼠急性结肠炎中,杨梅素可以通过促进小鼠免疫细胞的内环境稳定,提高IL-10、TGF-β的水平,抑制IL-1β、IL-6的表达和Th1、Th17细胞的数量,增加CD25+Foxp3+Treg的比例,恢复Th17/Treg平衡,调节免疫反应[80-81]。杨梅素可以通过减少一氧化氮的生成,降低MPO和丙二醛的含量,增加SOD与GSH-Px的表达,在结肠炎症中发挥抗氧化作用,这可能与杨梅素能够抑制NF-κB和STAT1活化以及Nrf2介导的HO-1表达来抑制促炎介质的产生有关[81-82]。在改善肠黏膜屏障功能方面,杨梅素可以增加claudin-1、occludin的表达,恢复肠上皮紧密连接的完整性[80]。此外,杨梅素还可以通过增加阿曼克菌、瘤胃球菌的丰度,减少脱硫弧菌、梭菌等有害菌的比例,增加抗坏血酸、醛酸和脂质的代谢,改善肠道微环境[83]。
3.5 柚皮苷
柚皮苷是从葡萄和柑橘类等水果中提取的黄酮类糖苷化合物,实验证明柚皮苷具有抗炎、抗凋亡、抗氧化应激等生物学活性[84],是一种潜在的治疗IBD的有效药物。柚皮苷可以通过上调SOD、GSH-Px的含量,降低丙二醛和MPO的水平,减少结肠组织中的炎症反应,改善TNBS诱导的结肠炎的病理变化[85-86]。同样,在乙酸诱导的结肠炎模型中,柚皮苷可以通过降低黄嘌呤氧化酶(xanthine oxidase,XO)和一氧化氮的含量,阻止血清中乳酸脱氢酶(lactate dehydrogenase,LDH)和碱性磷酸酶(alkaline phosphatase,ALP)表达水平的增加,恢复结肠黏膜中的氧化平衡,减少DNA损伤[87]。此外,在调节UC小鼠的肠道菌群方面,柚皮苷能够降低厚壁菌、疣微菌、弯曲杆菌等致病菌的丰度,增加拟杆菌、蓝菌的相对比例,改善DSS诱导的肠道菌群失调[88]。对其潜在机制的探究表明,柚皮苷可以激活DSS诱导的PPARγ,抑制NF-κB、MAPK途径及NLRP3炎症小体的激活,调节ZO-1的表达[85]。综上,柚皮苷可能是一种潜在的改善DSS诱导的小鼠UC症状的天然药物。
4 萜类
根据异戊二烯单位的不同数目,中药中的萜类化合物大致分为倍半萜、单萜、二萜、三萜类等[89]。研究表明,一些萜类化合物能够显著调节T细胞亚群,通过降低Th1/Th17值,恢复Th17/Treg平衡,减少相关炎性因子的分泌,进而减轻炎症反应,治疗炎症相关性疾病,这与NF-κB、STAT等信号通路的调节有关。
4.1 芍药苷
芍药苷是一种从毛茛科植物白芍中提取的单萜类糖苷化合物[90],可通过剂量相关性的方式抑制TNBS诱导的UC小鼠结肠中IL-2、IL-1β、TNF-α和γ-干扰素等细胞因子的产生,上调IL-10的表达水平,减轻炎症反应[91]。芍药苷可以通过抑制JAK/STAT信号通路,降低体内外IL-12的水平及DC表面MHC-II和CD86的表达,抑制DC的成熟,并通过减少IL-17的分泌,上调Foxp3、IL-10的表达,促使幼稚T细胞分化为CD4+CD25+Foxp3+Treg细胞,恢复DC介导的Th17/Treg平衡[92]。芍药苷可以通过抑制NF-κB和STAT3磷酸化,显著降低嗜酸性粒细胞相关趋化因子配体11(chemotactic ligand 11,CCL11)、CCL24和CCL26的水平,减少肠道内嗜酸性粒细胞的迁移,进而改善UC的症状[93]。在调节肠道菌群组成上,芍药苷能够阻断胞壁酰二肽(muramyl dipeptide,MDP)/核苷酸结合寡聚结构域2(nucleotide binding oligomerization domain containing 2,NOD2)途径,进而抑制NF-κB p65的核易位,增加杯状细胞的数量,恢复结肠的隐窝结构,下调厚壁菌、毛螺菌和梭菌的相对丰度,并减少致病菌在肠道组织中的浸润面积,对DSS诱导的结肠炎起到一定的治疗作用[94]。此外,在脂多糖诱导的Caco-2细胞中,芍药苷通过激活Nrf2/HO-1信号途径,恢复claudin-5、occludin等紧密连接蛋白的表达,降低肠道上皮的通透性[95]。
4.2 穿心莲内酯(andrographolide,Andro)
Andro是穿心莲的主要活性成分[96]。研究表明,Andro在抗炎和免疫调节方面可以通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)途径,进而阻断NF-κB和p38 MAPK信号通路,减少一氧化氮的生成,降低iNOS和COX-2的表达,改善DSS诱导的急性结肠炎症状[97]。Andro可以通过调节STAT3信号途径,降低TNBS诱导的结肠炎小鼠血清和结肠组织中IL-23、IL-17和γ-干扰素的水平,降低CD4+细胞中Th1/Th17值,促进Th2的抗炎反应[98-99]。此外,Andro还可以通过阻断IL-4R/STAT6信号通路,减少IL-4/IL-13与IL-4R的特异性结合,抑制MPO活性和TNF-α的分泌,改善恶唑酮诱导的UC症状[96]。
4.3 雷公藤甲素(triptolide,TPL)
TPL是从雷公藤中提取的一种二萜内酯,具有多种生物学活性[100]。TPL可以通过抑制IL-10的小鼠结肠黏膜中TNF-α/TNFR2信号途径,减少Th1细胞因子的产生,使TNF-α、γ-干扰素、IL-12和IL-23的表达降低,并通过抑制IL-6/STAT3通路及IL-23/IL-17免疫轴,减弱Th17的促炎反应[101-102]。TPL可以通过激活Nrf2/HO-1信号级联反应,抑制磷酸二酯酶4(phosphodiesterase 4,PDE4)/Akt/ NF-κB信号通路,减少脂多糖诱导的巨噬细胞中活性氧的生成,增加M2介导的精氨酸酶-1(arginase-1,ARG-1)的表达,同时显著降低M1介导的细胞因子IL-1β、IL-6、MCP-1和CXCL10的水平,进而抑制巨噬细胞极化为M1型,减轻脂多糖刺激的RAW264.7巨噬细胞的炎症反应[103]。对于固有层单核细胞(lamina propria monocytes,LPMC)的凋亡,TPL可以显著诱导LPMC中SOCS3蛋白表达,并降低STAT3靶向Bcl-2和重组人B细胞淋巴瘤因子2-xl(recombinant human B-cell leukemia/lymphoma-xl,Bcl-xl)的表达,诱导有缺陷的LPCD4+细胞凋亡[104]。在肠道菌群调节方面,TPL治疗可增加拟杆菌、瘤胃球菌和乳酸菌的丰度,减少金黄色葡萄球菌、梭菌、颤螺菌在属水平上的比例,促进肠道微生物群的恢复,改善菌群的多样性[105]。
4.4 熊果酸
熊果酸是从迷迭香等植物以及水果果皮中提取的五环三萜类化合物[106]。熊果酸可以抑制肠道上皮细胞和巨噬细胞中NF-κB和MAPK信号通路的激活,降低TNBS诱导的小鼠结肠炎以及脂多糖刺激的炎症细胞中TNF-α、IL-1β、COX-2和iNOS的表达水平,减轻炎症反应[107-109]。熊果酸可以通过抑制十二烷基硫酸钠(sodium dodecyl sulfate,SDS)诱导的JAK/STAT激活以及c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)的信号转导,阻止肠道干细胞(intestinal stem cells,ISC)的过度增殖和分化,并上调CAT、T-SOD的表达,以降低细胞中活性氧的产生,缓解系膜细胞的损伤[110]。熊果酸治疗还可以降低肠道细菌群落丰富度,增加疣微菌门的丰度,调节脂肪酸代谢,影响免疫细胞的浸润和细胞因子的表达,这可能与熊果酸治疗后MAPK、IL-6/STAT3、AMPK/FoxO和PI3K信号通路有关[111]。
5 醌类
醌类化合物属于天然活性化合物,是大黄、丹参等药用植物的活性成分。根据不同的结构,分为苯醌、萘醌、菲醌和蒽醌类,具有广泛的生物学活性[112]。目前,对于醌类化合物治疗IBD的研究较少,主要集中于靶向炎症和氧化应激方面,这与抑制相关促炎因子水平,减少受损组织的炎性细胞浸润有关。
5.1 大黄酸
大黄酸是从唐古特大黄或药用大黄中提取的活性蒽醌,广泛存在于各种中药中[113]。大黄酸可以下调巨噬细胞中的NF-κB和NLRP3炎症小体的活性,并激活Nrf2/HO-1/NQO1途径,抑制NADPH氧化酶2(NADPH-oxidase 2,NOX2)亚基的表达和易位,下调IL-6、IL-1β、TNF-α、iNOS和COX-2的蛋白表达水平,显著减少一氧化氮的生成,调节氧化还原平衡,介导巨噬细胞从促炎性的M1到抗炎性的M2表型的转化,减少受损组织中巨噬细胞的浸润,进而减轻UC小鼠的炎症反应[114-116]。大黄酸可以增加乳酸杆菌、苏黎世杆菌的数量,降低肠杆菌等致病菌的比例,改变肠道微生物群的组成,进而改善菌群失调[115]。大黄酸还可以通过增加乳酸杆菌发酵产物,间接调节肠道的嘌呤代谢,如尿酸的水平,并通过增加claudin-1、E-钙黏蛋白(E-cadherin)的表达和黏液的分泌,降低肠道通透性,恢复肠道的屏障功能[115]。
5.2 丹参酮IIA
丹参酮IIA是从唇形科植物丹参中提取的脂溶性成分[117]。丹参酮IIA是一种有效的PXR激动剂,经丹参酮IIA治疗的结肠炎小鼠能够通过激活PXR,减弱NF-κB信号转导,下调结肠组织中iNOS、MCP、IL-1β、TNF-α和MPO的表达,增加谷胱甘肽的水平,减少结肠组织的氧化应激反应,显著改善TNBS诱导的小鼠结肠炎[118-119]。此外,丹参酮IIA能通过调节NEUT的数量来预防实验性结肠炎,具体机制可能为丹参酮IIA显著降低活性氧和炎性细胞因子水平,阻止C-X-C基序趋化因子受体1诱导的NEUT的迁移[120]。综上,丹参酮IIA具有缓解小鼠炎症性结肠炎的潜力。
6 皂苷类
皂苷是天然的表面活性糖苷,是人参、黄芪、三七等常见的草本植物的主要成分,在许多疾病中发挥抗炎作用并调节免疫稳态,尤其是与肠道炎症相关的消化系统疾病[121]。多项研究表明,皂苷类化合物的免疫调节作用主要集中在通过调节巨噬细胞功能,诱导M2巨噬细胞的极化,恢复抗炎和促炎因子的平衡,进而抑制肠道炎症反应,恢复肠黏膜屏障功能。
6.1 人参皂苷
人参皂苷是从人参属药材的根、茎、叶和果实中提取的固醇类三萜皂苷[122],人参皂苷Rg1是人参皂苷的特征性成分之一。在调节免疫细胞平衡和细胞因子表达方面,人参皂苷Rg1阻断TLR的识别并激活磷酸酯酶与张力蛋白同源物基因和SOCS,抑制PI3K/Akt途径的转导和STAT蛋白的活化,调节滤泡辅助性T细胞(follicular helper T cells,Tfh)/Treg细胞的平衡[123]。人参皂苷Rg1可以靶向调节轴突生长抑制因子-B(neurite outgrowth inhibitor-B,Nogo-B)/RhoA信号通路途径,调节M1和M2巨噬细胞的极化比例,并通过TLR4信号通路,上调NLRP12的表达,抑制IL-1β和TNF-α,进一步恢复抗炎因子和促炎因子平衡,缓解DSS诱导的实验性结肠炎[124-125]。此外,人参皂苷Rg1治疗可以调节拟杆菌、乳酸菌、瘤胃球菌和葡萄球菌的相对丰度,改善结肠炎小鼠结肠微生物群的多样性,有效减轻实验性结肠炎的症状[125]。
6.2 三七皂苷
三七皂苷是从三七的干燥根及根茎中提取的皂苷类成分,可以用于治疗糖尿病、动脉粥样硬化等多种疾病[126]。三七皂苷治疗能够剂量相关性地降低PI3K和Akt的磷酸化水平,抑制PI3K/Akt的激活,增加IL-10的表达,显著降低DSS诱导的SD大鼠结肠组织中CD11b+F4/80+标记的巨噬细胞的百分比,诱导巨噬细胞极化为抗炎性的CD206+M2巨噬细胞,从而抑制肠道炎症反应[127]。三七皂苷通过靶向p38 MAPK和TLR/NF-κB信号转导途径,抑制三酰脂肽(Pam3-Cys-Ser-Lys4,Pam3CSK4)诱导的RAW264.7炎症细胞释放一氧化氮的水平及TNF-α、IL-6和MCP-1的表达,并降低丙二醛和MPO的活性,增加肠道组织中CAT、SOD的表达活性,缓解肠道氧化应激损伤[128]。三七皂苷可通过增加Bcl-2、Bcl-3的表达,下调Caspase-3和Bax的表达水平,抑制肠道上皮的细胞凋亡反应[127]。此外,在恢复肠道机械屏障功能方面,三七皂苷可以通过增加结肠黏膜组织中ZO-1、claudin-1和occludin的表达,缓解肠黏膜屏障的损伤[127]。
6.3 黄芪甲苷Ⅳ
黄芪甲苷IV是从豆科植物黄芪中提取的天然皂苷类成分,具有缓解哮喘、抗氧化应激和调节免疫功能等作用[129]。黄芪甲苷Ⅳ可以通过下调NF-κB信号传导,降低脂多糖诱导的人结肠组织CCD-18Co细胞中TNF-α、IL-β和IL-6的产生[130]。在骨髓来源巨噬细胞(bone marrow derived macrophages,BMDM)中,黄芪甲苷Ⅳ能够通过抑制STAT1的激活来调节STAT3的信号传导,增加M2型巨噬细胞标志物CD206、几丁质酶3样分子(chitinase 3-like molecule,Ym1)、TGF-β的表达,抑制促炎性M1巨噬细胞标志物iNOS、IL-6和IL-1β的活性,降低M1和M2比例,调节脾脏中巨噬细胞的功能[131]。Jiang等[132]研究表明黄芪甲苷Ⅳ可以增加三磷酸腺苷的含量,刺激β-catenin的核易位,加速上皮细胞增殖,改善TNBS诱导的肌动蛋白丝的破坏,抑制claudin-5、occludin的降解,减轻结肠黏膜的损伤程度。综上,黄芪甲苷Ⅳ可能是IBD的一种新的潜在治疗药物。
7 多糖类
多糖是中药中常见的天然活性成分之一,具有多种生物学作用,如抗氧化应激、调节血脂等,因其高效、毒性低和广泛的生物活性,作为IBD的潜在治疗剂而受到广泛的关注[133]。现有的实验研究表明,多糖类化合物通过增加有益菌和SCFAs的产生来调节肠道菌群的多样性和丰富度,维持肠道微环境,促进抗炎细胞因子的分泌,减少促炎因子的产生,提高抗氧化能力,修复受损的肠黏膜屏障,进而改善IBD小鼠模型中的肠道炎症反应。
7.1 黄芪多糖
黄芪多糖是从黄芪中提取出来的活性多糖成分,在抗氧化、抗病毒感染、调节免疫功能、抗炎等方面发挥着重要作用[134]。黄芪多糖通过抑制NF-κB信号转导,下调TNF-α、IL-1β、IL-6、IL-17的表达和MPO活性,促进CD4+T细胞中T-bet和GATA-3的表达,从而调节GATA-3/T-bet值,促进T细胞向Th2抗炎细胞表型的转变[135-136]。黄芪多糖可以调节脂联素/TLR/NF-κB信号通路,显著降低UC小鼠结肠组织中一氧化氮的生成和丙二醛的水平及血清TNF-α、IL-6的表达,增加TGF-β1水平及SOD、谷胱甘肽的活性,下调P-选择素和细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的活性,减少NEUT的浸润和iNOS合成,抑制小鼠体内的炎症反应并激活自身组织抗氧化应激损伤的修复作用,缓解炎症的病理状态[137-138]。此外,黄芪多糖还可以下调结肠组织中NLRP3、Caspase-1和ASC的表达,从而阻止NLRP3炎性小体的活化,进而减少IL-18和IL-1β的表达,缓解DSS诱导的结肠炎症反应[139]。有研究表明,在DSS诱导的实验性结肠炎和GSH-Px4抑制剂RSL3刺激的Caco-2细胞的模型中,黄芪多糖能够降低前列腺素内过氧化物合酶-2(prostaglandin endoperoxide synthase-2,)、铁蛋白重链(ferritin heavy chain,)以及铁蛋白轻链(ferritin light chain,)等铁凋亡相关基因的表达,进而预防铁凋亡,这可能与Nrf2/HO-1途径的调节有关[140]。
7.2 铁皮石斛多糖(Dendrobium officinale polysaccharides,DOPS)
DOPS是兰科植物铁皮石斛的多糖成分,具有广泛的药理活性[141]。DOPS治疗能够激活G蛋白偶联受体,以剂量相关性方式上调IL-10的表达水平,降低Caspase-1、IL-6、TNF-α、γ-干扰素、IL-18和IL-1β的水平,同时下调β-抑制蛋白1(β-arrestin 1)的活性水平,阻断NLRP3信号通路,显著减轻DSS诱导的结肠炎反应[142]。通过下调TNF-α信号通路,DOPS可以增加Nrf2、Kelch样ECH相关蛋白1(Kelch like ECH associated protein 1,Keap1)、HO-1和NQO1的表达,抑制活性氧的产生和丙二醛的水平,并增加小鼠结肠组织中抗氧化酶SOD、GSH-Px的活性,显著提高抗氧化活性[143]。此外,DOPS可以通过上调类杆菌、乳酸杆菌和瘤胃球菌的比例,同时在一定程度上减少变形菌的丰度,改善结肠炎小鼠肠道微生物群的多样性,并通过刺激结肠中SCFAs的产生,增加乙酸盐和丁酸盐的水平及ZO-1、occludin的表达,降低肠道上皮的通透性,恢复肠道屏障功能[144]。
7.3 白术多糖
白术多糖是白术的主要活性成分,具有免疫调节活性[145]。研究表明,白术多糖治疗能够降低促炎细胞因子,包括TNF-α、IL-1β、IL-18和IL-23的表达水平,通过调节RAR相关孤儿受体C、Foxp3、IL-17a、TGF-β1和IL-10在结肠组织中的相对表达,恢复DSS诱导的结肠炎小鼠肠系膜淋巴结和脾脏中的Th17/Treg平衡,并显著提高ZO-1、occludin的表达,这可能取决于IL-6/STAT3信号通路的抑制[146]。白术多糖可以增加丁酸菌和乳酸菌的比例,减少放线菌、阿克曼菌、副杆菌、细小杆菌、疣状芽胞杆菌来改变肠道微生物群的组成,调节肠道微生物群产生SCFAs的能力及宿主和肠道微生物消化食物营养、氨基酸和胆汁酸代谢的能力,达到治疗UC的效果[147]。
7.4 枸杞多糖
枸杞多糖是枸杞子的主要活性成分,在脂多糖诱导的RAW264.7细胞炎症模型中,枸杞多糖通过抑制TLR4/NF-κB途径,降低IL-6和TNF-α的表达水平,抑制一氧化氮的过度产生及的mRNA表达,起到抗炎、抗氧化的作用[148]。枸杞多糖能够通过抑制NF-κB介导的肌球蛋白轻链激酶(myosin light chain kinase,MLCK)-肌球蛋白轻链(myosin light chain,MLC)信号通路,抑制促炎因子IL-8、IL-6、ICAM-1、MCP-1的分泌,增加occludin、ZO-3、claudin-1蛋白的表达,降低Caco-2细胞旁途径通透性,恢复跨上皮电阻(transepithelial resistance,TER),进而减轻TNF-α诱导的肠道屏障功能障碍[149]。
7.5 五味子多糖
五味子多糖是五味子抗肿瘤和增强免疫的重要物质基础,主要通过恢复肠道的正常结构,显著降低结肠组织中MPO、丙二醛的水平及TNF-α、IL-17、IL-13、IL-6的表达,提高谷胱甘肽、SOD、IL-4和γ-干扰素的水平,调节肠道微生物群的丰富度和多样性,增加乙酸、丙酸、丁酸和总SCFAs的水平,改善UC小鼠的结肠炎症状[150]。
7.6 金银花多糖
金银花多糖是金银花的主要活性成分,可以通过促进UC小鼠肠黏膜中sIgA的分泌,增强自然杀伤细胞(natural killer cell,NK)和细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的细胞毒性,减弱UC小鼠脾脏淋巴细胞的凋亡,并通过调节双歧杆菌、乳酸杆菌与大肠杆菌、肠球菌的相对比例,恢复肠道菌群的多样性,在一定程度上缓解DSS引起的肠道疾病[151]。
8 结语与展望
IBD是一种病因尚不明确的肠道炎症性疾病,其病程较长且易反复发作。临床上常见的治疗药物有5-氨基水杨酸、柳氮磺胺吡啶等,但治愈率较低且长时间具有一定的不良反应。近年来,中药天然产物在治疗IBD方面取得了很大的进展,中药天然产物可以有效地控制IBD的疾病发展,改善疾病异常指标,减轻临床症状。如图1所示,中药天然产物对IBD的调节机制主要集中在调节免疫功能、抗炎、抗氧化应激、调节肠道菌群以及恢复肠黏膜屏障功能方面。这与中药天然产物能够上调IL-4、IL-10等抗炎因子的水平,减少IL-1β、TNF-α、γ-干扰素、IL-17等促炎因子的表达,调节Th1/Th2、Th17/Treg的比例失衡,诱导巨噬细胞分化为具有抗炎作用的M2表型,降低MPO、丙二醛、iNOS、COX-2的活性及一氧化氮、活性氧的过度生成,增加谷胱甘肽、SOD、CAT的水平,增强TC、SCFAs的代谢,改变肠道菌群的多样性和丰富度,调节厚壁菌和拟杆菌的比例,增加紧密连接蛋白和黏蛋白的表达,恢复肠上皮紧密连接的完整性,降低肠道上皮细胞的通透性有关。除了上述作用外,一些中药天然产物被证明可以通过增加自噬体的数量,调节肠上皮细胞的自噬,并通过减少Bax、FasL的表达,上调抗凋亡蛋白(如Bcl-3、Bcl-2)的水平,抑制细胞凋亡,进而有效减轻肠黏膜屏障的损伤,这可能与TLR/MyD88/NF-κB、NLRP3、JAK/STAT3、p38 MAPK、PI3K/Akt、Keap1/Nrf2/HO-1等多条信号通路的调节及各通路之间的相互作用有关。生物碱类、多酚类、黄酮类、萜类、醌类、皂苷类等类型的中药天然产物调控IBD的作用机制见表1。
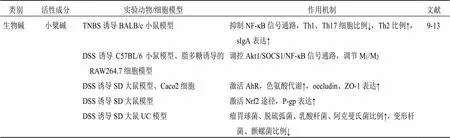
表1 中药天然产物调控IBD
续表1

类别活性成分实验动物/细胞模型作用机制文献 生物碱苦参碱HT29细胞、DSS诱导C57BL/6小鼠模型激活Nrf2途径,TNF-α、IL-1β、IL-6表达↓15-18 DSS刺激NCM460细胞模型抑制JAK2/STAT3信号通路,调节细胞凋亡相关因子 DSS诱导C57BL/6小鼠UC模型调节PPARα信号通路,ZO-1、claudins、occludin表达↑,黏蛋白2表达↑ TNBS诱导BALB/c小鼠模型抑制TLR4/MyD88/NF-κB信号通路,β变形菌、拟杆菌、柔膜菌、消化链球菌、甲基杆菌等相对丰度↑ 氧化苦参碱TNBS诱导SD大鼠模型抑制TLR4/MyD88/NF-κB信号通路,TNF-α、IL-1β、IL-6表达↓,紧密连接蛋白表达↑20-23 DSS诱导BALB/c小鼠模型阻断RhoA/ROCK信号通路,Th1/Th17↓,促进Treg细胞分化,谷胱甘肽、SOD水平↑,MPO、iNOS、COX-2活性↓,活性氧产生↓ 3% DSS诱导BALB/c小鼠模型抑制PI3K/Akt途径,Bcl-2、Bcl-3表达↑,Caspase-3、Caspase-9表达↓ 胡椒碱TNBS诱导SD大鼠模型阻断IκB-α/NF-κB信号通路,ILs、TNF-α、COX-2、iNOS表达↓,Caspase-1表达↓,ZO-1、claudin-1、occludin表达↑24-26 SW480细胞、HT-29细胞模型阻断MAPK信号通路,IL-8表达↓ LS174T细胞、DSS诱导C57BL/6J小鼠模型作为PXR的激动剂,诱导CYP3A4基因表达 多酚姜黄素DSS诱导BALB/c小鼠模型抑制TLR4/MyD88/NF-κB、p38 MAPK信号通路,TNF-α、IL-6、IL-17、IL-23表达↓,中性粒细胞浸润程度↓,改变Th1、Th2的比例,恢复Treg/Th17的平衡30-35 DSS诱导BALB/c小鼠模型调节M1/M2巨噬细胞的极化平衡 脂多糖、DSS刺激BMDM细胞模型活性氧产生↓,Caspase-1、IL-1β、ASC表达↓,抑制NLRP3炎性小体活化 DSS诱导BALB/c小鼠模型调节上皮细胞自噬过程 白藜芦醇TNF-α刺激Caco-2细胞模型IL-1β↓,IL-11↑37-42 DSS诱导BALB/c小鼠模型抑制PI3K/Akt信号通路,VEGFA表达↓,TNF-α、γ-干扰素、IL-6、IL-4水平↓ TNBS诱导BALB/c小鼠模型miR-31表达↓,Foxp3+T细胞数量↑,IL-17+T细胞的比例↓ DSS诱导BALB/c小鼠模型调控Wnt信号途径,调节SUMO1、β-catenin表达 TNBS诱导BALB/c小鼠模型酸性拟杆菌数量↓,促进SCFAs代谢,丁酸水平↑ DSS诱导C57BL/6小鼠模型肠上皮细胞自噬↑,自噬体数量↑,LC3B和Beclin-1表达↑,occludin和ZO-1↑ 丹皮酚DSS诱导C57BL6/J小鼠模型、脂多糖刺激RAW264.7细胞模型阻断MAPK/ERK/p38信号通路,IL-17等炎性因子分泌↓,诱导Treg的分化,抑制Th17细胞增殖43-46 CW-2细胞、TNBS诱导BALB/c小鼠模型抑制NF-κB、STAT1信号通路,IL-17、IL-6等炎性因子↓,iNOS表达↓,诱导Treg的分化,抑制Th17细胞增殖 DSS诱导C57BL/6小鼠UC模型调节Dectin-1/NF-κB途径,改善白色念珠菌感染的影响 绿原酸脂多糖刺激RAW264.7细胞、DSS诱导C57BL/6小鼠模型、TNBS诱导BALB/c小鼠模型抑制TLR4介导的PI3K/Akt和NF-κB途径,MPO表达水平↓,中性粒细胞浸润↓47-52 DSS诱导ICR小鼠模型SOD1、CAT表达↑,丙二醛含量↓,活性氧生成↓,SCFAs代谢↑,丁酸水平↑ DSS诱导C57BL/6小鼠模型抑制凋亡信号通路,Bax、Caspase-8、Caspase-9表达↓ 高脂饮食的SD大鼠模型调节氨基酸、脂质代谢、肠道菌群丰富度
续表1

类别活性成分实验动物/细胞模型作用机制文献 多酚没食子酸TNBS诱导BALB/c小鼠模型抑制IκBα/NF-κB通路,IL-4和IL-10水平↑,IL-6、IL-12、IL-17、IL-23、TGF-β、TNF-α表达↓53-56 2.5% DSS诱导BALB/c小鼠模型激活Nrf2途径,UDP-GT、NQO1表达↑,MPO活性↓,iNOS、COX-2表达↓ DSS诱导SD大鼠模型增加碳水化合物代谢和胆汁酸代谢,降低氨基酸代谢,减少变形杆门和厚壁杆菌门的相对丰度 儿茶素、EGCGDSS诱导C57BL/6小鼠模型IL-6、MCP-1、IL-1β、IL-8、TNF-α表达↓,MPO水平↓,T细胞和巨噬细胞浸润程度↓,T-AOC、T-SOD、CAT表达↑,丙二醛水平↓58-60 DSS诱导SD大鼠模型抑制TLR4/MyD88/NF-κB信号通路,阻止Th1细胞分化,调节Th1/Th2平衡 DSS诱导C57BL/6小鼠模型产SCFAs细菌数量↑,促进醋酸盐、丁酸盐和丙酸盐的产生 黄酮黄芩苷TNBS诱导SD大鼠模型、脂多糖诱导的HT-29细胞模型阻断PI3K/Akt信号通路,IL-6、IL-1β、TNF-α释放↓,IL-10水平↑,ZO-1、β-catenin表达↑63-68 TNBS诱导SD大鼠模型、脂多糖诱导RAW264.7细胞模型抑制NF-κB信号通路,CAT、SOD、GSH-Px活性↑,Caspase-3、Caspase-9、FasL表达↓,Bcl-2表达↑ TNBS诱导SD大鼠模型抑制MIF表达,调节巨噬细胞功能,MCP-1、CCL2、MIP-3、CCL20表达↓ TNBS诱导SD大鼠模型促进CD4+CD29+细胞增殖,调节Th17/Treg平衡,活性氧、丙二醛水平↓,occludin、ZO-1和黏蛋白-2表达↑,厚壁菌门与拟杆菌门比例↓,变形杆菌门丰度↓,丁酸蓖麻单胞菌属、罗氏菌属等比例↑,调节SCFAs代谢,丁酸水平↑ DSS诱导C57BL/6小鼠模型IRF4表达↑,促进M2型巨噬细胞极化 TNF-α诱导IEC-6细胞模型miR-191a水平↓,TNF-α诱导IEC-6迁移↓ 木犀草素DSS诱导C57BL/6小鼠模型激活Nrf2途径,HO-1、NQO1表达↑,SOD、CAT表达↑,丙二醛水平↓70-74 HCT-6细胞模型抑制JAK1/STAT1信号通路,COX-2、iNOS、IL-8的含量↓,NO生成↓ TNBS诱导Wistar大鼠UC模型抑制NF-κB信号通路,MPO、丙二醛水平↓ TNF-α、γ-干扰素刺激Caco-2细胞模型阻断SHP-1/STAT3信号通路,阻力值↑,ZO-1、claudin-1、OCLN表达↑ PMA刺激RBL-2H3细胞模型、2.5% DSS诱导C57BL/6小鼠模型抑制MAPK信号通路,5-HT、TPH-1表达↓ DSS诱导Wistar大鼠UC模型拟杆菌、罗氏菌、丁酸梭菌比例↑,厚壁菌、变形菌丰度↓ 小豆蔻素脂多糖诱导RAW264.7细胞模型抑制TLR4和MyD88,IL-1β、TNF-α、IL-6表达↓75-78 THP-1细胞、骨髓巨噬细胞、DSS诱导C57BL/6小鼠模型、TNBS诱导BALB/c小鼠模型激活AhR,促进Nrf2/NQO1信号途径,抑制NLRP3炎性小体活化,下调相关促炎因子表达 乙酸诱导SD大鼠UC模型Caspase-3、MPO、iNOS、COX-2、丙二醛水平↓,抑制细胞凋亡,减少氧化应激 杨梅素DSS诱导C57BL/6小鼠模型IL-10、TGF-β水平↑,IL-17↓,Th1、Th17数量↓,CD4+CD25+ Treg比例↑,恢复Th17/Treg平衡,claudin-1等表达↑80-81,83 DSS诱导BALB/c小鼠模型IL-1β、IL-6表达↓,一氧化氮生成↓,MPO、丙二醛含量↓,SOD、GSH-Px表达↑ DSS诱导C57BL/6小鼠模型阿曼克菌、瘤胃球菌的丰度↑,脱硫弧菌、梭菌的比例↓
续表1

类别活性成分实验动物/细胞模型作用机制文献 黄酮柚皮苷TNBS诱导Wistar大鼠模型SOD、GSH-Px含量↑,丙二醛、MPO水平↓85-88 DSS诱导C57BL/6小鼠模型调控PPARγ,抑制NF-κB、MAPK信号通路,阻止NLRP3炎症小体的激活,调节ZO-1表达 乙酸诱导Wistar大鼠模型LDH、ALP表达水平↓,XO、一氧化氮↓,减少DNA损伤 DSS诱导C57BL/6小鼠模型肠道菌群丰富度和多样性↑,厚壁菌、疣微菌、弯曲杆菌丰度↓,拟杆菌、蓝菌比例↑ 萜类芍药苷TNBS诱导BALB/c小鼠模型抑制NF-κB信号通路,抑制细胞凋亡,IL-2、IL-1β、TNF-α、γ-干扰素的产生↓91-95 TNBS诱导的C57BL/6小鼠模型抑制JAK/STAT通路,IL-17等分泌↓,Foxp3、IL-10表达↑,使幼稚T细胞分化为Treg细胞,恢复Th17/Treg平衡 DSS诱导的C57BL/6小鼠模型抑制NF-κB和STAT3信号通路,CCL11、CCL24、CCL26水平↓,肠道内嗜酸性粒细胞的迁移↓ DSS诱导的C57BL/6小鼠模型阻断MDP/NOD2信号途径,抑制NF-κB,杯状细胞数量↑,厚壁菌、毛螺菌、梭菌相对丰度↓ 脂多糖诱导的Caco-2细胞模型激活Nrf2/HO-1信号通路,claudin-5、occludin↑ Andro脂多糖诱导RAW264.7细胞模型、DSS诱导BALB/c小鼠模型激活AMPK途径,阻断NF-κB和p38 MAPK信号通路,一氧化氮生成↓,iNOS、COX-2表达↓96-99 TNBS诱导C57BL/6小鼠UC模型调节STAT3信号通路,IL-23、IL-17、γ-干扰素水平↓,Th1和Th17细胞百分比↓,促进Th2抗炎反应 恶唑酮诱导SD大鼠模型阻断IL-4R/STAT6信号通路,抑制MPO活性和TNF-α分泌 TPLIL-10−∕−小鼠CD模型抑制IL-6/STAT3信号途径,Th17细胞因子产生↓101-105 DSS诱导IL-10−∕−C57BL/6小鼠模型抑制TNF-α/TNFR2信号途径,Th1细胞因子产生↓,TNF-α、γ-干扰素、IL-12、IL-23表达↓ DSS诱导C57BL/6小鼠模型激活Nrf2/HO-1信号级联反应,抑制PDE4/Akt/NF-κB信号通路,活性氧生成↓,抑制M1型巨噬细胞极化,调节M1/M2细胞平衡 IL-10−∕−小鼠CD模型Bcl-2、Bcl-xl表达↓,诱导有缺陷的细胞凋亡 DSS诱导C57BL/6小鼠模型拟杆菌、瘤胃球菌、乳酸菌丰度↑,金黄色属、梭菌属等↓ 熊果酸TNBS诱导C57BL/6小鼠模型抑制NF-κB、MAPK信号通路,TNF-α、IL-1β、COX-2和iNOS表达↓107-111 SDS诱导果蝇模型抑制JAK/STAT、JNK信号通路,阻止ISC的过度增殖和分化,CAT、T-SOD表达↑,活性氧产生↓ DSS诱导C57BL/6小鼠模型调节MAPK、IL-6/STAT3、AMPK/FoxO、PI3K信号通路,疣微菌门↑,调节脂肪酸代谢,减少免疫细胞浸润和炎性因子表达 醌类大黄酸脂多糖/脂多糖+ATP诱导的RAW264.7细胞抑制NF-κB信号通路和NLRP3炎症小体的活化,激活Nrf2/HO-1/NQO1途径IL-6、等蛋白表达↓,介导巨噬细胞从M1到M2表型的转化,减少巨噬细胞浸润114-116 DSS诱导C57BL/6小鼠模型乳酸杆菌、苏黎世杆菌丰度↑,肠杆菌丰度↓,调节嘌呤代谢,claudin-1、E-cadherin↑,黏液分泌↑ 丹参酮ⅡATNBS诱导BALB/c小鼠模型抑制NF-κB信号通路,iNOS、MCP、IL-1β、TNF-α、MPO表达水平↓,谷胱甘肽表达↑,减少氧化应激118-120 HepG2细胞、LS174T细胞激活PXR,抑制NF-κB信号通路 DSS诱导C57BL/6小鼠模型调节中性粒细胞数量,阻止中性粒细胞迁移和活化,活性氧↓
续表1

类别活性成分实验动物/细胞模型作用机制文献 皂苷人参皂苷Rg1DSS诱导BALB/c小鼠模型阻断TLR4,激活PTEN和SOCS,抑制PI3K/Akt途径,调节Tfh/Treg细胞平衡123-125 DSS诱导BALB/c小鼠模型靶向Nogo/RhoA信号通路,调节M1和M2巨噬细胞极化比例,拟杆菌、乳酸菌、瘤胃球菌、葡萄球菌丰度↑ DSS诱导C57BL/6小鼠模型NLRP12表达↑,IL-1β、TNF-α表达↓ 三七皂苷DSS诱导SD大鼠模型阻断PI3K/Akt信号途径,IL-10表达↑,诱导M2型巨噬细胞极化,Bcl-2、Bcl-3表达↑,Caspase-3、Bax表达↓,ZO-1、claudin-1、occludin↑127-128 Pam3CSK4诱导RAW264.7细胞、DSS诱导C57BL/6小鼠模型靶向MAPK、TLR/NF-κB信号转导途径,TNF-α、IL-6等表达↓,丙二醛、MPO活性↓,CAT、SOD表达↑ 黄芪甲苷Ⅳ脂多糖诱导的CCD-18Co细胞下调NF-κB信号传导,TNF-α,IL-β、IL-6表达↓130-132 DSS诱导C57BL/6模型、脂多糖、γ-干扰素诱导的BMDM细胞抑制STAT1的激活,调节STAT3信号转导,M1标志物IL-1β、IL-6、iNOS表达↓,M2标志物TGF-β、Ym1、CD206表达↑,M1/M2↓ TNBS诱导SD大鼠模型ATP含量↑,刺激β-catenin的核易位,抑制claudin-5、occludin降解 多糖黄芪多糖DSS诱导C57BL/6小鼠模型抑制NF-κB信号通路,TNF-α、IL-1β、IL-6等表达↓,MPO↓135-140 TNBS诱导SD大鼠模型调节GATA-3/T-bet,促进T细胞向Th2表型的转变 DNBS诱导SD大鼠模型调节脂联素/TLR/NF-κB信号通路,一氧化氮、丙二醛水平↓,TNF-α、IL-6表达↓,TGF-β1水平及SOD、谷胱甘肽↑,P-选择素、ICAM-1、iNOS活性↓,减少NEUT的浸润 DSS诱导C57BL/6小鼠模型NLRP3、Caspase-1、ASC表达↓,阻止NLRP3小体活化 RSL3刺激的Caco-2细胞模型激活Nrf2/HO-1途径,PTGS2、FTH、FTL↓,预防铁凋亡 DOPSDSS诱导BALB/c小鼠模型阻断NLRP3信号通路,激活G蛋白偶联受体,IL-10表达水平↑,Caspase-1、IL-6、TNF-α等表达↓,β-arrestin 1活性↓142-144 DSS诱导BALB/c小鼠模型激活Keap1/Nrf2/HO-1信号通路,活性氧产生↓,丙二醛↓,SOD、GSH-Px表达↑ DSS诱导BALB/c小鼠模型类杆菌、乳酸杆菌、瘤胃球菌比例↑,变形杆菌↓,SCFAs产生↑,乙酸盐、丁酸盐水平↑,ZO-1、occludin↑ 白术多糖DSS诱导C57BL/6小鼠模型TNF-α、IL-1β、IL-18和IL-23表达↓,调节Th17/Treg细胞平衡,ZO-1、occludin表达↑146-147 2.5% DSS诱导C57BL/6小鼠模型丁酸菌、乳酸菌比例↑,放线菌、阿克曼菌等↓,调节肠道微生物群产生SCFAs 枸杞多糖脂多糖刺激RAW264.7细胞模型抑制TLR4/NF-κB途径,IL-6、TNF-α表达↓,抑制一氧化氮的过度产生,iNOS表达↓148-149 TNF-α刺激Caco-2细胞模型抑制NF-κB介导MLCK-MLC信号通路,细胞旁途径通透性↓,TER↑,抑制IL-8、IL-6、ICAM-1、MCP-1的分泌 五味子多糖DSS诱导C57BL/6小鼠模型TNF-α、IL-17、IL-13、IL-6水平↓,SOD、谷胱甘肽、IL-4表达↑,调节肠道微生物群的组成,乙酸、丙酸、丁酸和总SCFAs↑150 金银花多糖DSS诱导BALB/c小鼠模型sIgA分泌↑,NK、CTL的细胞毒性↑,淋巴细胞凋亡↓,双歧杆菌、乳酸杆菌数量↑,大肠杆菌、肠球菌丰度↓151
“↓”-降低或抑制 “↑”-增加或促进
“↓”-lower or inhibit “↑”-increase or promote
综上,中药天然产物在治疗IBD及预防其复发方面具有明显的优势和潜在的临床应用价值。但是由于中药天然产物的成分较多、作用机制复杂、基础研究的深度不够及缺乏大量的随机临床实验,对于其最佳治疗效果、确切靶点和生物利用度仍需要做进一步的研究和评估。在此基础上,继续深入研究机体免疫功能、肠道菌群、肠黏膜屏障等组分的异常与IBD发病的关系及相互作用,以及各种中药天然产物对上述方面的潜在机制和调节作用,可以促进中药天然产物的进一步研发,使中药天然产物更广泛、更准确地应用于临床上IBD的治疗。
利益冲突 所有作者均声明不存在利益冲突
[1] Neurath M F. Current and emerging therapeutic targets for IBD [J]., 2017, 14(5): 269-278.
[2] Zhang Y Z, Li Y Y. Inflammatory bowel disease: pathogenesis [J]., 2014, 20(1): 91-99.
[3] Linson E A, Hanauer S B. Epidemiology of colorectal cancer in inflammatory bowel disease-the evolving landscape [J]., 2021, 23(9): 16.
[4] 许海健, 朱倩, 丁康, 等. 黄芩苷治疗炎症性肠病的作用机制研究进展[J]. 现代药物与临床, 2023, 38(1): 219-223.
[5] Seyedian S S, Nokhostin F, Malamir M D. A review of the diagnosis, prevention, and treatment methods of inflammatory bowel disease [J]., 2019, 12(2): 113-122.
[6] Zhu X, Yao Q, Yang P S,. Multi-omics approaches for in-depth understanding of therapeutic mechanism for traditional Chinese medicine [J]., 2022, 13: 1031051.
[7] Yang L, Luo H, Tan D C,. A recent update on the use of Chinese medicine in the treatment of inflammatory bowel disease [J]., 2021, 92: 153709.
[8] Peng J, Zheng T T, Li X,. Plant-derived alkaloids: The promising disease-modifying agents for inflammatory bowel disease [J]., 2019, 10: 351.
[9] Li C, Xi Y, Li S,Berberine ameliorates TNBS induced colitis by inhibiting inflammatory responses and Th1/Th17 differentiation [J].2015, 67(2 Pt B): 444-454.
[10] Liu Y X, Liu X, Hua W W,. Berberine inhibits macrophage M1polarization via Akt1/SOCS1/NF-κB signaling pathway to protect against DSS-induced colitis [J]., 2018, 57: 121-131.
[11] Jing W H, Dong S J, Luo X L,. Berberine improves colitis by triggering AhR activation by microbial tryptophan catabolites [J]., 2021, 164.
[12] Liao Z Q, Xie Y Z, Zhou B J,. Berberine ameliorates colonic damage accompanied with the modulation of dysfunctional bacteria and functions in ulcerative colitis rats [J]., 2020, 104(4): 1737-1749.
[13] Jing W H, Safarpour Y, Zhang T,. Berberine upregulates P-glycoprotein in human Caco-2 cells and in an experimental model of colitis in the rat via activation of Nrf2-dependent mechanisms [J]., 2018, 366(2): 332-340.
[14] 张晓雯, 李凌宇, 尚海, 等. 苦参碱及其类似物的结构修饰研究进展 [J]. 中草药, 2019, 50(23): 5892-5900.
[15] Fang R M, Wu R Y, Zuo Q,.containing-QYJD formula activates Nrf2 anti-oxidant response, blocks cellular transformation and protects against DSS-induced colitis in mouse model [J]., 2018:1-15.
[16] Chen A M, Fang D F, Ren Y,. Matrine protects colon mucosal epithelial cells against inflammation and apoptosis via the Janus kinase 2/signal transducer and activator of transcription 3 pathway [J]., 2022, 13(3): 6490-6499.
[17] Yao H, Shi Y, Yuan J,. Matrine protects against DSS-induced murine colitis by improving gut barrier integrity, inhibiting the PPAR-α signaling pathway, and modulating gut microbiota [J]., 2021, 100: 108091.
[18] Li P Y, Lei J J, Hu G S,. Matrine mediates inflammatory response via gut microbiota in TNBS- induced murine colitis [J]., 2019, 10: 28.
[19] Zhou P Q, Fan H, Hu H,. Role of DOR-β-arrestin1-Bcl2 signal transduction pathway and intervention effects of oxymatrine in ulcerative colitis [J]., 2014, 34(6): 815-820.
[20] Wang Y F, Shou Z X, Fan H,. Protective effects of oxymatrine against DSS-induced acute intestinal inflammation in mice via blocking the RhoA/ROCK signaling pathway [J]., 2019, 39(7): BSR20182297.
[21] Tang Q, Zhang W, Zhang C,. Oxymatrine loaded nitric oxide-releasing liposomes for the treatment of ulcerative colitis [J]., 2020, 586: 119617.
[22] Chen Q Y, Duan X Y, Fan H,. Oxymatrine protects against DSS-induced colitis via inhibiting the PI3K/Akt signaling pathway [J]., 2017, 53: 149-157.
[23] Li S W, Feng G Q, Zhang M,. Oxymatrine attenuates TNBS-induced colinutis in rats through TLR9/Myd88/ NF-κB signal pathway [J]., 2022, 41: 9603271221078866.
[24] Guo G, Shi F, Zhu J,. Piperine, a functional food alkaloid, exhibits inhibitory potential against TNBS- induced colitis via the inhibition of IκB-α/NF-κB and induces tight junction protein (claudin-1, occludin, and ZO-1) signaling pathway in experimental mice [J]., 2020, 39(4): 477-491.
[25] Hou X F, Pan H, Xu L H,. Piperine suppresses the expression of CXCL8 in lipopolysaccharide-activated SW480 and HT-29 cells via downregulating the mitogen- activated protein kinase pathways [J]., 2015, 38(3): 1093-1102.
[26] Hu D H, Wang Y G, Chen Z W,. The protective effect of piperine on dextran sulfate sodium induced inflammatory bowel disease and its relation with pregnane X receptor activation [J]., 2015, 169: 109-123.
[27] Zhou Y, Zheng J, Li Y,. Natural polyphenols for prevention and treatment of cancer [J]., 2016, 8(8): 515.
[28] Pandey K B, Rizvi S I. Plant polyphenols as dietary antioxidants in human health and disease [J]., 2009, 2(5): 270-278.
[29] 陈欠欠, 朱凤阁, 陈香美. 姜黄素治疗肾间质纤维化分子机制研究进展 [J]. 中草药, 2023, 54(3): 966-975.
[30] Wei C, Wang J Y, Xiong F,. Curcumin ameliorates DSS‑induced colitis in mice by regulating the Treg/Th17 signaling pathway [J]., 2021, 23(1): 34.
[31] Rahimi K, Ahmadi A, Hassanzadeh K,. Targeting the balance of T helper cell responses by curcumin in inflammatory and autoimmune states [J]., 2019, 18(7): 738-748.
[32] Mouzaoui S, Banerjee S, Djerdjouri B. Low-dose curcumin reduced TNBS-associated mucin depleted foci in mice by scavenging superoxide anion and lipid peroxides, rebalancing matrix NO synthase and aconitase activities, and recoupling mitochondria [J]., 2020, 28(4): 949-965.
[33] Kang Z P, Wang M X, Wu T T,. Curcumin alleviated dextran sulfate sodium-induced colitis by regulating M1/M2macrophage polarization and TLRs signaling pathway [J]., 2021, 2021: 3334994.
[34] Gong Z Z, Zhao S N, Zhou J F,. Curcumin alleviates DSS-induced colitis via inhibiting NLRP3 inflammsome activation and IL-1β production [J]., 2018, 104: 11-19.
[35] Yue W J, Liu Y, Li X,. Curcumin ameliorates dextran sulfate sodium-induced colitis in mice via regulation of autophagy and intestinal immunity [J]., 2019, 30(3): 290-298.
[36] 杨萍. 白藜芦醇通过调控信号通路治疗膝骨关节炎的研究进展 [J]. 中草药, 2023, 54(4): 1311-1320.
[37] Sabzevary-Ghahfarokhi M, Soltani A, Luzza F,. The protective effects of resveratrol on ulcerative colitis via changing the profile of Nrf2 and IL-1β protein [J]., 2020, 47(9): 6941-6947.
[38] Zhu F, Zheng J J, Xu F,. Resveratrol alleviates dextran sulfate sodium-induced acute ulcerative colitis in mice by mediating PI3K/Akt/VEGFA pathway [J]., 2021, 12: 693982.
[39] Alrafas H R, Busbee P B, Nagarkatti M,. Resveratrol downregulates miR-31 to promote T regulatory cells during prevention of TNBS-induced colitis [J]., 2020, 64(1): e1900633.
[40] Alrafas H R, Busbee P B, Nagarkatti M,. Resveratrol modulates the gut microbiota to prevent murine colitis development through induction of Tregs and suppression of Th17 cells [J]., 2019, 106(2): 467-480.
[41] Wang J Y, Zhang Z Y, Fang A N,. Resveratrol attenuates inflammatory bowel disease in mice by regulating SUMO1 [J]., 2020, 43(3): 450-457.
[42] Pan H H, Zhou X X, Ma Y Y,. Resveratrol alleviates intestinal mucosal barrier dysfunction in dextran sulfate sodium-induced colitis mice by enhancing autophagy [J]., 2020, 26(33): 4945-4959.
[43] 吴桂莹, 亓玉玲, 郝宝燕, 等. 丹皮酚衍生物及其药理活性研究进展 [J]. 中草药, 2019, 50(4): 1001-1006.
[44] Zong S Y, Pu Y Q, Xu B L,. Study on the physicochemical properties and anti-inflammatory effects of paeonol in rats with TNBS-induced ulcerative colitis [J]., 2017, 42: 32-38.
[45] Ishiguro K, Ando T, Maeda O,. Paeonol attenuates TNBS-induced colitis by inhibiting NF-kappaB and STAT1 transactivation [J]., 2006, 217(1): 35-42.
[46] Ge Y Z, Pan M, Zhang C F,. Paeonol alleviates dextran sodium sulfate induced colitis involving-associated dysbiosis [J]., 2021, 59(4): 335-344.
[47] Zatorski H, Sałaga M, Zielińska M,. Experimental colitis in mice is attenuated by topical administration of chlorogenic acid [J]., 2015, 388(6): 643-651.
[48] Chen L P, Zhang C Y, Cao J J,. Yiyi Fuzi Baijiang Decoction alleviates ulcerative colitis partly by regulating TLR4-mediated PI3K/Akt and NF-κB pathways [J]., 2022, 2022: 8780514.
[49] Zhang P, Jiao H L, Wang C L,. Chlorogenic acid ameliorates colitis and alters colonic microbiota in a mouse model of dextran sulfate sodium-induced colitis [J]., 2019, 10: 325.
[50] Wan F, Wang M Y, Zhong R Q,. Supplementation with Chinese medicinal plant extracts fromandmitigates colonic inflammation by regulating oxidative stress and gut microbiota in a colitis mouse model [J]., 2022, 11: 798052.
[51] Vukelić I, Detel D, Pučar L B,. Chlorogenic acid ameliorates experimental colitis in mice by suppressing signaling pathways involved in inflammatory response and apoptosis [J]., 2018, 121: 140-150.
[52] Xie M G, Fei Y Q, Wang Y,. Chlorogenic acid alleviates colon mucosal damage induced by a high-fat diet via gut microflora adjustment to increase short-chain fatty acid accumulation in rats [J]., 2021, 2021: 3456542.
[53] Zhu L, Gu P Q, Shen H. Gallic acid improved inflammation via NF-κB pathway in TNBS-induced ulcerative colitis [J]., 2019, 67: 129-137.
[54] Pandurangan A K, Mohebali N, Esa N M. Gallic acid suppresses inflammation in dextran sodium sulfate- induced colitis in mice: Possible mechanisms [J]., 2015, 28(2): 1034-1043.
[55] Pandurangan A K, Mohebali N, Norhaizan M E,. Gallic acid attenuates dextran sulfate sodium-induced experimental colitis in BALB/c mice [J]., 2015, 9: 3923-3934.
[56] Li Y, Xie Z Y, Gao T T,. A holistic view of gallic acid-induced attenuation in colitis based on microbiome- metabolomics analysis [J]., 2019, 10(7): 4046-4061.
[57] 李晓阳, 吴志平, 王梦馨, 等. 表没食子儿茶素没食子酸酯抗癌分子机制及其应用的研究进展 [J]. 中草药, 2019, 50(13): 3217-3229.
[58] Du Y, Ding H H, Vanarsa K,. Low dose epigallocatechin gallate alleviates experimental colitis by subduing inflammatory cells and cytokines, and improving intestinal permeability [J]., 2019, 11(8): 1743.
[59] Wu Z H, Huang S M, Li T T,. Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis [J]., 2021, 9(1): 184.
[60] Xue B, Liu X L, Dong W W,. EGCG maintains Th1/Th2 balance and mitigates ulcerative colitis induced by dextran sulfate sodium through TLR4/MyD88/NF-κB signaling pathway in rats [J]., 2017, 2017: 3057268.
[61] Salaritabar A, Darvishi B, Hadjiakhoondi F,. Therapeutic potential of flavonoids in inflammatory bowel disease: A comprehensive review [J]., 2017, 23(28): 5097-5114.
[62] 龙宇, 向燕, 谭裕君, 等. 黄芩苷药理作用及新剂型的研究进展 [J]. 中草药, 2019, 50(24): 6142-6148.
[63] Zhu L, Shen H, Gu P Q,. Baicalin alleviates TNBS-induced colitis by inhibiting PI3K/Akt pathway activation [J]., 2020, 20(1): 581-590.
[64] Shen J, Cheng J Z, Zhu S G,. Regulating effect of baicalin on IKK/IKB/NF-kB signaling pathway and apoptosis-related proteins in rats with ulcerative colitis [J]., 2019, 73: 193-200.
[65] Dai S X, Zou Y, Feng Y L,. Baicalin down-regulates the expression of macrophage migration inhibitory factor (MIF) effectively for rats with ulcerative colitis [J]., 2012, 26(4): 498-504.
[66] Zhu L, Xu L Z, Zhao S,. Protective effect of baicalin on the regulation of Treg/Th17 balance, gut microbiota and short-chain fatty acids in rats with ulcerative colitis [J]., 2020, 104(12): 5449-5460.
[67] Zhu W, Jin Z S, Yu J B,. Baicalin ameliorates experimental inflammatory bowel disease through polarization of macrophages to an M2phenotype [J]., 2016, 35: 119-126.
[68] Wang L, Zhang R, Chen J,. Baicalin protects against TNF-α-induced injury by down-regulating miR-191a that targets the tight junction protein ZO-1 in IEC-6 cells [J]., 2017, 40(4): 435-443.
[69] Pandurangan A K, Esa N M. Luteolin, a bioflavonoid inhibits colorectal cancer through modulation of multiple signaling pathways: A review [J]., 2014, 15(14): 5501-5508.
[70] Nunes C, Almeida L, Barbosa R M,. Luteolin suppresses the JAK/STAT pathway in a cellular model of intestinal inflammation [J]., 2017, 8(1): 387-396.
[71] Li Y, Shen L, Luo H S. Luteolin ameliorates dextran sulfate sodium-induced colitis in mice possibly through activation of the Nrf2 signaling pathway [J]., 2016, 40: 24-31.
[72] Li B L, Zhao D Y, Du P L,. Luteolin alleviates ulcerative colitis through SHP-1/STAT3 pathway [J]., 2021, 70(6): 705-717.
[73] Suga N, Murakami A, Arimitsu H,. Luteolin suppresses 5-hydroxytryptamine elevation in stimulated RBL-2H3 cells and experimental colitis mice [J]., 2021, 69(1): 20-27.
[74] Li B L, Du P L, Du Y,. Luteolin alleviates inflammation and modulates gut microbiota in ulcerative colitis rats [J]., 2021, 269: 119008.
[75] James S, Aparna J S, Babu A,. Cardamonin attenuates experimental colitis and associated colorectal cancer [J]., 2021, 11(5): 661.
[76] Ren G Y, Sun A N, Deng C,. The anti-inflammatory effect and potential mechanism of cardamonin in DSS- induced colitis [J]., 2015, 309(7): G517-G527.
[77] Wang K, Lv Q, Miao Y M,. Cardamonin, a natural flavone, alleviates inflammatory bowel disease by the inhibition of NLRP3 inflammasome activation via an AhR/Nrf2/NQO1 pathway [J]., 2018, 155: 494-509.
[78] Ali A A, Al Haleem E N A, Khaleel S A H,. Protective effect of cardamonin against acetic acid-induced ulcerative colitis in rats [J]., 2017, 69(2): 268-275.
[79] 王潞, 周云英. 杨梅素抗感染、抗炎及抗氧化活性研究进展 [J]. 中草药, 2019, 50(3): 778-784.
[80] Qu X Y, Li Q J, Song Y,. Potential of myricetin to restore the immune balance in dextran sulfate sodium- induced acute murine ulcerative colitis [J]., 2020, 72(1): 92-100.
[81] Zhao J, Hong T, Dong M,. Protective effect of myricetin in dextran sulphate sodium-induced murine ulcerative colitis [J]., 2013, 7(2): 565-570.
[82] Cho B O, Yin H H, Park S H,. Anti-inflammatory activity of myricetin fromthrough suppression of NF-κB and STAT1 activation and Nrf2-mediated HO-1 induction in lipopolysaccharide- stimulated RAW264.7 macrophages [J]., 2016, 80(8): 1520-1530.
[83] Miao R R, Zhan S, Hu X T,. Myricetin and M10, a myricetin-3--β--lactose sodium salt, modify composition of gut microbiota in mice with ulcerative colitis [J]., 2021, 346: 7-15.
[84] 杨新荣, 窦霞, 李国峰, 等. 柚皮苷药理作用及机制的研究进展 [J]. 中草药, 2022, 53(10): 3226-3240.
[85] Cao H Y, Liu J X, Shen P,. Protective effect of naringin on DSS-induced ulcerative colitis in mice [J]., 2018, 66(50): 13133-13140.
[86] Hambardikar V R, Mandlik D S. Protective effect of naringin ameliorates TNBS-induced colitis in rats via improving antioxidant status and pro-inflammatory cytokines [J]., 2022, 44(3): 373-386.
[87] Kumar V S, Rajmane A R, Adil M,. Naringin ameliorates acetic acid induced colitis through modulation of endogenous oxido-nitrosative balance and DNA damage in rats [J]., 2014, 28(2): 132-145.
[88] Cao R G, Wu X, Guo H,. Naringin exhibited therapeutic effects against DSS-induced mice ulcerative colitis in intestinal barrier-dependent manner [J]., 2021, 26(21): 6604.
[89] Yang L, Yang C Q, Li C Y,. Recent advances in biosynthesis of bioactive compounds in traditional Chinese medicinal plants [J]., 2016, 61(1): 3-17.
[90] 张育贵, 张淑娟, 边甜甜, 等. 芍药苷药理作用研究新进展 [J]. 中草药, 2019, 50(15): 3735-3740.
[91] Gu P, Zhu L, Liu Y,. Protective effects of paeoniflorin on TNBS-induced ulcerative colitis through inhibiting NF-kappaB pathway and apoptosis in mice [J]., 2017, 50: 152-160.
[92] Zheng K, Jia J, Yan S H,. Paeoniflorin ameliorates ulcerative colitis by modulating the dendritic cell- mediated Th17/Treg balance [J]., 2020, 28(6): 1705-1716.
[93] Li J J, Ren S Y, Li M,. Paeoniflorin protects against dextran sulfate sodium (DSS)-induced colitis in mice through inhibition of inflammation and eosinophil infiltration [J]., 2021, 97: 107667.
[94] Luo X, Wang X J, Huang S W,. Paeoniflorin ameliorates experimental colitis by inhibiting gram- positive bacteria-dependent MDP-NOD2 pathway [J]., 2021, 90: 107224.
[95] Wu X X, Huang X L, Chen R R,. Paeoniflorin prevents intestinal barrier disruption and inhibits lipopolysaccharide (LPS)-induced inflammation in caco-2 cell monolayers [J]., 2019, 42(6): 2215-2225.
[96] Zhang L H, Cao N, Wang Y W,. Improvement of oxazolone-induced ulcerative colitis in rats using andrographolide [J]., 2019, 25(1): 76.
[97] Kim N, Lertnimitphun P, Jiang Y,. Andrographolide inhibits inflammatory responses in LPS-stimulated macrophages and murine acute colitis through activating AMPK [J]., 2019, 170: 113646.
[98] Zhu Q, Zheng P F, Chen X Y,. Andrographolide presents therapeutic effect on ulcerative colitis through the inhibition of IL-23/IL-17 axis [J]., 2018, 10(2): 465-473.
[99] Zhu Q, Zheng P F, Zhou J Y,. Andrographolide affects Th1/Th2/Th17 responses of peripheral blood mononuclear cells from ulcerative colitis patients [J]., 2018, 18(1): 622-626.
[100] 宋基正, 刘宇灵, 林龙飞, 等. 雷公藤甲素抗肿瘤新型给药系统研究进展 [J]. 中草药, 2019, 50(5): 1269-1275.
[101] Li Y, Yu C, Zhu W M,. Triptolide ameliorates IL-10-deficient mice colitis by mechanisms involving suppression of IL-6/STAT3 signaling pathway and down-regulation of IL-17 [J]., 2010, 47(15): 2467-2474.
[102] Wei X W, Gong J F, Zhu J,. The suppressive effect of triptolide on chronic colitis and TNF-alpha/TNFR2 signal pathway in interleukin-10 deficient mice [J]., 2008, 129(2): 211-218.
[103] Tang B F, Zhu J Y, Zhang B H,. Therapeutic potential of triptolide as an anti-inflammatory agent in dextran sulfate sodium-induced murine experimental colitis [J]., 2020, 11: 592084.
[104] Li Y, Tian Y, Zhu W M,. Triptolide induces suppressor of cytokine signaling-3 expression and promotes lamina propria mononuclear cells apoptosis in Crohn’s colitis [J]., 2013, 16(2): 268-274.
[105] Wu H, Rao Q, Ma G C,. Effect of triptolide on dextran sodium sulfate-induced ulcerative colitis and gut microbiota in mice [J]., 2020, 10: 1652.
[106] Seo D Y, Lee S R, Heo J W,. Ursolic acid in health and disease [J]., 2018, 22(3): 235-248.
[107] Chun J, Lee C, Hwang S W,. Ursolic acid inhibits nuclear factor-κB signaling in intestinal epithelial cells and macrophages, and attenuates experimental colitis in mice [J]., 2014, 110(1): 23-34.
[108] Liu B H, Piao X H, Guo L Y,. Ursolic acid protects against ulcerative colitis via anti-inflammatory and antioxidant effects in mice [J]., 2016, 13(6): 4779-4785.
[109] Jang S E, Jeong J J, Hyam S R,. Ursolic acid isolated from the seed ofameliorates colitis in mice by inhibiting the binding of lipopolysaccharide to Toll-like receptor 4 on macrophages [J]., 2014, 62(40): 9711-9721.
[110] Wei T, Wu L, Ji X W,. Ursolic acid protects sodium dodecyl sulfate-inducedulcerative colitis model by inhibiting the JNK signaling [J]., 2022, 11(2): 426.
[111] Sheng Q S, Li F, Chen G P,. Ursolic acid regulates intestinal microbiota and inflammatory cell infiltration to prevent ulcerative colitis [J]., 2021, 2021: 6679316.
[112] Dahlem Junior M A, Nguema Edzang R W, Catto A L,. Quinones as an efficient molecular scaffold in the antibacterial/antifungal or antitumoral arsenal [J]., 2022, 23(22): 14108.
[113] Wu C, Cao H Y, Zhou H,. Research progress on the antitumor effects of rhein: Literature review [J]., 2017, 17(12): 1624-1632.
[114] Zhou Y Y, Gao C F, Vong C T,. Rhein regulates redox-mediated activation of NLRP3 inflammasomes in intestinal inflammation through macrophage-activated crosstalk [J]., 2022, 179(9): 1978-1997.
[115] Wu J W, Wei Z H, Cheng P,. Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis [J]., 2020, 10(23): 10665-10679.
[116] Ge H, Tang H, Liang Y B,. Rhein attenuates inflammation through inhibition of NF-κB and NALP3 inflammasomeand[J]., 2017, 11: 1663-1671.
[117] Guo R, Li L, Su J,. Pharmacological activity and mechanism of tanshinone IIAin related diseases [J]., 2020, 14: 4735-4748.
[118] Bai A P, Lu N H, Guo Y,. Tanshinone IIAameliorates trinitrobenzene sulfonic acid (TNBS)-induced murine colitis [J]., 2008, 53(2): 421-428.
[119] Zhang X X, Wang Y G, Ma Z C,. Tanshinone IIAameliorates dextran sulfate sodium-induced inflammatory bowel disease via the pregnane X receptor [J]., 2015, 9: 6343-6362.
[120] Liu X W, He H Y, Huang T T,. Tanshinone IIAprotects against dextran sulfate sodium-(DSS-) induced colitis in mice by modulation of neutrophil infiltration and activation [J]., 2016, 2016: 7916763.
[121] Dong J Y, Liang W, Wang T X,. Saponins regulate intestinal inflammation in colon cancer and IBD [J]., 2019, 144: 66-72.
[122] 张浩然, 叶安琪, 张跃伟, 等. 人参皂苷衍生化及生物活性研究进展 [J]. 中草药, 2022, 53(14): 4554-4567.
[123] Jin J, Zhong Y B, Long J,. Ginsenoside Rg1relieves experimental colitis by regulating balanced differentiation of Tfh/Treg cells [J]., 2021, 100: 108133.
[124] Zhu G, Wang H N, Wang T C,. Ginsenoside Rg1attenuates the inflammatory response in DSS-induced mice colitis [J]., 2017, 50: 1-5.
[125] Long J, Liu X K, Kang Z P,. Ginsenoside Rg1ameliorated experimental colitis by regulating the balance of M1/M2macrophage polarization and the homeostasis of intestinal flora [J]., 2022, 917: 174742.
[126] Xu C C, Wang W W, Wang B,. Analytical methods and biological activities ofsaponins: Recent trends [J]., 2019, 236: 443-465.
[127] Lu Q G, Zeng L, Li X H,. Protective effects ofsaponin on dextran sulfate sodium-induced colitis in rats through phosphoinositide-3-kinase protein kinase B signaling pathway inhibition [J]., 2020, 26(11): 1156-1171.
[128] Luo H, Vong C T, Tan D C,.saponins modulate the inflammatory response and improve IBD-like symptoms via TLR/NF-κB and MAPK signaling pathways [J]., 2021, 49(4): 925-939.
[129] Li L, Hou X J, Xu R F,. Research review on the pharmacological effects of astragaloside IV [J]., 2017, 31(1): 17-36.
[130] Wu S X, Chen Z L. Astragaloside IV alleviates the symptoms of experimental ulcerative colitisand[J]., 2019, 18(4): 2877-2884.
[131] Tian L L, Zhao J L, Kang J Q,. Astragaloside IV alleviates the experimental DSS-induced colitis by remodeling macrophage polarization through STAT signaling [J]., 2021, 12: 740565.
[132] Jiang X G, Sun K, Liu Y Y,. Astragaloside IV ameliorates 2,4,6-trinitrobenzene sulfonic acid (TNBS)- induced colitis implicating regulation of energy metabolism [J]., 2017, 7: 41832.
[133] Zeng P J, Li J, Chen Y L,. The structures and biological functions of polysaccharides from traditional Chinese herbs [J]., 2019, 163: 423-444.
[134] 周龙云, 田子睿, 刘书芬, 等. 黄芪对中枢神经系统的药理作用及毒理研究现状 [J]. 中草药, 2018, 49(20): 4935-4944.
[135] Gao Y J, Zhu F, Qian J M,. Therapeutic and immunoregulatory effect of GATA-binding protein-3/T-box expressed in T-cells ratio of astragalus polysaccharides on 2,4,6-trinitrobenzene sulfonic acid-induced colitis in rats [J]., 2016, 22(12): 918-924.
[136] Lv J, Zhang Y, Tian Z,.polysaccharides protect against dextran sulfate sodium-induced colitis by inhibiting NF-κВ activation [J]., 2017, 98: 723-729.
[137] Ko J K S, Lam F Y L, Cheung A P L. Amelioration of experimental colitis bythrough anti-oxidation and inhibition of adhesion molecule synthesis [J]., 2005, 11(37): 5787-5794.
[138] Yan X, Lu Q G, Zeng L,. Synergistic protection of astragalus polysaccharides and matrine against ulcerative colitis and associated lung injury in rats [J]., 2020, 26(1): 55-69.
[139] Tian Z Q, Liu Y, Yang B,.polysaccharide attenuates murine colitis through inhibiton of the NLRP3 inflammasome [J]., 2017, 83(1/2): 70-77.
[140] Chen Y J, Wang J Y, Li J T,.polysaccharide prevents ferroptosis in a murine model of experimental colitis and human Caco-2 cells via inhibiting NRF2/HO-1 pathway [J]., 2021, 911: 174518.
[141] Liang J, Chen S X, Hu Y D,. Protective roles and mechanisms ofpolysaccharides on secondary liver injury in acute colitis [J]., 2018, 107: 2201-2210.
[142] Liang J, Chen S X, Chen J H,. Therapeutic roles of polysaccharides fromcolitis and its underlying mechanisms [J]., 2018, 185: 159-168.
[143] Wen Y F, Xiao H Y, Liu Y,. Polysaccharides frome ameliorate colitis-induced lung injury via inhibiting inflammation and oxidative stress [J]., 2021, 347: 109615.
[144] Zhang Y, Wu Z, Liu J,. Identification of the core active structure of ae polysaccharide and its protective effect against dextran sulfate sodium-induced colitis via alleviating gut microbiota dysbiosis [J]., 2020, 137: 109641.
[145] Xue W Y, Gao Y, Li Q W,. Immunomodulatory activity-guided isolation and characterization of a novel polysaccharide fromKoidz [J]., 2020, 161: 514-524.
[146] Yang M J, Zhang Q W, Taha R,. Polysaccharide fromKoidz. ameliorates DSS- induced colitis in mice by regulating the Th17/Treg cell balance [J]., 2022, 13: 1021695.
[147] Feng W W, Liu J, Tan Y Z,. Polysaccharides fromKoidz. ameliorate ulcerative colitis via extensive modification of gut microbiota and host metabolism [J]., 2020, 138: 109777.
[148] Peng Q, Liu H J, Shi S H,.polysaccharide attenuates inflammation through inhibiting TLR4/NF-κB signaling pathway [J]., 2014, 67: 330-335.
[149] Li W, Gao M B, Han T.polysaccharides ameliorate intestinal barrier dysfunction and inflammation through the MLCK-MLC signaling pathway in Caco-2 cells [J]., 2020, 11(4): 3741-3748.
[150] Su L L, Mao C Q, Wang X C,. The anti-colitis effect ofpolysaccharide is associated with the regulation of the composition and metabolism of gut microbiota [J]., 2020, 10: 519479.
[151] Zhou X N, Lu Q Q, Kang X Z,. Protective role of a new polysaccharide extracted fromin mice with ulcerative colitis induced by dextran sulphate sodium [J]., 2021, 2021: 8878633.
Research progress on natural products from traditional Chinese medicine in treatment of inflammatory bowel disease
MENG Huan1, HOU Xiao-ting1, ZHANG Hua-min2, WANG Xu-de1
1. Dalian Key Laboratory of Chronic Disease Research Center, Dalian University, Dalian 116622, China 2. College of Pharmacy, Yanbian University, Yanbian 133002, China
Inflammatory bowel disease (IBD) is a non-specific intestinal inflammatory disease with unclear causes. It is thought that genetic elements, environmental elements, immune dysfunction, imbalance of intestinal flora and impairment of intestinal mucosal barrier function are the primary causes for the occurrence and development of IBD. The frequently used therapeutic drugs in clinic contain aminosalicylic acids (ASA), antibiotics and corticosteroids, yet the curative ratio is inferior and the side effects are obvious. New research suggests that the active constituents of traditional Chinese medicine (TCM) have the impact on such as adjusting immune function, ameliorating the composition of intestinal flora and promoting the function of intestinal mucosal barrier. Therefore, it can be used to treat IBD effectively. This article summarizes application and research advance about common natural products extracted from TCM in the treatment or prevention of IBD, mainly containing alkaloids, polyphenols, flavonoids, terpenoids, quinones, saponins and polysaccharides, which may contribute to comprehending more about their action mechanism for natural products of TCM in improving IBD, offering some theoretical guidance for the further development of natural products of TCM and the therapy of IBD.
inflammatory bowel disease; natural products of traditional Chinese medicine; immune regulation; intestinal flora; intestinal mucosal barrier function; berberine; curcumin; baicalin; paeoniflorin; rhein; ginsenoside;polysaccharide
R285
A
0253 - 2670(2023)10 - 3349 - 21
10.7501/j.issn.0253-2670.2023.10.032
2022-11-18
国家自然科学基金资助项目(61671098);韩国食品研究项目(2017029)
孟 欢(1998—),女,硕士研究生,研究方向为免疫药理学。E-mail: 15563776072@163.com
王旭德(1985—),男,博士,讲师,从事天然药物化学研究。E-mail: Xudewanglnu@gmail.com
[责任编辑 赵慧亮]
