基于指纹图谱结合化学模式识别法对不同种质白芍质量评价
2023-05-20杜倩倩张铁军谢冬梅汪天明孙叶芬岳倩侠俞年军
杜倩倩,张铁军,谢冬梅, 3,张 伟, 3,汪天明, 3,孙叶芬,岳倩侠,杨 爽,马 磊,俞年军, 3,曹 勇
基于指纹图谱结合化学模式识别法对不同种质白芍质量评价
杜倩倩1,张铁军2,谢冬梅1, 3,张 伟1, 3,汪天明1, 3,孙叶芬1,岳倩侠1,杨 爽1,马 磊4,俞年军1, 3*,曹 勇5, 6*
1. 安徽中医药大学药学院,安徽 合肥 230012 2. 天津药物研究院,天津 300301 3. 省部共建安徽道地中药材品质提升协同创新中心,安徽 合肥 230012 4. 安徽普康中药资源有限公司,安徽 亳州 236800 5. 中药提取安徽省技术创新中心,安徽 亳州 236800 6. 安徽济人药业股份有限公司,安徽 亳州 236800
采用指纹图谱与化学模式识别方法,以质量标志物(quality marker,Q-Marker)为指标,评价不同种质白芍的质量。采用HPLC法,以乙腈-0.1%磷酸水溶液为流动相进行梯度洗脱,柱温30 ℃,体积流量1 mL/min,检测波长230 nm;绘制40批白芍样品的指纹图谱,结合相似度分析、聚类分析(cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘法(orthogonal partial least square,OPLS-DA)等化学模式识别技术,对不同种质的白芍样品进行质量评价。从质量传递与溯源,植物亲缘性及化学成分的特有性、有效性及可测性等方面对白芍Q-Marker的选择进行了分析,推测白芍中芍药苷、氧化芍药苷、苯甲酰芍药苷、芍药内酯苷、儿茶素、没食子酰芍药苷、1,2,3,4,6-五没食子酰葡萄糖和没食子酸可作为白芍的Q-Marker。以40批白芍HPLC指纹图谱标定白芍的Q-Marker,相似度在0.892~1.000;聚类分析初步区分出了不同种质的白芍,四川中江、浙江杭州和河北安国的白芍样品质量较为相近;PCA和OPLS-DA结果显示,筛选出的Q-Marker可作为不同种质白芍的特征化学成分;对Q-Marker进行含量测定,结果不同种质样品间差异较大;TOPSIS分析结果表明山西运城的白芍质量排名最高,人工培育的杂花白芍质量排名最低。通过指纹图谱结合化学模式识别技术,以白芍Q-Marker为评价指标能较为全面地反映白芍的质量,可以为白芍优质种质资源的选育和育种提供参考。
白芍;种质资源;质量标志物;HPLC;指纹图谱;没食子酸;氧化芍药苷;儿茶素;芍药内酯苷;芍药苷;没食子酰芍药苷;PGG;苯甲酰芍药苷;化学模式识别
白芍为毛茛科植物芍药Pall.的干燥根,有养血调经、敛阴止汗、柔肝止痛、平抑肝阳的功能[1],是中医临床常用的大宗药材之一。现代药理研究表明,白芍有免疫调节[2]、抗炎[3]、肝脏保护[4]、心血管保护[5]、脑保护[6]和神经保护[7-8]等作用,临床用于治疗多种自身免疫性疾病[9-10]、肝损伤[11-13]、帕金森病[14-15]和抑郁症[16-17]等。近年,山东省菏泽市、安徽省亳州市、浙江省磐安县及四川省中江县等已成为我国药用白芍的主要产区[18-19]。白芍的质量问题一直深受重视,产地[20]、加工[21]、种质[22]及硫熏[23]等是造成市场上白芍药材质量良莠不齐的主要因素。目前,人工栽培是满足白芍市场需求的主要途径,经长期栽培后,白芍的遗传特性发生明显变异,形成了各个产地的不同种质[24-25]。种质是影响中药材质量和产量的重要因素[26],选育优良品种是提高白芍质量和产量的有效途径。现行白芍的质量评价及质量控制方法多是以芍药苷作为指标,但中药材具有化学成分复杂、多成分协同作用的特点,单一的指标可能难以反映白芍的内在品质。
中药质量是中药有效性、安全性的关键因素,是中药临床疗效的根本保证[27-29]。由刘昌孝院士[30]提出的中药质量标志物(quality marker,Q-Marker)以整体观为指导,有利于使中药变得更加安全有效、质量可控且机制明确。王倩等[31]通过比较白芍、赤芍的功能主治、化学成分、药理作用的异同,认为白芍、赤芍中所含有的单萜及其苷类及鞣质类成分较为活跃,可作为预测白芍、赤芍Q-Marker的主要选择对象。徐佳新等[32]总结了白芍的化学成分、药理作用和质量控制方法的研究进展,从质量传递与溯源,植物亲缘性及化学成分的特有性、有效性及可测性等方面对白芍Q-Marker的选择进行了分析,推测白芍中芍药苷、氧化芍药苷、苯甲酰芍药苷、芍药内酯苷、1,2,3,4,6-五没食子酰葡萄糖(1,2,3,4,6-pentagalloylglucose,PGG)和没食子酸等化合物可作为白芍的Q-Marker。
本课题组前期利用液质联用技术、计算机模拟分子对接技术、网络药理学和体外炎症模型等研究,初步筛选出芍药苷、芍药内酯苷、氧化芍药苷、没食子酰芍药苷、苯甲酰芍药苷、儿茶素、PGG和没食子酸8种成分作为白芍的Q-Marker。指纹图谱是实现鉴别中药真实性、评价质量一致性和产品稳定性的可行模式,能较全面地反映药材所含化学成分的相对关系[33-35],指纹图谱结合化学模式识别技术能够科学、有效地反映药材的内在质量[36-37]。本研究初步筛选出来的白芍Q-Marker为指标,利用指纹图谱结合化学模式识别技术评价不同种质白芍的质量。
1 材料
1.1 仪器
Agilent Infinity 1260型高效液相色谱仪(美国Agilent公司),PALL Cascada III超纯水一体化系统(美国PALL公司),CP214型1/1万电子天平(美国OHAUS公司),AE240型1/10万电子天平(美国Mettler-Toledo公司);高速多功能打粉机(上海赛耐机械有限公司);AS30600BT型系列超声波清洗仪(天津奥特赛恩斯仪器有限公司)。
1.2 试剂
没食子酸(批号C17D10C105977,质量分数≥98%),儿茶素(批号P21J11F118380,质量分数≥98%),芍药内酯苷(批号DST190120-071,质量分数≥91.4%),PGG(批号G16M11L113433,质量分数≥99%),苯甲酰芍药苷(O11G1B163260,质量分数≥99%),没食子酰芍药苷(P16A11S111470,质量分数≥98%)购于上海源叶生物科技有限公司;芍药苷(批号110736-201842,质量分数≥98%)购于中国食品药品检定研究院,氧化芍药苷(批号21092304,质量分数≥98%)购于成都普菲德生物技术有限公司;乙腈(瑞典OCEANPAK,色谱纯);磷酸(国药集团化学试剂有限公司,分析纯);甲醇(国药集团化学试剂有限公司,色谱纯);超纯水、蒸馏水(自制)。
1.3 药材
基因型决定药用植物合成次生代谢产物,而环境条件影响其次生代谢产物合成的数量[38]。本研究将不同种质白芍的种苗集中栽培,在排除栽培环境因素的条件下评价其质量,为种质筛选和种苗繁育奠定基础。2016年,分别收集安徽亳州、四川中江、山东菏泽、山西运城、浙江杭州、河北安国和四川成都的药用芍药的芽头,采用芽头繁殖的方式,在安徽省亳州市谯城区十河镇试验田进行统一栽培管理。2021年9月对以上药材进行采样。此外,采集相同生长年限的安徽亳州试培育品种“杂花芍药”,即农户人工培育的新品种。本实验所用白芍药材经安徽中医药大学俞年军教授鉴定为毛茛科植物芍药Pall.的干燥根。40批药材信息见表1。
2 方法
2.1 色谱条件
安捷伦ZORBAX Eclipse Plus-C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~5 min,9% B;5~8 min,9%~15% B;8~23 min,15%~25% B;23~28 min,25%~35% B;28~35 min,35%~90% B。体积流量1.0 mL/min,柱温30 ℃,检测波长230 nm,进样量10 μL,进样前在其初始条件下平衡5 min。
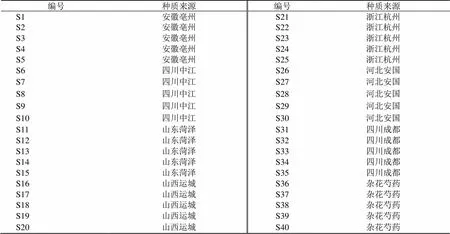
表1 白芍采样情况
2.2 溶液的制备
2.2.1 供试品溶液的制备 样品采集回实验室,洗净后置于沸水中煮至透心,捞出,去皮,60 ℃烘干。将干燥品打粉过四号筛(65目)。
精密称定本品粉末0.5 g,倒入25 mL的量瓶中,加稀乙醇15 mL,超声处理(功率240 W,频率45 kHz)30 min,放冷,加稀乙醇定容至刻度,摇匀,0.22 μm微孔滤膜滤过,取续滤液,制成供试品溶液。
2.2.2 对照品溶液的制备 精密称取芍药苷、儿茶素、芍药内酯苷、没食子酰芍药苷、氧化芍药苷、苯甲酰芍药苷、PGG和没食子酸对照品适量,加入甲醇(色谱纯)溶液,超声30 min(功率240 W、频率45 kHz),使其溶解完全后振荡摇匀,制成没食子酸、氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、没食子酰芍药苷、PGG和苯甲酰芍药苷质量浓度分别为0.154、0.127、0.121、0.720、0.985、0.132、0.210、0.209 mg/mL的混合对照品溶液。
2.3 方法学考察
2.3.1 线性范围 精密吸取混合对照品溶液适量,用甲醇溶液稀释制成不同浓度的混合对照品溶液,按照“2.1”项下色谱条件进样分析,平行进样3次,测得峰面积。以各对照品质量浓度为横坐标(),峰面积为纵坐标(),求得回归方程,绘制标准曲线,见表2。结果表明,各待测成分在相应质量范围内线性关系良好。
2.3.2 精密度试验 取S1样品粉末,照“2.2.1”项下方法制备供试品溶液,按“2.1”项下条件连续进样6次分析,结果没食子酸、氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、没食子酰芍药苷、PGG和苯甲酰芍药苷8个成分的相对保留时间的RSD分别为0.35%、0.22%、0.27%、0.12%、0.12%、0.11%、0.19%和0.01%,峰面积的RSD分别为0.84%、2.83%、0.79%、0.96%、2.08%、0.87%、2.72%、0.38%,RSD均<3%,表明仪器精密度良好。

表2 回归方程及线性范围
2.3.3 重复性试验 取S1样品粉末,按照“2.2.1”项下方法平行制备6份制备供试品溶液,按“2.1”项下条件进样,结果没食子酸、氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、没食子酰芍药苷、PGG和苯甲酰芍药苷8个成分的相对保留时间的RSD分别为0.40%、0.25%、0.27%、0.17%、0.20%、0.22%、0.35%和0.01%,峰面积的RSD分别为0.09%、2.52%、0.48%、0.28%、1.94%、0.50%、0.92%和0.11%,表明方法重复性好。
2.3.4 稳定性试验 取S1样品粉末,按照“2.2.1”项下方法制备供试品溶液,按“2.1”项下条件分别于供试品溶液制备后0、2、4、8、10、12、14、16、24 h进样分析,结果没食子酸、氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、没食子酰芍药苷、PGG和苯甲酰芍药苷8个成分的相对保留时间的RSD分别为0.68%、0.29%、0.39%、0.22%、0.22%、0.20%、0.32%和0.01%,峰面积的RSD分别为1.64%、2.79%、2.32%、0.81%、0.69%、0.84%、2.90%和1.12%。
2.3.5 加样回收率试验 精密称取已知各指标成分含量的白芍样品(S1)8份,每份0.25 g,分别加入与样品中各成分含量相等的对照品溶液,按“2.2.1”项下条件制备供试品溶液,按“2.1”项下条件进行测定,计算各成分含量[39],得到8个成分的平均加样回收率及RSD。结果没食子酸、氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、没食子酰芍药苷、PGG和苯甲酰芍药苷的平均加样回收率分别为96.76%、91.46%、96.17%、102.39%、101.92%、96.36%、100.17%和98.04%,保留时间RSD依次为0.32%、0.27%、0.16%、0.08%、0.08%、0.10%、0.18%、0.01%,表明该方法准确可靠。
2.4 数据分析
利用“中药色谱指纹图谱相似系统(2012版)”软件绘制40批白芍样品的指纹图谱,并进行相似度评价分析。利用SPSS 23.0软件以白芍Q-Marker含量为指标,采用平均联接法,选择平方欧氏距离为测度对样品数据进行聚类分析(cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和优劣解距离法分析(TOPSIS)。利用SIMCA 14.1软件进行不同种质白芍的PCA分析和正交偏最小二乘-判别分析(orthogonal partial least square,OPLS-DA)分析。
3 结果与分析
3.1 指纹图谱的建立
分别混合对照品溶液和40批白芍样品溶液,按照“2.1”项下色谱条件进行分析,将HPLC图谱以AIA格式导入“中药色谱指纹图谱相似系统(2012.130723)”软件。将S1白芍样品的HPLC图设为参照图谱,采用中位数法,时间窗宽度为0.1 min,经多点校正后匹配,生成40批白芍样品的指纹图谱,见图1。
在指纹图谱中,保留时间2~35 min内共出现了11个共有峰,与混合对照品的色谱峰进行比较,指认了8个色谱峰,2号峰为没食子酸,4号峰为氧化芍药苷,5号峰为儿茶素,6号峰为芍药内酯苷,7号峰为芍药苷,8号峰为没食子酰芍药苷,9号峰为PGG,11号峰为苯甲酰芍药苷,见图2。对40批白芍药材指纹图谱进行相似度评价分析,结果除S36~S40样品外,其余样品的相似度均大于0.95,见表3。结果表明杂花芍药与其他种质的样品具有明显差异,而各个种质的白芍指纹图谱相似度较高,说明各个种质的药材质量较为稳定和均一。

图1 40批白芍样品的指纹图谱
3.2 含量测定结果
按照“2.1”项下条件测定白芍样品,每个样品平行测定3次,结果显示,不同种质白芍样品之间的Q-Marker含量有较大差异,见表4。
3.3 HCA
HCA可将样本分为不同的类别[40]。40批白芍样品HPLC指纹图谱中的Q-Marker 的峰面积经标准化处理后,运用SPSS 23.0进行HCA,选择以组间连接作为聚类方法,绘制树状图,见图3。当分类距离为25时,白芍样品分为2类,S36~S40聚为一类,S1~S35聚为一类。当分类距离为5时白芍样品分为6类,S6~S10和S21~S30聚为一类,其他样品按照来源各自聚为一类。结果表明,HCA可大致区分出各种质白芍,其中四川中江、浙江杭州和河北安国的样品质量较为相近。

2-没食子酸 4-氧化芍药苷 5-儿茶素 6-芍药内酯苷 7-芍药苷 8-没食子酰芍药苷 9-PGG 11-苯甲酰芍药苷
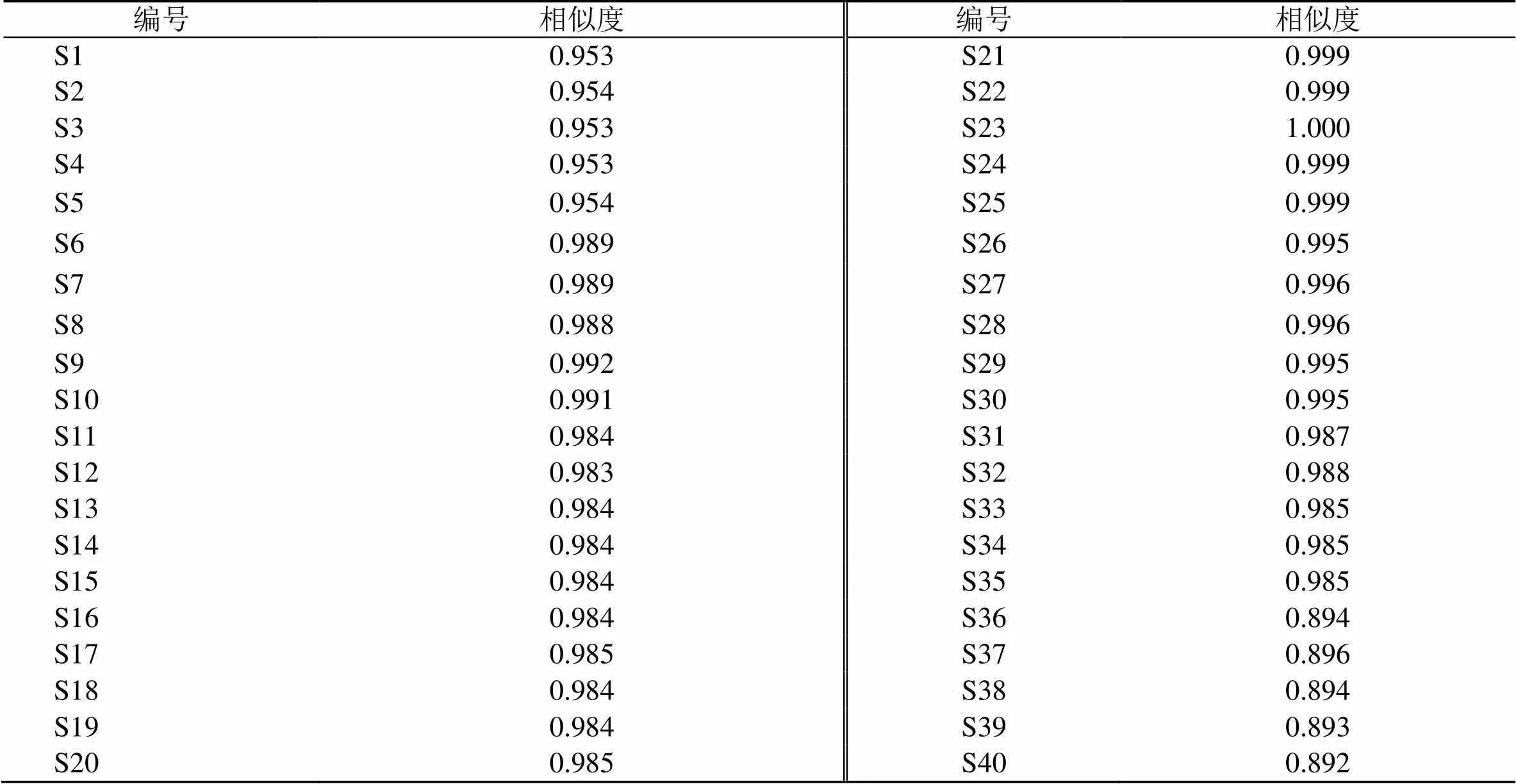
表3 40批白芍样品相似度评价结果
3.4 PCA
将40批白芍样品的Q-Marker的峰面积导入SPSS 23.0统计软件进行PCA,结果显示KMO为0.615,大于0.6,满足PCA的前提要求;Bartlett球形度检验<0.05,说明研究数据适合进行PCA。以特征值大于1为提取标准,筛选得到3个主成分(碎石图见图4),累积贡献率大于90%,即提取的3个主成分包含了白芍Q-Marker的95.877%的信息,结果见表5。将得到的成分矩阵进行正交旋转得到8个共有峰成分在3个主成分中的旋转矩阵,权重值越大表明该成分在决定样品区分中的作用越大[41],见表6。结果显示第1个主成分信息主要来自苯甲酰芍药苷、芍药苷、没食子酰芍药苷和PGG,第2个主成分信息主要来自氧化芍药苷、儿茶素和芍药内酯苷,第3个主成分信息主要来自没食子酸。根据各主要化学成分在不同因子上的载荷,可确定白芍Q-Marker的8种化学成分均可作为不同种质白芍的特征化学成分。将白芍样品Q-Marker的峰面积导入SIMCA 14.1软件绘制40批不同种质白芍样品的PCA得分图(图5),结果显示3个主成分能反映不同种质白芍的主要特征。

表4 不同种质白芍Q-Marker的含量

图3 样品HCA树状图
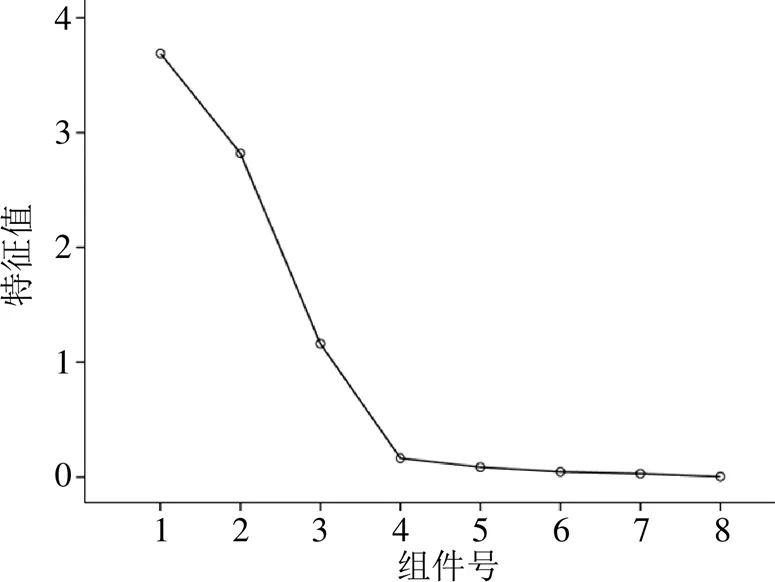
图4 40批白芍药材的Q-MarkerPCA碎石图

表5 特征值及方差贡献率

表6 旋转后的成分矩阵
3.5 OPLS-DA
为更好地观察不同种质样本间的组间差异,采用SIMCA 14.1软件对40批样品进行OPLS-DA分析,将样品的Q-Marker的数据导入,建立OPLS-DA模型,模型得分见图6。模型分析验证参数可知,2(cum)=1,2(cum)=0.881,2(cum)=0.819,2(cum)=1,均大于0.5且接近于1,说明模型稳定且具有良好、可靠的预测准确性。为避免模型过度拟合造成结果假阳性,设置分类Y矩阵变量随机排列200次做置换检验[42],检验图见图7。2回归线在Y轴截距为0.079 9、2回归线在Y轴截距为−0.483,说明模型没有出现过拟合现象,可用于判别分析40批样品的组间差异。OPLS-DA模型中的VIP值显示,在95%置信区间内,筛选出VIP>1.0的差异标志物为芍药苷、芍药内酯苷和PGG,见图8。计算差异标志物峰面积占共有峰峰面积占比,可知40批样品的差异标志物中芍药苷平均占比最高,为48.82%,芍药内酯苷占比其次,为28.12%,且这些成分RSD均大于23.64%,表明这些成分在各批次间含量差异较大。
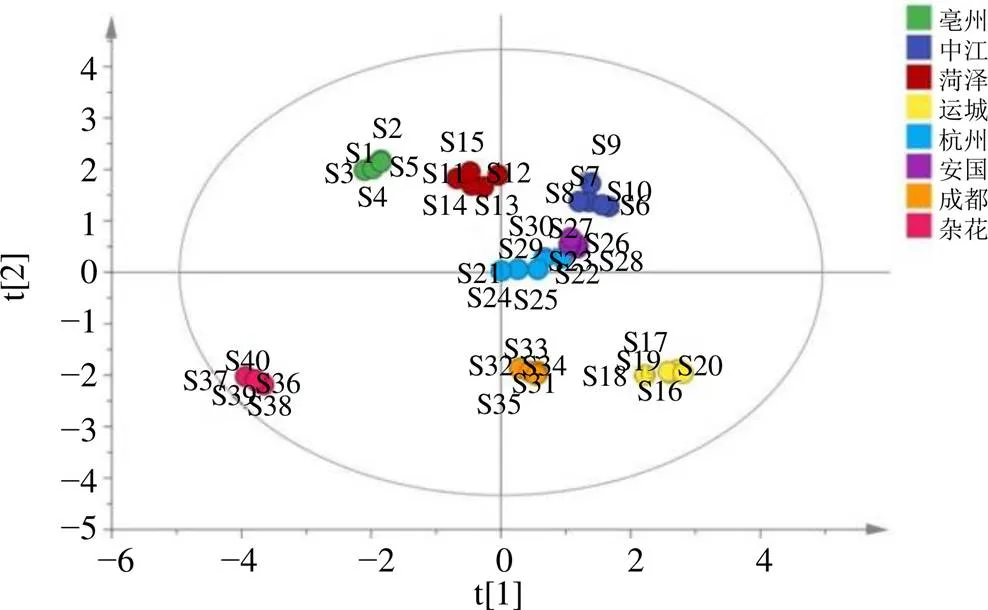
图5 40批白芍PCA得分图
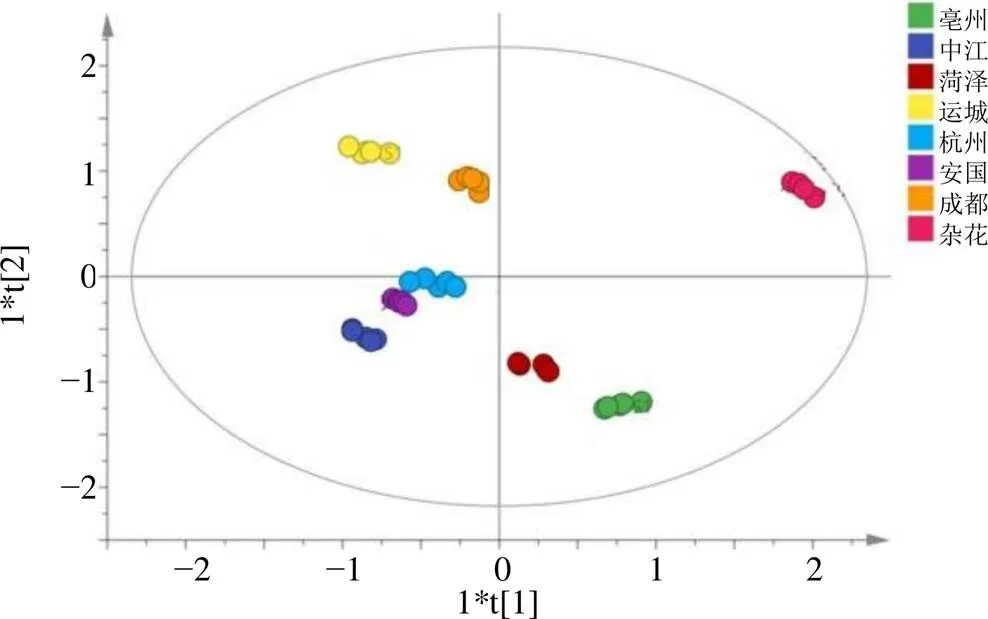
图6 OPLS-DA得分图
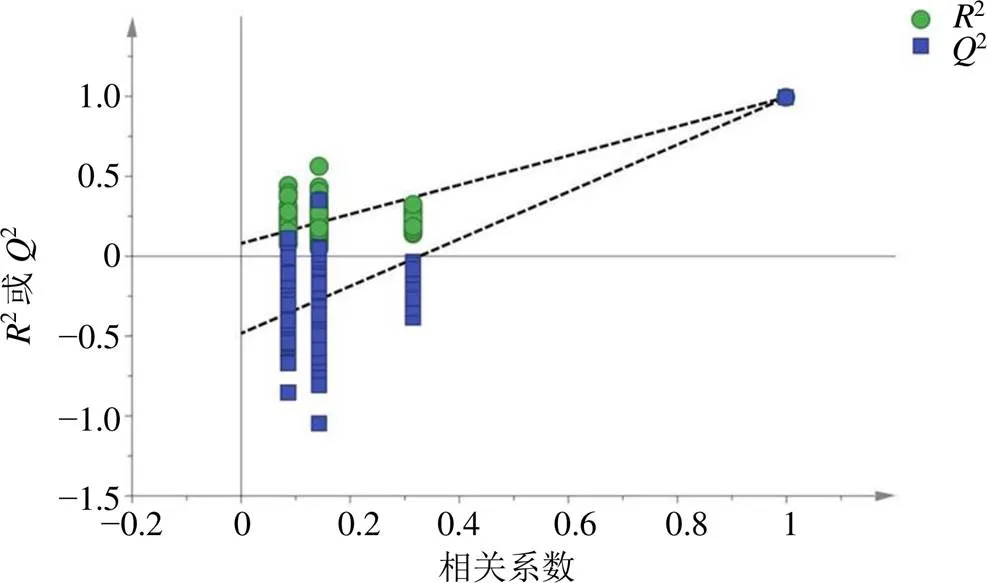
图7 OPLS-DA置换检验图

图8 VIP得分图
3.6 TOPSIS
将白芍Q-Marker的峰面积作为原始数据,Zscore标准化处理后进行TOPSIS分析,以分析和比较不同种质白芍的质量差异,结果见表7。由结果可知,S16~S20位列前5名,综合比较后本研究认为以Q-Marker为评价指标,山西运城的白芍的综合品质较优异且稳定,其次是四川中江与河北安国的白芍评价较好,人工培育的杂花芍药的质量最次,指纹图谱Q-Marker的数据可作为白芍质量评价的依据,TOPSIS分析可用于白芍的质量评价[43]。
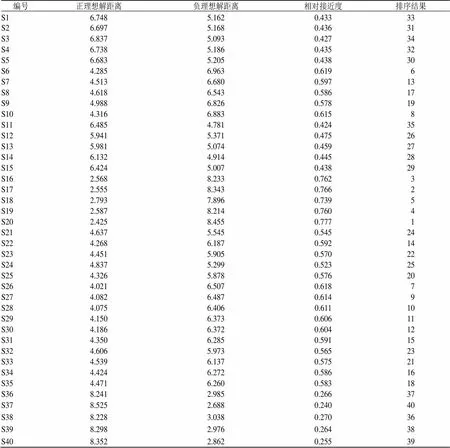
表7 TOPSIS评价结果
4 讨论
本实验分别考察了提取溶剂(甲醇、乙醇和稀乙醇)、提取溶剂浓度(30%、40%、45%、50%和70%)、检测波长(230、245、270 nm等)等条件,确定了以50%稀乙醇超声提取30 min为最佳提取条件。提取的样品在230 nm下检测所得图谱的色谱峰较多且分离度较好,整体代表性较强。
本研究所建立的指纹图谱主要针对不同种质白芍的Q-Marker 8种成分,相似度评价结果显示40批样品的相似度在0.892~1.000,其中杂花芍药的5批样品相似度低于0.9,且芍药苷的含量低于药典规定的1.6%,这种人工培育的种质是否能作药用还有待进一步研究。不同种质白芍的Q-Marker含量有较大差异,在本实验条件设计下可以排除生长环境和栽培年限因素的影响[44],差异的产生主要来源于种质的不同,即原种质遗传物质的差异。在HCA中,40批白芍样品分为了6类,四川中江白芍、浙江杭州白芍和河北安国白芍聚为一类,其他种质白芍各自聚为一类,与指纹图谱相似度评价结果一致,表明8个种质白芍样品既存在相似性又存在差异性。PCA结果可知本研究使用的白芍Q-Marker的8种成分均可作为影响不同种质白芍质量的特征化学成分。OPLS-DA结果表明,芍药苷、芍药内酯苷和PGG在各批次间含量差异较大,可以作为不同种质白芍差异性分析的表征化合物。TOPSIS排序结果表明以Q-Marker为指标,山西运城的白芍较为优质且质量稳定,杂花芍药的质量较差,结果提示山西运城的种质可为白芍种质资源的筛选和优化提供材料。
通过指纹图谱结合化学模式识别以Q-Marker为指标评价不同种质的白芍,实验结果表明,选用这8种成分作为白芍的Q-Marker较为合理科学,通过HPLC指纹图谱对白芍Q-Marker进行宏观整体表征,能够较为全面的反映白芍的化学信息。采用化学模式识别技术对Q-Marker的8种成分的峰面积数据进行分析,结果表明筛选出的Q-Marker具有较好的代表性,有利于白芍质量评价标准的研究,促进资源的开发利用。
环境因素和基因型是影响道地药材形成的主要外在因素和内部因素,生长环境不同造就了道地药材独特的化学物质基础[45-46],遗传变异和自然选择促进药材在特定环境下形成优良种质资源[47]。优良的种质资源是药材质量稳定的基础[48],其优劣对中药的产量和质量有决定性的作用[49],关系到药用植物的确切疗效和疗效的重现性,进而直接影响到中药制剂的质量[50]。从各主产地引种的道地白芍种质在换了栽培环境后,药效物质的含量仍优于人工育成品种,表明道地白芍种质稳定而优质,人工培育的种质是否能作为中药材使用应谨慎。白芍新品种的选育,应基于现有种质资源的特有基因中发现[51-52]。对白芍种质资源进行综合分析,可以为白芍种质资源评价提供一定的参考,为白芍优良种质的选育和育种奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 余婧萍, 宋祯彦, 李富周, 等. 芍药苷通过促进细胞自噬抑制H2O2诱导的SH-SY5Y细胞的氧化损伤 [J]. 湖南中医药大学学报, 2020, 40(6): 653-659.
[2] 李娴, 王国芬, 詹雅萍. 白芍总苷对系统性红斑狼疮患者肝损伤的保护效果分析 [J]. 现代实用医学, 2020, 32(6): 637-639.
[3] 章丽. 基于“品种-ITS2序列—成分—药效”关联性探究丹皮、赤芍、白芍功效差异的科学内涵 [D]. 镇江: 江苏大学, 2016.
[4] 史丽璞. 白芍总苷加来氟米特治疗类风湿关节炎时肝保护及对炎性因子的影响: 中国, CN 107225636 [P]. 2010-08-08.
[5] 吕仕超, 王云姣, 张婉勤, 等. 白芍总苷的心血管保护效应及其作用机制的研究进展 [J]. 现代药物与临床, 2022, 37(1): 207-210.
[6] 王丽. 白芍总苷对缺血性脑损伤大鼠脑保护作用的研究 [J]. 医学研究杂志, 2020, 49(11): 91-95.
[7] 陈恒石, 蒋磊. 白芍总苷胶囊对4-VO诱导的MCAO大鼠的神经保护作用及其机制探究 [J]. 医学综述, 2020, 26(13): 2675-2680.
[8] 杨山景, 封安杰, 孙越, 等. 白芍总苷的药理作用及机制研究进展 [J]. 中国现代应用药学, 2021, 38(13): 1627-1633.
[9] 汪娟, 王芳. 白芍总苷治疗自身免疫性疾病的研究进展 [J]. 医学综述, 2021, 27(22): 4481-4485.
[10] 郑寅涛, 曹岗, 吴鑫. 山茱萸-白芍酒炙配伍前后通过调节OPG/RANKL/RANK信号通路抗类风湿性关节炎药效机制研究[J]. 中草药, 2022, 53(10): 3084-3092.
[11] 王继萱, 艾宗雄, 谢晶日. 土鳖虫、姜黄、鳖甲、白芍治疗肝纤维化经验 [J]. 环球中医药, 2021, 14(2): 306-308.
[12] Shin M R, Lee S H, Roh S S. The potential hepatoprotective effect ofin thioacetamide-induced acute liver injury in rats [J]., 2022, 2022: 7904845.
[13] 贾岚, 王蕾蕾, 孟靓, 等. 白芍总苷对大鼠化学性肝损伤与肝阴虚证结合模型的影响和机制研究[J]. 中草药, 2020, 51(7): 1885-1892.
[14] 王文鑫. 中药白芍在帕金森领域的应用及临床研究进展 [J]. 医学食疗与健康, 2021, 19(15): 226-227.
[15] 吴林, 陈静, 唐秀松, 等. 基于网络药理学探讨白芍治疗帕金森病的作用机制 [J]. 中华中医药学刊, 2021, 39(4): 1-5.
[16] 张景霞, 赵重博, 李凡, 等. 基于网络药理学和分子对接技术的白芍治疗抑郁症作用机制探讨 [J]. 中国现代中药, 2021, 23(9): 1582-1589.
[17] 李添, 李肖, 田俊生, 等. 基于1H-NMR肝脏代谢组学的白芍抗抑郁作用研究 [J]. 中医药学报, 2021, 49(8): 17-26.
[18] 查良平, 杨俊, 彭华胜, 等. 四大产地白芍的种质调查 [J]. 中药材, 2011, 34(7): 1037-1040.
[19] 李洋, 陈健, 张越, 等. 基于指纹图谱结合化学模式识别及多成分含量测定的白芍药材质量评价研究[J]. 中草药, 2022, 53(1): 231-237.
[20] 严倩茹, 邬伟魁. 白芍饮片的质量现状与质量控制方法研究进展 [J]. 药物评价研究, 2015, 38(2): 229-232.
[21] 王金丹. 不同的炮制方法对白芍质量的影响 [J]. 当代农机, 2021(10): 63-64.
[22] 孟肖, 李靖季, 姚洁, 等. 不同因素对白芍药材产量及品质的影响研究进展 [J]. 现代农业科技, 2020(20): 59-62.
[23] 游广娇, 刘亚男, 任晓亮, 等. 基于主成分分析-分组分析模型的白芍/硫熏白芍模式识别研究 [J]. 中华中医药杂志, 2020, 35(5): 2315-2320.
[24] 查良平, 王德群, 彭华胜, 等. 中国药用芍药栽培品种 [J]. 安徽中医学院学报, 2011, 30(5): 70-73.
[25] 姚杰, 王文姌, 郭盛磊, 等. 白芍与赤芍种质问题探讨 [J]. 中国现代中药, 2020, 22(11): 1933-1937.
[26] 黄文静, 熊乐文, 张龙霏, 等. 不同种质金银花发育过程中黄酮类成分含量变化规律研究 [J]. 中草药, 2022, 53(10): 3156-3164.
[27] 张铁军, 王杰, 陈常青, 等. 基于中药属性和作用特点的中药质量标志物研究与质量评价路径[J]. 中草药, 2017, 48(6): 1051-1060.
[28] 阳长明, 杨平, 刘乐环, 等. 中药质量标志物(Q-Marker) 研究进展及对中药质量研究的思考 [J]. 中草药, 2021, 52(9): 2519-2526.
[29] 叶霁, 李睿旻, 曾华武, 等. 基于整体观中药质量标志物的发现及研究进展 [J]. 中草药, 2019, 50(19): 4529-4537.
[30] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[31] 王倩, 李柳潼, 马永犇, 等. 白芍与赤芍化学成分和药理作用比较研究及质量标志物的预测分析 [J]. 中国新药杂志, 2021, 30(12): 1093-1098.
[32] 徐佳新, 许浚, 曹勇, 等. 中药白芍现代研究进展及其质量标志物的预测分析 [J]. 中国中药杂志, 2021, 46(21): 5486-5495.
[33] 李洋, 陈健, 张越, 等. 基于指纹图谱结合化学模式识别及多成分含量测定的白芍药材质量评价研究 [J]. 中草药, 2022, 53(1): 231-237.
[34] 李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望 [J]. 中草药, 2013, 44(22): 3095-3104.
[35] 严辉, 谢舒平, 濮宗进, 等. 基于UPLC-PDA指纹图谱及多成分含量的化学模式识别法评价大黄质量 [J]. 中草药, 2020, 51(18): 4755-4762.
[36] 杨玉莹, 张丹丹, 罗心遥, 等. 指纹图谱及多成分定量结合化学模式识别法评价不同产地青钱柳质量 [J]. 中草药, 2020, 51(4): 1082-1088.
[37] 孙立丽, 王萌, 任晓亮. 化学模式识别方法在中药质量控制研究中的应用进展 [J]. 中草药, 2017, 48(20): 4339-4345.
[38] 杨利民, 张永刚, 林红梅, 等. 中药材质量形成理论与控制技术研究进展 [J]. 吉林农业大学学报, 2012, 34(2): 119-124.
[39] 史素影. 栽培芍药加工成赤芍药材的合理性研究 [D]. 合肥: 安徽中医药大学, 2021.
[40] 刘东方, 赵丽娜, 李银峰, 等. 中药指纹图谱技术的研究进展及应用 [J]. 中草药, 2016, 47(22): 4085-4094.
[41] 赵宏苏, 赵茹, 乔金为, 等. 基于指纹图谱结合化学模式识别绿萼梅质量标志物的评价研究 [J]. 中草药, 2022, 53(5): 1345-1353.
[42] 谢苏梦, 季巧遇, 吕尚, 等. 不同产地野菊花HPLC指纹图谱建立及化学模式识别研究 [J]. 中草药, 2021, 52(24): 7616-7623.
[43] 李学学, 曹亚楠, 苏宏娜, 等. 西南委陵菜质量标志物初步研究及指纹图谱结合多元统计综合评价其质量 [J]. 中草药, 2021, 52(12): 3696-3704.
[44] 周学刚, 陈淑欣, 魏东华, 等. 不同种质和不同部位白芍原植物中芍药苷和芍药内酯苷的含量测定 [J]. 医药导报, 2011, 30(11): 1477-1480.
[45] 马晓晶, 郭娟, 唐金富, 等. 论中药资源可持续发展的现状与未来 [J]. 中国中药杂志, 2015, 40(10): 1887-1892.
[46] 车欣, 于雪冬, 郑翔宇, 等. 我国道地药材适生区研究应用现状 [J]. 中华中医药学刊, 2022, 40(7): 121-124.
[47] 袁媛, 黄璐琦. 道地药材分子生药学研究进展和发展趋势 [J]. 科学通报, 2020, 65(12): 1093-1102.
[48] 杨成民, 魏建和, 隋春, 等. 我国中药材新品种选育进展与建议 [J]. 中国现代中药, 2013, 15(9): 727-737.
[49] 侯嘉. 不同产地川芎种质资源的品质研究 [D]. 成都: 成都中医药大学, 2007.
[50] 孟祥才, 曹伍林, 宋琦, 等. 谈种质在中药资源开发中的意义 [J]. 中国现代中药, 2013, 15(1): 29-32.
[51] 李隆云, 钟国跃, 卫莹芳, 等. 中国中药种质资源的保存与评价研究 [J]. 中国中药杂志, 2002, 27(9): 641-645.
[52] 王继永, 郑司浩, 曾燕, 等. 中药材种质资源收集保存与评价利用现状 [J]. 中国现代中药, 2020, 22(3): 311-321.
Evaluation of quality markers ofin different germplasm based on fingerprint and chemical pattern recognition
DU Qian-qian1, ZHANG Tie-jun2, XIE Dong-mei1, 3, ZHANG Wei1, 3, WANG Tian-ming1, 3, SUN Ye-fen1, YUE Qian-Xia1, YANG Shuang1, MA Lei4, YU Nian-jun1, 3, CAO Yong5, 6
1. School of Pharmacy, Anhui University of Traditional Chinese Medicine, Hefei 230012, China 2. Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China 3. MOE-Anhui Joint Collaborative Innovation Center for Quality Improvement of Anhui Genuine Chinese Medicinal Materials, Hefei 230012, China 4. Anhui Pukang traditional Chinese Medicine Resources Co., Ltd., Bozhou 236800, China 5. Anhui Innovation Center of Extraction Technology of Chinese Medicinal Materials, Bozhou 236800, China 6. Anhui Jiren Pharmaceutical Co., Ltd., Bozhou 236800, China
To evaluate the quality of different germplasms of Baishao () taking quality marker (Q-Marker) as indicators by using fingerprint and chemical pattern recognition methods.Using the HPLC method, acetonitrile-0.1% phosphoric acid aqueous solution was used as mobile phase for gradient elution, column temperature 30oC, volume flow rate 1 mL/min, detection wavelength 230 nm. The fingerprints of 40 batches ofwere drawn, combined with chemical pattern recognition techniques such as similarity analysis, cluster analysis (HCA), principal component analysis (PCA), and orthogonal partial least square (OPLS-DA). The quality of different germplasm samples ofwas evaluated.The selection of Q-Marker ofwas analyzed from the aspects of quality transfer and traceability, plant relationship, and chemical composition specificity, effectiveness and detecability. It was suggested that paeoniflorin, oxypaeoniflorin, benzoyl paeoniflorin, albiflorin, catechin, gallic paeoniflorin, 1,2,3,4, 6-penogalylglucose and gallic acid in paeony could be used as Q-Marker of. The HPLC fingerprints of 40 batches ofAlba were used to calibrate the Q-Marker ofAlba, and the similarity was between 0.892 and 1. Cluster analysis preliminarily distinguished theAlba of various germplasms. The quality of samples from Zhongjiang in Sichuan, Hangzhou in Zhejiang, and Anguo in Hebei was similar. The results of PCA and OPLS-DA showed that the selected Q-Marker could be used as the characteristic chemical constituents of different germplasm. The content of Q-Marker varied greatly among different germplasm samples. The results of TOPSIS analysis showed that the quality ofin Yuncheng, Shanxi was the highest, and the quality ofin Zahua was the lowest.Through fingerprint combined with chemical pattern recognition technology, taking the Q-Marker ofas an evaluation index can comprehensively reflect the quality of, which can provide a reference for the breeding and breeding high-quality germplasm resources ofAlba.
; germplasm resources; quality marker; HPLC fingerprint; gallic acid; oxidized paeoniflorin; catechin; albiflorin; paeoniflorin; galloyl paeoniflorin; PGG; benzoyl paeoniflorin; chemical pattern recognition
R286
A
0253 - 2670(2023)10 - 3292 -10
10.7501/j.issn.0253-2670.2023.10.026
2022-10-06
国家重点研发计划项目(2017YFC1701600);国家重点研发计划项目(2017YFC1701602);2021年安徽省重点研发项目(202104h04020029);亳州市科技重大专项(BZSKXJSJ2020-59)
杜倩倩(1997—),女,安徽省肥西县,硕士研究生,研究方向为中药资源与质量评价。Tel: 13739292310 E-mail: 1009347120@qq.com
俞年军,教授,研究方向为中药生物技术及栽培药材质量等。Tel: (0551)68129173 E-mail: ynj2005288@sina.com
曹 勇,副研究员,研究方向为中药质量控制及新药研发。E-mail: caoyong20021226@163.com
[责任编辑 时圣明]
