当归多糖对糖尿病肾病KK-Ay小鼠肾脏AMPK信号通路及线粒体自噬的影响
2023-05-20王江侠杨丽霞米登海魏瑞贤崔阳阳马仙康
王江侠,杨丽霞,米登海,魏瑞贤,崔阳阳,马仙康
当归多糖对糖尿病肾病KK-Ay小鼠肾脏AMPK信号通路及线粒体自噬的影响
王江侠1,杨丽霞2*,米登海2,魏瑞贤1,崔阳阳1,马仙康1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中医药研究院,甘肃 兰州 730050
研究当归多糖对糖尿病肾病(diabetic nephropathy,DN)KK-Ay小鼠肾脏磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)信号通路及线粒体自噬的影响。SPF级雄性KK-Ay小鼠用高糖高脂饲料喂养,随机分为模型组、厄贝沙坦(25 mg/kg)组和当归多糖高、中、低剂量(400、200、100 mg/kg)组,每组10只;将10只雄性C57BL/6J小鼠作为对照组。给予药物干预4周,观察小鼠一般情况,每周称定体质量并检测血糖;末次给药后,心脏取血并处死小鼠,分离血清检测尿微量白蛋白(urine microalbuminuria,U-ALB)、肌酐(creatinine,SCr)、尿素氮(urea nitrogen,BUN);采用苏木素-伊红(HE)染色观察肾组织病理变化;采用Western blotting检测肾组织线粒体自噬相关蛋白[微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、p62、Nix]和线粒体裂变蛋白[线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)]的表达;采用免疫组化法检测肾组织AMPK、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)蛋白表达;采用qRT-PCR检测肾组织、mRNA表达。与模型组比较,各给药组U-ALB、SCr、BUN水平均明显降低(<0.05、0.01),呈剂量相关性;肾组织病理变化有所改善;肾组织线粒体自噬相关蛋白LC3Ⅱ/LC3Ⅰ、Nix蛋白表达水平显著降低(<0.01),p62蛋白表达水平显著升高(<0.05);线粒体裂变蛋白Drp1表达下调(<0.01);AMPK、mTOR蛋白及mRNA表达显著下调(<0.05、0.01)。当归多糖能改善DN小鼠肾损伤,延缓DN发病进展,其作用机制与抑制AMPK信号通路介导的线粒体自噬有关。
当归多糖;糖尿病肾病;KK-Ay小鼠;线粒体自噬;磷酸腺苷激活的蛋白激酶信号通路
糖尿病肾病(diabetic nephropathy,DN)是2型糖尿病(type 2 diabetes,T2DM)最常见且最严重的并发症之一,是终末期肾脏疾病(end stage renal disease,ESRD)的主要原因[1]。在2017年因DN死亡的人约为219 451,从1990年开始呈现稳定增长趋势[2],到2035年,全球范围内35%~40%的T2DM会发展为DN[3],这给家庭和社会带来严重的经济及心理负担。目前,治疗DN并没有特定药物,主要通过控制血糖和血压来降低发生ESRD的风险,但并不能长期阻止DN的进展。因此,寻求改善糖尿病肾病的方法具有重要意义。
中药长期应用于糖尿病及其并发症的治疗,具有不良反应少、安全性高等特点。当归是临床上治疗DN的方剂中最常用的中药之一,并且具有良好的临床疗效。当归多糖作为当归的主要活性成分,具有改善贫血、抗肿瘤、免疫调节、降血糖、调血脂[4]、治疗糖尿病肾病[5]的药理作用,可以改善DN。当归多糖是天然植物提取物,具有多途径、多靶点、成分稳定等优点,能够通过多种机制作用于疾病,因此将当归多糖开发为治疗DN的药物具有良好的前景。但当归多糖对DN的疗效和潜在机制尚不完全清楚,还需进行多层次的研究。
肾脏中含有丰富的线粒体,是线粒体含量第二高的器官[6-7]。越来越多的研究表明,线粒体功能障碍在糖尿病肾脏疾病的发病机制中起着重要作用[8]。线粒体质量控制的缺失会导致线粒体功能障碍,因此维持线粒体稳态和质量控制对DN至关重要。线粒体质量控制中重要的一个环节就是线粒体自噬,通过选择性的清除受损或多余的线粒体,从而保护正常的线粒体功能[9]。目前许多研究发现,调控线粒体自噬能改善DN,是防治DN的重要作用机制之一[10-11]。线粒体自噬由PTEN诱导的蛋白激酶1(PTEN induced putative kinase 1,PINK1)/ Parkin通路和线粒体自噬受体信号通路介导[11],磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)为线粒体代谢和线粒体自噬的关键参与者[12-13]。本研究通过观察当归多糖在DN中的作用,探索当归多糖在KK-Ay小鼠T2DM模型中与AMPK介导的线粒体自噬相关的潜在机制。
1 材料
1.1 动物
SPF级雄性KK-Ay小鼠50只、C57BL/6J小鼠10只,10~12周龄,体质量(38±2)g,均购自北京华阜康生物科技有限公司,许可证号SCXK(京)2019-0008。高糖高脂饲料、普通小鼠饲料购自甘肃中医药大学实验动物中心。动物饲养于甘肃中医药大学实验动物中心,每5只为一笼,昼夜循环,充分保证小鼠的适宜活动空间,每周更换2次笼内垫料,确保小鼠生存环境的洁净,室内温度为26.7 ℃,自由进食饮水。动物实验经甘肃中医药大学动物伦理委员会批准(批准号2021-368)。
1.2 药品与试剂
当归多糖(批号CY210714,多糖质量分数为98.14%)购自西安杨凌慈缘生物技术有限公司;厄贝沙坦片(批号DA282,国药准字J20080061)购自杭州赛诺菲安万特民生制药有限公司;尿微量白蛋白(urine microalbuminuria,U-ALB)、肌酐(creatinine,SCr)、尿素氮(urea nitrogen,BUN)试剂盒(批号分别为202205、m1092663、m1210673)购自上海酶联生物科技有限公司;苏木素-伊红(HE)染色试剂盒(批号20191104)购自北京索莱宝科技有限公司;微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)抗体(批号BST17924827)购自武汉博士德生物工程有限公司;p62抗体(批号00048269)购自Proteintech公司;Nix抗体(批号GR39116-6)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号GR303514-13)购自英国Abcam公司;线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)抗体(批号AB04263210)、AMPK抗体(批号bsm-3426M)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(批号bs-1992R)购自北京博奥森生物科技有限公司;山羊抗兔二抗(批号CR2102123)购自武汉赛维尔生物科技有限公司;RNAex Pro RNA提取试剂、Evo M-MLV反转录预混型试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒(批号分别为A3A2161、A4A0056、A4A0185)购自Accurate Biotechnology。
1.3 仪器
5424R型高速冷冻离心机(德国Eppendorf公司);iMark酶标仪、梯度PCR仪(美国Bio-Rad公司);StepOne Plus实时定量PCR仪(美国Thermo公司);MX-S型涡旋振荡器(美国赛洛捷克公司);DYCZ-40G型Western blotting转膜仪、DYCZ-25D型电泳仪(北京六一生物科技公司);MiniChemi 610型化学发光成像仪(北京赛智科技有限公司);ACCU-CHEK Performa血糖仪(瑞士罗氏公司);DM2500型显微镜(德国Leica公司)。
2 方法
2.1 DN小鼠模型建立、分组及给药
小鼠适应性喂养1周,取10只C57BL/6J小鼠作为正常组,以普通饲料喂养;50只KK-Ay小鼠用高糖高脂饲料喂养。KK-Ay小鼠是T2DM的自发动物模型,随机监测小鼠血糖,KK-Ay小鼠随机血糖≥13.9 mmol/L,出现微量蛋白尿,即视为成功构建DN模型[14-15]。将造模成功的KK-Ay小鼠随机分为模型组、厄贝沙坦(25 mg/kg)组和当归多糖高、中、低剂量(400、200、100 mg/kg,根据人和动物体表面积等效剂量比率表计算[16])组,每组10只。各给药组ig相应药物,正常组和模型组ig等体积生理盐水,1次/d,连续4周。
2.2 取样
末次给药后,收集小鼠24 h尿液,于−20 ℃保存待测;小鼠禁食不禁水12 h后,ip 10%水合氯醛麻醉,行心脏采血,4 ℃、3500 r/min离心10 min,分离血清,−80 ℃保存备用。快速分离两侧肾脏,左肾置于4%多聚甲醛中,室温固定备用;右肾纵向切开去除肾髓质,−80 ℃保存备用。
2.3 小鼠一般情况及生化指标检测
观察小鼠皮毛的光泽度、活动度、精神状态及进食情况等。按照试剂盒说明书检测U-ALB、SCr、BUN水平。
2.4 HE染色观察肾脏组织病理学变化
取出固定在4%多聚甲醛中的肾组织,经脱水、浸蜡、包埋后,将包埋好的蜡块切成薄片,然后进行HE染色,于显微镜下观察并拍照。
2.5 Western blotting检测线粒体自噬蛋白LC3、p62、Nix和线粒体裂变蛋白Drp1的表达
取研碎的肾组织200 mg,加入RIPA蛋白裂解液2 mL,冰上充分裂解,4 ℃、12 000 r/min离心15 min,取上清。使用BCA法进行蛋白定量分析,加30 μL 5×上样缓冲液,混匀,在100 ℃沸水中加热10 min使蛋白变性。蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶封闭1.5 h,分别加入p62(1∶1000)、Nix(1∶1000)、Drp1(1∶1000)、LC3(1∶500)、GAPDH(1∶3000)抗体,4 ℃孵育过夜;TBST洗膜,加入二抗(1∶6000),室温孵育1 h,TBST洗膜,滴加发光液,反应5 min。使用化学发光成像仪曝光,采用Image J软件分析条带灰度值。
2.6 免疫组化检测肾组织AMPK和mTOR蛋白表达
取肾组织石蜡切片,脱蜡、水化,柠檬酸钠热修复2次,3% H2O2孵育15 min,血清37 ℃封闭30 min,滴加AMPK、mTOR抗体(1∶100),4 ℃孵育过夜,37 ℃复苏后,滴加二抗,37 ℃孵育30 min,滴加三抗,37 ℃孵育30 min,DAB显色,苏木素复染,中性树胶封片。在每张切片中选取5个视野,使用Image Pro Plus 6软件进行分析。
2.7 qRT-PCR检测肾组织AMPK、mTOR mRNA表达
取100 mg肾组织研磨成粉末状,加入1 mL RNAex Pro提取总RNA,经超微量分光光度计测定RNA的浓度和纯度,将RNA逆转录成cDNA,进行qRT-PCR分析。引物序列见表1。
2.8 统计学分析
3 结果
3.1 当归多糖对DN小鼠体征的影响
实验期间,模型组出现多饮多食、皮毛枯槁易脱落、蜷缩懒动等现象,甚至出现皮肤溃疡等并发症。各给药组小鼠症状和体征较模型组有明显改善。

表1 引物序列
3.2 当归多糖对DN小鼠肾功能的影响
如表2所示,与对照组比较,模型组U-ALB、SCr、BUN水平均明显升高(<0.01);与模型组比较,厄贝沙坦组和当归多糖高、中剂量组U-ALB、SCr、BUN水平均明显降低(<0.05、0.01),且呈剂量相关性。

表2 当归多糖对DN小鼠肾功能的影响(, n = 8)
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
3.3 当归多糖对DN小鼠肾脏病理变化的影响
如图1所示,对照组肾组织结构清晰完整,细胞大小均一,肾小管排列紧密,基底膜完整,未见炎性细胞浸润;与对照组比较,模型组肾小管壁出现大量空泡样变性,肾组织排列疏松,出现间隙,结构紊乱,肾小球出现萎缩,出现炎性细胞浸润;与模型组比较,厄贝沙坦组细胞排列紊乱,肾小管依然有较多空泡,且组织内有出血现象,肾小球基底膜损伤,肾小球萎缩;当归多糖各剂量组细胞排列逐渐紧密,空泡样变性明显减少,肾小管排列整齐,肾小球逐渐恢复大小,肾小管壁逐渐完整,出血现象减少,且呈剂量相关性。
3.4 当归多糖对DN小鼠肾组织LC3、p62、Nix蛋白表达的影响
如图2所示,与对照组比较,模型组小鼠肾组织LC3Ⅱ/LC3Ⅰ、Nix蛋白表达水平均显著升高(<0.01),p62蛋白表达水平显著降低(<0.01);与模型组比较,厄贝沙坦组和当归多糖高剂量组LC3Ⅱ/LC3Ⅰ蛋白表达水平显著降低(<0.01),厄贝沙坦组和当归多糖低、高剂量组Nix蛋白表达水平显著降低(<0.01),各给药组p62蛋白表达水平显著升高(<0.01)。
3.5 当归多糖对DN小鼠肾组织Drp1蛋白表达的影响
如图3所示,与对照组比较,模型组小鼠肾组织Drp1蛋白表达水平显著升高(<0.01);与模型组比较,厄贝沙坦组和当归多糖高、中剂量组Drp1蛋白表达水平显著降低(<0.01)。
3.6 当归多糖对DN小鼠肾组织AMPK、mTOR mRNA表达的影响
如表3所示,与对照组比较,模型组小鼠肾组织、mRNA表达水平均显著升高(<0.01);与模型组比较,各给药组小鼠肾组织、mRNA表达水平均显著降低(<0.01)。
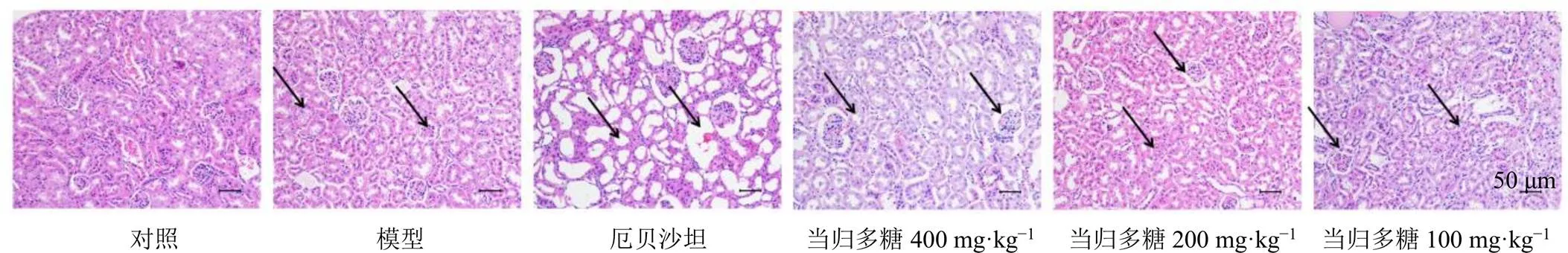
箭头表示肾细胞空泡样变性、肾小球萎缩、炎性细胞浸润

与对照组比较:##P<0.01;与模型组比较:**P<0.01,图3同

图3 当归多糖对DN小鼠肾组织Drp1蛋白表达的影响(, n = 3)
3.7 当归多糖对DN小鼠肾组织AMPK、mTOR蛋白表达的影响
如图4和表4所示,与对照组比较,模型组小鼠肾组织中AMPK、mTOR蛋白表达水平均显著升高(<0.01);与模型组比较,厄贝沙坦组和当归多糖中、高剂量组AMPK、mTOR蛋白表达水平均显著降低(<0.05、0.01)。

表3 当归多糖对DN小鼠肾组织AMPK和mTOR mRNA表达的影响(, n = 3)
4 讨论
自发性T2DM动物模型KK-Ay小鼠在8~20周龄中表现出DN,其肾小球的病理变化与人类DN的早期阶段一致[17],因此KK-Ay小鼠被认为是研究DN的合适动物实验模型。根据中医理论,气虚血瘀是DN的常见证型,随着病情的发展,会出现阴血亏虚、瘀血阻滞,因此,补血活血化瘀是中医治疗DN的关键。当归具有补血活血的功效,是治疗DN的常用中药。当归的活性成分当归多糖具有改善DN的疗效[18-19],但是具体机制并不完全清楚。在DN大鼠模型中,当归多糖可降低肾组织中炎性指标,改善DN[18]。石毅琼[19]发现当归多糖能抑制肾小管上皮细胞转分化的发生,通过降低转化生长因子-β1(transforming growth factor-β1,TGF-β1)/ Smads信号通路活性延缓糖尿病肾纤维化的发展。本研究结果显示,当归多糖能够降低KK-Ay小鼠U-ALB并改善了肾损伤,AMPK介导的线粒体自噬在KK-Ay小鼠的肾脏中被激活,给予当归多糖干预后线粒体自噬下调。
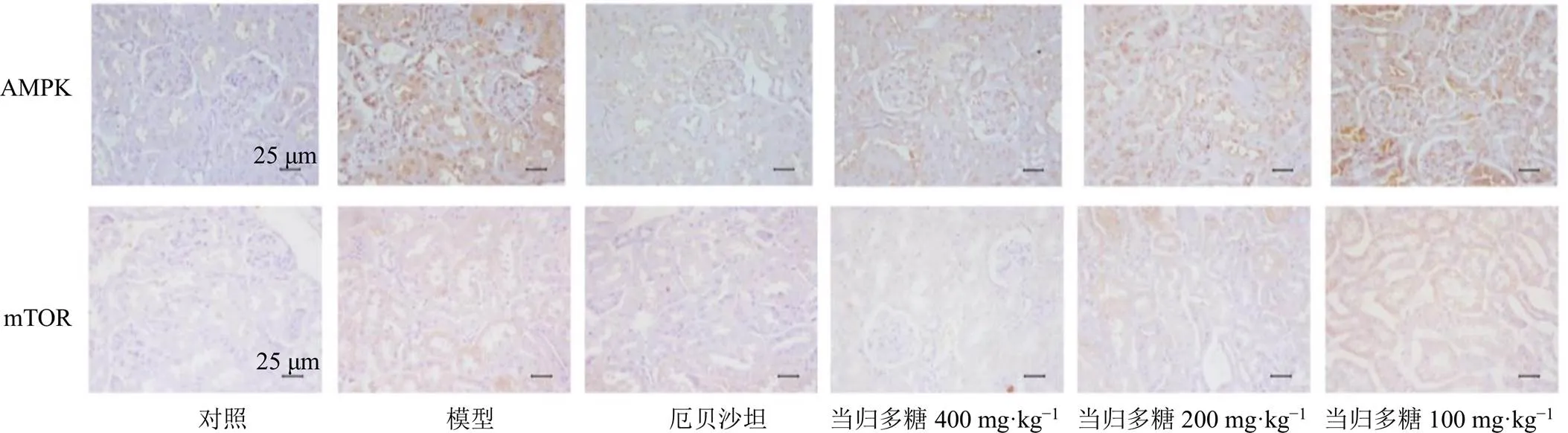
图4 当归多糖对DN小鼠肾组织AMPK和mTOR蛋白表达的影响(免疫组化,×400)

表4 当归多糖对DN小鼠肾组织AMPK和mTOR蛋白表达的影响(, n = 3)
越来越多的研究证明线粒体功能障碍会影响DN的发展[8]。线粒体不断通过裂变融合、生物发生及线粒体自噬保持动态平衡,其中线粒体自噬可以清除受损线粒体发挥着重要作用[20]。然而线粒体自噬是一把双刃剑,中度线粒体自噬可去除受损线粒体,减少细胞死亡和组织损伤,而线粒体自噬障碍或线粒体自噬过度都可引起细胞能量代谢紊乱,加重细胞凋亡[21],表明线粒体自噬过度对细胞是有害的。先前的研究报道DN的线粒体自噬状态并不一致。在链脲佐菌素诱导的糖尿病小鼠模型中,AMPK激动剂二甲双胍能通过p-AMPK/PINK1/Parkin通路激活线粒体自噬,改善肾小管间质纤维化[22],AMPK通路的激活会诱导线粒体自噬并促进线粒体裂变[23]。益气解毒方能够抑制DN大鼠模型的线粒体过度自噬[24],黄芪甲苷可以减轻PINK1/Parkin介导的肾小管上皮细胞线粒体自噬[25]。这些不同的结果也可能是受动物模型、用药剂量及实验周期等因素的影响,因此,还需进一步研究药物在不同的动物模型或其他条件下对线粒体自噬水平的影响,观察这种变化对DN是有益还是有害。
AMPK充当细胞的能量传感器,是线粒体生物发生的关键调节剂,其激活会促进线粒体自噬。AMPK与下游分子协同作用在线粒体自噬中发挥着重要作用,mTOR是AMPK的关键下游靶点,是自噬的负调节因子[26]。LC3和p62是重要的自噬标记蛋白。p62通过与LC3结合,诱导自噬体形成,从而吞噬并清除受损线粒体,p62水平与自噬通量成反比。当自噬体形成时,胞质蛋白LC3I通过酶水解转化为LC3Ⅱ,LC3Ⅱ的升高代表自噬的开始[27],因此LC3Ⅱ/LC3Ⅰ值的大小可估计自噬水平的高低。Nix是一种线粒体自噬受体蛋白,能够与LC3蛋白结合诱导线粒体自噬的发生[28],线粒体自噬随着Nix的增加而增强。线粒体裂变是线粒体自噬的先决条件,通过将线粒体分裂成易于自噬体吞噬的片段,然后将其包裹在自噬囊泡中[29],促进线粒体自噬清除受损线粒体[30]。Drp1是线粒体裂变的主要调控因子,促进Drp1表达有助于线粒体裂变[31],线粒体裂变过多是糖尿病肾脏中线粒体功能障碍的特征之一,其过程对肾脏有害。Drp1过表达不仅增加了线粒体裂变,而且加速了线粒体自噬通量,线粒体裂变和线粒体自噬之间具有相互正向作用[32],线粒体裂变可以诱导线粒体自噬发生,因此在本实验中研究了线粒体裂变。
本研究结果显示,线粒体裂变调节因子Drp1在模型组小鼠肾脏的表达显著上调,在当归多糖组的表达显著降低,这表明当归多糖抑制了DN小鼠的线粒体分裂。与模型组相比,当归多糖组小鼠肾脏的线粒体自噬相关蛋白LC3、Nix的表达明显下降,p62的表达明显增加,AMPK、mTOR蛋白及mRNA的表达下降,其中当归多糖高剂量组疗效最佳,表明当归多糖抑制了DN小鼠的线粒体自噬。mTOR是AMPK的下游靶点,AMPK能够抑制mTOR的活性从而激活自噬,而在本研究结果中发现,AMPK并没有抑制mTOR活性,因此推断当归多糖可能不是通过AMPK/mTOR信号轴调节线粒体自噬,而是通过抑制AMPK通路及其他下游分子来减轻线粒体自噬。线粒体裂变对线粒体自噬具有正向作用,当归多糖可能是通过抑制小鼠肾脏的线粒体裂变进一步减轻线粒体自噬,两者之间的相互作用还需进一步研究。本研究还存在许多不足,可以在后续研究中,通过体外实验观察当归多糖对DN小鼠肾小管上皮细胞的影响及线粒体自噬的动态变化,研究AMPK信号通路的其他信号轴及靶蛋白,确定调节线粒体自噬的具体信号通路。通过这些实验,进一步验证当归多糖是否通过体内AMPK信号通路调节线粒体自噬,明确当归多糖防治DN的具体分子机制。
综上,当归多糖改善了KK-Ay小鼠的DN,这可能与抑制AMPK介导的线粒体自噬有关。本研究揭示了当归多糖对KK-Ay小鼠T2DM模型中AMPK介导的线粒体自噬调节作用。然而,当归多糖如何调节线粒体自噬及线粒体自噬如何促进糖尿病肾病还需要进一步的研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Valencia W M, Florez H. How to prevent the microvascular complications of type 2 diabetes beyond glucose control [J]., 2017, 356: i6505.
[2] GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017 [J]., 2020, 395(10225): 709-733.
[3] Xue R, Gui D K, Zheng L Y,. Mechanistic insight and management of diabetic nephropathy: Recent progress and future perspective [J]., 2017, 2017: 1839809.
[4] Sui Y, Liu W J, Tian W,. A branched arabinoglucan fromameliorates diabetic renal damage in rats [J]., 2019, 33(3): 818-831.
[5] Forbes J M. Mitochondria-power players in kidney function? [J]., 2016, 27(7): 441-442.
[6] Bhargava P, Schnellmann R G. Mitochondrial energetics in the kidney [J]., 2017, 13(10): 629-646.
[7] Wei P Z, Szeto C C. Mitochondrial dysfunction in diabetic kidney disease [J]., 2019, 496: 108-116.
[8] Bravo-San Pedro J M, Kroemer G, Galluzzi L. Autophagy and mitophagy in cardiovascular disease [J]., 2017, 120(11): 1812-1824.
[9] Zhang X F, Feng J, Li X,. Mitophagy in diabetic kidney disease [J]., 2021, 9: 778011.
[10] Liu B H, Cao Y W, Wang D J,. Zhen-Wu-Tang induced mitophagy to protect mitochondrial function in chronic glomerulonephritis via PI3K/AKT/mTOR and AMPK pathways [J]., 2021, 12: 777670.
[11] Novak I. Mitophagy: A complex mechanism of mitochondrial removal [J]., 2012, 17(5): 794-802.
[12] Herzig S, Shaw R J. AMPK: Guardian of metabolism and mitochondrial homeostasis [J]., 2018, 19(2): 121-135.
[13] Iorio R, Celenza G, Petricca S. Mitophagy: Molecular mechanisms, new concepts on Parkin activation and the emerging role of AMPK/ULK1 axis [J]., 2021, 11(1): 30.
[14] 常智跃. 降糖消渴颗粒对自发性糖尿病KKAy小鼠肾脏保护作用及机制研究 [D]. 北京: 北京中医药大学, 2017.
[15] 傅亮. 从线粒体—内质网偶联角度探讨肾气丸对糖尿病肾病的干预作用 [D]. 北京: 北京中医药大学, 2020.
[16] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算 [J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[17] Ito T, Tanimoto M, Yamada K,. Glomerular changes in the KK-Ay/Ta mouse: A possible model for human type 2 diabetic nephropathy [J]., 2006, 11(1): 29-35.
[18] 白宇, 杨丽霞, 贺云, 等. 当归多糖通过TLR4/NF-κB信号通路对糖尿病肾病大鼠的影响 [J]. 中成药, 2021, 43(3): 755-760.
[19] 石毅琼. 基于TGF-β1/Smads信号通路探讨当归多糖干预糖尿病肾病的作用机制 [D]. 兰州: 兰州大学, 2018.
[20] Ni H M, Williams J A, Ding W X. Mitochondrial dynamics and mitochondrial quality control [J]., 2015, 4: 6-13.
[21] Dai W N, Lu H C, Chen Y Y,. The loss of mitochondrial quality control in diabetic kidney disease [J]., 2021, 9: 706832.
[22] Han Y C, Tang S Q, Liu Y T,. AMPK agonist alleviate renal tubulointerstitial fibrosis via activating mitophagy in high fat and streptozotocin induced diabetic mice [J]., 2021, 12(10): 925.
[23] Seabright A P, Fine N H F, Barlow J P,. AMPK activation induces mitophagy and promotes mitochondrial fission while activating TBK1 in a PINK1-Parkin independent manner [J]., 2020, 34(5): 6284-6301.
[24] 孙敏, 顾俊菲, 封亮. 益气解毒方对糖尿病肾病大鼠肾小管上皮细胞线粒体自噬作用机制 [J]. 中国实验方剂学杂志, 2017, 23(2): 109-114.
[25] 刘新辉. 黄芪甲苷对高糖诱导肾小管上皮细胞凋亡及线粒体自噬相关蛋白表达的影响 [J]. 广州中医药大学学报, 2019, 36(2): 251-255.
[26] Kaushal G P, Chandrashekar K, Juncos L A. Molecular interactions between reactive oxygen species and autophagy in kidney disease [J]., 2019, 20(15): 3791.
[27] Wang X, Zhang J Q, Xiu C K,. Ginseng-Sanqi-Chuanxiong (GSC) extracts ameliorate diabetes-induced endothelial cell senescence through regulating mitophagy via the AMPK pathway [J]., 2020, 2020: 7151946.
[28] Novak I, Kirkin V, McEwan D G,. Nix is a selective autophagy receptor for mitochondrial clearance [J]., 2010, 11(1): 45-51.
[29] Twig G, Elorza A, Molina A J,. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy [J]., 2008, 27(2): 433-446.
[30] Burman J L, Pickles S, Wang C X,. Mitochondrial fission facilitates the selective mitophagy of protein aggregates [J]., 2017, 216(10): 3231-3247.
[31] Hu C X, Huang Y, Li L J. Drp1-dependent mitochondrial fission plays critical roles in physiological and pathological progresses in mammals [J]., 2017, 18(1): 144.
[32] Kobayashi S, Zhao F, Zhang Z,. Mitochondrial fission and mitophagy coordinately restrict high glucose toxicity in cardiomyocytes [J]., 2020, 11: 604069.
Effect ofpolysaccharides on AMPK signaling pathway and mitochondrial autophagy in kidney of diabetic nephropathy KK-Ay mice
WANG Jiang-xia1, YANG Li-xia2, MI Deng-hai2, WEI Rui-xian1, CUI Yang-yang1, MA Xian-kang1
1. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China 2. Gansu Province Academy of Chinese Medicine, Lanzhou 730050, China
To study the effects ofpolysaccharides (ASP) on AMP activated protein kinase (AMPK) signaling pathway and mitochondrial autophagy in kidney of KK-Ay mice with diabetes nephropathy (DN).SPF male KK-Ay mice were fed with high sugar and high fat diet and randomly divided into model group, irbesartan (25 mg/kg) group, ASP high-, medium-, and low-dose (400, 200, 100 mg/kg) groups, with 10 mice in each group, 10 male C57BL/6J mice were used as control group. Drugs were given for intervention for four weeks, the general condition of mice was observed, body weight and blood sugar were measured weekly; After the last administration, blood was taken from heart and mice were euthanized. Serum was separated and tested for urinary microalbuminuria (U-ALB), creatinine (SCr), and urea nitrogen (BUN); Pathological changes of renal tissue was observed by hematoxylin eosin (HE) staining; Western blotting was used to detect the expressions of mitochondrial autophagy related proteins [microtubule associated protein 1 light chain 3 (LC3), p62, Nix] and mitochondrial fission protein [mitochondrial related protein 1 (Drp1)] in renal tissue; Immunohistochemical method was used to detect the expressions of AMPK and mammalian target of rapamycin (mTOR) protein in renal tissue; The expressions ofandmRNA in renal tissue were detected by qRT-PCR.Compared with model group, levels of U-ALB, SCr and BUN in each treatment group were significantly reduced (< 0.05, 0.01), showing a dose-dependent relationship; The pathological changes of renal tissue was improved; The expression levels of mitochondrial autophagy related proteins LC3II/LC3I and Nix in renal tissue were significantly reduced (< 0.01), while the expression level of p62 protein was significantly increased (< 0.05); The expression of mitochondrial fission protein Drp1 was downregulated (< 0.01); AMPK, mTOR protein and mRNA expressions were significantly downregulated (< 0.05, 0.01).ASP can improve renal injury in DN mice and delay the progression of DN. Its mechanism is related to the inhibition of AMPK signaling pathway mediated mitochondrial autophagy.
polysaccharides; diabetic nephropathy; KK-Ay mice; mitochondrial autophagy; AMP-activated protein kinase signaling pathway
R285.5
A
0253 - 2670(2023)10 - 3189 - 08
10.7501/j.issn.0253-2670.2023.10.016
2022-12-06
陇药大品种二次开发及临床疗效评价行业技术中心(2019);甘肃省省属科研院所条件建设专项(20JR10RA432)
王江侠(1997—),女,硕士研究生,研究方向为中医药防治糖尿病。Tel: 15179112512 E-mail: 2605469879@qq.com
杨丽霞(1979—),女,博士,主任医师,硕士生导师,研究方向为中医药防治糖尿病。E-mail: yanglixia-415@163.com
[责任编辑 李亚楠]
