白芍总苷对胶原诱导性关节炎大鼠长期给药的组织分布研究
2023-05-20宋志敏韩雅馨龚慕辛
马 喆,宋志敏#,韩雅馨,龚慕辛,仇 峰,李 静,贺 蕊
白芍总苷对胶原诱导性关节炎大鼠长期给药的组织分布研究
马 喆1, 2,宋志敏1, 2#,韩雅馨1, 2,龚慕辛1, 2*,仇 峰1, 2,李 静1, 2,贺 蕊1, 2
1. 首都医科大学中医药学院,北京 100069 2. 中医络病研究北京市重点实验室,北京 100069
研究白芍总苷的主要成分芍药苷、芍药内酯苷对胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠长期给药后的组织分布。建立超高效液相色谱串联质谱(UPLC-MS/MS)法,测定白芍总苷长期给药后大鼠心、肝、脾、肺、肾、小肠、胸腺、滑膜等组织中芍药苷和芍药内酯苷的分布情况。长期给药后,芍药苷和芍药内酯苷主要分布于小肠和肾,其次为脾、胸腺、滑膜、肝、肺、心。2种成分在CIA大鼠中的组织分布大多低于正常大鼠。揭示了白芍总苷长期给药后的组织分布特征,为探讨白芍总苷治疗类风湿性关节炎的靶器官以及疗效的改进提供了参考。
白芍总苷;胶原诱导性关节炎;组织分布;芍药苷;芍药内酯苷
类风湿性关节炎(rheumatoid arthritis,RA)是一种以多关节慢性炎性持续反复发作为特点的慢性、炎性、多系统性自身免疫性疾病,目前具体机制依然不清,尚无理想治疗手段[1]。白芍总苷是从白芍Pall.根部提取的有效成分,其主要成分为芍药苷、芍药内酯苷等单萜苷类成分[2-3],作为抗炎免疫调节药在临床上应用广泛,治疗RA具有疗效确切、耐受性好、不良反应少、适合长期应用的优点,但也存在起效慢、疗效个体差异大的问题[4-6]。为了明确白芍总苷的作用机制与直接起效物质,目前国内外学者对白芍总苷相关成分及其制剂的作用机制以及白芍总苷给药后的体内过程和代谢产物进行了大量研究[7-13],取得了许多有价值的研究成果。然而,与临床上白芍总苷治疗RA长期用药的情况不同,目前对其体内过程研究多为单次给药或短期给药,缺乏白芍总苷长期给药后的组织分布研究。此外,已有针对白芍总苷药动学研究多采用正常动物,在模型动物中的研究很少。而据报道,白芍总苷在佐剂性关节炎模型大鼠和正常大鼠中的药动学行为存在显著差异[12]。为了探讨白芍总苷长期给药的药动学特征,以及与起效靶点、作用机制之间的关系,本研究在前期工作基础上,建立了超高效液相色谱串联质谱(UPLC-MS/MS)法,进一步模拟临床给药方案,测定白芍总苷长期给药后在胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠和正常大鼠的心、肝、脾、肺、肾等主要脏器以及小肠、胸腺、滑膜等免疫器官和主要病变组织中芍药苷和芍药内酯苷的组织分布,为探讨其起效部位和作用机制提供参考。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(220±20)g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2015-0001。动物饲养于首都医科大学实验动物中心屏障环境内,室温22~24 ℃,相对湿度55%~60%,每日光照12 h,自由饮水,实验前适应性饲养7 d。伦理审查经首都医科大学实验动物伦理委员会批准(批准号AEEI-2014-128)。
1.2 药品与试剂
白芍总苷胶囊(帕夫林,国药准字H20055058,批号210502)购自宁波立华制药有限公司,内容物0.3 g/粒,含有37.98%芍药苷、11.70%芍药内酯苷;对照品芍药苷(批号PS161215-02,质量分数≥95%)、芍药内酯苷(批号PS010200,质量分数>97.5%)购自成都普思生物科技股份有限公司;内标物盐酸丁螺环酮(批号6-EOD-111-1,质量分数>98.0%)购自TRC公司;色谱级甲醇、乙腈、甲酸均购自美国Thermo Fisher Scientific公司;分析纯乙酸铵(批号631618,质量分数>98.0%)购自天津市致远化学试剂有限公司;娃哈哈纯净水购自杭州娃哈哈有限公司;牛源性Ⅱ型胶原蛋白(批号160425)、完全弗氏佐剂(批号160410)、不完全弗氏佐剂(批号160417)均购自美国Chondrex公司;EDTA脱钙液(批号E1171)购自北京索莱宝科技有限公司;苏木素-伊红(HE)染液(批号G1005)、柠檬酸(pH 6.0)抗原修复液(批号G1202)、牛血清白蛋白(bovine serum albumin,BSA,批号G5001)、血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(批号GB11034)、组化试剂盒DAB显色剂(批号G1211)购自武汉赛维尔生物科技有限公司;中性树胶(批号10004160)购自国药集团化学试剂有限公司;二抗(批号K5007)购自DAKO公司。
1.3 仪器
1290 Inifinity型超高效液相色谱仪,配有G4220A泵、G1316C柱温箱、G4226A进样器、G1330B恒温器(美国安捷伦公司);QTRAP 6500型三重四极杆串联液质联用仪(UPLC-MS/MS),ESI源-电喷雾离子源,Analyst质谱工作站软件(美国Applied Biosystems公司);MG-2200型氮吹仪(日本Eyela公司);3K15型离心机(美国Sigma公司);SI-T246型漩涡振荡仪(美国Spectral Instruments公司);PRO200型精密匀浆器(美国PRO Scientific公司);超低温冰箱(美国Fisher Thermo Scientific公司);DV215CD型1/10万电子天平(上海奥豪斯公司);Matrx VMR小动物气体麻醉机(美国MIDMARK公司)。
2 方法
2.1 CIA大鼠模型的建立
依据课题组前期建立的方法造模[14]。将牛II型胶原与完全弗氏佐剂按1∶1比例混合乳化完全,并将0.1 mL该乳液皮内注射于大鼠尾部距离尾根部1.5 cm处。21 d后,将牛II型胶原与与不完全弗氏佐剂按1∶1比例混合乳化完全,将0.1 mL该乳液皮内注射于大鼠尾部距离尾根部1.5 cm处。根据足部红斑和肿胀对关节炎的程度进行评分,4个足爪的累计积分为关节炎指数(arthritis index,AI)。在造模第28天,AI≥4的大鼠视为造模成功。
2.2 动物分组和给药
将正常大鼠随机分为正常组和白芍总苷低、高剂量(158、474 mg/kg)组,每组12只。并将CIA大鼠随机分为CIA组和CIA+白芍总苷低、高剂量(158、474 mg/kg)组,每组12只。各给药组连续ig白芍总苷胶囊内容物28 d,末次给药后15 min、30 min、4 h、24 h记录大鼠体质量并收集心、肝、脾、肺、肾、小肠、胸腺、滑膜组织样品,用生理盐水冲洗血渍并用滤纸吸去多余水分,记录新鲜、干净的各组织质量,通过器官质量与体质量的比值计算器官指数。取动物的后爪,储存在10%中性福尔马林中。
2.3 HE染色观察踝关节病理变化
大鼠后爪在10%中性福尔马林中固定48 h后,用20% EDTA脱钙至骨软化,乙醇脱水,石蜡包埋,然后沿纵轴切片,进行HE染色,于光学显微镜下观察并拍照。
2.4 免疫组化检测滑膜中VEGF表达
滑膜组织用10%中性福尔马林固定后,乙醇脱水,石蜡包埋,用3% H2O2孵育,置于枸橼酸缓冲液中微波抗原修复。BSA封闭后,分别用VEGF抗体和二抗孵育,DAB显色。切片用苏木精复染细胞核,中性树胶密封并扫描。用Image Pro Plus 6.0软件对图像进行处理,随机计量5个视野的阳性颗粒总量,取平均值进行统计。
2.5 色谱条件
Waters Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸和0.1%乙酸铵的水溶液(A)-含0.1%甲酸的乙腈溶液(B),梯度洗脱:0~1 min,80% A;1~2 min,80%~60% A;2~4 min,60% A;4~4.5 min,60% A~100% B;4.5~6.5 min,100% B;柱温25 ℃;体积流量0.3 mL/min;进样体积1 μL。
2.6 质谱条件
采用电喷雾离子源,正离子模式检测,多反应离子检测模式(MRM)扫描;气帘气压力40 psi(1 psi=6.895 kPa);喷雾电压3000 V;离子源温度120 ℃;雾化气压力55 psi;辅助气压力55 psi;射入电压10 V;碰撞室射出电压13 V;2种成分及内标物的质谱工作参数见表1。

表1 LC-MS/MS法测定白芍总苷中2种成分以及内标物的质谱工作参数
2.7 对照品溶液制备
精密称取芍药内酯苷、芍药苷对照品适量,加入甲醇制成每种成分为10 μg/mL的混合对照品储备溶液,−20 ℃保存,备用。取混合对照品储备液适量,加色谱甲醇逐级稀释成0.016、0.040、0.080、0.200、0.400、1.00、2.00、5.00、10.0 μg/mL或0.05、0.10、0.20、0.50、1.00、2.00、5.00、8.00、10.0、20.0、30.0、40.0、50.0 μg/mL的系列混合标准工作溶液。精密称取适量盐酸丁螺环酮,用甲醇-乙腈(1∶1)溶液制成丁螺环酮质量浓度为0.05 μg/mL的内标溶液。
2.8 组织样品制备
精密称定各种组织0.5 g,加入3倍量预冷的生理盐水,冰水浴匀浆,4 ℃、5000 r/min离心15 min,取上清液为组织样品匀浆液。精密吸取100 μL匀浆液,依次加入10 μL甲醇、200 μL质量浓度为0.05 μg/mL的丁螺环酮甲醇-乙腈(1∶1)溶液,涡旋混合1 min,4 ℃、14 000 r/min离心10 min,吸出上清液并氮气吹干,临检测时加入100 μL甲醇,超声5 min并涡旋1 min复溶,4 ℃、14 000 r/min离心10 min,吸出上清液进样分析。
滑膜质地较坚韧且质量过小,单个大鼠滑膜不足0.02 g,因此精确称取滑膜,加入30倍量预冷的生理盐水,冰浴匀浆。所得匀浆按照上述方法进行处理。
2.9 统计学分析

匀浆=样品
组织=匀浆×匀浆/组织
为体积
3 结果
3.1 白芍总苷对CIA模型大鼠的药效学研究
3.1.1 白芍总苷对CIA大鼠AI的影响 正常组大鼠足部无明显红斑和肿胀(AI=0)。与正常组比较,CIA组大鼠在造模后第14天时足部红斑和肿胀程度增加(AI=6.34±0.14),在第28天关节炎指数进一步增加(AI=9.63±0.14,<0.01)。CIA+白芍总苷低、高剂量组大鼠足部虽也有红斑和肿胀,但与CIA组比较,在第14天(CIA+白芍总苷低剂量组AI=4.37±0.18,CIA+白芍总苷高剂量组AI=3.87±0.24)和第28天(CIA+白芍总苷低剂量组AI=5.99±0.26,CIA+白芍总苷高剂量组AI=4.55±0.46)时AI显著降低(<0.01),说明白芍总苷能改善CIA大鼠关节炎程度。
3.1.2 白芍总苷对大鼠胸腺和脾脏指数的影响 如图1所示,与正常组比较,白芍总苷低、高剂量组和CIA组脾脏指数显著升高(<0.05、0.01);与CIA组比较,CIA+白芍总苷低剂量组脾脏指数显著降低(<0.01),说明白芍总苷对CIA大鼠脾脏指数的影响可能与给药剂量有关,不同剂量白芍总苷的影响可能不同。本研究未观察到白芍总苷对正常和CIA大鼠胸腺指数的影响,但在课题组前期研究中发现白芍总苷给药12周后可降低大鼠胸腺指数[13],可能与本研究给药时间短有关。
3.1.3 白芍总苷对大鼠踝关节病理和滑膜中VEGF表达的影响 如图2-A所示,CIA组关节面软骨被侵蚀,滑膜组织增生,表明模型组大鼠造模成功;白芍总苷可以保护关节软骨,抑制滑膜组织增生。如图2-B、C所示,正常组大鼠膝关节滑膜有少量的VEGF阳性细胞表达,CIA组VEGF表达显著升高(<0.01);与CIA组比较,CIA+白芍总苷低、高剂量组VEGF表达显著降低(<0.01)。说明CIA大鼠滑膜中VEGF表达明显增加,白芍总苷可以明显抑制其增加。药效学实验证明CIA大鼠造模成功且白芍总苷对CIA大鼠具有较好的疗效,为后续进行组织分布研究奠定了基础。
3.2 方法学考察
3.2.1 专属性 比较从6只不同大鼠获得的空白组织、加混合对照品及内标的空白组织、白芍总苷末次给药后24 h采集的体内组织样本的峰,空白大鼠组织匀浆中的内源物不干扰芍药内酯苷、芍药苷的测定,方法专属性良好,各组织色谱图见图3。

TGP-L-低剂量白芍总苷 TGP-H-高剂量白芍总苷 与正常组比较:*P<0.05 **P<0.01;与CIA组比较:▲▲P<0.01,图2同
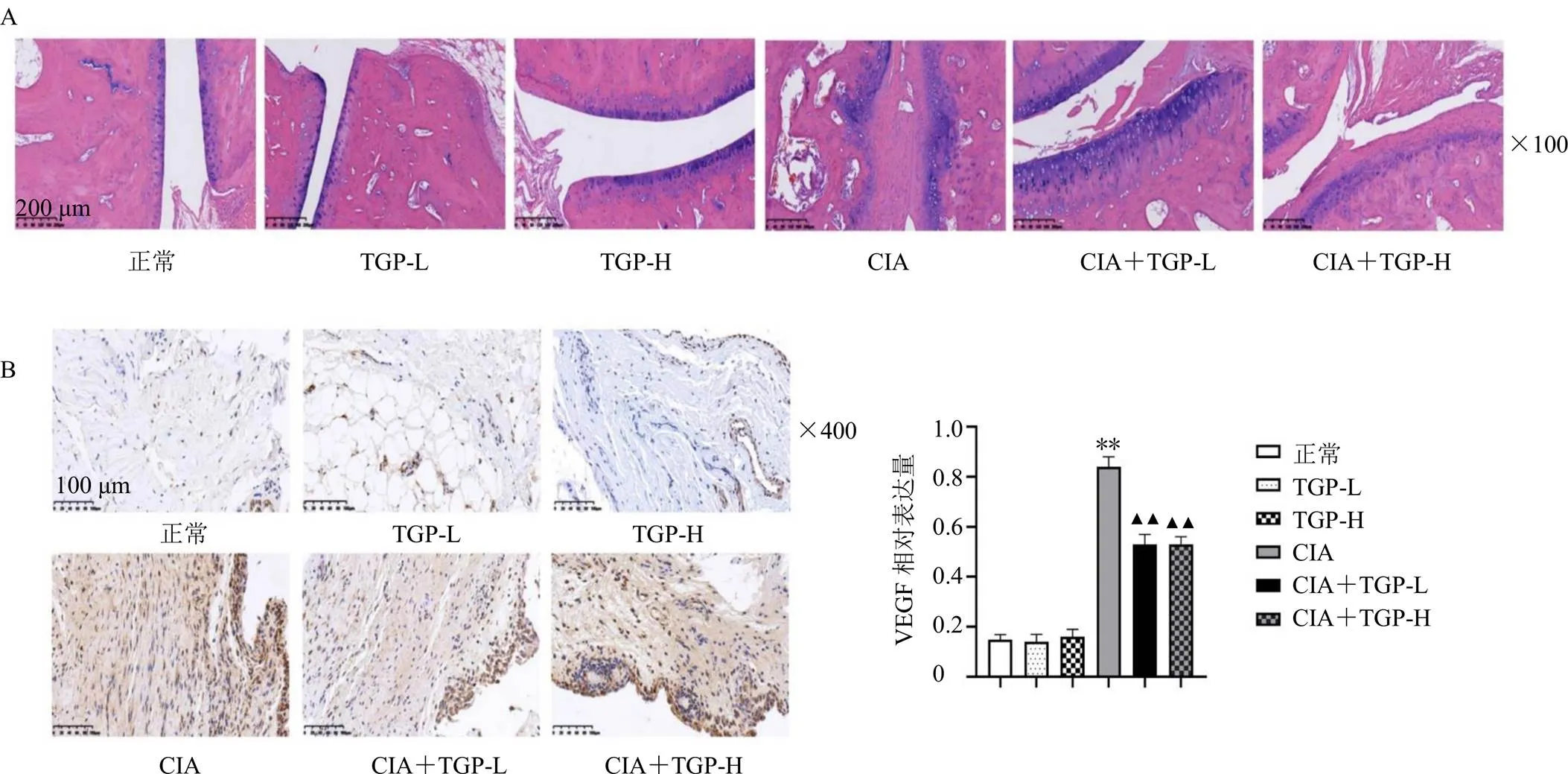
图2 白芍总苷对大鼠踝关节病理(A) 和滑膜中VEGF表达(B) 的影响(, n = 6)
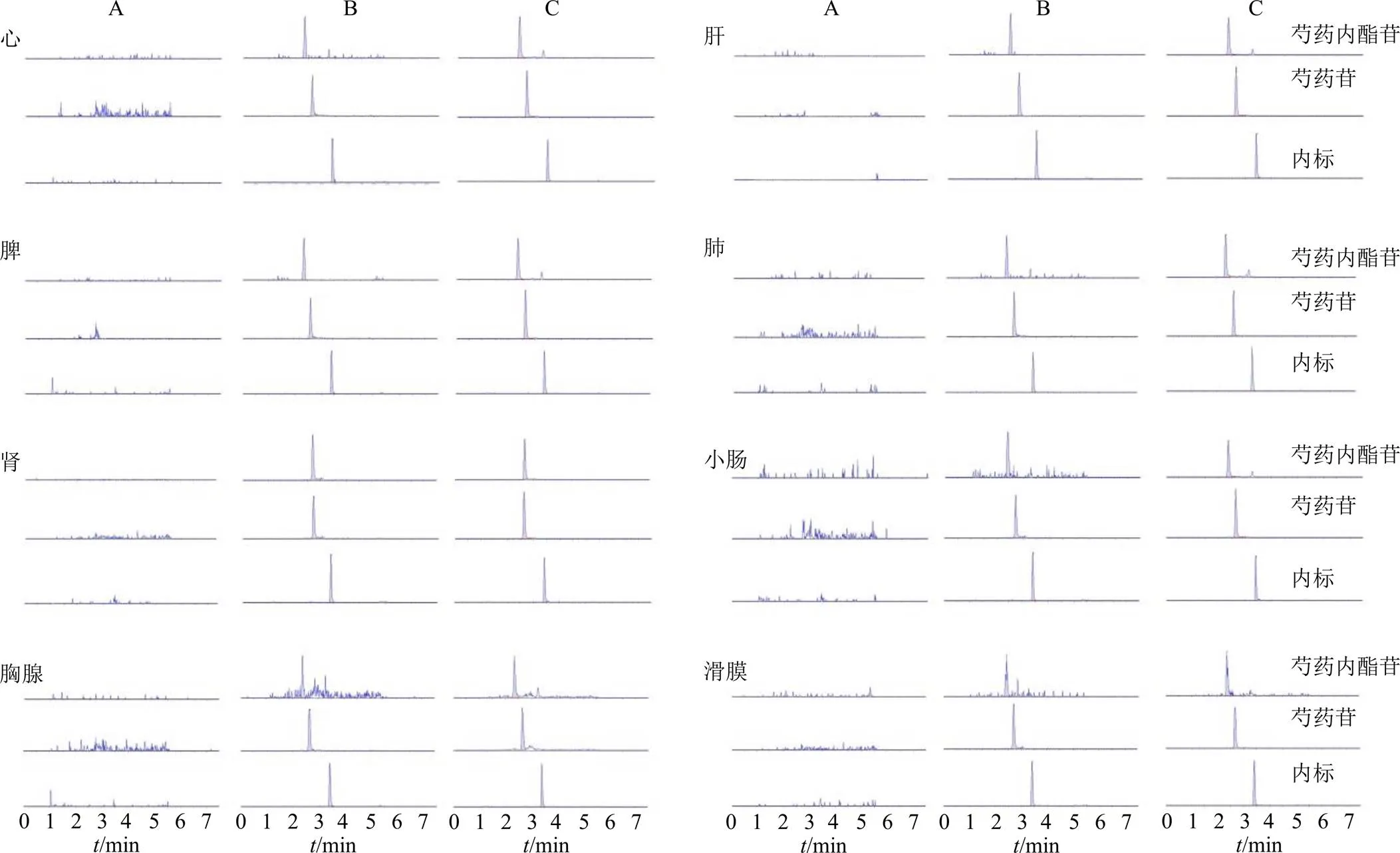
A-空白组织样本 B-添加了内标、芍药内酯苷、芍药苷的组织样本 C-末次给药24 h后的组织样本
3.2.2 标准曲线与线性范围 分别取心、脾、肺、小肠、胸腺、滑膜空白组织匀浆液100 μL,再分别加入10 μL不同浓度的系列混合标准溶液和200 μL质量浓度为50 ng/mL的丁螺环酮甲醇-乙腈(1∶1)溶液,其余操作按照“2.8”项下处理,配制成待测成分为1.60、4.00、8.00、20.0、40.0、100、200、500、1000 ng/mL的系列组织样品;再分别取肝、肾空白组织匀浆液100 μL,按照上述方法配制成待测成分为5.00、10.0、20.0、50.0、100、200、500、1000、2000、5000 ng/mL的系列组织样品,以待测物浓度为横坐标(),待测物与内标物丁螺环酮的峰面积比值为纵坐标(),以加权最小二乘法作线性回归,芍药内酯苷的权重为1/2,芍药苷的权重为1/。各组织中各成分的回归方程见表2。

表2 白芍总苷在不同组织中的线性回归方程与线性范围
3.2.3 精密度和准确度 按“3.2.2”项下方法操作,分别制备心、脾、肺、小肠、胸腺、滑膜含芍药苷、芍药内酯苷的低、中、高质量浓度的质控样品(4.00、40.0、800 ng/mL)和肝、肾含芍药苷、芍药内酯苷的低、中、高质量浓度的质控样品(5.00、200、5000 ng/mL),每个浓度制备的6个样品来自不同供体。连续进样3 d,记录2种成分的色谱峰面积和内标峰面积的比值,代入随行标准曲线算出相应的浓度,计算批内精密度、批间精密度及准确度。各成分在组织中精密度和准确度测定结果见表3。可见低、中、高3个质量浓度下2种成分在相应组织的精密度和准确度均小于15%,符合生物样品检测的要求。
表3 采用LC-MS/MS法测定不同组织中成分的精密度和准确度(, n = 6)
3.2.4 稳定性 取空白匀浆液100 μL,按“3.2.2”项下方法操作,分别配制低、中、高浓度的质量控制样品,每个浓度制备5个样品。在室温放置24 h后进样,考察室温下样品稳定性。样品预处理后于−80 ℃冰箱中冻存,然后取出室温下解冻,如此反复冻融3次后进样分析,考察3次冻融后的稳定性;样品预处理后于−80 ℃冰箱冻存30 d后进样分析,考察长期冻存稳定性。如表4所示,在3种考察条件下,低、中、高3个质量浓度不同成分在相应组织的精密度和准确度均小于15%,在所考察条件下稳定性良好。
3.2.5 提取回收率与基质效应 取空白匀浆液100 μL,按“3.2.2”项下方法操作,分别配制低、中、高质量浓度的质控样品,每个质量浓度分别使用来自不同供体的6个空白组织,处理后进样分析获得相应峰面积值均值(1)。
表4 采用LC-MS/MS法测定各组织中成分的稳定性考察(, n = 5)
另取空白匀浆液100 μL,加入10 μL甲醇、200 μL甲醇-乙腈(1∶1)溶液,制备得到不含内标的空白溶液,离心后获得上清液,氮气吹干,加入10 μL甲醇、200 μL内标溶液,制成低、中、高3个质量浓度的未经提取的对照样品,每个质量浓度分别使用来自不同供体的6个空白组织,处理后进样分析获得相应峰面积值均值(2)。
取不同质量浓度的标准溶液加入内标溶液,氮气吹干后用甲醇稀释成低、中、高3个质量浓度的标准对照样品,每质量浓度制备6个样品,获得相应峰面积均值(3)。以1/2计算提取回收率,2/3计算基质效应。如表5所示,化合物的提取回收率为89.57%~117.24%,化合物的基质效应为88.45%~109.24%,说明该方法是稳定和可行的。
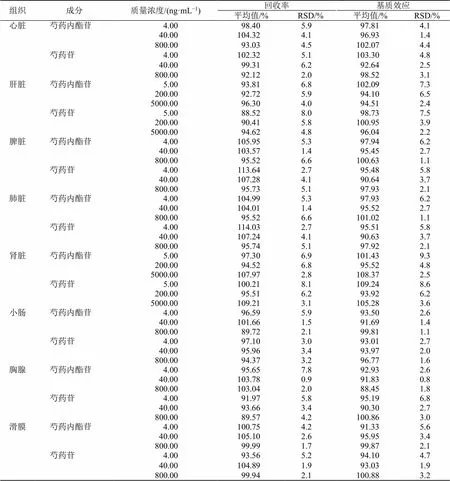
表5 不同组织中2种成分的基质效应和提取回收率 (n = 6)
3.3 组织分布研究
如表6所示,白芍总苷给药后在体内迅速分布,在30 min之内各组织芍药内酯苷、芍药苷含量达到峰值,说明这2种成分吸收较快,能够迅速达到各个组织,而在给药24 h后含量较少,说明其代谢速度较快,不易在体内蓄积。对比各组织之间成分含量可以发现,芍药内酯苷、芍药苷在小肠中的含量远高于其他各组织,肾脏中芍药内酯苷、芍药苷含量仅次于小肠,肾脏中的含量高这一结果从侧面说明了白芍总苷在大鼠体内消除快且滞留时间短。脾脏中芍药内酯苷、芍药苷含量也相对较高,结合药效学研究结果可以发现,白芍总苷给药后可以降低CIA大鼠脾脏系数,加之本实验发现不同剂量给药后芍药内酯苷和芍药苷在CIA大鼠脾脏内的消除速度均较正常动物慢,这说明CIA大鼠白芍总苷多剂量给药后芍药内酯苷和芍药苷能更快地分布到脾脏,且在脾脏停留更长时间。而其他组织中芍药内酯苷、芍药苷含量相对较低,对比给药白芍总苷后芍药内酯苷、芍药苷含量可见各组织在同一时间点正常组和模型组大鼠存在一定差异,说明病理状态对大鼠的器官造成了一定的影响,从而影响了组织分布情况。
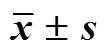
表6 大鼠给药后组织分布(, n = 3)
续表6

组织成分分组质量分数/(ng·g−1) 15 min30 min4 h24 h 肾脏芍药内酯苷TGP-L3 638.70±692.091 131.21±606.08357.32±39.60ND CIA+TGP-L1 765.04±756.90*2 101.02±938.09910.43±218.09*80.01±13.83** TGP-H1 412.08±435.55**4 013.00±1 838.492 743.34±390.07**52.40±6.72** CIA+TGP-H2 539.09±1 031.435 002.06±757.33Δ1 678.27±302.48Δ#ND 芍药苷TGP-L13 726.99±1 877.344 328.29±1 912.092 089.05±539.0943.30±13.84 CIA+TGP-L8 303.57±2 724.78*7 915.06±775.41*757.00±75.40*92.21±15.14* TGP-H4 169.34±566.43**10 582.00±1 423.33**3 471.21±697.0760.72±24.31 CIA+TGP-H2 256.42±884.00Δ#14 772.48±2 210.00ΔΔ4 470.42±831.07ΔND 小肠芍药内酯苷TGP-L3 602.34±434.633 298.04±589.67305.08±124.0063.14±33.60 CIA+TGP-L1 975.70±491.971 887.16±541.39171.35±9.1076.77±37.84 TGP-H16 078.11±6 978.84**3 668.88±1 496.90381.01±67.9047.94±5.92 CIA+TGP-H17 973.78±1 917.88ΔΔ6 790.90±2 569.20ΔΔ#650.71±202.10ΔΔ#32.53±12.14 芍药苷TGP-L13 882.43±3 389.9112 501.80±2 921.301 248.40±580.54204.64±122.60 CIA+TGP-L9 622.60±3 121.616 485.30±1 560.60289.00±48.51*205.79±78.23 TGP-H40 858.77±5 786.00**14 467.49±3 163.005 147.30±372.62**193.26±49.51 CIA+TGP-H47 087.90±3 287.20ΔΔ23 000.30±7 294.01ΔΔ#2 221.15±137.10ΔΔ##128.63±43.30 胸腺芍药内酯苷TGP-L785.34±192.40309.51±168.2135.29±15.5220.31±4.60 CIA+TGP-L600.28±172.87196.08±18.0233.12±9.7017.47±8.32 TGP-H1 443.20±293.52**222.77±27.83313.09±32.80**48.48±25.40 CIA+TGP-H1 087.40±81.37Δ226.99±67.01120.40±32.30ΔΔ##4.68±1.80 芍药苷TGP-L5 225.80±742.932 305.80±443.90269.38±60.1045.80±12.91 CIA+TGP-L2 678.60±712.70**1 308.40±71.70**229.79±7.30162.36±42.31** TGP-H6 702.81±1 175.761 541.20±322.20*1 537.72±327.54**254.67±32.21** CIA+TGP-H4 833.15±613.22Δ#1 855.50±44.30Δ638.24±152.42Δ##90.48±6.70Δ## 滑膜芍药内酯苷TGP-L63.60±28.81352.58±14.90308.43±163.33ND CIA+TGP-L279.30±31.51**417.40±65.20255.53±100.74ND TGP-H583.10±63.60**1 514.01±533.01**405.20±157.60ND CIA+TGP-H592.30±15.50ΔΔ466.20±76.13##635.40±183.42ΔND 芍药苷TGP-L537.10±114.702 752.96±435.201 523.80±349.84199.43±47.30 CIA+TGP-L1 035.89±109.00*1 458.38±110.502 020.21±458.31445.90±94.91** TGP-H2 533.00±347.50**5 198.80±1 812.40*1 760.52±128.52355.00±19.00** CIA+TGP-H2 399.91±111.30ΔΔ1 782.43±268.50##1 452.64±493.60180.20±20.22ΔΔ##
ND-未检测到;TGP-L-低剂量白芍总苷,TGP-H-高剂量白芍总苷 与TGP-L组比较:*<0.05**<0.01;与TGP-H组比较:#<0.05##<0.01;与CIA+TGP-L组比较:Δ<0.05ΔΔ<0.01
ND-no detected; TGP-L-low-dose total glucosides of paeony, TGP-H-high-dose total glucosides of paeony*< 0.05**< 0.01TGP-L group;#< 0.05##< 0.01TGP-H group;Δ< 0.05ΔΔ< 0.01CIA + TGP-L group
4 讨论
4.1 检测方法的优化
在正离子模式下分别对白芍总苷中2个组分进行检测,发现在流动相中加入可促进各组分电离的乙酸铵后响应更好,但含量较高时易析出沉淀,堵塞色谱柱及仪器管道,故选用0.1%乙酸铵。芍药苷浓度较高时,易残留在色谱柱中,可选用洗脱能力较强的乙腈,并增长洗针时间。同时在流动相中加入0.1%甲酸,可改善芍药苷拖尾的情况。
4.2 检测组织的选择
课题组前期研究表明,白芍总苷长期给药能降低CIA大鼠的胸腺(给药12周)、脾脏指数(给药8周),降低CIA大鼠VEGF的表达,减轻滑膜病变,同时发现白芍总苷可以显著降低CIA大鼠小肠组织的γ干扰素(interferon-γ,IFN-γ)含量,下调小肠分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)分泌,从而下调肠黏膜免疫应答,并可以纠正CIA大鼠与正常大鼠相比的肠道菌群紊乱,证明了白芍总苷对CIA大鼠的治疗作用可能与肠道有关。此外,还发现白芍总苷可以改变血中的免疫相关指标[14],胸腺和脾脏是重要的免疫器官[15],滑膜是类风湿关节炎的重要病变部位[16-17],肠道黏膜免疫在类风湿性关节炎的治疗中具有重要作用[18]。因此,本实验测定了心、肝、脾、肺、肾等主要脏器以及小肠、胸腺、滑膜等免疫器官和主要病变组织中的含量,以探究白芍总苷相关成分在正常和模型大鼠中的分布特征。
4.3 组织分布结果
本研究发现,白芍总苷中芍药内酯苷在CIA模型大鼠不同组织中的分布顺序为:肠>肾>脾>胸腺>肝>滑膜>肺>心,在正常大鼠不同组织中的分布顺序为:肠>肾>脾>滑膜>胸腺>肝>肺>心;白芍总苷中芍药苷在CIA模型大鼠不同组织中的分布顺序为:肠>肾>脾>胸腺>滑膜>肝>肺>心,在正常大鼠不同组织中的分布顺序为:肠>肾>脾>胸腺>滑膜>肺>肝>心。可见小肠组织芍药内酯苷和芍药苷含量均高于其他组织,结合课题组前期研究结果,进一步说明其可能是白芍总苷的主要作用部位。芍药内酯苷和芍药苷在肾脏中分布较多,这一结果侧面支持了白芍总苷在大鼠体内消除快且滞留时间短的结论[19]。而芍药内酯苷和芍药苷在心脏、肝脏、脾脏、肺、胸腺和滑膜中分布较少。
芍药内酯苷、芍药苷在正常大鼠胸腺中分布较CIA组多。低剂量给药时,芍药内酯苷、芍药苷在正常组小肠内的分布多于CIA组;高剂量给药时,芍药内酯苷、芍药苷在正常组滑膜内的分布多于CIA组,这些结果可能与P-糖蛋白(P-glycoprotein,P-gp)的外排有关,P-gp是一种能量依赖性药物外排泵,可以将细胞内的药物泵出细胞,从而降低细胞内的药物浓度[20]。P-gp主要分布于空肠绒毛的吸收细胞中,也存在于滑膜、脾脏、肺等组织中[21],CIA大鼠的滑膜、脾脏和肠道中P-gp的表达明显高于正常小鼠[22]。大多数文献证明芍药苷是P-gp的底物[23-25],有文献支持芍药内酯苷可能是P-gp的底物[26],也有学者认为芍药内酯苷可能不是P-gp的底物[27-28]。不同组织中P-gp含量和表达的差异可能是芍药内酯苷和芍药苷分布差异的原因之一。胸腺细胞中P-gp的活性和水平随着胸腺细胞的成熟和CD3表达的增加而增加[29],而类风湿性关节炎可导致CD3水平升高[30],因此P-gp的活性水平在模型组胸腺中可能高于正常组。值得注意的是,在高剂量给药时,CIA组肠道组织中的芍药内酯苷和芍药苷比正常组分布更多,这表明除了P-gp之外,可能还有其他因素影响TGP主要成分的吸收。这些因素使剂量增加对分布的影响超过了P-gp的影响。
心脏和肝脏中芍药内酯苷和芍药苷的含量较低,而已有的一些研究表明心脏和肝脏组织中芍药内酯苷和芍药苷的含量较高[7-8],这可能是由于本研究中对心脏和肝脏组织进行灌洗,除去了大量血液导致。白芍总苷给药后,芍药内酯苷和芍药苷在尿中排泄迅速,但主要排泄途径为经胆汁排泄[31],这也可能是肝脏中白芍总苷含量较低的原因。滑膜和胸腺上血供较少,但芍药内酯苷、芍药苷含量高于肝、心、肺,说明比起普通组织,芍药内酯苷和芍药苷更容易到达滑膜和胸腺,而其机制需要进一步研究。
综上,白芍总苷主要成分的生物利用度较低,多剂量给药后,广泛分布于大鼠的肠组织和肾脏,在心脏、肝脏、脾脏、肺、胸腺和滑膜中分布较少,并且发现芍药内酯苷、芍药苷在组织中消除较快,给药后4~24 h未检出成分或各组织中含量极低,说明白芍总苷主要成分原型不易在体内蓄积。白芍总苷主要成分在体内的快速清除提示应考虑每天多次给药,以维持体内药物水平。此前研究发现白芍总苷对CIA大鼠肠黏膜免疫有显著影响,结合芍药内酯苷、芍药苷在肠组织的大量分布,肠道组织可能是白芍总苷治疗RA的有效部位和靶点,白芍总苷有可能直接作用于肠道,维持肠黏膜的免疫平衡,发挥治疗作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Chaudhari K, Rizvi S, Syed B A. Rheumatoid arthritis: Current and future trends [J]., 2016, 15(5): 305-306.
[2] 牧亚峰, 向楠, 左新河, 等. 白芍总苷对自身免疫性甲状腺炎大鼠肠黏膜屏障及肠道菌群的影响[J]. 中草药, 2021, 52(11): 3269-3277.
[3] 母会丹, 朱靖博, 丁燕, 等. 白芍化学成分的UPLC/Q-TOF-MS分析 [J]. 分析试验室, 2013, 32(7): 113-117.
[4] Zhang X, Zhang D Y, Jia H J,. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment [J]., 2015, 21(8): 895-905.
[5] Vaghef-Mehrabany E, Alipour B, Homayouni-Rad A,. Probiotic supplementation improves inflammatory status in patients with rheumatoid arthritis [J]., 2014, 30(4): 430-435.
[6] Liu X F, Zeng B H, Zhang J,. Role of the gut microbiome in modulating arthritis progression in mice [J]., 2016, 6: 30594.
[7] Zhao M M, Wang Q. Pharmacokinetic and tissue distribution studies of paeoniflorin and albiflorin in rats after oral administration of total glycosides of paeony by HPLC-MS/MS [J]., 2014, 23(6): 403-411.
[8] Fei F, Yang H L, Peng Y,. Sensitive analysis and pharmacokinetic study of the isomers paeoniflorin and albiflorin after oral administration of total glucosides of white paeony capsule in rats [J]., 2016, 1022: 30-37.
[9] 张玲非, 李向军, 王玉峰, 等. 白芍总苷在正常大鼠体内的组织分布研究 [J]. 天然产物研究与开发, 2012, 24(8): 1040-1046.
[10] Jiang F J, Zhao Y L, Wang J B,. Comparative pharmacokinetic study of paeoniflorin and albiflorin after oral administration ofin normal rats and the acute cholestasis hepatitis rats [J]., 2012, 83(2): 415-421.
[11] 张玲非, 刘敏彦, 潘会敏, 等. 白芍总苷在免疫性肝损伤大鼠体内的药代动力学研究 [J]. 中国药理学通报, 2011, 27(10): 1462-1466.
[12] 袁秀泽, 邹盛勤, 王晓刚, 等. 白芍总苷在佐剂性关节炎大鼠与正常大鼠体内的药动学差异 [J]. 中国实验方剂学杂志, 2016, 22(20): 86-89.
[13] 李雪岩, 韩星, 杨文宁, 等. 基于大鼠体内序贯代谢的白芍质控成分遴选研究[J]. 药物评价研究, 2021, 44(2): 329-337.
[14] Peng J E, Lu X R, Xie K L,. Dynamic alterations in the gut microbiota of collagen-induced arthritis rats following the prolonged administration of total glucosides of paeony [J]., 2019, 9: 204.
[15] Zhao C B, Li X Y, Wu N,. Effect of(Wall) Schott rhizome extract on rheumatoid arthritis [J]., 2016, 15(4): 805.
[16] Hu W, Xia L J, Chen F H,. Recombinant human endostatin inhibits adjuvant arthritis by down-regulating VEGF expression and suppression of TNF-α, IL-1β production [J]., 2012, 61(8): 827-835.
[17] Szekanecz Z, Besenyei T, Paragh G,. New insights in synovial angiogenesis [J]., 2010, 77(1): 13-19.
[18] Zaiss M M, Wu H J J, Mauro D,. The gut-joint axis in rheumatoid arthritis [J]., 2021, 17(4): 224-237.
[19] Sun H J, Wang J F, Lv J. Effects of glycyrrhizin on the pharmacokinetics of paeoniflorin in rats and its potential mechanism [J]., 2019, 57(1): 550-554.
[20] 鞠晓畅. 胡桃楸茎枝水提物的体外吸收与代谢研究 [D]. 沈阳: 辽宁中医药大学, 2019.
[21] 范艳芳, 冯潜, 唐澜, 等. 野黄芩素FVB/NCrlVr小鼠磺酸化代谢特征研究 [J]. 中国药学杂志, 2012, 47(18): 1493-1497.
[22] 董冉冉, 王萌, 刘志东, 等. 微透析技术在中药成分体内分析研究中的应用 [J]. 中草药, 2015, 46(20): 3117-3124.
[23] Asano T, Kushida H, Sadakane C,. Metabolism of ipecac alkaloids cephaeline and emetine by human hepatic microsomal cytochrome P450s, and their inhibitory effects on P450 enzyme activities [J]., 2001, 24(6): 678-682.
[24] 朱玲英, 沈红, 武洁. LC-MS/MS法体外测定肝匀浆液中乌头碱及其代谢产物 [J]. 药物分析杂志, 2012, 32(11): 1923-1928.
[25] Ji H Y, Liu K H, Lee H,. Corydaline inhibits multiple cytochrome P450 and UDP-glucuronosyltransferase enzyme activities in human liver microsomes [J]., 2011, 16(8): 6591-6602.
[26] Dogterom P. Development of a simple incubation system for metabolism studies with precision-cut liver slices [J]., 1993, 21(4): 699-704.
[27] Brendel K, Jay Gandolfi A, Krumdieck C L,. Tissue slicing and culturing revisited [J]., 1987, 8(1): 11-15.
[28] Teensma A, Beamand J A, Walters D G,. Metabolism of coumarin and 7-ethoxycoumarin by rat, mouse, guinea pig, cynomolgus monkey and human precision-cut liver slices [J]., 1994, 24(9): 893-907.
[29] 刘利利, 张继瑜. 药物体外肝代谢模型的研究进展 [J]. 中国兽医学报, 2018, 38(10): 2015-2019.
[30] 尤杰, 赫蕾, 陈明苍, 等. LC-MS法测定离体大鼠肝灌流模型中知母皂苷B2的含量及药动学研究 [J]. 中药新药与临床药理, 2013, 24(1): 70-74.
[31] 刘艳文. 甘草酸对中毒剂量下马钱子碱代谢动力学影响及解毒机制研究 [D]. 长沙: 中南大学, 2010.
Tissue distribution of total glucosides of paeony after long-term administration in collagen-induced arthritis rats
MA Zhe1, 2, SONG Zhi-min1, 2, HAN Ya-xin1, 2, GONG Mu-xin1, 2, QIU Feng1, 2, LI Jing1, 2, HE Rui1, 2
1. School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China 2. Beijing Key Laboratory of TCM Collateral Disease Theory Research, Beijing 100069, China
To study the tissue distribution of paeoniflorin and albiflorin, the main components of total glucosides of paeony, in collagen-induced arthritis (CIA) rats after long-term administration.UPLC-MS/MS method was established to determine the distribution of paeoniflorin and albiflorin in heart, liver, spleen, lung, kidney, small intestine, thymus and synovium of rats after long-term administration.After long-term administration, paeoniflorin and albiflorin were mainly distributed in small intestine and kidney, followed by spleen, thymus, synovium, liver, lung and heart. The tissue distribution of the two components in CIA rats were mostly lower than that in normal rats.The tissue distribution characteristics of total glucosides of paeony after long-term administration are revealed, which provides a reference for exploring the target organ of total glucosides of paeony in the treatment of rheumatoid arthritis and improving the curative effect.
total glucosides of paeony; collagen-induced arthritis; tissue distribution; paeoniflorin; albiflorin
R285.61
A
0253 - 2670(2023)10 - 3167 - 12
10.7501/j.issn.0253-2670.2023.10.014
2022-12-16
国家自然科学基金面上项目(81773860);北京市教育委员会科学研究计划项目资助(KM201910025021)
马 喆,硕士研究生,主要从事中药复方物质基础研究。E-mail: 1144938549@qq.com
龚慕辛,教授,主要从事中药复方物质基础研究。E-mail: gongmuxin@126.com
#共同第一作者:宋志敏,博士研究生,主要从事中药复方物质基础研究。E-mail: songzhimin00@163.com
[责任编辑 李亚楠]
