基于肝脂调控为核心的中药调血脂活性和评价方法研究
2023-05-20李建超李荣荣宋绪钰黄娜娜
李建超,钟 颖,李荣荣,宋绪钰,黄娜娜,孙 蓉, 3*
基于肝脂调控为核心的中药调血脂活性和评价方法研究
李建超1, 2,钟 颖2,李荣荣1, 2,宋绪钰2,黄娜娜2,孙 蓉2, 3*
1. 山东中医药大学,山东 济南 250355 2. 山东大学第二医院,山东 济南 250033 3. 山东大学高等医学研究院,山东 济南 250012
构建适宜于评价中药以“肝脂调控”为核心的调血脂活性和评价的“多细胞来源”“稳定性好”的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)体外细胞模型,以利于精准发现中药脂代谢调控活性物质并评价其调血脂药理学作用特征。选择人肝癌HepG2细胞系及小鼠肝实质AML12细胞系,对造模试剂(油酸及棕榈酸)、造模方法、作用浓度以及作用时间和溶媒选择进行文献和实验研究,并以CCK-8及油红O实验确定最佳造模浓度,进而循形人体肝脂代谢轮廓,采用Western blotting法检测细胞中脂代谢相关蛋白的表达情况,作为模型评价标准。经文献和实验研究发现,10%无脂肪酸牛血清白蛋白(fatty acid free bovine serum albumin,BSA)为油酸溶媒,20% BSA为棕榈酸溶媒稳定性好;500 μmol/L油酸及500 μmol/L油酸+棕榈酸(体积比2∶1)造模,作用24 h,可显著增加细胞内脂质积累(<0.001),且不影响细胞活性,证明造模成功;单独使用棕榈酸造模,对2种细胞损伤都较大,模型不适宜于调血脂物质发现与评价;500 μmol/L油酸及500 μmol/L油酸+棕榈酸造模后,脂肪从头合成相关蛋白固醇调节元件结合蛋白-1(sterol regulatory element-binding protein-1,SREBP-1)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)及脂肪酸合酶(fatty acid synthase,FASN)的表达无显著变化,脂肪分解相关蛋白三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)的表达显著升高(<0.05、0.001),激素敏感脂肪酶(hormone sensitive lipase,HSL)的磷酸化显著降低(<0.05、0.01),脂肪酸氧化相关蛋白过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha,PPARα)的表达无显著差异,肉碱棕榈酰转移酶1A(carnitine palmitoyl transferase 1A,CPT1A)的表达显著增加(<0.05)。500 μmol/L油酸及500 μmol/L油酸+棕榈酸(体积比2∶1)造模24 h,均可显著增加HepG2、AML12细胞中的脂质积累,成功构建NAFLD体外细胞模型,且具有稳定、经济、高效的特点。
肝脂代谢;体外模型;非酒精性脂肪性肝病;游离脂肪酸;油酸;棕榈酸
脂代谢功能紊乱是指长期能量摄入与代谢失衡导致大量脂质堆积,引起内分泌环境紊乱和异位脂质积累,导致脂毒性代谢应激,进而促进肝脏、脂肪组织和骨骼肌等靶器官的代谢功能失调与慢性炎症[1]。肝脏是参与脂肪代谢的主要器官,作为脂质平衡的中心调节器,是脂蛋白摄取、形成、输出和循环的主要加工中心[2-3]。非酒精性脂肪性肝病(non-alcoholic fatty liver diseases,NAFLD)是指5%~10%的肝细胞出现大泡状脂肪变性,或肝内三酰甘油(triglyceride,TG)质量分数超过5.5%[4]。NAFLD已经发展成为全球最常见的慢性肝病,且增长迅速,约25%的人口患有NAFLD[5-6]。近年来,我国的NAFLD发病率明显上升,已成为仅次于病毒性肝炎的第二大肝病。高发病率的NAFLD严重影响了人类的生活健康,给社会造成沉重的经济负担。因此,有效调控肝脂代谢稳态的治疗手段在当下社会显得愈发重要[6]。
中医本无NAFLD的病名,其最早记载于《难经》中,属于中医“肝癖”“痰证”“胁痛”“积聚”等范畴,调肝化浊、健脾利湿、养血柔肝等是其有效治法[7-10]。鉴于目前西医临床针对NAFLD尚缺乏特效治疗策略,亟需在中医药临床丰富的有效经验中发现并开发创新中药。目前NAFLD动物模型制备存在造模时间长、价格昂贵现象,不适宜于中药调控肝脂代谢的活性成分高效筛选,体外细胞模型构建方法统一性较差,如细胞系选择、油酸及棕榈酸造模浓度、单用还是合用、溶媒选择、造模时间及评价指标等方面,文献各不相同,差异较大。因此,亟需建立与临床发病机制相吻合、适宜于以“肝脂调控”为核心的中药调血脂活性和评价方法研究,且不同细胞来源的稳定、经济、高效的NAFLD体外细胞模型,以更好地适应创新中药发现、不同药理学特征的评价研究,也为建立统一的模型标准提供数据支撑。
1 材料
1.1 细胞系
小鼠肝实质细胞AML12细胞系购自中国科学院干细胞库,人肝癌HepG2细胞系购自中国科学院上海细胞生物学研究所。
1.2 药品与试剂
油酸(批号30138518)、棕榈酸(批号30139518)购自上海国药集团化学试剂有限公司;青霉素-链霉素(批号S110JV)、DMEM/F12(1∶1)培养基(批号L310KJ)、胰岛素-转铁蛋白-硒添加剂(批号S450J7)购自上海源培生物科技股份有限公司;DMEM培养基(批号C11995500BT)、胎牛血清(批号A3160801)购自美国Gibco公司;地塞米松(批号D1756)、油红O(批号O0625)购自美国Sigma公司;无脂肪酸牛血清白蛋白(fatty acid free bovine serum albumin,BSA,批号ST025)、蛋白酶抑制剂混合物(批号P1050-1)、磷酸酶抑制剂混合物(批号P1050-2)购自上海碧云天生物技术有限公司;CCK-8试剂盒(A311-02)、BCA蛋白浓度测定试剂盒(批号E112-01)、高敏型ECL化学发光检测试剂盒(批号E412-01)购自南京诺唯赞生物科技股份有限公司;TG测定试剂盒(批号A110-1-1)购自南京建成生物工程研究所;酮体含量检测试剂盒(批号BC5065)购自北京索莱宝科技有限公司;固醇调节元件结合蛋白-1(sterol regulatory element-binding protein-1,SREBP-1)一抗(批号ab28481)、过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha,PPARα)一抗(批号ab126285)、肉碱棕榈酰转移酶1A(carnitine palmitoyl transferase 1A,CPT1A)一抗(批号ab234111)购自英国Abcam公司;乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)一抗(批号3676S)、脂肪酸合酶(fatty acid synthase,FASN)一抗(批号3180S)、三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)一抗(批号2138S)、激素敏感脂肪酶(hormone sensitive lipase,HSL)一抗(批号4107S)、磷酸化HSL(phosphorylated HSL,p-HSL)一抗(批号45804S)购自美国CST公司;β-肌动蛋白(β-actin)一抗(批号20536-1-AP)购自美国Proteintech公司;HRP标记的山羊抗兔IgG抗体(批号GB23303)购自武汉赛维尔生物科技有限公司。
1.3 仪器
精密电子天平(瑞士梅特勒-托利多有限公司);CKX53型倒置生物显微镜(日本Olympus公司);HH-S型恒温水浴锅(北京市永光明医疗仪器厂);5200型全自动化学发光图像分析系统(上海天能科技有限公司);Multiskan Go-1510型全波长酶标仪、3111型CO2培养箱(美国Thermo Fisher Scientific公司);SDS PAGE凝胶电泳及转膜电泳仪(美国Bio-Rad公司)。
2 方法
2.1 文献检索
检索中国知网(CNKI)中以HepG2为细胞模型,研究中药调血脂活性的期刊文献,以“NAFLD”“HepG2”为主题词,时间为2018年1月1日至2023年2月4日;以“NAFLD”“HepG2”“Traditional Chinese Medicine”为主题词在PubMed数据库中搜索近5年文献,通过阅读标题与摘要首先排除与中药、中药方剂及中药活性成分研究无关的文献;然后进行全文阅读,筛选出明确标识造模方法的文献纳入统计。
2.2 油酸、棕榈酸储存液的配制
将油酸加入到0.1 mol/L NaOH溶液中,置于75 ℃水浴锅中皂化30 min,得20 mmol/L油酸溶液,之后加入到等体积的20% BSA溶液中充分混匀,得10 mmol/L油酸储存液(含10% BSA)。
将棕榈酸加入到0.1 mol/L NaOH溶液中,置于75 ℃水浴锅中皂化30 min,得40 mmol/L棕榈酸溶液,之后加入到等体积的40% BSA溶液中充分混匀,得20 mmol/L棕榈酸储存液(含20% BSA)。
将储存液于超净台中过0.22 μm微孔滤膜,置于4 ℃冰箱保存。使用时用相应的细胞培养基稀释至所需浓度,油酸+棕榈酸组为油酸与棕榈酸体积比2∶1配制。
2.3 细胞培养
AML12细胞用含10%胎牛血清、1%胰岛素-转铁蛋白-硒添加剂、1%青霉素-链霉素、40 ng/mL地塞米松的DMEM/F12培养基培养;HepG2细胞用含10%胎牛血清、1%青霉素-链霉素的DMEM培养基培养。细胞于37 ℃、5% CO2培养箱中培养,取对数生长期细胞进行实验。
2.4 CCK-8实验
细胞以1×106个/mL接种于96孔板中,贴壁生长24 h,设置对照组、油酸组、棕榈酸组和油酸+棕榈酸组,对照组仅加入培养基,其余各组分别加入125、250、500、800、1000 μmol/L相应药物,继续培养24 h,用CCK-8试剂盒测定细胞活力。
2.5 油红O实验
细胞以1×106个/mL接种于12孔板中,贴壁生长24 h,设置对照组、油酸组和油酸+棕榈酸组,对照组仅加入培养基,其余各组分别加入125、250、500、800、1000 μmol/L相应药物,继续培养24 h。用4%多聚甲醛固定30 min,在60%异丙醇中孵育2 min。然后在37 ℃下用60%油红O染色20 min,60%异丙醇脱色15 s后,在磷酸盐缓冲液中漂洗3次。采用倒置生物显微镜拍摄图片。染色后的样品在100%异丙醇中室温摇晃30 min,提取油红O,在510 nm处测定吸光度()值。
2.6 TG及酮体含量检测
细胞以1×106个/mL接种于6孔板中,贴壁生长24 h,设置对照组、油酸组和油酸+棕榈酸组,对照组仅加入培养基,其余各组分别加入500 μmol/L相应药物,继续培养24 h。按说明书要求,收取培养基上清液检测酮体含量,收集细胞匀浆检测细胞内TG含量。
2.7 Western blotting检测脂代谢相关蛋白表达
细胞以1×106个/mL接种于6孔板中,贴壁生长24 h,设置对照组、油酸组和油酸+棕榈酸组,对照组仅加入培养基,其余各组分别加入500 μmol/L相应药物,继续培养24 h。收集细胞,加入RIPA缓冲液裂解,使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂奶粉,封闭1 h,加入一抗,4 ℃孵育过夜;加入二抗,4 ℃孵育1.5 h;最后使用ECL化学发光检测试剂盒,在全自动化学发光图像分析系统中显影[11]。
2.8 统计学分析
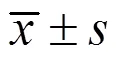
3 结果
3.1 利用HepG2细胞建立NAFLD模型的应用现状
HepG2细胞是人肝癌细胞,保留了正常肝细胞的糖脂代谢功能,是应用最广泛的NAFLD体外模型之一[12]。利用CNKI数据库,以“NAFLD”“HepG2”为主题词搜索最近5年期刊文献106条,筛选出与中药脂代谢研究相关且明确标识造模方法的文章49篇,利用PubMed数据库,搜索最近5年期刊文献64条,筛选出有效文章38篇。其中单独使用油酸造模的24篇,占28%;单独使用棕榈酸造模的20篇,占23%;使用油酸+棕榈酸造模的43篇,占49%。造模所用浓度从100~1000 μmol/L不等。造模或造模同时给药作用时间多为24 h,约占91%。
3.2 不同浓度脂肪酸对肝细胞活性的影响
3.2.1 对HepG2细胞活性的影响 采用125~1000 μmol/L油酸、棕榈酸、油酸+棕榈酸处理HepG2细胞,作用24 h,可见不同浓度的脂肪酸均可浓度相关性地降低HepG2细胞活力。油酸浓度达到800 μmol/L时,细胞活性显著降低(<0.001)。棕榈酸浓度达到125 μmol/L时,细胞活性显著降低(<0.01),说明棕榈酸对细胞的损伤更大。油酸+棕榈酸浓度达到1000 μmol/L时,细胞活性才出现显著降低(<0.001),说明油酸可一定程度抑制棕榈酸对细胞的伤害(图1-A)。
3.2.2 对AML12细胞活性的影响 采用125~1000 μmol/L油酸、棕榈酸、油酸+棕榈酸处理AML12细胞,作用24 h,可见油酸浓度达到800 μmol/L时,细胞活性出现显著降低(<0.01)。棕榈酸浓度达到500 μmol/L时,细胞活性显著降低(<0.001)。油酸+棕榈酸浓度达到1000 μmol/L时,细胞活性仍没有表现出显著降低(图1-B)。相较于HepG2细胞来说,脂肪酸对AML12细胞的伤害更小。

与对照组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
3.3 不同浓度脂肪酸对肝细胞脂肪超载的影响
3.3.1 对HepG2细胞脂肪超载的影响 采用125~1000 μmol/L油酸、油酸+棕榈酸处理HepG2细胞24 h,细胞固定后,进行油红O染色,可见油酸、油酸+棕榈酸均呈浓度相关性地增加HepG2细胞的脂质积累(<0.05、0.01,图2-A)。结合CCK-8实验结果,500 μmol/L油酸及500 μmol/L油酸+棕榈酸在未导致HepG2细胞活力明显下降的情况下,成功诱导了NAFLD细胞模型。接着检测干预后细胞内TG的含量,发现与对照组比较,500 μmol/L油酸及500 μmol/L油酸+棕榈酸均可显著增加HepG2细胞内TG积累(<0.001,图2-B)。
3.3.2 对AML12细胞脂肪超载的影响 采用125~1000 μmol/L油酸、油酸+棕榈酸处理AML12细胞24 h,细胞固定后,进行油红O染色,可见油酸、油酸+棕榈酸均呈浓度相关性地增加AML12细胞的脂质积累(<0.01、0.001,图2-C)。结合CCK-8实验结果,500 μmol/L油酸及500 μmol/L油酸+棕榈酸在不影响AML12细胞活力的情况下,成功诱导了NAFLD细胞模型。同样的,如图2-D所示,500 μmol/L油酸及500 μmol/L油酸+棕榈酸可显著增加AML12细胞中TG含量(<0.001)。
由于棕榈酸对2种细胞的损伤都较大,且低剂量的棕榈酸并不足以诱导2种细胞产生显著的脂质堆积。所以按照当前棕榈酸配制方法,并不推荐单独使用棕榈酸构建NAFLD细胞模型。
3.4 不同浓度脂肪酸对脂代谢的影响
3.4.1 对脂肪从头合成(De novo lipogenesis,DNL)的影响 如图3-A所示,与对照组比较,500 μmol/L油酸组和500 μmol/L油酸+棕榈酸组的HepG2细胞中SREBP-1、ACC及FASN的蛋白表达没有出现显著升高。同样的,在AML12细胞中也未观察到显著差异。表明在此模型中,脂肪酸的引入并没有显著激活肝脏DNL的生理过程。
3.4.2 对脂肪分解的影响 接着对调控肝细胞脂肪分解速率的蛋白进行了检测,结果表明,在2种细胞系的细胞模型中,ATGL蛋白表达水平显著升高(<0.05、0.001),而HSL的磷酸化水平显著降低(<0.05、0.01,图3-B)。说明肝细胞中脂肪超载激活TG第一步水解的同时抑制了脂肪酸的进一步生成,HSL活性的降低促使肝细胞中脂质的进一步积累。
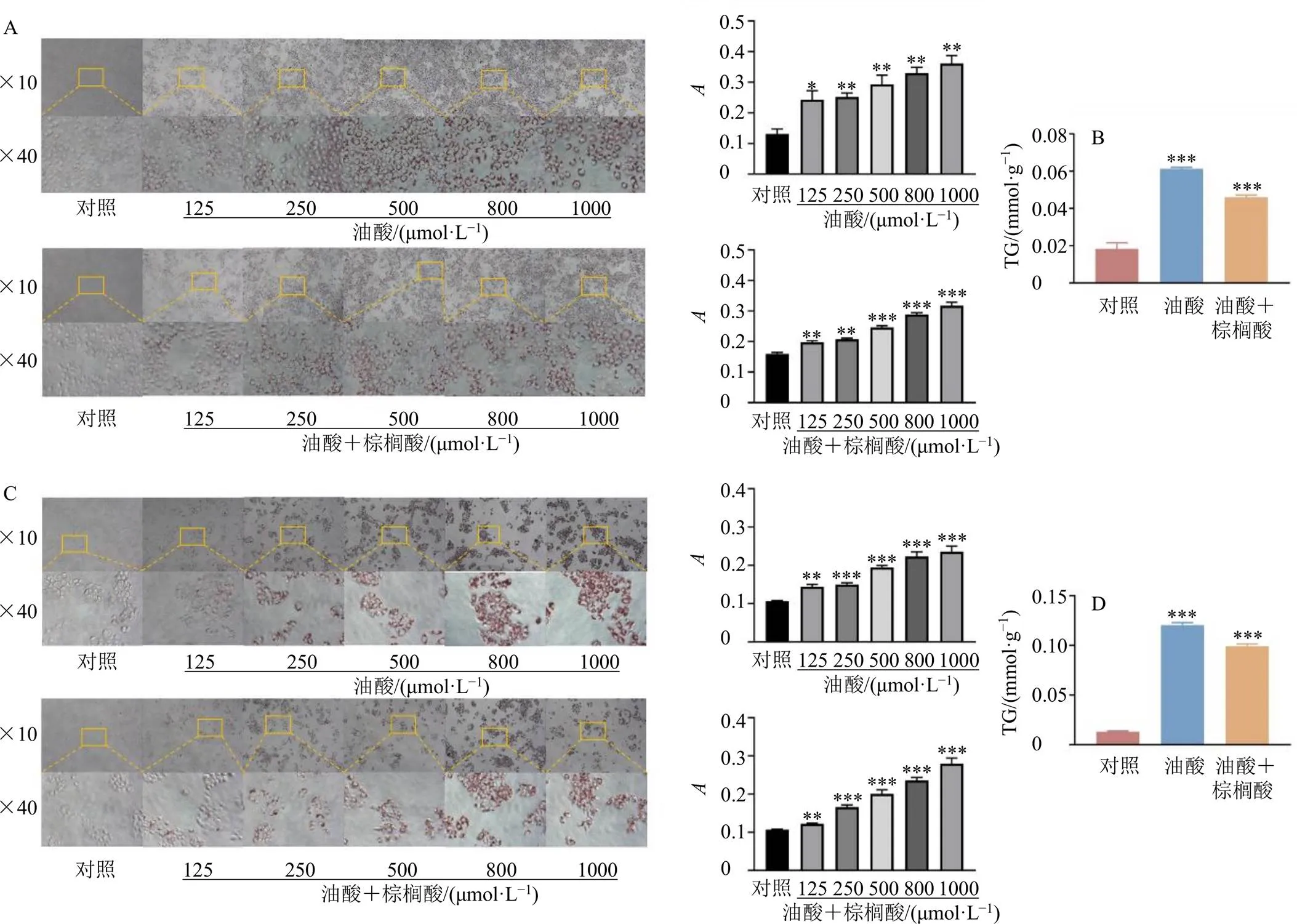
图2 不同浓度脂肪酸对HepG2细胞(A、B) 及AML12细胞(C、D) 油红O染色及细胞内TG累积的影响(, n = 3)

A-脂肪从头合成相关蛋白表达 B-脂肪分解相关蛋白表达 C-脂肪酸氧化相关蛋白表达 D-酮体含量
3.4.3 对脂肪酸氧化的影响 如图3-C所示,在HepG2细胞模型中,与对照组比较,油酸组和油酸+棕榈酸组的PPARα蛋白表达水平虽然存在降低趋势但未出现显著差异,CPT1A蛋白表达水平显著升高(<0.05),表明过量的脂肪酸促进了肝细胞中脂肪酸的氧化。在AML12细胞模型中观察到同样的现象。为了进一步说明脂肪酸氧化的变化,检测了细胞培养基中酮体含量的变化情况,发现在HepG2细胞和AML12细胞中,500 μmol/L油酸和500 μmol/L油酸+棕榈酸均显著升高了酮体的含量(<0.001,图3-D)。
4 讨论
NAFLD是指除酒精外和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[13]。游离脂肪酸可用于肝脏摄取和再酯化为TG,是肝中TG库的主要来源,在NAFLD的发生发展中起着重要作用[14]。棕榈酸和油酸是最丰富的游离脂肪酸,与正常人群相比,NAFLD患者血浆中棕榈酸和油酸的含量显著增加[15]。研究表明棕榈酸对肝细胞有显著的细胞毒性效应,通过联合油酸可减轻细胞损伤[16]。
文献研究发现,目前在以肝脂调控为核心的中药调血脂活性物质发现和评价中所使用的模型较为多样,统一性较差。HepG2细胞是人肝癌细胞,具有生长速度快、易于培养、脂滴形态学变化明显等特点,被广泛用于肝脂代谢的研究中[12]。AML12细胞是小鼠正常肝细胞,属于永生化细胞,具有稳定的表型,存在过氧化物酶体和胆小管样结构,更容易标准化,适用于多种肝脏疾病的研究[17]。本研究利用油酸、棕榈酸在体外分别诱导人源HepG2细胞及鼠源AML12细胞脂肪变性,并通过检测脂代谢相关蛋白的表达阐释模型特点。
在造模时间的选择上,根据不同的实验目的,多选择1~48 h,其中应用最多的为24 h(占94%)[18-21]。根据中药的作用特点、细胞生长周期及前期实验结果,选择24 h作为本研究中2种细胞模型的造模时间。另外,目前可供选择的脂肪酸溶媒也较多,文献中多存在对溶媒表述不清的现象。常使用的包括甲醇、乙醇、二甲亚砜等有机溶剂,但都对细胞有较大的毒性作用,且溶解不充分,导致模型稳定性差。本研究选择毒性较小的BSA作为溶媒,可与游离脂肪酸稳定结合,同时更加符合脂肪酸在体内的运输特点[22]。实验结果表明,500 μmol/L油酸及500 μmol/L油酸+棕榈酸干预细胞24 h后,在不影响细胞活性的情况下能够显著增加细胞内脂质积累。虽然在800 μmol/L甚至更高浓度的油酸+棕榈酸组中HepG2细胞及AML12细胞的活力仍未下降,但综合考虑药效验证敏感性,选择500 μmol/L作为构建NAFLD体外模型的最佳剂量,在此浓度下,继续验证了脂代谢相关蛋白的表达情况。
DNL主要发生在肝脏中[23]。乙酰辅酶A在ACC的作用下转化为丙二酰辅酶A,继而通过FASN转化为脂肪酸主要为棕榈酸,最终经过延长、酯化等步骤形成TG[23-24]。研究发现,NAFLD患者的DNL速率显著增加,是导致肝脏脂质沉积的主要因素之一[25]。患者肝脏脂肪中15%~38%的棕榈酸酯来自DNL,显著高于正常群体[26]。一方面大量棕榈酸的产生可引发炎症和细胞凋亡;另一方面DNL的上调促使细胞转向合成代谢而不是分解代谢,导致肝脏脂质堆积[4]。SREBP-1是DNL速率的主要调控因子,在NAFLD患者中表达增强,同时促进ACC及FASN的表达[23]。在本研究的模型中,SREBP-1、ACC及FASN的表达并未出现显著升高。培养基中添加大量的游离脂肪酸使得DNL进程并未激活。
脂肪分解是TG分解为非酯化游离脂肪酸及甘油进入体循环的生理过程[4]。其中,ATGL是水解TG的第一步,也是限速步骤,生成甘油二酯和脂肪酸[27]。研究表明,肝脏中ATGL的缺失可以减轻肝脏炎症及内质网应激,减缓病程的发展[19]。HSL是一种多功能的酶,主要调控二酰甘油酯的分解,其蛋白磷酸化可显著激活蛋白活性,促进脂解速率[28-29]。最后,单甘酯脂肪酶(monoglyceride lipase,MGL)将单酰甘油水解为甘油和脂肪酸。ATGL、HSL和MGL的生理活性受不同蛋白质和辅助激活剂的相互调节,共同确保脂解速率以适应代谢需要[30]。在本研究的模型中,过量TG的积累显著促进了肝细胞中ATGL的表达,以激活TG水解的第一步。然而,过量的游离脂肪酸负向调控了进一步的脂解过程,抑制HSL的磷酸化。
氧化供能是肝内脂肪酸代谢的主要途径。脂肪酸的氧化由PPARα调节,长链脂肪酸依赖位于外膜的CPT1进入线粒体中[1,31]。PPARα的激活诱导了线粒体、过氧化物酶体和细胞色素中脂肪酸氧化相关基因的转录[32]。然而,这些过程会产生相当数量的活性氧、氧化应激和有毒的二元酸,进一步促进炎症产生[33]。丙酮是肝脏中脂肪酸氧化的中间产物,包括乙酰乙酸、β-羟丁酸和丙酮。在2种模型中,酮体的含量显著升高,PPARα的表达呈降低趋势,但未出现显著差异,CPT1A的表达呈现不同程度的显著增加,说明细胞中多余的脂肪酸大量进入线粒体中,易造成线粒体DNA的氧化损伤,加剧线粒体功能障碍和氧化应激。
从上述结果可以看出,人源肝癌细胞HepG2与鼠源正常肝细胞AML12所建立的模型差异并不明显,在不超生理浓度的情况下,细胞内脂质积累均随脂肪酸浓度的增加而增加;但与HepG2细胞相比,AML12细胞对脂肪酸引起的细胞毒性耐受力更强,尤其是单独使用棕榈酸时,在浓度达到250 μmol/L时,细胞活性仍未出现显著差异。从TG检测可以看出,在相同的作用条件下AML12的脂质积累更加严重,说明AML12细胞对脂肪酸变化更加敏感。
本实验选用的脂肪酸浓度相对较低,对细胞伤害较小。因此,更加适宜于反映NAFLD疾病初期病理特征,对于后续疾病出现的炎症及细胞损伤,可采用更高剂量的脂肪酸进行诱导;另外,实验采用单一因素即脂肪酸浓度增加作为造模条件,不能全面反映NAFLD临床中复杂的多重致病因素[34],因此,在药物发现或药效评价中可根据需求,注意结合其他体外模型进行交互验证。
综上,500 μmol/L油酸、500 μmol/L油酸+棕榈酸(体积比2∶1)作用于HepG2细胞及AML12细胞可成功诱导NAFLD体外细胞模型,影响肝细胞脂肪分解和脂肪酸氧化相关蛋白的表达,具有脂质堆积稳定、成模周期较短、经济高效的特点。适用于中药及中药方剂中调血脂活性物质的广泛筛选,为有效治疗NAFLD的创新中药发现及不同药理学特征的评价研究提供模型参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Yoon H, Shaw J L, Haigis M C,. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity [J]., 2021, 81(18): 3708-3730.
[2] Nguyen P, Leray V, Diez M,. Liver lipid metabolism [J]., 2008, 92(3): 272-283.
[3] Zheng Q, Li X J Y, Huang N N,. Saikosaponins ameliorate hyperlipidemia in rats by enhancing hepatic lipid and cholesterol metabolism [J]., 2023, 305: 116110.
[4] Yki-Järvinen H, Luukkonen P K, Hodson L,. Dietary carbohydrates and fats in nonalcoholic fatty liver disease [J]., 2021, 18(11): 770-786.
[5] Watanabe S, Hashimoto E, Ikejima K,. Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis [J]., 2015, 45(4): 363-377.
[6] Lazarus J V, Mark H E, Anstee Q M,. Advancing the global public health agenda for NAFLD: A consensus statement [J]., 2022, 19(1): 60-78.
[7] 李文怡, 袁成民. 非酒精性脂肪性肝病的中西医治疗 [J]. 临床肝胆病杂志, 2020, 36(4): 919-923.
[8] 童光东, 邢宇锋, 周晓玲, 等. 肝癖 (非酒精性脂肪性肝炎) 诊疗方案 [J]. 中国肝脏病杂志: 电子版, 2021, 13(1): 1-9.
[9] 张声生, 李军祥. 非酒精性脂肪性肝病中医诊疗专家共识意见 (2017) [J]. 临床肝胆病杂志, 2017, 33(12): 2270-2274.
[10] 刘静, 孙蓉. 小柴胡汤对非酒精性脂肪性肝炎模型小鼠的保护作用研究 [J]. 中草药, 2020, 51(14): 3708-3716.
[11] Li J C, Wu K Y, Zhong Y,. Si-Ni-SAN ameliorates obesity through AKT/AMPK/HSL pathway-mediated lipolysis: Network pharmacology and experimental validation [J]., 2023, 302: 115892.
[12] 罗燕, 和兴萍, 李雪, 等. 几种细胞脂肪变性模型的建立与比较分析 [J]. 中华中医药学刊, 2017, 35(8): 2074-2077.
[13] 中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会, 非酒精性脂肪性肝病防治指南(2018年更新版) [J]. 临床肝胆病杂志, 2018, 34(5): 947-957.
[14] Kawano Y, Cohen D E. Mechanisms of hepatic triglyceride accumulation in non-alcoholic fatty liver disease [J]., 2013, 48(4): 434-441.
[15] Puri P, Wiest M M, Cheung O,. The plasma lipidomic signature of nonalcoholic steatohepatitis [J]., 2009, 50(6): 1827-1838.
[16] Leamy A K, Egnatchik R A, Young J D. Molecular mechanisms and the role of saturated fatty acids in the progression of non-alcoholic fatty liver disease [J]., 2013, 52(1): 165-174.
[17] Kanuri G, Bergheim I.andmodels of non-alcoholic fatty liver disease (NAFLD) [J]., 2013, 14(6): 11963-11980.
[18] Luo W, Ye L, Hu X T,. MD2 deficiency prevents high-fat diet-induced AMPK suppression and lipid accumulation through regulating TBK1 in non-alcoholic fatty liver disease [J]., 2022, 12(3): e777.
[19] Fuchs C D, Radun R, Dixon E D,. Hepatocyte-specific deletion of adipose triglyceride lipase (adipose triglyceride lipase/patatin-like phospholipase domain containing 2) ameliorates dietary induced steatohepatitis in mice [J]., 2022, 75(1): 125-139.
[20] da Silva Lima N, Fondevila M F, Nóvoa E,. Inhibition of ATG3 ameliorates liver steatosis by increasing mitochondrial function [J]., 2022, 76(1): 11-24.
[21] Zhang J, Tan J, Wang M K,. Lipid-induced DRAM recruits STOM to lysosomes and induces LMP to promote exosome release from hepatocytes in NAFLD [J]., 2021, 7(45): eabh1541.
[22] Liu Y X, Qiao Z C, Liu W Q,. Oleic acid as a protein ligand improving intestinal absorption and ocular benefit of fucoxanthin in water through protein-based encapsulation [J]., 2019, 10(7): 4381-4395.
[23] Ipsen D H, Lykkesfeldt J, Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease [J]., 2018, 75(18): 3313-3327.
[24] Badmus O O, Hillhouse S A, Anderson C D,. Molecular mechanisms of metabolic associated fatty liver disease (MAFLD): Functional analysis of lipid metabolism pathways [J]., 2022, 136(18): 1347-1366.
[25] Smith G I, Shankaran M, Yoshino M,. Insulin resistance drives hepaticlipogenesis in nonalcoholic fatty liver disease [J]., 2020, 130(3): 1453-1460.
[26] Batchuluun B, Pinkosky S L, Steinberg G R. Lipogenesis inhibitors: Therapeutic opportunities and challenges [J]., 2022, 21(4): 283-305.
[27] Zechner R, Zimmermann R, Eichmann T O,. FAT SIGNALS: Lipases and lipolysis in lipid metabolism and signaling [J]., 2012, 15(3): 279-291.
[28] Tardelli M, Bruschi F V, Trauner M. The role of metabolic lipases in the pathogenesis and management of liver disease [J]., 2020, 72(3): 1117-1126.
[29] Anthonsen M W, Rönnstrand L, Wernstedt C,. Identification of novel phosphorylation sites in hormone-sensitive lipase that are phosphorylated in response to isoproterenol and govern activation properties[J]., 1998, 273(1): 215-221.
[30] Morigny P, Boucher J, Arner P,. Lipid and glucose metabolism in white adipocytes: Pathways, dysfunction and therapeutics [J]., 2021, 17(5): 276-295.
[31] Li X J Y, Ge J D, Li Y J,. Integrative lipidomic and transcriptomic study unravels the therapeutic effects of saikosaponins A and D on non-alcoholic fatty liver disease [J]., 2021, 11(11): 3527-3541.
[32] Wang Y P, Nakajima T, Gonzalez F J,. PPARs as metabolic regulators in the liver: Lessons from liver-specific PPAR-null mice [J]., 2020, 21(6): 2061.
[33] Rao M S, Reddy J K. Peroxisomal beta-oxidation and steatohepatitis [J]., 2001, 21(1): 43-55.
[34] Buzzetti E, Pinzani M, Tsochatzis E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD) [J]., 2016, 65(8): 1038-1048.
Lipid-regulating activity and evaluation method of traditional Chinese medicine based on liver lipid regulation
LI Jian-chao1, 2, ZHONG Ying2, LI Rong-rong1, 2, SONG Xu-yu2, HUANG Na-na2, SUN Rong2, 3
1. Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2. The Second Hospital of Shandong University, Jinan 250033, China 3. Shandong University, Institute of Advanced Medical Sciences, Jinan 250012, China
To construct ancell model of non-alcoholic fatty liver disease (NAFLD) with “multi-cell origin” and “good stability”, which is suitable for lipid-regulating activity and evaluation with “liver lipid regulation” as the core of traditional Chinese medicine, so as to facilitate the accurate discovery of lipid-regulating active substances of traditional Chinese medicine and evaluate their pharmacological effects of lipid regulation.HepG2 cell line of human hepatocellular carcinoma and AML12 cell line of mouse liver parenchyma were selected, modeling reagents (oleic acid and palmitic acid), modeling methods, action concentration, action time and solvent selection were studied by literature and experiments. CCK-8 and oil red O experiments were used to determine the optimal modeling concentration, and then the contour of human liver lipid metabolism was followed. The expressions of lipid metabolism-related proteins in cells was detected by Western blotting as a model evaluation standard.It was found that 10% fatty acid free bovine serum albumin (BSA) was oleic acid solvent and 20% BSA was palmitic acid solvent with good stability. 500 μmol/L oleic acid and 500 μmol/L oleic acid + palmitic acid (volume ratio 2∶1) treated for 24 h could significantly increase the intracellular lipid accumulation (< 0.001) without affecting the cell activity, which proves that the modeling is successful. Palmitic acid modeling alone caused great damage to both kinds of cells, so the model was not suitable for the discovery and evaluation of lipid-lowering substances. After modeling with 500 μmol/L oleic acid and 500 μmol/L oleic acid + palmitic acid, expressions of de novo lipogenesis synthesis related proteins sterol regulatory element-binding protein-1 (SREBP-1), acetyl-CoA carboxylase (ACC) and fatty acid synthase (FASN) were not significantly increased, but the expression of lipolysis related protein adipose triglyceride lipase (ATGL) was significantly increased (< 0.05, 0.001), and phosphorylation of hormone sensitive lipase (HSL) was significantly decreased (< 0.05, 0.01), and the expression of peroxisome proliferator-activated receptor α (PPARα), a protein related to fatty acid oxidation, had no significant difference, while the expression of carnitine palmitoyl transferase 1A (CPT1A) was significantly increased (< 0.05).500 μmol/L oleic acid and 500 μmol/L oleic acid + palmitic acid (volume ratio of 2∶1) can significantly increase the lipid accumulation in HepG2 and AML12 cells, and successfully construct the cell model of NAFLD, which is stable, economical and efficient.
liver lipid metabolism;model; non-alcoholic fatty liver disease; free fatty acid; oleic acid; palmitic acid
R285.5
A
0253 - 2670(2023)10 - 3158 - 09
10.7501/j.issn.0253-2670.2023.10.013
2023-02-07
国家重点研发计划项目(2022YFC3502100);国家自然科学基金面上项目(82274197);国家自然科学基金面上项目(81773997);济南市科研带头人工作室项目(202228099)
李建超,硕士研究生,研究方向为中药药理学与毒理学。E-mail: lijianchao0117@163.com
孙 蓉,博士生导师,教授,从事中药药理学与毒理学研究。E-mail: sunrong107@163.com
[责任编辑 李亚楠]
