蒲地蓝消炎口服液中黄芩提取工艺优化及其性质、含量及药动学研究
2023-05-20姜梦华朱法根何丹丹贾晓斌
李 萱,丁 珂,杨 挡,姜梦华,李 超,朱法根,何丹丹*,孙 娥*,封 亮,贾晓斌
蒲地蓝消炎口服液中黄芩提取工艺优化及其性质、含量及药动学研究
李 萱1, 2,丁 珂1, 2,杨 挡1, 2,姜梦华1, 2,李 超3,朱法根3,何丹丹1, 2*,孙 娥1, 2*,封 亮4,贾晓斌4
1. 南京中医药大学附属中西医结合医院,江苏 南京 210028 2. 江苏省中医药研究院 国家中医药管理局中药口服释药系统重点研究室,江苏 南京 210028 3. 济川药业集团有限公司 江苏省儿科中药与特色制剂重点实验室,江苏 泰兴 225400 4. 中国药科大学中药学院,江苏 南京 211198
优化蒲地蓝消炎口服液(Pudilan Xiaoyan Oral Liquid,PXOL)生产工艺过程中黄芩提取工艺,比较该提取工艺变更前后PXOL的制剂性质、质量标志物含量及其药动学特征。以PXOL(原口服液)和黄芩新工艺PXOL(新口服液)的流浸膏物料性质为基础,通过比较两者的制剂性质、质量标志物含量以及体内的药动学特征,评价新口服液的合理性和可行性。与原口服液相比,新口服液pH值、浊度和黏度发生了显著性变化,不良口感降低了13%;主要有效成分黄芩苷含量增加了25%;同时通过药动学评价原口服液和新口服液在成年大鼠体内的差异可知,给予新口服液后,黄芩苷、汉黄芩素和腺苷的曲线下面积(area under the curve,AUC)均提高、达峰时间(time ofmax,max)均提前,4种质量标志物的平均滞留时间(mean residence time,MRT)均延长,表明新口服液在体内吸收快、起效迅速。新口服液相较于原口服液,制剂质量和制备效率均提高,降低了安全隐患和环保压力,科学合理。为新口服液的体内药效研究提供了数据支撑,也为其安全、合理用药奠定基础。
蒲地蓝消炎口服液;黄芩;合理性;物料性质;药动学;黄芩苷;汉黄芩素;腺苷
蒲地蓝消炎口服液(Pudilan Xiaoyan Oral Liquid,PXOL,原口服液)由蒲公英、苦地丁、板蓝根和黄芩4味中草药组成,前3者均有清热解毒、消肿利咽的作用,而黄芩具有清热燥湿、凉血止血的作用,4种药物结合起来能起到清心脾热毒、燥湿消肿的功效[1-5]。据《中国药典》2020年版记载[6],该药原生产工艺是将黄芩单味中药提取液和其他3味中药提取液合并后加入辅料后制得,其中黄芩提取液是将黄芩用氢氧化钠调节pH值后煎煮2次,提取液合并后醇沉除杂,酸沉静置得黄芩苷粗品。课题组前期研究发现,黄芩经碱提、醇沉后再经酸沉得黄芩苷粗品,工艺复杂,耗时长,操作繁琐;且黄芩提取液醇沉工序过程中黄芩苷损耗较多;黄芩在提取生产过程中需在煮沸10 min后用碱液调节pH值,此过程存在安全隐患。因此,对黄芩提取工艺进行优化,新工艺由原来的碱提变更为水提,降低安全隐患及环保压力;删除醇沉工艺,降低黄芩苷损失,提高效率,减少能耗;酸沉工序删除静置步骤,节约时间,提高生产效率。
因此,本实验在分析黄芩提取工艺优化前后口服液的物料性质基础上,对比其有效成分的变化,同时结合二者质量标志物黄芩苷、汉黄芩素、腺苷和紫堇灵[7-8]在成年大鼠体内的药动学过程,以评价其工艺优化的科学性和合理性,为PXOL质量和制备效率的提高提供了理论依据。
1 仪器与材料
1.1 仪器
AB Sciex QTRAP 5500液相色谱质谱联用仪,配有在线脱气系统、超高压四元泵、自动进样器、柱温箱、Spd-m20a型DAD紫外检测器、三重四极杆质谱检测器及Analyst 1.5分析软件,美国AB Sciex公司;Waters X Select C18色谱柱(100 mm×3.0 mm,2.5 μm;SN:01543929018511);Waters 2695型高效液相色谱仪系统,美国Waters公司;Agilent SB C18色谱柱(250 mm×4.6 mm,5 µm;SN:USCL035287);MT5型百万分之一分析天平,瑞士Mettler Toledo公司;FE28型pH计、AL204型电子天平,梅特勒-托利多仪器(上海)有限公司;RE52CS-1型旋转蒸发仪,上海亚荣生化仪器厂;WH-B06型电子秤,广州市威衡电子有限公司;1.0-1.1型浮子式密度计,上海方瑞仪器设备有限公司;NDJ-5S型旋转粘度仪,邦西仪器科技(上海)有限公司;AQ4500型浊度仪,上海昕瑞仪器仪表有限公司;Nano-ZS型粒径仪,英国马尔文仪器有限公司;SD9011B型色度仪,上海昕瑞仪器仪表有限公司;TS-5000Z型电子舌,日本Insent公司;Labconco型离心浓缩仪,北京照生行仪器设备有限公司;DW-86L578S型−80 ℃低温冰箱,青岛海尔生物医疗股份有限公司;Centrifuge 5430R型离心机,中国艾本德有限公司;VM-300S型混匀仪,群安实验仪器有限公司。
1.2 原料、药材及试剂
制剂PXOL(批号2007094)、黄芩新工艺PXOL(新口服液,批号2108002)及药材饮片蒲公英(批号190112)、板蓝根(批号190201)、苦地丁(批号190118)、黄芩(批号190201),以上制剂及饮片均由济川药业集团有限公司提供。盐酸购自南京化学试剂股份有限公司,批号18101781pk;氢氧化钠购自天津市博迪化工有限公司,批号GB/T629-1997;肝素钠注射液购自常州千红生化制药股份有限公司,批号H32022088;HPLC级甲醇购自南京润凯化玻仪器有限公司,批号21085133;实验用水为娃哈哈纯净水,批号3108NJ;对照品腺苷(批号110879-201703,质量分数99.7%)、菊苣酸(批号111752-201703,质量分数98.3%)、紫堇灵(批号111734-201602,质量分数98.2%)、黄芩苷(批号110715-201821,质量分数95.4%)和汉黄芩素(批号111514-201706,质量分数99.92%)均购自中国食品药品检定研究院。
1.3 动物
SPF级SD雄性成年大鼠,体质量(220±20)g,由江苏省中医药研究院/蚌埠依诺佳生物科技有限公司提供,许可证号:SYXK(苏)2021-0025。所有动物分笼饲养于江苏省中医药研究院动物实验中心SPF环境下,保持温度24 ℃,湿度50%左右。本实验涉及的动物实验符合伦理学标准,已获得江苏省中医药研究院动物伦理委员会批准(批准号:AEWC-20200702-119)。
2 方法与结果
2.1 物料性质表征法分析原口服液和新口服液性质
2.1.1 流浸膏和口服液的制备 黄芩原工艺和新工艺流浸膏及口服液制备方法见表1。
(1)黄芩原工艺流浸膏的制备:取黄芩投入沸水中,每次先煎煮10 min,用氢氧化钠溶液调节pH值,再继续煎煮,重复2次,滤过,合并滤液,浓缩至清膏,醇沉滤过,酸沉静置得黄芩苷粗品,加水溶解备用。

表1 黄芩原工艺和新工艺流浸膏及口服液制备流程对比
(2)黄芩新工艺流浸膏的制备:取黄芩投入沸水中,煎煮3次,滤过,合并滤液,浓缩至清膏,酸沉得黄芩苷粗品,加水溶解备用。
(3)3味药流浸膏的制备:取蒲公英、板蓝根、苦地丁加水煎煮2次,滤过,合并滤液,浓缩至清膏,醇沉除杂,加水备用。
(4)原口服液流浸膏的制备:取黄芩原工艺流浸膏和3味药流浸膏合并,即得。
(5)新口服液流浸膏的制备:取黄芩新工艺流浸膏和3味药流浸膏合并,即得。
(6)原口服液的制备:取原口服液流浸膏,用氢氧化钠溶液调节pH值,加入甜菊糖苷,加水分装,灭菌,即得。
(7)新口服液的制备:取新口服液流浸膏,用氢氧化钠溶液调节pH值,加入甜菊糖苷,加水分装,灭菌,即得。
2.1.2 性质分析 采用pH计、浮子式密度计、浊度仪、旋转粘度仪、色度仪、粒径仪和电子舌等物理性质测定的相关仪器,按照《中国药典》2020年版规定的合剂通则[6]对二者流浸膏和制剂的pH值、密度、浊度、黏度、色度、粒径和口感进行测定。
(1)pH值:取样品溶液450 mL,置于500 mL烧杯中,采用pH计测定溶液的pH值。
(2)密度:取样品溶液450 mL,置于500 mL量筒中,采用浮子式密度计测定溶液的密度。
(3)浊度:取样品溶液10 mL,置于浊度测试比色瓶中,采用浊度仪测定样品溶液的浊度。
(4)黏度:取样品溶液450 mL,置于500 mL烧杯中,采用旋转黏度仪测定溶液的黏度。测量时,应选择规格合适的转子,待转子凹槽与样品溶液液面相平时,可进入测量阶段,待读数稳定后,记录数值。
(5)色度:取样品溶液10 mL,置于色度测试比色瓶中,采用色度仪测定样品溶液的色度。样品溶液颜色较深,需对样品溶液稀释后测定。
(6)粒径:取样品溶液2 mL,置于溶液粒径测试比色皿中,采用马尔文Nano-ZS仪器测定样品溶液中微粒的粒径。
(7)电子舌法评价方法的建立[9-11]:采用电子舌法测定二者流浸膏和制剂的苦味、涩味、苦味回味、涩味回味和咸味,根据味道数值绘成雷达图,通过计算雷达曲线面积来表征其不良口感的程度,其计算公式和雷达图见图1。面积越大,不良口感越严重,反之则不良口感较轻。同时以不良口感降低率作为数字化直观指标,更清晰明了。

图1 雷达曲线面积图示
结果如表2、3和图2、3所示,在流浸膏阶段,新口服液流浸膏的密度、浊度和黏度发生了显著性变化,密度由1.18 g/cm3显著降低到1.15 g/cm3(<0.01),浊度由51.70 NTU显著增加到108.30 NTU(<0.001),黏度从13.76 mPa∙s显著降低到9.90 mPa∙s(<0.01);新口服液流浸膏的电子舌口感雷达曲线面积由385减少到316,不良口感降低8%。在制剂阶段,新口服液的pH值、浊度、黏度和发生了显著性变化,pH值由5.82显著降低到5.70 (<0.05),浊度由7.84 NTU显著增加到181.70 NTU(<0.001),黏度由3.70 mPa∙s显著增加到4.00 mPa∙s(<0.05);新口服液的电子舌口感雷达曲线面积由250降低到217,不良口感降低13%,其中苦味回味、涩味回味和咸味均较原口服液的好。
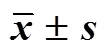
表2 流浸膏和制剂性质分析(, n = 3)
与原口服液流浸膏相比:#<0.05##<0.01###<0.001;与原口服液相比:*<0.05**<0.01***<0.001
#< 0.05##< 0.01###< 0.001original oral liquid fluid extract;*< 0.05**< 0.01***< 0.001original oral liquid
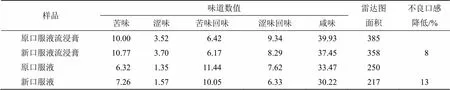
表3 流浸膏和制剂口感分析
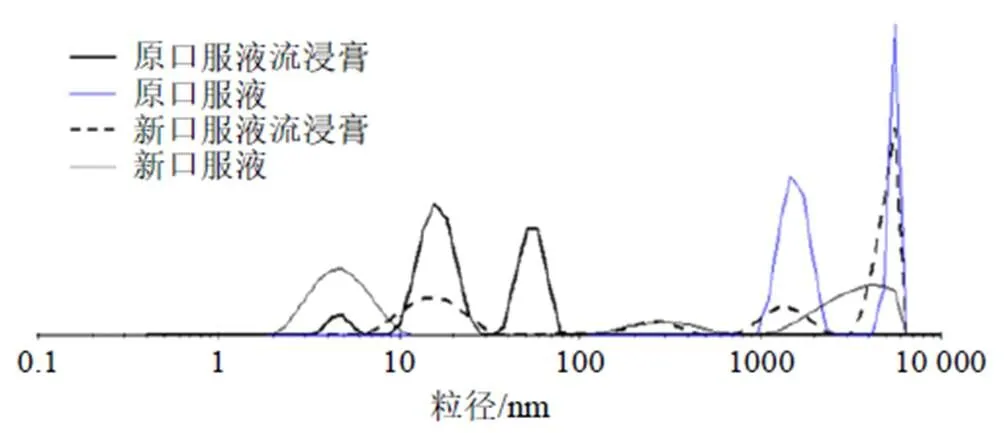
图2 流浸膏和制剂粒径分布(, n = 3)
2.2 HPLC法分析原口服液和新口服液的质量标志物含量
2.2.1 对照品溶液的制备 精密称取黄芩苷、汉黄芩素、腺苷、菊苣酸和紫堇灵对照品适量,用50%甲醇溶解配制成单一对照品储备液;分别精密吸取适量于5 mL量瓶中,50%甲醇定容,配制成混合对照品储备液。
2.2.2 供试品溶液的制备 精密吸取原口服液流浸膏1.0 mL于10 mL量瓶中,平行2份,50%甲醇定容,摇匀,0.45 μm微孔滤膜滤过,即得。
A-原口服液流浸膏 B-新口服液流浸膏 C-原口服液 D-新口服液
原口服液、新口服液流浸膏及新口服液的供试品溶液同法制备。
2.2.3 色谱条件 色谱柱为Agilent SB C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~10 min,0~5%甲醇;10~15 min,5%~15%甲醇;15~30 min,15%甲醇;30~35 min,15%~25%甲醇;35~70 min,25%~50%甲醇;70~90 min,50%~80%甲醇;90~100 min,80%~0甲醇;检测波长280 nm;体积流量1.0 mL/min;柱温30 ℃;进样量10 μL。色谱图见图4。本方法的线性关系、精密度、重复性、稳定性和加样回收率试验均符合要求[12]。
2.2.4 样品测定 分别取原口服液和新口服液的流浸膏和制剂,按照“2.2.2”项下方法制备供试品溶液,并对样品中5种成分进行HPLC分析,记录5个质量标志物的峰面积并计算在样品中的含量,结果见表4。新口服液的流浸膏和制剂中黄芩苷和汉黄芩素含量均提高,且制剂中黄芩苷质量浓度由11.51 mg/mL增加到14.41 mg/mL,增加25%,从而提高了制剂中黄芩苷利用率。
2.3 HPLC-MS法分析原口服液和新口服液在成年大鼠体内吸收
由于研究前期根据药动学预实验分析得出,菊苣酸在吸收和代谢之前会被肠道微生物降解[13-16],代谢加快,无法测得其原型的药动学特征,因此本实验分析了腺苷、黄芩苷、紫堇灵和汉黄芩素在成年大鼠体内的药动学特征。

1-腺苷 2-菊苣酸 3-紫堇灵 4-黄芩苷 5-汉黄芩素

表4 流浸膏和制剂中质量标志物含量
2.3.1 动物分组、给药及样品采集 SD成年大鼠12只,随机分为2组,每组6只,分别为原口服液组和新口服液组。实验前禁食12 h,自由饮水,采用眼底静脉丛取血。大鼠口服给药(3.78 mL/kg)后,分别在0、5、10、25、45 min及1、2、3、4、6、8、12、24 h时间点采血150 μL,采集的血样置于预先加入肝素钠抗凝的试管中,将样本3500 r/min离心5 min(离心力1205×),即得血浆。−80 ℃冰箱保存,备用。
2.3.2 对照品溶液的制备 精密称取对照品腺苷、黄芩苷、汉黄芩素和紫堇灵,配制成单一对照品的甲醇母液,低温密封保存。根据各质量标志物在血浆样品中的质量浓度,分别精密吸取相应体积的对照品溶液混合、稀释得混标母液;一系列稀释后,得系列混标溶液。精密称取一定量的柚皮苷于5 mL量瓶,用甲醇定容至刻度并稀释,得内标溶液质量浓度。
2.3.3 血浆样品处理 精确吸取100 μL血浆于离心管中,加入400 μL甲醇,涡旋2 min,在4 ℃条件下,12 000 r/min离心(离心力14 167×)10 min取上清液,以除去血浆中蛋白,置于氮吹仪中吹干,再加入100 μL甲醇复溶,12 000 r/min离心10 min取上清液,加入74 ng的内标物柚皮苷,待测。
2.3.4 色谱条件 色谱柱为Waters X Select C18柱(100 mm×3.0 mm,2.5 μm);流动相为甲醇-0.1%甲酸水溶液,梯度洗脱程序:0~0.5 min,0~15%甲醇;0.5~2.5 min,15%甲醇;2.5~7 min,15%~80%甲醇;7~9 min,80%甲醇;9~11 min,80%~15%甲醇;11~12 min,15%甲醇;体积流量0.4 mL/min;柱温40 ℃;进样量4 μL。
2.3.5 质谱条件 电喷雾离子源(ESI),正、负离子切换模式扫描,多重反应监测模式(multiple reaction monitoring,MRM),源喷射电压5500 V(正离子模式),−4500 V(负离子模式),4个待测成分和1个内标成分的质谱参数见表5。
2.3.6 专属性考察 取已处理好的空白血浆100 μL,空白血浆中加入一定质量浓度混合对照品溶液和内标溶液直接进样,获得相应的总离子流色谱图见图5。结果表明,在此色谱和质谱条件下,分析物和内标在空白血浆中无杂质干扰,可用于大鼠血浆样本中腺苷、黄芩苷、汉黄芩素、紫堇灵的含量测定。
2.3.7 线性关系考察 取“2.3.2”项下各质量浓度的对照品溶液,按照“2.3.4”项下色谱条件及“2.3.5”项下质谱条件进行HPLC-MS分析。分别进样4 μL,以各分析物质量浓度为横坐标(),各分析物与内标的峰面积比值为纵坐标(),得到线性回归方程分别为腺苷=0.013 7+0.028 6,2=0.992 1,线性范围0.734~47.000 μg/L;紫堇灵=0.033 9+0.180 5,2=0.994 2,线性范围0.432~27.675 μg/L;黄芩苷=0.000 9+0.001 1,2=0.998 9,线性范围16.716~1 069.810 μg/L;汉黄芩素=0.081 7+0.105 2,2=0.991 2,线性范围0.644~10.300 μg/L。
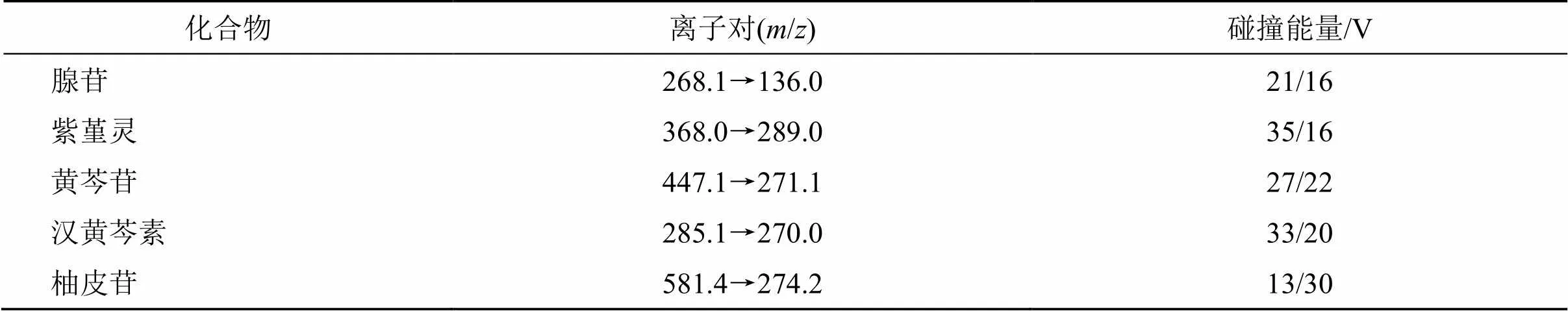
表5 质量标志物和内标的质谱分析参数
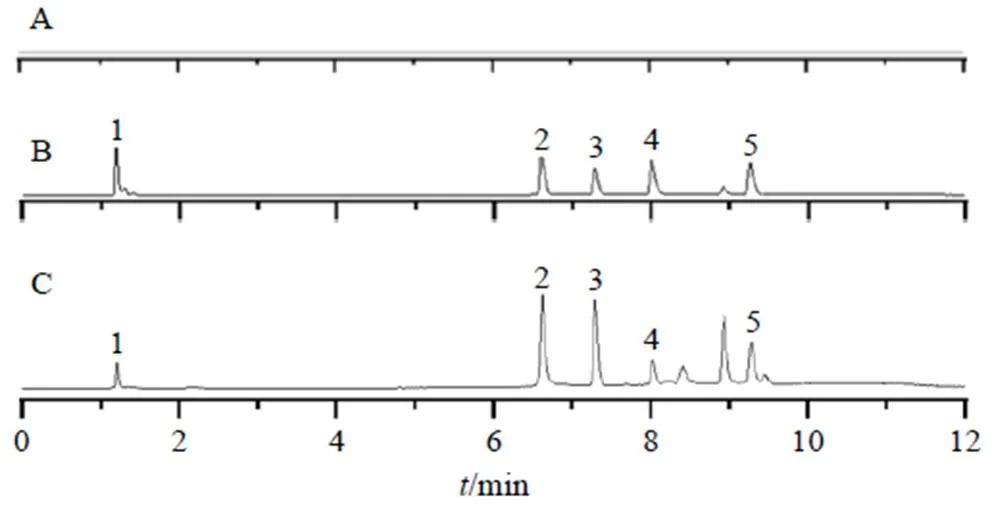
1-腺苷 2-紫堇灵 3-柚皮苷 4-黄芩苷 5-汉黄芩素
2.3.8 精确度试验 取空白血浆100 μL,加入低、中、高3个质量浓度的混合对照品溶液各100 μL,放入1.5 mL EP管中,40 ℃水浴氮气吹干后复溶,制成低、中、高3个质量浓度的质控样品,其质量浓度分别为腺苷(1.47、5.88、23.50 ng/mL)、紫堇灵(0.86、3.46、13.84 ng/mL)、黄芩苷(33.43、133.73、534.91 ng/mL)、汉黄芩素(0.32、1.29、5.15 ng/mL),每个测定5次,连续测定5 d,计算日内精密度的RSD在1.3%~4.8%,日间精密度的RSD在2.8%~3.8%,表明该方法的精密度良好。
2.3.9 稳定性试验 取空白血浆100 μL,加入低、中、高3个质量浓度的混合对照品溶液各100 μL,按“2.3.3”项下方法处理,处理后的样品进样室中放置0、2、4、6、8、12 h测定,考察稳定性均在1.0%~9.2%,结果表明生物样品在12 h内稳定。
2.3.10 回收率试验 取空白血浆100 μL,加入低、中、高3个质量浓度的混合对照品溶液各100 μL,按“2.3.3”项下方法处理,测定各质量标志物的峰面积及含量,回收率=测得含量/理论含量,得到回收率均在88.76%~114.5%,符合回收率要求。
2.3.11 药动学参数 运用Phoenix WinNonlin药动学软件处理数据和非房室统计模型计算药动学参数。平均血药浓度-时间曲线见图6,药动学参数见表6。由药动学参数可知,成年大鼠分别给予原口服液和新口服液后,体内腺苷、紫堇灵、黄芩苷和汉黄芩素在半衰期(terminal half-life,1/2)、曲线下面积(area under the curve,AUC)、达峰时间(time ofmax,max)、达峰浓度(maximum observed concentration,max)和体内滞留时间(mean residence time,MRT)中存在差异。
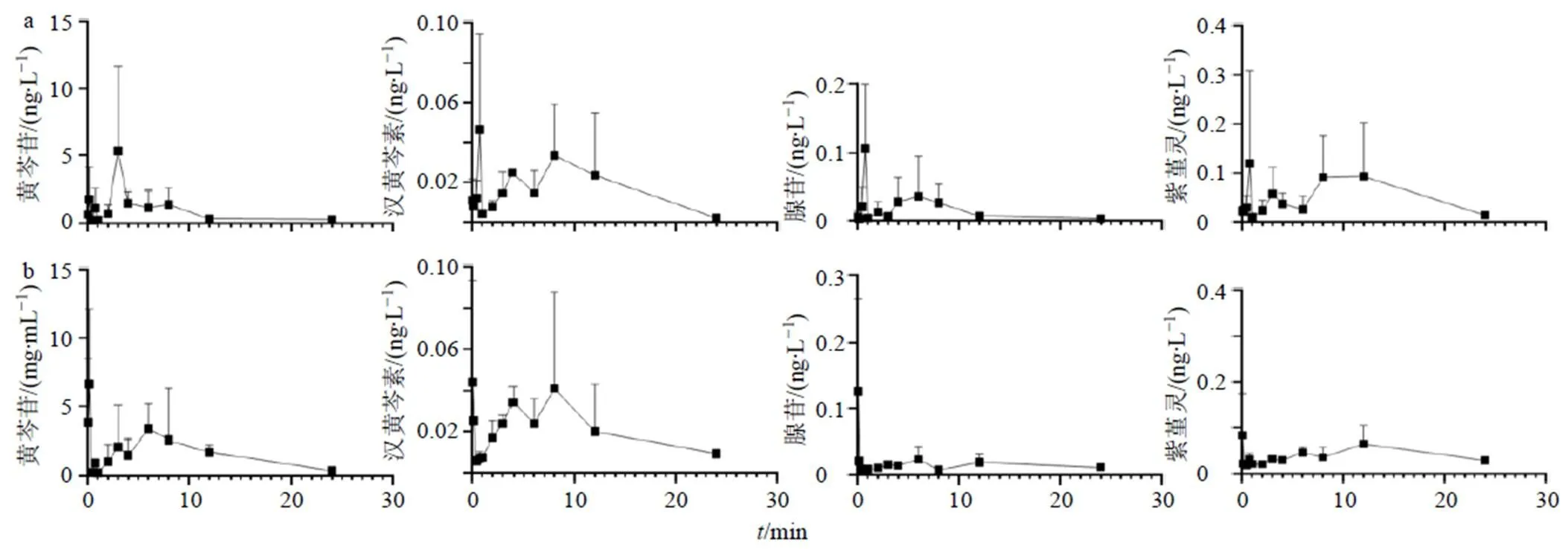
图6 原口服液(a)和新口服液(b)在成年大鼠体内血药浓度-时间曲线

表6 原口服液和新口服液药动学参数(, n = 6)
给予新口服液的成年大鼠和给予原口服液的成年大鼠相比,黄芩苷的max由2.39 h提前到2.11 h,max由6.09 ng/L增加到8.24 ng/L,AUC由20.02 ng∙h/L增加到37.66 ng∙h/L,MRT由7.80 h延迟到9.10 h;汉黄芩素的max由6.92 h提前到2.69 h,AUC由0.41 ng∙h/L增加到0.50 ng∙h/L,MRT由 8.60 h延迟到9.71 h;腺苷的max由2.50 h提前到0.11 h,MRT由7.08 h延迟到11.33 h。结果表明,黄芩苷和汉黄芩素在体内达峰时间提前,AUC总量增加,MRT延长,因此新口服液吸收速度快,起效迅速,且在体内滞留时间久,有利于发挥药效。
将4个成分的最大血药浓度用相应的给药剂量标准化(max/Dose),成年大鼠给予原口服液后,黄芩苷(37.891 mg/kg)的max/Dose为0.161,汉黄芩素(0.435 mg/kg)的max/Dose为0.184,紫堇灵(1.546 mg/kg)的max/Dose为0.162,腺苷(0.272 mg/kg)的max/Dose为0.515,可知体内吸收程度,腺苷>汉黄芩素>紫堇灵>黄芩苷。
成年大鼠给予新口服液后,黄芩苷(54.470 mg/kg)的max/Dose为0.151,汉黄芩素(0.491 mg/kg)的max/Dose为0.122,紫堇灵(1.149 mg/kg)的max/Dose为0.096,腺苷(0.442 mg/kg)的max/Dose为0.294,可知体内吸收程度,腺苷>黄芩苷>汉黄芩素>紫堇灵。
3 讨论
本实验在分析黄芩制备工艺优化前后的流浸膏物料性质的基础上,对比其有效成分的变化,同时结合二者黄芩苷、汉黄芩素、腺苷和紫堇灵在成年大鼠体内的药动学过程,以评价其工艺优化的合理性,为PXOL黄芩制备工艺的优化提供了理论依据。
黄芩提取工艺优化后,新口服液在pH值、浊度和黏度发生了显著性变化,由于黄芩新工艺在煎煮过程中减少氢氧化钠的加入,所以使pH值显著降低;而且提取药液无醇沉环节,直接酸沉得黄芩苷,使浊度显著性升高,黏度随之改变。与此同时,新口服液的不良口感降低了13%,尤其是其中咸味得到了较大的改善。其次,对比二者流浸膏及制剂中质量标志物的含量,新口服液的黄芩苷含量增加25%,提高了黄芩苷利用率,说明优化黄芩工艺合理可行。
研究发现给予新口服液的成鼠体内黄芩苷和汉黄芩素的AUC增加88%,说明成鼠给予新口服液后吸收黄芩苷总量和汉黄芩素总量较原口服液的高;除紫堇灵外,其他3个质量标志物的max均提前,表明给予新口服液后,吸收速度较给予原工艺口服液快;给予新口服液后4个质量标志物的体内滞留时间均延迟,有利于药物可在体内发挥其药效。由此可见,由于新口服液质量标志物含量增加,药动学参数AUC增加、max提前、MRT延迟,所以药物在体内吸收增加、吸收快、起效迅速,药效优于工艺变更前[17-19]。
综上所述,新口服液通过优化黄芩提取工艺后,不仅提高了黄芩苷和汉黄芩素利用率,还改善不良口感,提高服药顺应性。因此新口服液较原口服液,提高制剂质量和效率,降低安全隐患和环保压力,科学合理。本实验为新口服液的体内药效研究提供了数据支撑,也为其安全、合理用药奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 李晨虹. 单磷酸阿糖腺苷联合蒲地蓝消炎口服液治疗疱疹性口腔炎临床研究 [J]. 新中医, 2019, 51(1): 164-167.
[2] 白涛敏, 刘虹. 蒲地蓝消炎口服液联合莪术油葡萄糖注射液治疗儿童疱疹性咽峡炎的临床研究 [J]. 现代药物与临床, 2017, 32(10): 1925-1928.
[3] 王连心, 苗青, 谢雁鸣. 《蒲地蓝消炎口服液临床应用专家共识》编制要点与关键内容解读 [J]. 辽宁中医杂志, 2021, 48(6): 60-62.
[4] Liu Y, Cui X, Xi J Y,. Clinical efficacy evaluation and potential mechanism prediction on Pudilan Xiaoyan Oral Liquid in treatment of mumps in children based on meta-analysis, network pharmacology, and molecular docking [J]., 2022, doi: 10.3389/FPHAR.2022. 956219.
[5] Tian G, Gu X Q, Bao K F,. Anti-inflammatory effects and mechanisms of Pudilan Antiphlogistic Oral Liquid [J]., 2021, doi: 10.1021/ACSOMEGA.1C04797.
[6] 中国药典[S].一部. 2020: 26, 1787-1788.
[7] Shang L Y, Zhou M H, Cao S Y,. Effect of polyethylene glycol 400 on the pharmacokinetics and tissue distribution of baicalin by intravenous injection based on the enzyme activity of UGT1A8/1A9. [J]., 2022, doi: 10.1016/J.EJPS.2022.106328.
[8] 张伟, 潘梦瑾, 郎靖, 等. 基于网络药理学研究蒲地蓝消炎口服液的药理作用分子机制及与疾病的关系 [J]. 新中医, 2022, 54(8): 1-9.
[9] 李晨旭, 姚静, 任延娜, 等. 基于感官评价法的清热类中药口服液味觉评价研究[J]. 中草药, 2023, 54(1): 81-91.
[10] 李学林, 康欢, 田亮玉, 等. 不同类型掩味剂对龙胆、苦参、穿心莲、莲子心4种中药水煎液的抑苦效能及抑苦规律评价 [J]. 中草药, 2018, 49(22): 5280-5291.
[11] 李萱, 丁珂, 杨挡, 等. 基于物料性质表征的小儿蒲地蓝消炎糖浆剂型优化评价研究 [J]. 中国中药杂志, 2022, 47(21): 5746-5756.
[12] 姜梦华, 李超, 朱法根, 等. 基于抗炎活性的蒲地蓝消炎口服液质量标志物的辨识 [J]. 中国中药杂志, 2020, 45(18): 4299-4306.
[13] Manzanilla B, Robles J. Antiradical properties of curcumin, caffeic acid phenethyl ester, and chicoric acid: A DFT study [J]., 2022, 28(3): 68.
[14] 熊晓红. 菊苣酸的临床前药代动力学研究 [D]. 广州: 广东药科大学, 2017.
[15] 王庚南, 王建平, 宋娇, 等. 菊苣酸的胃肠道稳定性研究 [J]. 安徽农业科学, 2013, 41(29): 11640-11641.
[16] 吴超, 丛晓娟, 高源, 等. 菊苣酸的研究现状与展望 [J]. 中华中医药杂志, 2021, 36(12): 7234-7238.
[17] 刘莹, 贾兰, 张晓喻, 等. 肠道菌群紊乱对泻心汤药效成分大黄素药动学的影响 [J]. 中草药, 2022, 53(16): 5066-5073.
[18] 李东红, 徐翠珊, 韩德恩, 等. 复方麝香黄芪滴丸中7个活性成分在正常大鼠和脑缺血再灌注损伤模型大鼠体内药动学研究 [J]. 中草药, 2022, 53(15): 4746-4754.
[19] 朱洪萱, 黄天养, 余孝云, 等. 花旗参在大鼠体内的药代动力学特征研究 [J]. 遵义医科大学学报, 2022, 45(4): 438-443.
Properties, content and pharmacokinetics offrom Pudilan Xiaoyan Oral Liquid after optimization of extraction process
LI Xuan1, 2, DING Ke1, 2, YANG Dang1, 2, JIANG Meng-hua1, 2, LI Chao3, ZHU Fa-gen3, HE Dan-dan1, 2, SUN E1, 2, FENG Liang4, JIA Xiao-bin4
1. Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China 2.Key Laboratory of New Drug Delivery Systems of Chinese Materia Medica, Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China 3. Jiangsu Key Laboratory of Chinese Medicine and Characteristic Preparations for Paediatrics, Jumpcan Pharmaceutical Co., Ltd., Taixing 225400, China 4. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China
Optimize the extraction process of Huangqin () in the production process of Pudilan Xiaoyan Oral Liquid (蒲地蓝消炎口服液, PXOL), compare the preparation properties, quality marker content, and pharmacokinetic characteristics of PXOL before and after the change in the extraction process.Based on the properties of the flow extract materials of Pudilan Xiaoyan Oral Liquid (PXOL, original oral liquid, OOL) andnew process PXOL (new oral liquid, NOL), the rationality and feasibility of the NOL were evaluated by comparing the preparation properties, quality marker content and pharmacokinetic characteristics of the two.Compared with OOL, the pH, turbidity and viscosity of NOL changed significantly, and the bad taste was reduced by 13%. The main active ingredient baicalin content increased by 25%; At the same time, through pharmacokinetic evaluation of the difference between the OOL and NOL in adult rats, it can be seen that after the administration of NOL, the area under the curve (AUC) of baicalin, wogonin and adenosine were increased, themaxwas advanced, and the mean residence time (MRT) of the four quality markers was prolonged, indicating that the NOL was absorbed quickly and had a rapid onset of effect.Compared with OOL, NOL can improve the quality and preparation efficiency of the preparation, reduce the potential safety hazard and environmental protection pressure, which is scientific and reasonable. It provides data support for the study of the efficacy of PXOL, and also lays a foundation for its safe and rational drug use.
Pudilan Xiaoyan Oral Liquid;; rationality; material properties; pharmacokinetics;baicalin; wogonin; adenosine
R283.6
A
0253 - 2670(2023)10 - 3101 - 08
10.7501/j.issn.0253-2670.2023.10.007
2022-11-08
国家重点研发计划项目(2018YFC1706902);国家中医药管理局重点研究室能力提升项目(2022GJJZDYJS-01);江苏省儿科中药与特色制剂重点实验室开放课题(BM2019011);江苏省科技成果转化专项资金(BA2020077);江苏省医学创新团队项目(CXTDB2017003);江苏省研究生实践创新计划项目(SJCX21-0716)
李 萱,硕士研究生,研究方向中药制剂。Tel: (025)52362115 E-mail: lixuan542021@163.com
何丹丹,副主任中药师,研究方向中药制剂与中药临床药学。Tel: 13813005935 E-mail: happydandan007@163.com
孙 娥,研究员,研究方向为中药制剂与炮制。Tel: (025)52362115 E-mail: sune0825@163.com
[责任编辑 郑礼胜]
