大蓟内生真菌Coniothyrium sp.DJ-1抗SARS-CoV-2 Mpro活性的化学成分研究
2023-05-20曾洁醇李艳平汪伟光
曾洁醇,杨 润,黄 金,李艳平,高 路,汪伟光*
大蓟内生真菌sp.DJ-1抗SARS-CoV-2 Mpro活性的化学成分研究
曾洁醇1,杨 润1,黄 金1,李艳平2,高 路1,汪伟光1*
1. 云南民族大学 国家民委民族药内生菌天然产物合成生物学重点实验室,民族医药学院,云南 昆明 650031 2. 云南中医药大学中药学院,云南 昆明 650500
研究大蓟内生真菌sp. DJ-1中抑制新型冠状病毒主蛋白酶(severe acute respiratory syndrome coronavirus 2 main protease,SARS-CoV-2 Mpro)活性的化学成分。运用新型冠状病毒Mpro/3CLpro抑制剂筛选模型从30株菌株中筛选具有抑制活性的菌株和化学成分。采用正相硅胶、反相RP-18柱色谱和HPLC等技术对抑制率高的菌株的次生代谢产物进行分离纯化,通过NMR、质谱等谱学技术解析化合物结构,利用荧光共振能量转移法测定化合物对SARS-CoV-2 Mpro的抑制活性。在30株菌株中发现抑制活性良好的菌株sp. DJ-1,并从该菌的大米发酵提取物中分离到17个化合物,分别鉴定为德加隆内酯(1)、5-表细链格孢烯(2)、细链格孢烯(3)、4-表细链格孢烯(4)、3-表-二氢细链格孢烯A(5)、瓶霉酚(6)、1-脱氧红藻内酯(7)、6-羟基-8-甲氧基-3a-甲基-3a,9b-二氢-3-呋喃并[3,2-]异色烯-2,5-二酮(8)、黄色篮状菌酮(9)、链格孢毒素II(10)、二氢链格孢苝醇(11)、2-(2-羟基丙基)-5-甲基-7-羟基色酮(12)、7-羟基-2-羟甲基-5-甲基-4-色烯-4-酮(13)、三环链格孢霉烯6b(14)、三环链格孢霉烯D(15)、苯乙醇(16)和对羟基苯甲醛(17)。化合物5、9、11对SARS-CoV-2 Mpro的半数抑制浓度(median inhibition concentration,IC50)分别为42.77、25.85和24.26 μmol/L。化合物1~15和17均为首次从sp.属中分离得到,化合物5、9、11对SARS-CoV-2 Mpro有较好的抑制作用。通过筛选活性菌株的策略,快速从真菌天然产物中挖掘抗新冠病毒活性的化合物,为抗新冠病毒药物的研发提供了参考。
大蓟;盾壳霉属;内生真菌;次生代谢产物;抗病毒活性;新型冠状病毒主蛋白酶;3-表-二氢细链格孢烯A;黄色篮状菌酮;二氢链格孢苝醇
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是一种由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的急性呼吸道传染病,其传播速度快和致病率高,对全球卫生和人口安全造成了严重的威胁。尽管一些抗病毒的药物,如瑞德西韦、法匹拉韦、莫那匹拉韦等被各国批准用于作为COVID-19的治疗药物[1-5],但由于SARS-CoV-2的高突变性,这些治疗药物对于变异毒株的有效性面临巨大的挑战。因此,寻找和开发抗COVID-19有效药物仍迫在眉睫。
研究表明,针对冠状病毒中保守的靶点,研发抗冠状病毒活性的抑制剂,可以提高药物的有效性[6]。主蛋白酶(main protease,Mpro)是冠状病毒的1个关键酶,在病毒复制和转录中发挥重要作用,且保守性高,在人体内没有同源蛋白,所以Mpro是药物设计和开发的理想靶点[7-8]。目前,已有文献报道一些小分子药物如奈玛特韦、依布硒、tideglusib、disulfiram、carmofur、PX-12和紫草素等对SARS-CoV-2 Mpro有很好的抑制作用[8-10],同时在细胞检测中也显示了良好的抗病毒活性,这表明以SARS-CoV-2 Mpro作为靶点来筛选药物是一种有效的策略。不仅如此,中药在治疗COVID-19方面发挥了巨大的作用,挽救了大量人民群众的生命[11]。许多来源于传统中药的天然产物(银杏酚酸、胡桃醌及其衍生物、4甲基黄芩素、新刺孢曲霉素A和甘草酸苷等)也纷纷被报道对SARS-CoV-2 Mpro有很强的抑制作用,均被认为是潜在的抗SARS-CoV-2药物[12-18]。由此可见,从天然产物中发现具有抗SARS-CoV-2 Mpro活性的化合物,是获得抗新冠病毒先导化合物的一种有效途径。
真菌来源的天然产物结构多样,生物活性显著,是药物先导化合物的重要源泉[19-23]。目前有学者针对性地从真菌天然产物中寻找抗新冠病毒活性的化合物,如Pang等[24]从1株青霉属菌株sp. SCSIO06868.中发现了1个tetramic acid衍生物对新冠病毒有抑制作用。本课题组在1株真菌sp.中发现了化合物曲霉狐扁枝衣酮D、M和R对SARS-CoV-2有抑制活性,且能减少SARS-CoV-2引起的炎症反应[25]。为了从真菌天然产物中寻找更多活性较好的抗SARS-CoV-2药物先导化合物,本课题组对30株植物内生真菌的大米发酵提取物进行了活性筛选,发现有多株菌株对SARS-CoV-2 Mpro有明显的抑制作用。其中1株大蓟Fisch. ex DC.内生真菌sp. DJ-1的组分在40 μg/mL质量浓度下对SARS-CoV-2 Mpro的抑制率达75.0%,提示该菌株代谢物中极有可能存在抗COVID-19活性较好的化合物。为了挖掘该菌株抑制SARS-CoV-2 Mpro活性的化学成分,进一步对sp. DJ-1进行扩大发酵。综合运用现代色谱和光谱技术,从sp. DJ-1的大米发酵粗提物中分离鉴定了17个单体化合物,分别为德加隆内酯(djalonensone,1)、5-表细链格孢烯(5-epialtenuene,2)、细链格孢烯(altenuene,3)、4-表细链格孢烯(4-epialtenuene,4)、3-表-二氢细链格孢烯A(3-- dihydroaltenuene A,5)、瓶霉酚(phialophoriol,6)、1-脱氧红藻内酯(1-deoxyrubralactone,7)、6-羟基-8-甲氧基-3a-甲基-3a,9b-二氢-3-呋喃并[3,2-]异色烯-2,5-二酮(6-hydroxy-8-methoxy-3a-methyl-3a,9b- dihydro-3-furo[3,2-c]isochromene-2,5-dione,8)、黄色篮状菌酮(talaroflavone,9)、链格孢毒素II(altertoxin II,10)、二氢链格孢苝醇(dihydro- alterperylenol,11)、2-(2-羟基丙基)-5-甲基-7-羟基色酮[2-(2-hydroxypropyl)-5-methyl-7-hydroxy- chromone,12]、7-羟基-2-羟甲基-5-甲基-4-色烯-4-酮(7-hydroxy-2-hydroxymethyl-5-methyl-4-chromen- 4-one,13)、三环链格孢霉烯6b(tricycloalternarene 6b,14)、三环链格孢霉烯D(tricycloalternarene D,15)、苯乙醇(2-phenylethan-1-ol,16)和对羟基苯甲醛(4-hydroxybenzaldehyde,17)。活性测定发现,化合物5、9和11对SARS-CoV-2 Mpro有较好的抑制作用,其半数抑制浓度(median inhibition concentration,IC50)分别为42.77、25.85和24.26 μmol/L。
1 仪器与材料
1.1 仪器
Avance III HD 600 MHz核磁共振波谱仪(瑞士Bruker公司),Acquity UPLC I-Class plus Xevo G2-XS Qtof高分辨液质联用仪(美国Waters公司),AUTOPOL V plus高精度旋光仪(美国鲁道夫公司),SpectraMax i3x多功能酶标仪(美国Molecular Devices公司),Aglient 1100高效液相色谱仪(美国Aglient公司),Venusil MP-C18柱(250 mm×10 mm,5 μm;美国Aglient公司),LDZX-40B型立式自动电热蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂),SW-CJ-ZFD型无菌操作台(苏净集团安泰公司),DHP-9082型电热恒温培养箱(上海一恒科学仪器有限公司),ZWY-2112B型恒温培养振荡器(上海智城分析仪器制造有限公司)。
1.2 材料
正相色谱柱硅胶(200~300目,青岛谱科公司)、2019-nCoV Mpro/3CLpro抑制剂筛选试剂盒(上海碧云天生物技术有限公司)、依布硒(Ebselen,上海碧云天生物技术有限公司)、大米(秋田小町)、马铃薯、葡萄糖、琼脂、娃哈哈纯净水、乙腈(色谱纯)、二甲基亚砜(DMSO)、二氯甲烷、甲醇、石油醚、醋酸乙酯(均为分析纯)。
大蓟植株采自云南省昆明市呈贡区,经云南民族大学熊勇副教授鉴定为菊科蓟属植物蓟Fisch. ex DC.。本实验所用菌株从新鲜的大蓟茎部分离得到,根据其菌落形态特征和ITS rDNA序列比对鉴定为盾壳霉属sp.,登录号(MH205926.1)。菌株培养在斜面并保存于云南民族大学国家民委民族药内生菌天然产物合成生物学重点实验室。
2 方法
2.1 菌株筛选
将30株内生真菌用PDA培养基活化后分别接种到PDB培养基中,在28 ℃、200 r/min的条件下培养3 d;将种子液以10%的接种量接种到大米培养基中,在28 ℃组培室静置培养30 d后,在无菌条件下,分别取出20 g大米发酵物,用醋酸乙酯超声萃取2次,每次用100 mL醋酸乙酯,将2次萃取的醋酸乙酯减压浓缩得到粗提组分。将此粗提组分溶解于DMSO中,终质量浓度为40 μg/mL;利用2019-nCoV Mpro/3CLpro抑制剂筛选试剂盒进行SARS-CoV-2 Mpro活性实验,通过酶标仪读取相应的荧光值,计算分析抑制效果,以此筛选出对SARS-CoV-2 Mpro抑制效果最好的活性菌株。
2.2 扩大发酵
菌株sp. DJ-1用PDA平板活化,将长满菌落的平板切成1 mm×1 mm×1 mm的小块,以5%的接种量加入到10瓶PDB培养基中,每瓶体积为200 mL,在28 ℃、200 r/min条件下培养3 d,此10瓶作为大量发酵的种子液。配制100瓶大米培养基(大米80 g、珍珠岩10 g、100 mL纯净水),高温灭菌备用。将10瓶种子液以10%的接种量加入到100瓶大米培养基中,于28 ℃组培室静置培养30 d。
2.3 提取与分离
采用醋酸乙酯对菌株sp. DJ-1的大米发酵物超声提取,每次20 L,提取4次。将提取液减压浓缩,得到78 g总浸膏;经正相硅胶柱色谱,二氯甲烷-甲醇(1∶0→1∶1)梯度洗脱,合并相同流分得到9个组分(Fr. 1~9)。Fr. 2(7.5 g)经正相硅胶柱色谱,石油醚-醋酸乙酯(30∶1→0∶1)洗脱,得到5个亚组分(Fr. 2-1~2-5)。Fr. 2-3经半制备HPLC(乙腈-水47∶53)得到化合物16(3.1 mg);Fr. 2-5经半制备HPLC(乙腈-水58∶42)得到化合物7(6.1 mg)和8(33 mg)。Fr. 4(6.0 g)经正相硅胶柱色谱,石油醚-醋酸乙酯(10∶1→1∶1)洗脱,得到7个亚组分,其中Fr. 4-2经半制备HPLC(乙腈-水38∶62)得到化合物17(14.2 mg);Fr. 4-5经半制备HPLC(乙腈-水67∶33)得到化合物1(26.1 mg)、6(3.4 mg)、10(31.0 mg)和15(10.5 mg)。Fr. 6(5.8 g)经正相硅胶柱色谱,石油醚-醋酸乙酯(5∶1→0∶1)洗脱,得到6个亚组分,其中Fr. 6-4经半制备HPLC(乙腈-水52∶48)得到化合物11(6.0 mg);Fr. 6-5经半制备HPLC(乙腈-水45∶55)得到化合物2(3.3 mg)、3(30.3 mg)和9(4.2 mg)。Fr. 7(1.1 g)经RP-18柱色谱并结合半制备HPLC纯化,得到化合物4(7.4 mg)、5(4.0 mg)、12(7.6 mg)、13(2.0 mg)和14(2.5 mg)。
2.4 SARS-CoV-2 Mpro抑制活性测定
在荧光共振能量转移的基础上,通过2019-nCoV Mpro/3CLpro抑制剂筛选试剂盒(增强型)对SARS-CoV-2 Mpro进行抑制实验。将所有待测化合物溶解于DMSO中,备用。设空白组、100%酶活性组、阳性对照组和给药组。在黑色的96孔板中,各组分别加入90 μL的Assay Buffer,100%酶活性组、阳性对照组和给药组加入1 μL SARS-CoV-2 Mpro、空白组补加1 μL Assay Buffer,空白组和100%酶活性组各加入5 μL DMSO,阳性对照组和给药组分别加入5 μL的阳性药物依布硒(Ebselen)和待测化合物溶液,混匀。在37 ℃恒温避光孵育30 min后,转移至冰上冷却10 min,再快速加入4 μL底物,混匀。然后,在SpectraMax i3x多功能酶标仪上读取相对荧光单元(relative fluorescence unit,RFU),激发波长为325 nm,发射波长为393 nm。按照公式计算各化合物对SARS-CoV-2 Mpro的抑制率。
抑制率=(RFU100%酶活性-RFU样品)/(RFU100%酶活性-RFU空白)
3 结果与分析
3.1 菌株筛选结果
采用2019-nCoV-Mpro/3CLpro抑制剂筛选模型对30株菌株的大米发酵组分进行活性筛选,结果见表1。根据结果可以判断出在这30株菌株中,有9株菌的抑制率≥60.0%,其中菌株sp. DJ-1的抑制效果是最好的,抑制率为75.0%。

表1 30株内生真菌的来源和SARS-CoV-2 Mpro抑制活性
“–”表示无抑制作用
“–”means no inhibition activity
3.2 结构鉴定
化合物1:白色粉末。HR-ESI-MS/273.075 8 [M+H]+(计算值C15H13O5,273.075 7),确定分子式为C15H12O5。1H-NMR (600 MHz, CD3COCD3): 11.98 (1H, s, 3-OH), 9.27 (1H, s, 4-OH), 7.31 (1H, d,= 2.2 Hz, H-6), 6.80 (1H, m, H-5), 6.71 (1H, d,= 2.7 Hz, H-3), 6.58 (1H, d,= 2.2 Hz, H-4), 3.98 (3H, s, 5-OCH3), 2.80 (3H, s, 6-CH3);13C-NMR (150 MHz, CD3COCD3): 167.6 (C-5), 166.1 (C-7), 166.0 (C-3), 159.4 (C-4), 154.1 (C-2), 139.7 (C-6), 139.1 (C-1), 118.4 (C-5), 110.6 (C-1), 104.6 (C-6), 102.7 (C-3), 99.9 (C-4), 99.8 (C-2), 56.3 (5-OMe), 25.6 (6-Me)。以上数据与文献报道的数据基本一致[26],故鉴定化合物1为德加隆内酯。
化合物7:白色粉末。HR-ESI-MS/261.075 8 [M+H]+(计算值C14H13O5,261.075 7),确定它的分子式为C14H12O5。1H-NMR (600 MHz, CDCl3): 11.32 (1H, s, 6-OH), 6.68 (2H, t,= 1.7 Hz, H-7, 9), 3.93 (3H, s, 8-OCH3), 3.43 (1H, td,= 6.8, 1.3 Hz, H-1), 2.94 (1H, dd,= 19.0, 6.5 Hz, H-2α), 2.30 (1H, dd,= 18.9, 1.3 Hz, H-2β), 1.45 (3H, d,= 7.0 Hz, 1-CH3);13C-NMR (150 MHz, CDCl3): 195.4 (C-3), 167.0 (C-8), 165.4 (C-6), 165.0 (C-5), 148.3 (C-3a), 144.8 (C-10a), 134.6 (C-9a), 103.4 (C-7), 103.2 (C-9), 100.9 (C-5a), 56.2 (8-OCH3), 42.9 (C-2), 28.5 (C-1), 21.1 (CH3-1)。以上数据与文献报道基本一致[31],故鉴定化合物7为1-脱氧红藻内酯。
化合物9:黄色固体。HR-ESI-MS/277.071 6 [M+H]+(计算值C14H13O6,277.070 6),确定它的分子式为C14H12O6。1H-NMR (600 MHz, CDCl3): 6.49 (1H, d,= 1.8 Hz, H-4), 6.33 (1H, d,= 1.6 Hz, H-6), 6.07 (1H, d,= 1.8 Hz, H-3), 4.82 (1H, s, H-5), 3.82 (3H, s, 5-OCH3), 1.92 (3H, d,= 1.5 Hz, 2-CH3);13C-NMR (150 MHz, CDCl3): 199.9 (C-4), 170.6 (C-2), 170.4 (C-1), 167.8 (C-5), 158.2 (C-7), 147.1 (C-3a), 130.0 (C-3), 104.5 (C-7a), 102.2 (C-4), 101.4 (C-6), 93.7 (C-3), 78.7 (C-5), 56.3 (5-OCH3), 13.9 (2-CH3)。以上数据与文献报道基本一致[31],因此鉴定化合物9为黄色篮状菌酮。
化合物11:红色粉末。HR-ESI-MS/351.088 3 [M-H]−(计算值C20H15O6,351.087 4),确定它的分子式为C20H16O6。1H-NMR (600 MHz, DMSO-6): 12.70 (1H, s, 3-OH), 12.29 (1H, s, 10-OH), 8.03 (1H, d,= 8.8 Hz, H-1), 7.97 (1H, d,= 8.7 Hz, H-12), 7.01 (1H, d,= 8.7 Hz, H-2), 6.91 (1H, d,= 8.6 Hz, H-11), 5.36 (1H, s, 7-OH), 5.26 (1H, s, 6a-OH), 4.54~4.43 (1H, m, H-7), 3.05 (1H, dd,= 17.3, 14.4 Hz, H-6b), 3.02 (1H, m, H-5ax), 2.98 (1H, m, H-5eq), 2.92 (1H, d,= 8.3 Hz, H-8ax) 2.83 (1H, dd,= 15.8, 4.6 Hz, H-8eq), 2.59~2.50 (1H, m, H-6ax), 2.27 (1H, td,= 14.3, 3.9 Hz, H-6eq);13C- NMR (150 MHz, DMSO-6): 206.1 (C-4), 204.2 (C-9), 161.0 (C-3), 160.4 (C-10), 140.7 (C-9b), 138.4 (C-12c), 132.9 (C-1), 132.6 (C-12), 124.8 (C-12a), 123.5 (C-12b), 117.9 (C-2), 116.5 (C-9a), 115.6 (C-11), 113.8 (C-3a), 68.0 (C-6a), 64.7 (C-7), 51.4 (C-6b), 47.5 (C-8), 34.8 (C-6), 33.5 (C-5)。以上数据与文献报道基本一致[34],故鉴定化合物11为二氢链格孢苝醇。
化合物12:白色粉末。HR-ESI-MS/235.096 7 [M+H]+(计算值C13H15O4,235.096 4),确定它的分子式为C13H14O4。1H-NMR (600 MHz, CD3OD): 6.62 (1H, d,= 2.5 Hz, H-6), 6.60 (1H, dd,= 2.4, 1.1 Hz, H-8), 6.03 (1H, s, H-3), 4.16 (1H, m, H-2), 2.68 (3H, s, 5-CH3), 2.63 (2H, m, H-1), 1.25 (3H, d,= 6.3 Hz, 2-CH3);13C-NMR (150 MHz, CD3OD): 182.1 (C-4), 167.2 (C-2), 163.7 (C-7), 161.7 (C-9), 143.7 (C-5), 118.4 (C-3), 115.8 (C-10), 112.6 (C-6), 101.9 (C-8), 66.5 (C-2), 44.4 (C-1), 23.7 (2-CH3), 23.3 (CH3-5)。以上数据与文献报道基本一致[35],故鉴定化合物12为2-(2-羟基丙基)-5-甲基-7-羟基色酮。
化合物13:白色粉末。HR-ESI-MS/207.065 3 [M+H]+(计算值C11H11O4,207.065 1),确定它的分子式为C11H10O4。1H-NMR (600 MHz, CD3OD): 6.66~6.62 (2H, m, H-6, 8), 6.22 (1H, d,= 1.1 Hz, H-3), 4.43 (2H, d,= 1.0 Hz, 2-CH2OH), 2.71 (3H, s, 5-CH3);13C-NMR (150 MHz, CD3OD): 182.1 (C-4), 168.7 (C-2), 163.9 (C-7), 161.3 (C-8a), 143.8 (C-5), 118.4 (C-6), 115.8 (C-4a), 109.1 (C-3), 101.8 (C-8), 61.3 (2-CH2OH), 23.2 (5-CH3)。以上数据与文献报道基本一致[36],故鉴定化合物13为7-羟基-2-羟甲基- 5-甲基-4-色烯-4-酮。
化合物16:无色油状物。HR-ESI-MS/145.062 6 [M+Na]+(计算值C8H10ONa,145.062 3),确定它的分子式为C8H10O。1H-NMR (600 MHz, CDCl3): 7.35~7.29 (2H, m, H-4), 7.24 (3H, m, H-2, 3, 5, 6), 3.87 (2H, td,= 6.6, 1.4 Hz, H-8), 2.88 (2H, dd,= 7.2, 5.9 Hz, H-7);13C-NMR (150 MHz, CDCl3): 138.6 (C-1), 129.2 (C-3, 5), 128.7 (C-2, 6), 126.6 (C-4), 63.9 (C-8), 39.3 (C-7)。以上数据与文献报道的数据基本一致[39],故鉴定化合物16为苯乙醇。
化合物17:浅黄色粉末。HR-ESI-MS/123.043 4 [M+H]+(计算值C7H7O2,123.044 0),确定它的分子式为C7H6O2。1H-NMR (600 MHz, CD3OD): 9.75 (1H, s, H-7), 7.79 (2H, d,= 8.0 Hz, H-2, 6), 6.93 (2H, d,= 8.0 Hz, H-3, 5);13C-NMR (150 MHz, CD3OD): 193.0 (C-7), 165.7 (C-4), 133.6 (C-2, 6), 130.3 (C-1), 117.1 (C-3, 5)。以上数据与文献报道的数据基本一致[40],故鉴定化合物17为对羟基苯甲醛。
3.3 化合物对SARS-CoV-2 Mpro抑制结果
以依布硒(1 μmol/L)为阳性对照,所有化合物在40 μmol/L的浓度下对SARS-CoV-2 Mpro抑制活性如图1所示。可以发现化合物1、4、6、13、16和17对SARS-CoV-2 Mpro基本无抑制作用(抑制率<10%),化合物2、3、7、8、10、12、14和15有一定抑制作用(抑制率20%~45%),而化合物5、9、11有较好的抑制作用(抑制率>48%),对化合物5、9和11进一步进行浓度梯度测试,得到IC50值分别为42.77、25.85和24.26 μmol/L。
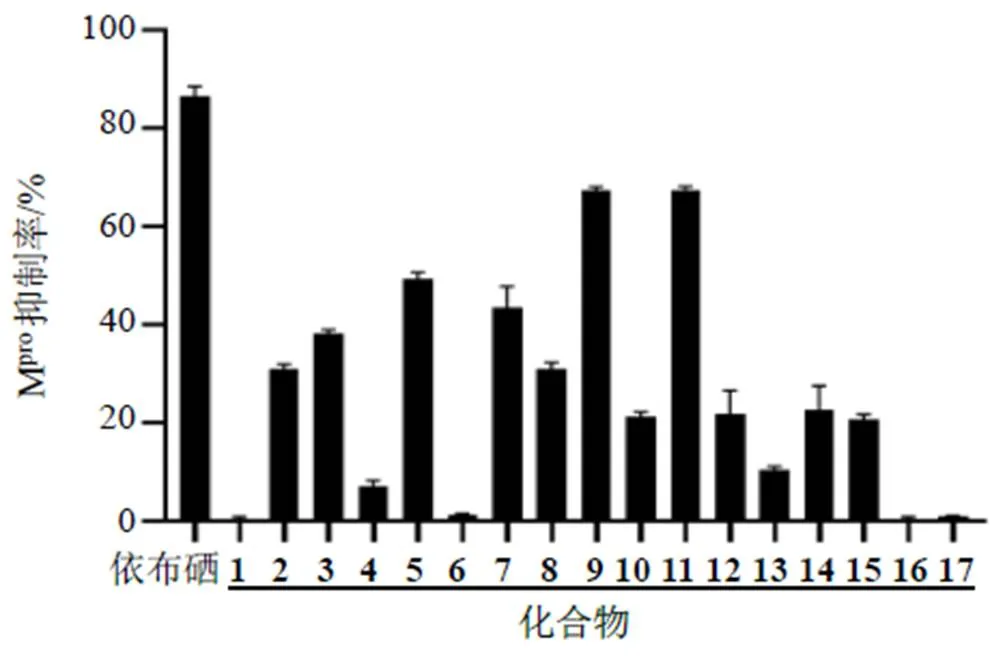
图1 化合物1~17对SARS-CoV-2 Mpro的抑制作用
4 讨论
本实验通过聚焦大量内生真菌菌株抗SARS-CoV-2活性筛选,导向发现大蓟内生真菌sp. DJ-1对SARS-CoV-2 Mpro有较好的抑制作用,并进一步对该菌抗SARS-CoV-2活性的化学成分进行研究。从sp. DJ-1菌株的大米发酵提取物中分离鉴定了17个化合物,其中化合物1~15和17均为首次从属菌株中分离得到。通过活性实验发现了该菌次生代谢产物中的主要活性成分是化合物5、9和11,IC50值分别为42.77、25.85和24.26 μmol/L。此外,本研究发现化合物11是链格孢毒素类化合物,曾被报道在2.2 μmol/L时能完全抑制HIV-1的复制[33],这意味着化合物11可能具有广谱抗病毒活性。本研究表明,通过大量内生真菌菌株的筛选并结合活性跟踪导向分离策略,可以提高抗COVID-19活性化合物发现的效率。此外,也为植物内生真菌的应用提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Wang Y M, Zhou F, Zhang D Y,. Evaluation of the efficacy and safety of intravenous remdesivir in adult patients with severe COVID-19: Study protocol for a phase 3 randomized, double-blind, placebo-controlled, multicentre trial [J]., 2020, 21(1): 422.
[2] Nakhlband A, Fakhari A, Azizi H. Interferon-beta offers promising avenues to COVID-19 treatment: A systematic review and meta-analysis of clinical trial studies [J]., 2021, 394(5): 829-838.
[3] Yildiz Pekoz A, Akbal Dagistan O, Fael H,. Pulmonary delivery of favipiravir inhalation solution for COVID-19 treatment:characterization, stability,cytotoxicity, and antiviral activity using real time cell analysis [J]., 2022, 29(1): 2846-2854.
[4] Zhao J Y, Zhang J N, Jin Y,. A trial of arbidol hydrochloride in adults with COVID-19 [J].(), 2022, 135(13): 1531-1538.
[5] Pourkarim F, Pourtaghi-Anvarian S, Rezaee H. Molnupiravir: A new candidate for COVID-19 treatment [J]., 2022, 10(1): e00909.
[6] Zumla A, Chan J F W, Azhar E I,. Coronaviruses - drug discovery and therapeutic options [J]., 2016, 15(5): 327-347.
[7] Fehr A R, Perlman S. Coronaviruses: An overview of their replication and pathogenesis [J]., 2015, 1282: 1-23.
[8] Jin Z M, Du X Y, Xu Y C,. Structure of mprofrom SARS-CoV-2 and discovery of its inhibitors [J]., 2020, 582(7811): 289-293.
[9] Ahmad B, Batool M, Ain Q U,. Exploring the binding mechanism of PF-07321332 SARS-CoV-2 protease inhibitor through molecular dynamics and binding free energy simulations [J]., 2021, 22(17): 9124.
[10] Hammond J, Leister-Tebbe H, Gardner A,. Oral nirmatrelvir for high-risk, nonhospitalized adults with Covid-19 [J]., 2022, 386(15): 1397-1408.
[11] Lee D Y W, Li Q Y, Liu J,. Traditional Chinese herbal medicine at the forefront battle against COVID-19: Clinical experience and scientific basis [J]., 2021, 80: 153337.
[12] Chen Z N, Cui Q H, Cooper L,. Ginkgolic acid and anacardic acid are specific covalent inhibitors of SARS-CoV-2 cysteine proteases [J]., 2021, 11(1): 45.
[13] Alhadrami H A, Burgio G, Thissera B,. Neoechinulin A as a promising SARS-CoV-2 mproinhibitor:andstudy showing the ability of simulations in discerning active from inactive enzyme inhibitors [J]., 2022, 20(3): 163.
[14] van de Sand L, Bormann M, Alt M,. Glycyrrhizin effectively inhibits SARS-CoV-2 replication by inhibiting the viral main protease [J]., 2021, 13(4): 609.
[15] Wu Q, Yan S, Wang Y,. Discovery of 4′--methylscutellarein as a potent SARS-CoV-2 main protease inhibitor [J]., 2022, 604: 76-82.
[16] Cui J H, Jia J P. Discovery of juglone and its derivatives as potent SARS-CoV-2 main proteinase inhibitors [J]., 2021, 225: 113789.
[17] Chapman R L, Andurkar S V. A review of natural products, their effects on SARS-CoV-2 and their utility as lead compounds in the discovery of drugs for the treatment of COVID-19 [J]., 2022, 31(1): 40-51.
[18] 李乾胜, 曹灿, 李玲玲, 等. 以C-C基序趋化因子配体2 (CCL2)为受体挖掘治疗新型冠状病毒肺炎(COVID-19)潜在中药单体化合物[J]. 世界中医药, 2021, 16(3): 415-425.
[19] Singh A, Singh D K, Kharwar R N,. Fungal endophytes as efficient sources of plant-derived bioactive compounds and their prospective applications in natural product drug discovery: Insights, avenues, and challenges [J]., 2021, 9(1): 197.
[20] Wang W G, Wang H, Du L Q,. Molecular basis for the biosynthesis of an unusual chain-fused polyketide, gregatin A [J]., 2020, 142(18): 8464-8472.
[21] Wang W G, Du L Q, Sheng S L,. Genome mining for fungal polyketide-diterpenoid hybrids: Discovery of key terpene cyclases and multifunctional P450s for structural diversification [J]., 2019, 6(5): 571-578.
[22] Xiao Z H, Dong J Y, Li A,. Biocatalytic and chemical derivatization of the fungal meroditerpenoid chevalone E [J]., 2022, 9(7): 1837-1843.
[23] 何毅文, 董佳钰, 胡秋芬, 等. 药用价值真菌抗肝纤维化活性成分及其作用机制研究进展 [J]. 云南中医学院学报, 2022, 45(4): 80-95.
[24] Pang X Y, Chen W H, Wang X,. New tetramic acid derivatives from the deep-sea-derived fungussp. SCSIO06868 with SARS-CoV-2 Mproinhibitory activity evaluation [J]., 2021, 12: 730807.
[25] Liang X X, Zhang X J, Zhao Y X,. Aspulvins A-H, aspulvinone analogues with SARS-CoV-2 Mproinhibitory and anti-inflammatory activities from an endophyticsp. [J]., 2022, 85(4): 878-887.
[26] Sun H, Gao S S, Li X M,. Chemical constituents of marine mangrove-derived endophytic fungusEN-192 [J]., 2013, 31(2): 464-470.
[27] Jiao P, Gloer J B, Campbell J,. Altenuene derivatives from an unidentified freshwater fungus in the family Tubeufiaceae [J]., 2006, 69(4): 612-615.
[28] Aly A H, Edrada-Ebel R, Indriani I D,. Cytotoxic metabolites from the fungal endophytesp. and their subsequent detection in its host plant[J]., 2008, 71(6): 972-980.
[29] Tian J, Fu L, Zhang Z,. Dibenzo-α-pyrones from the endophytic fungussp. Samif01: Isolation, structure elucidation, and their antibacterial and antioxidant activities [J]., 2017, 31(4): 387-396.
[30] Ye F, Chen G D, He J W,. Xinshengin, the first altenusin with tetracyclic skeleton core fromspp [J]., 2013, 54(34): 4551-4554.
[31] Naganuma M, Nishida M, Kuramochi K,. 1-Deoxyrubralactone, a novel specific inhibitor of families X and Y of eukaryotic DNA polymerases from a fungal strain derived from sea algae [J]., 2008, 16(6): 2939-2944.
[32] Wang Q X, Bao L, Yang X L,. Polyketides with antimicrobial activity from the solid culture of an endolichenic fungussp [J]., 2012, 83(1): 209-214.
[33] Bashyal B P, Wellensiek B P, Ramakrishnan R,. Altertoxins with potent anti-HIV activity fromQUE1Se, a fungal endophyte of[J]., 2014, 22(21): 6112-6116.
[34] Zhang S Y, Li Z L, Bai J,. A new perylenequinone from a halotolerant fungus,sp. M6 [J]., 2012, 10(1): 68-71.
[35] Kashiwada Y, Nonaka G, Nishioka I. Studies on rhubarb (rhei rhizoma). V. Isolation and characterization of chromone and chromanone derivatives [J]., 1984, 32(9): 3493-3500.
[36] Kimura Y, Shiojima K, Nakajima H,. Structure and biological activity of plant growth regulators produced bysp. No. 31f [J]., 1992, 56(7): 1138-1139.
[37] Wang Q X, Bao L, Yang X L,. Tricycloalternarenes F-H: Three new mixed terpenoids produced by an endolichenic fungussp. using OSMAC method [J]., 2013, 85: 8-13.
[38] Yuan L, Zhao P J, Ma J,. Tricycloalternarenes A-E: Five new mixed terpenoids from the endophytic fungal StrainLy83 [J]., 2008, 91(8): 1588-1594.
[39] Balzer H H, Berger S. Intrinsic deuterium isotope effects of deuteriatedtert-butyl groups on the13NMR spectra of aromaticcompounds [J]., 1990, 28(5): 437-442.
[40] 梁会, 赵玉敏, 刘翰飞, 等. 贵州鼠尾草中1个新的姜黄素类化合物 [J]. 中草药, 2022, 53(18): 5593-5599.
Chemical constituents with potential anti-SARS-CoV-2 Mproactivity from endophytic fungussp. DJ-1 of
ZENG Jie-chun1, YANG Run1, HUANG Jin1, LI Yan-ping2, GAO Lu1, WANG Wei-guang1
1. Key Laboratory of Natural Products Synthetic Biology of Ethnic Medicinal Endophytes, State Ethnic Affairs Commission, School of Ethnic Medicine, Yunnan Minzu University, Kunming 650031, China 2. College of Traditional of Chinese Medicine, Yunnan University of Chinese Medicine, Kunming 650500, China
To study the chemical constituents with severe acute respiratory syndrome coronavirus 2 main protease (SARS-CoV-2 Mpro) inhibitory activity fromsp. DJ-1, an endophytic fungus isolated from.The strains and chemical constituents both with inhibitory activity were screened from thirty endophytic fungi by using 2019-nCoV Mpro/3CLproinhibitor screening model. The secondary metabolites of the strain with high inhibition rate were separated and purified by normal phase silica gel column chromatography, reversed-phase RP-18 column chromatography, and HPLC. Their structures were identified by NMR, MS, and optical rotation data. And the compounds’ anti-SARS-CoV-2 Mproactivities were determined by fluorescence resonance energy transfer method.Thesp. DJ-1 strain with good inhibitory activity was screened from thirty endophytic fungi. Seventeen compounds were isolated from the rice fermentation extract ofsp. DJ-1, and identified as djalonensone (1), 5-epialtenuene (2), altenuene (3), 4-epialtenuene (4), 3--dihydroaltenuene A (5), phialophoriol (6), 1-deoxyrubralactone (7), 6-hydroxy-8-methoxy-3a-methyl-3a,9b-dihydro-3- furo[3,2-]isochromene-2,5-dione (8), talaroflavone (9), altertoxin II (10), dihydroalterperylenol (11), 2-(2-hydroxypropyl)-5- methyl-7-hydroxychromone (12), 7-hydroxy-2-hydroxymethyl-5-methyl-4-chromen-4-one (13), tricycloalternarene 6b (14), tricycloalternarene D (15), 2-phenylethan-1-ol (16) and 4-hydroxybenzaldehyde (17). Compounds 5, 9 and 11 exhibited potent inhibitory effects on SARS-CoV-2 Mprowith IC50values of 42.77, 25.85 and 24.26 μmol/L, respectively.Compounds 1—15 and 17 have been isolated from the extracts ofsp. genus for the first time. Compounds 5, 9 and 11 exhibit potent inhibitory effects on SARS-CoV-2 Mpro. The research concludes that the method of screening active strains is helpful for us to quickly excavate active compounds from natural fungal products, moreover provides a basis for the research and development of drugs for COVID-19.
Fisch. ex DC.;sp.; endophytic fungus; secondary metabolites; antiviral activity; SARS-CoV-2 Mpro; 3--dihydroaltenuene A; talaroflavone; dihydroalterperylenol
R284.1
A
0253 - 2670(2023)10 - 3071 - 09
10.7501/j.issn.0253-2670.2023.10.004
2023-01-24
国家自然科学基金项目(31960095);国家自然科学基金项目(82160670);云南省应用基础项目(202101AS070022,202201AT070228);云南省万人计划-青年拔尖人才(W.-G. Wang)
曾洁醇(1997—),女,硕士研究生,研究方向为天然产物化学。E-mail: mzengjiechun@163.com
汪伟光(1984—),男,研究员,硕士生导师,研究方向为天然药物化学。E-mail: wwg@live.cn
[责任编辑 王文倩]
