360 例胃肠道肿瘤患者术前合并肌肉减少症的现状及影响因素分析
2023-05-18张莹朱永健
张莹,朱永健
(1.青岛大学护理学院,山东 青岛 266000;2.烟台毓璜顶医院,山东 烟台 264000)
胃肠道肿瘤主要包括胃癌和结直肠癌[1],肌肉减少症在胃癌患者中的发生率为10%~57.7%, 在结直肠癌患者中的发生率为12%~71%[2]。 肌肉减少症(以下简称肌少症)是一种肌肉含量减少和肌肉功能减退的综合征[3],会延长患者的住院时间,增加化疗不良反应,远期预后较差[4]。 有研究显示,将肌少症的干预时机从术后提到术前,以预康复的理念提高患者应对化疗、手术等应激能力,可以降低化疗、术后的并发症[5]。 Kim[6]报道,胃癌根治性胃切除术患者肌少症的影响因素为女性、体质量减轻、肿瘤位于近端和肿瘤分化。 Xiao[7]调查了非转移性结直肠癌患者肌少症的影响因素,结果显示肌少症的发生与年龄、种族、总脂肪组织有关。肌少症与不同强度的体力活动水平息息相关,缺乏运动是导致肌肉质量和力量损失的重要因素[8],老年患者卧床休息10 d 会导致骨骼肌大量减少[9]。 目前我国对胃肠道肿瘤发生肌少症的影响因素方面的研究相对较少。本研究旨在调查胃肠道肿瘤患者术前肌少症发生现状,探讨其影响因素,以期为术前给予针对性的干预措施,防止和延缓肌少症的发生和发展提供一定的参考和依据。
1 对象与方法
1.1 研究对象 采用便利抽样法, 抽取2021 年3月—2022 年1 月于烟台市某三级甲等医院胃肠外科住院的胃肠道肿瘤术前患者为研究对象。 纳入标准:(1)年龄≥18 岁;(2)经病理学诊断,确诊为胃肠道恶性肿瘤;(3) 尚未进行胃肠道肿瘤根治性手术;(4)具有一定的读写能力、语言沟通能力良好;(5)自愿合作者并签署知情同意书。 排除标准:(1)不能接受肌肉力量或体能测试的身体畸形;(2)体内装有金属医疗器械或心脏起搏器等。
根据样本量计算公式[10],每个自变量需要5~10例患者。 本研究共纳入14 个自变量,按照自变量的10 倍计算样本量,考虑20%的失访率,估算需要样本14×10÷80%≈175 例,实际纳入360 例。本研究获青岛大学医学部伦理委员会审核批准(QDU-HEC-2021171)。
1.2 调查工具
1.2.1 一般资料调查表 自行编制, 包括一般人口学特征(性别、年龄、吸烟史、饮酒史)、合并慢性病情况(糖尿病、高血压、脑卒中、冠心病)、肿瘤分期、体质量指数。
1.2.2 Barthel 指数评定量表(Barthel Index, BI)本研究采用Barthel 指数评定量表评估患者的日常生活活动能力。 Barthel 指数评定量表由Mahoney 和Barthel[11]于1965 年设计并应用于临床,中文版由侯东哲[12]于2012 年汉化,主要用于评估脑卒中患者,量表的Cronbach α 系数为0.916。 该量表共10 个条目,包括进食、洗澡、修饰、穿衣、控制大便、控制小便、上厕所、床椅转移、平地行走、上下楼梯。 其中洗澡和修饰的得分范围为0~5 分,进食、穿衣、控制大便、控制小便、上厕所以及上下楼梯6 个条目的得分范围为0~10 分,床椅转移和平地行走的得分范围为0~15 分。 总分为0~100 分,分数越低表示患者的依赖性越大。 根据得分情况可以分为4 个等级,≤40分为重度依赖,41~60 分为中度依赖,61~99 分为轻度依赖,100 分为完全独立,无需他人照护[13]。
1.2.3 国际体力活动问卷短卷(International Physical Activity Questionnaire Short Form,IPAQ-SF) 本研究采用国际体力活动问卷短卷评估患者的体力活动水平。 源问卷由世界卫生组织[14]于1998 年制定,用于评估成人的体力活动水平和久坐时长。 中文版由屈宁宁等[15]于2004 年汉化,主要用于调查大学生群体的体力活动和久坐时长, 问卷的重测信度为0.626~0.887。 问卷共7 个条目,调查患者过去1 周内从事高等强度、 中等强度和步行这3 种不同强度体力活动的情况及每天静坐时间。 受试者每周从事某种强度体力活动水平为=该体力活动对应的MET赋值×每周频率(d/w)×每天的活动时间(min/d),其中,步行的MET 赋值为3.3,中等强度活动的赋值为4.0,高等强度活动的赋值为8.0。 总体力活动水平为3 种不同强度活动水平之和。 根据国际体力活动问卷工作组推荐的分组标准[16],按照患者每周活动时间及能量消耗总量将患者的活动水平分为高等水平、中等水平和低等水平。
1.2.4 上臂围、 腰围 上臂围测量采用无弹性的皮尺。研究对象手臂自然下垂,测量身体非优势侧肩峰与尺骨鹰嘴连线中点的周径,精确到0.1 cm。 测量2次,取平均值。
腰围测量采用无弹性的皮尺。 除去患者腰部覆盖衣物,轻松站立,将皮尺放在胯骨上缘与肋骨下缘连线的中点,与地面平行绕腹1 周,紧贴而不挤压皮肤,在正常呼气末测量腰围的长度。 测量2 次,取平均值。
1.3 肌少症的诊断 本研究肌少症的诊断采用2019 年亚洲肌少症工作组(Asian Working Group for Sarcopenia, AWGS)共识报告[17],肌少症定义为肌肉质量降低加肌肉力量降低和/或体能下降。
1.3.1 肌肉质量测定 采用Inbody S10 人体成分分析仪(韩国Biospace Co.Ltd) 测量受试者的肌肉质量, 结果以四肢骨骼肌质量与身高平方的比值(kg/m2)表示。 亚洲肌少症工作组推荐的分界值为女性<5.7 kg/m2,男性<7.0 kg/m2[17]。
1.3.2 肌肉力量和体能测定 肌肉力量的评估采用握力测试,通过JAMAR 握力计(广东香山衡器集团股份有限公司,CAMRYEH101)来测量,用2 只手或惯用手,用最大努力等距收缩并进行至少2 次测试,选取最大读数。 亚洲肌少症工作组推荐的分界值为男性握力值<28 kg,女性握力值<18 kg[17]。
体能测定采用6 m 步行速度, 计算患者从移动开始以正常步速行走6 m 所需的时间, 中途不加速不减速,至少测量2 次,记录平均速度。 亚洲肌少症工作组将阈值定位<1.0 m/s 为骨骼肌功能下降的诊断标准[17]。
1.4 资料收集方法 本研究调查团队由2 名营养科医师和3 名护士长(经过营养相关培训)组成。 在调查问卷发放前, 由调查者向调查对象介绍本研究的目的、方法及意义,并详细告知填写的注意事项,获得调查对象的知情同意后进行问卷的填写及资料收集,一般人口学特征、合并慢性病情况、Barthel 指数评定量表、 中文版国际体力活动问卷短卷由患者自行填写,肿瘤分期、上臂围、腰围、体质量指数、握力、6 m 步行速度由研究者填写。在填写过程中如有疑问,调查人员及时解释。 对于年龄较大、文化程度较低、视物不清者等情况,问卷由调查人员逐条口述, 根据患者情况如实填写。 问卷当场发放当场收回,在回收问卷的同时,由现场调查人员检查条目是否有遗漏; 如有遗漏, 则立即返还研究对象进行填补。 本研究共发放问卷375 份, 回收有效问卷360份,有效回收率为96.0%。
1.5 统计学方法 采用SPSS 26.0 分析数据。 符合正态分布的定量资料采用均数±标准差描述,组间比较采用两独立样本t 检验; 非正态分布的定量资料采用中位数和四分位数间距描述, 组间比较采用Mann-Whitney U 检验;定性资料采用频数和构成比描述,组间比较采用χ2检验。 将差异有统计学意义的变量纳入进行二分类Logistic 回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 360 例胃肠道肿瘤术前患者, 年龄(63.71±11.08)岁,其中男性232 例(64.4%),女性128 例(35.6%);81 例(22.5%)有 吸 烟 史;68 例(18.9%)有饮酒史;99 例(27.5%)合并糖尿病;109例(30.3%)合并高血压;22 例(6.1%)合并冠心病;16例(4.4%)合并脑卒中;肿瘤分期:I~II 期200 例(55.6%),III~IV 期160 例(44.4%);体 质 量 指 数(23.64±3.44)kg/m2。
2.2 胃肠道肿瘤患者术前肌少症发生情况及不同特征胃肠道肿瘤患者术前发生肌少症的单因素分析360 例胃肠道肿瘤患者, 根据2019 年亚洲肌少症工作组的诊断标准[11],81 例(22.5%)患者术前发生肌少症。 根据是否发生肌少症分成2 组,非肌少症组(n=279)和肌少症组(n=81),比较2 组不同特征胃肠道肿瘤患者术前肌少症发生情况。结果显示:不同性别、合并高血压、合并脑卒中的胃肠道肿瘤患者,其术前肌少症的发生情况比较,差异均无统计学意义(P>0.05);不同年龄、吸烟史、饮酒史、肿瘤分期、合并糖尿病、合并冠心病、日常生活能力、体力活动水平、上臂围、腰围、体质量指数的胃肠道肿瘤患者,其术前肌少症的发生情况比较,差异均有统计学意义(P<0.05),见表1。
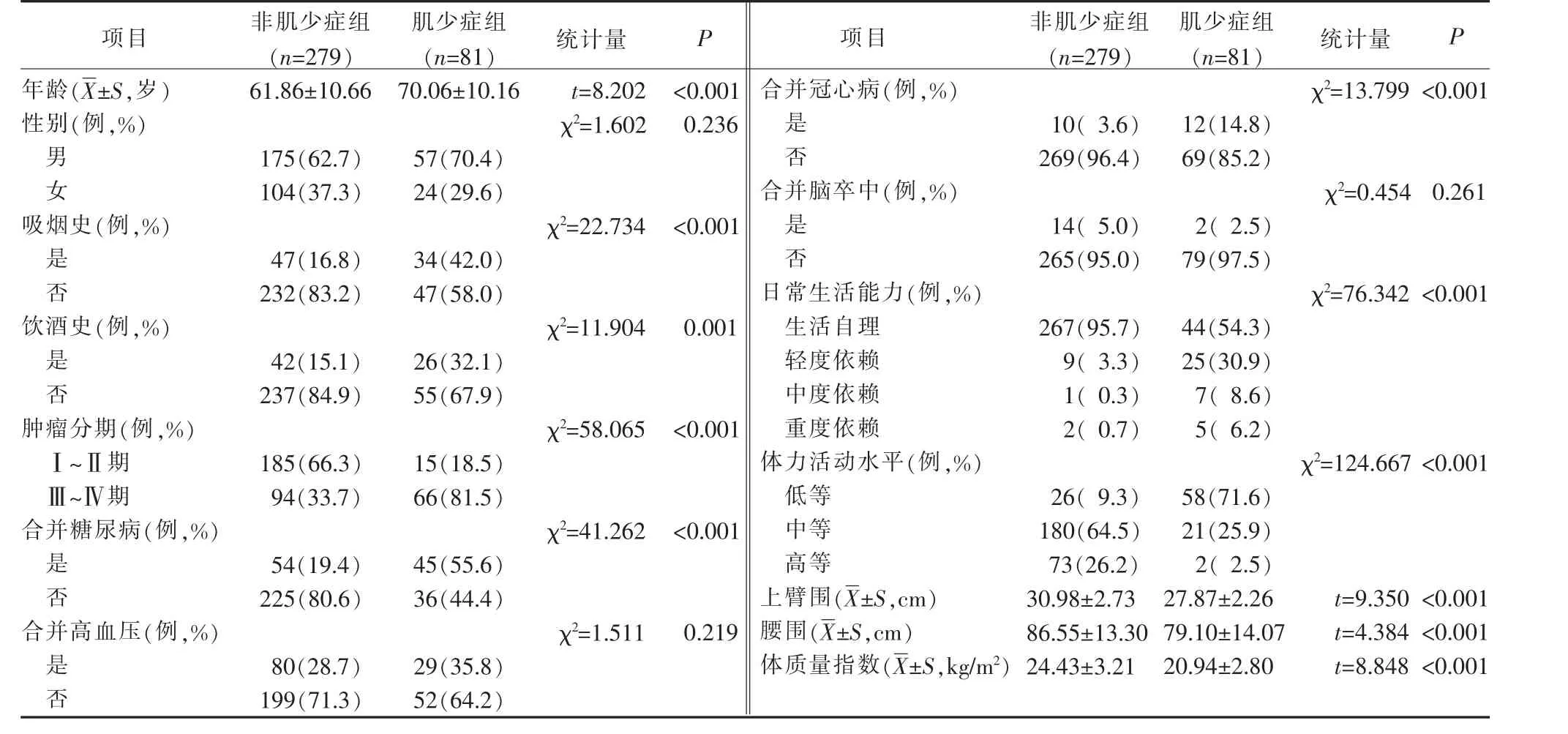
表1 不同特征胃肠道肿瘤患者术前肌少症发生情况的比较
2.2 胃肠道肿瘤患者术前发生肌少症的多因素分析 以术前是否发生肌少症为因变量(是=1,否=0),以单因素分析中差异有统计学意义的11 个变量(吸烟史、饮酒史、肿瘤分期、合并糖尿病、合并冠心病、日常生活能力、体力活动水平、年龄、上臂围、腰围、体质量指数)为自变量,进行二分类Logistic 回归分析。 结果显示,饮酒史(OR=3.181)、肿瘤分期(OR=6.402)、合并糖尿病(OR=6.156)、日常生活能力(OR=5.297)是肌少症的危险因素,体质量指数(OR=0.751)、体力活动水平(OR=0.101;OR=0.078)是术前肌少症的保护性因素。 Hosmer-Lemeshow 检验χ2=4.860(P=0.772), 表明模型的拟合度良好, 模型系数的Omnibus 检验结果χ2=217.946(P<0.001)。 见表2。
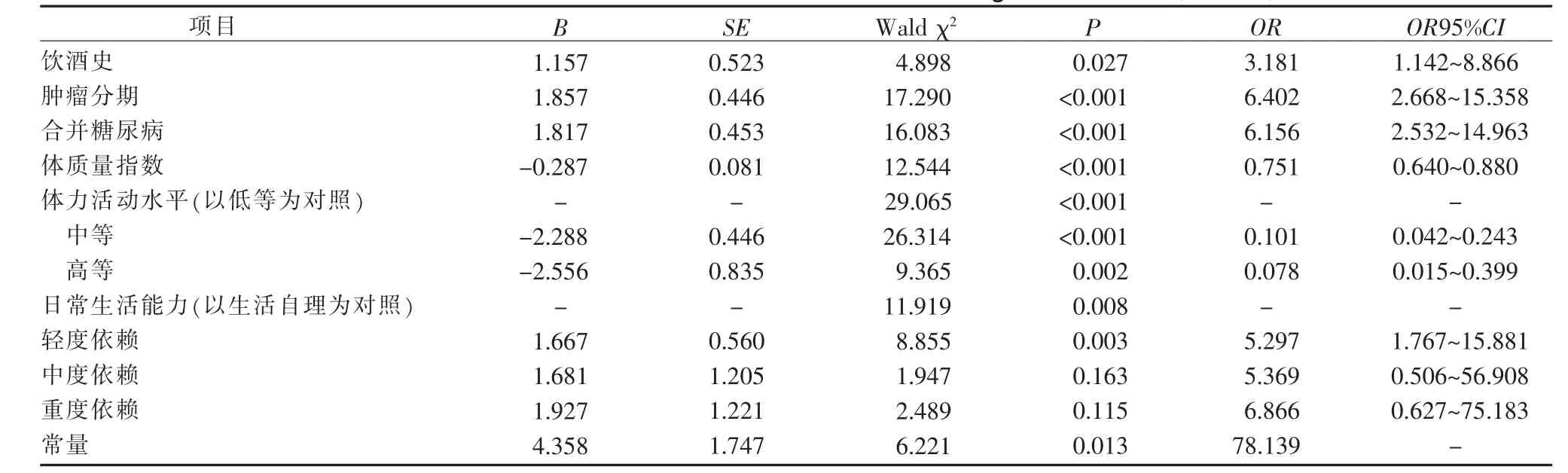
表2 胃肠道肿瘤患者术前肌少症影响因素的二分类Logistic 回归分析(n=360)
3 讨论
3.1 22.5%的胃肠道肿瘤患者术前有肌少症 本研究结果显示,根据2019 年亚洲肌少症工作组的诊断标准,胃肠道肿瘤患者术前肌少症发生率为22.5%,低于Wang[18]报道的28.9%。 可能是因为本研究调查人群为胃肠道肿瘤术前的患者, 由于癌症的侵袭作用,大部分患者会出现食欲下降、恶心、疼痛等反应,导致患者摄入量减少,体内蛋白质合成不足,导致肌少症的发生,但患者未经历手术的创伤应激,不会因为手术应激下代谢的特征模式丧失一部分肌肉质量[19],所以本研究的胃肠道肿瘤患者肌少症的发生率略低。
3.2 胃肠道肿瘤患者术前发生肌少症的影响因素
3.2.1 饮酒史 本研究结果显示,饮酒史是胃肠道肿瘤患者术前肌少症的危险因素(OR=3.181,P=0.027),即有饮酒史的患者发生肌少症的概率是无饮酒史的患者的3.181 倍;与Hong[20]的研究结果相似。究其原因, 胃肠道肿瘤患者长期饮酒可能导致肠道菌群失调和自噬诱导的高氨血症,激活myostatin、AMPK 和REDD1 和IGF-1 的失活启动肌肉蛋白质分解的上调和肌肉蛋白质合成的下调[21],从而导致肌少症的发生。 另有研究发现过量饮酒会抑制骨骼肌蛋白质合成速率, 并导致肌肉特异性E3 连接酶,atroin-1和MuRF1 上调,从而导致肌肉蛋白水解[22]。 因此,医护人员应在患者入院后了解患者是否饮酒、饮酒的年限及每天饮酒量,劝导患者戒酒;对于饮酒的患者术前应做各项肝功能检查。
3.2.2 合并糖尿病 本研究结果显示, 合并糖尿病是胃肠道肿瘤患者术前发生肌少症的危险因素(OR=6.156,P<0.001), 即合并糖尿病的患者发生肌少症的风险是未合并糖尿病患者的6.156 倍。 合并糖尿病的患者, 因存在肌肉血流灌注异常进而氧摄取量不足,导致肌肉不能摄取足够的能量,从而发生肌少症[23]。 而长期处于高糖的环境下,会导致相关炎症反应发生,产生大量的活性氧,机体处于氧化应激的状态,会进一步加剧肌少症的发病率[24]。 因此,胃肠道肿瘤合并糖尿病患者术前饮食应以低糖、 高蛋白为主。同时应密切监测血糖的变化,根据血糖变化调整胰岛素用量,术前血糖浓度应控制正常水平,以延缓肌少症的发展,提高患者对手术的耐受能力。
3.2.3 体质量指数 本研究结果显示, 体质量指数是胃肠道肿瘤患者术前肌少症的保护性因素(OR=0.751,P<0.001),即体质量指数越高,患者发生肌少症的风险越低,与Kim[6]的结果相似。 胃肠道肿瘤患者由于疾病的消耗以及进食减少, 体质量指数明显降低,体质量指数与体内脂肪的含量密切相关,体质量指数偏低说明体内脂肪含量较少, 而脂肪量的减少则会导致患者骨骼肌合成代谢速度减慢,肌肉含量下降,从而使患者发生肌少症的风险增加[25]。 医护人员应关注术前患者体质量指数的变化,对于体质量指数过低的患者,应行营养筛查,并联合营养师制定个性化的营养策略,合理安排膳食,保证患者营养的摄入[26],对于不能进食的患者,应给予肠内肠外营养支持,鼓励并指导患者进行恰当的锻炼,最大程度降低患者发生肌少症的风险,从而减少术后并发症的发生。
3.2.4 肿瘤分期 本研究结果显示, 肿瘤分期是胃肠道肿瘤患者术前肌少症的危险因素 (OR=6.402,P<0.001), 即III~IV 期患者发生肌少症的概率为I~II 期患者的6.402 倍;与Souza[27]的研究结果相似。胃肠道肿瘤III~IV 期患者由于癌细胞已经扩散到周围淋巴结以及远处的组织, 更易出现食欲下降和异常高代谢导致的负氮平衡及负能量平衡, 导致骨骼肌摄取葡萄糖减少,葡萄糖的有效利用率下降,为满足体内能量需求,肌肉内的非必需氨基酸氧化增加,促使肌肉蛋白降解加快,最终出现肌少症[28]。 因此,医护人员应关注处于III~IV 期的胃肠道肿瘤患者,及时进行营养风险筛查。 对于营养不良的患者给予营养预康复,首先考虑患者的能源需求,采用间接测热法(代谢车)测定患者的静息能量消耗,并根据其他额外运动进行调整[29],根据能量消耗补充充足的蛋白质,以家禽、乳制品、鱼肉、鸡蛋为首选;若患者无法进食可给予肠内或肠外营养支持。
3.2.5 日常生活能力 本研究结果显示, 日常生活能力是胃肠道肿瘤患者术前肌少症的危险因素(OR=5.297,P=0.003),即与生活自理为参照,患者的依赖程度越高,发生肌少症的风险越大;与王建华[30]的研究结果相似。对本研究胃肠道肿瘤术前患者而言,患者依赖程度越高, 表明患者从事体力活动时面临的困难和阻碍越多,患者的活动能力下降,会加速肌肉的衰老,易导致肌少症的发生。医护人员应加强对患者日常生活能力的评估,对于中重度依赖的患者,指导其在病情允许的情况下进食一些富含维生素D和优质蛋白的食物,并制定最容易、最切实可行的训练计划,例如:对于移动障碍(卧位-坐位)的患者,可以指导患者利用上身摆动的力量翻身至侧卧位,再用肘部和前臂支撑,躯干前屈,用上肢的力量撑起,完成坐起;设定的活动难度应比患者的能力稍高,鼓励患者尽量自己完成所有的训练步骤, 必要的时候考虑使用辅助器具,以提高患者的日常生活能力,延缓肌少症的发展。
3.2.6 体力活动水平 本研究结果显示, 体力活动水平是胃肠道肿瘤患者术前肌少症的保护性因素(中等:OR=0.101,P<0.001;高等:OR=0.078,P=0.002),即中等体力活动水平和高等体力活动水平患者肌少症的可能性低于低等体力活动水平患者;与Bilski[31]的观点一致。 体力活动是指任何由骨骼肌收缩引起的导致能量消耗的身体运动,例如工作、家务、体育运动等。研究表明,缺乏体力活动的患者更易发生骨骼肌量减少、肌力下降,而骨骼肌量下降主要是由于Ⅱ型肌纤维萎缩[32]。 适当的体力活动可以激活骨骼肌中的AMPK、p38 丝裂原活化蛋白激酶以及SIRT1,从而激活PGC-1α,促进线粒体生物的合成,优化线粒体功能,改善肌肉萎缩[33]。 目前认为,抗阻运动较有氧运动更能提高肌肉力量, 是胃肠道肿瘤患者肌少症首选的运动类型[33]。 因此,医护人员应在患者入院后及时评估其体力活动水平及身体情况, 对于体力活动水平较低的患者,为其制定详细的运动处方,例如:患者可以每周进行2~3 次弹力带抗阻运动,每次训练时间约45 min,每次运动间隔时间大于48 h,训练强度控制在患者完成时有轻度疲劳感为宜,运动持续到术前一天, 从而提高患者的肌肉含量和肌肉力量。
4 本研究的局限性
本研究的局限性在于, 只纳入了山东省1 所三级甲等医院的胃肠道肿瘤患者, 在资料收集过程中可能存在偏倚,纳入的样本量也有一定的限制,另外本研究纳入影响因素尚不全面, 未来需要开展多中心、大样本调查,深入分析胃肠道患者术前肌少症的影响因素,为临床干预提供理论依据。
