基于分子标记技术玉米抗粗缩病种质资源的筛选与应用
2023-05-17王江浩王立伟张动敏郭瑞张全国李兴华魏剑锋宋炜王宝强李荣改
王江浩,王立伟,张动敏,郭瑞,张全国,李兴华,魏剑锋,宋炜,王宝强,李荣改
基于分子标记技术玉米抗粗缩病种质资源的筛选与应用
王江浩,王立伟,张动敏,郭瑞,张全国,李兴华,魏剑锋,宋炜,王宝强,李荣改
河北省农林科学院粮油作物研究所/河北省作物遗传育种实验室,石家庄 050035
【目的】利用与3个玉米抗粗缩病位点、和紧密连锁的分子标记筛选高抗玉米粗缩病自交系,并进行杂种优势类群分类和配合力分析,为玉米抗粗缩病品种的快速高效选育提供依据和方法。【方法】将抗病自交系K36与感病自交系S221杂交,从F2开始,采用单粒传的方法构建一个包括263个F9家系的重组自交系(recombinant inbred lines,RILs)群体;在不同种植环境下,对RILs进行抗病性鉴定,同时,采用与3个抗病位点、和紧密连锁的分子标记5FR、6W53和IDP25K进行基因型分型,筛选出抗病且农艺性状优良家系;利用Maize56K SNP芯片对包括优良家系在内的24份玉米自交系进行基因型分型,根据Roger’s算法计算优良家系与其他骨干自交系之间的遗传距离,并在构建聚类图的基础上进行杂种优势类群划分;同时利用优良家系与不同类群的自交系测交配制杂交组合,在田间进行配合力测定和抗病性鉴定,筛选出抗病且杂种优势强的组合。【结果】自交系K36在、和等3个抗性位点处均为抗病性纯合基因型,自交系S221均为感病性纯合基因型。RILs群体的263个家系在粗缩病抗性遗传组成上分为21种基因型,3个位点均为抗性纯合基因型家系的病情指数(DSI)最小(0.281),均为感病性纯合基因型家系的DSI最大(0.776),这与抗、感性亲本的DSI表现一致(0.257和0.623);2个位点为感病性纯合基因型时,1个位点为抗病性纯合基因型的DSI由小到大的位点是(0.396)、(0.478)和(0.654),结果表明,抗病性最强,次之,最弱。筛选出的3个抗性位点纯合基因型家系JR2136与其他23份自交系的遗传距离变化范围为0.2234—0.2895,平均值为0.2612,与之遗传距离最小的自交系是C413,最大的是Chang7-2。根据聚类分析结果,将JR2136划分在瑞德群,与属于黄改群的自交系H92和H521配制出抗病强的优势组合,分别比郑单958增产7.01%和7.80%,表明JR2136与属于黄改群的自交系之间具有良好的配合力。【结论】玉米自交系K36对粗缩病的抗性由、和等3个基因控制、呈数量遗传特征且具有基因累加效应,具有3个抗性纯合基因型的玉米品种抗病性最强。开发的与3个位点紧密连锁的分子标记在抗病品种选育和抗性种质资源筛选上具有实用价值,利用分子标记进行辅助选择和基因聚合的方法选育抗病性强的优势组合应用于生产切实可行。
玉米粗缩病;抗病基因;分子标记辅助选择;优势类群划分;配合力
0 引言
【研究意义】玉米粗缩病(maize rough dwarf disease,MRDD)是一种由灰飞虱()传播的世界性病毒病,1949年,在意大利首次发现,后续研究发现,导致MRDD的病毒有4种,均属于呼肠孤病毒家族中的斐济病毒属(,)[1]。病毒种类因地区不同而异,在中国流行的主要是水稻黑条矮缩病毒(rice black streaked dwarf virus,RBSDV)[2-3],近年来,在长江流域及山东济宁地区也发现了感南方水稻黑条矮缩病毒(southern rice black streaked dwarf virus,SRBSDV)的玉米粗缩病株[4-5]。病毒由灰飞虱传播,小麦、玉米、水稻及禾本科的杂草是灰飞虱的寄主植物,因此,由于灰飞虱在中国黄淮海地区小麦收获前后迁飞,导致此时期播种的玉米粗缩病发生尤为严重,一般造成30%以上的产量损失,发病严重的地块甚至绝收,严重影响玉米的产量和品质[6-8]。近年来,MRDD有向北蔓延的趋势,对中国东北玉米的生产构成重大威胁[9-10]。因此,筛选抗病种质、挖掘抗病基因及选育抗病品种对防治粗缩病的发生尤显重要。【前人研究进展】近年来,国内外加大了对玉米抗粗缩病的遗传研究,尽管未发现免疫的材料,但也筛选出少量的抗性种质,如X178、Qi319、黄早四等自交系,它们分别属于衍生自美国杂交种P78599的PB亚群和国内唐四平头亚群[11-13]。遗传分析表明,玉米对粗缩病的抗性多呈数量性状特征,且包含主效基因[8, 14-17]。利用连锁分析和全基因组关联分析的方法对抗性基因(位点)进行挖掘,发现在玉米的每条染色体上均有与粗缩病抗性相关的位点,遗传背景不同的材料具有不同的抗性位点[18]。目前,中国应用的抗源主要来自美国杂交种P78599,其抗病性由位于玉米第2和第8染色体上的2个抗性主效位点和控制,呈部分显性遗传,而呈隐性遗传,并已开发出紧密连锁的分子标记[14, 19-22]。【本研究切入点】鉴于目前中国生产上应用的抗源单一且遗传效应低,不能满足玉米抗粗缩病育种与生产的需求。因此,发掘新的抗性种质、利用新的抗性基因成为玉米抗粗缩病育种的重要任务。前期通过对不同遗传背景的种质资源进行多年抗病性鉴定,发现了一个高抗玉米粗缩病的自交系K36,在第6染色体bin6.02区域存在一个抗性位点,命名为,其抗性遗传与和不同,呈显性遗传模式[23]。【拟解决的关键问题】本研究利用与3个抗性位点、和紧密连锁的分子标记对K36衍生的重组自交系群体(recombinant inbred lines,RILs)的遗传组成进行分析,并对筛选出的抗性优良家系进行杂种优势类群分类和配合力分析,为后期抗性基因分离和分子标记应用于抗病育种的辅助选择奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 重组自交系 2014年利用多年抗性鉴定筛选出的高抗玉米粗缩病自交系K36为父本,与高感玉米粗缩病的自交系S221杂交获得F1代。结合南繁加代,从F2代开始采用单粒传的方法构建了一个包括263个F9家系的重组自交系群体(RILs)。
1.1.2 24份玉米自交系的类群划分 选取包括本单位20份已知系谱来源的骨干自交系和4份从RILs筛选出的携带的抗病家系共24份材料进行类群划分(电子附表1)。
1.2 玉米粗缩病抗性的鉴定
2019年5月,将抗病亲本K36、感病亲本S221及其衍生的RILs,分别种植于山东济宁、河南原阳和河北藁城3个粗缩病高发试验点,进行田间抗病性鉴定。试验点邻近地块均为小麦田,玉米出苗后恰逢灰飞虱迁飞高峰期。玉米苗期不使用任何杀虫剂,水肥按常规管理措施进行。每个试验点田间试验采用随机区组设计,设3次重复,每份材料单行区种植,行长5 m,行距0.6 m,每行播种18穴,双粒点播,出苗后每穴定苗留1株。此外,在河北藁城试验点增设一个6月下旬播种的重复试验,以鉴别植株在非感病状态的表型。在灌浆期调查每份材料的发病情况,按单株详细记录。参照苗洪芹等[24]提出的0—4级抗性等级标准进行病情严重程度调查。在分级调查的基础上,计算每份材料的病情指数,根据病情指数将抗病性划分为免疫、高抗(high resistance,HR)、抗(resistance,R)、感(susceptibility,S)和高感(high susceptibility,HS)5级。病情指数(disease severity index,DSI)=∑(发病级值×各级病株数)/(调查总株数×最高发病级值)。
1.3 DNA的提取
在玉米苗期,采用改良的CTAB法提取植株幼叶基因组DNA,去除RNA。利用琼脂糖电泳和NanoDrop 2000型分光光度计分别检测DNA的质量和浓度。DNA样品在琼脂糖电泳中显示条带单一、完整无降解,分光光度计检测DNA样品A260/280介于1.8—2.0、A260/230介于1.8—2.0,无蛋白、RNA污染及盐离子浓度低,提取的DNA样品质量满足后续PCR扩增要求,-20 ℃保存备用。
1.4 分子标记检测
SSR标记检测:利用与连锁及和的功能性SSR标记引物(电子附表2),对RILs群体进行基因型分型并筛选抗病家系。IDP25K和GMS分别由中国农业大学徐明良教授团队和中国农业科学院作物研究所李新海教授团队开发的位点功能基因特异性引物[19-20, 25];IDP25K在B73(感病)、X178(抗病)品种的扩增产物分别为360和290 bp,并且已在玉米育种中用于分子标记辅助选择[25]。5FR引物是由李新海教授团队友情提供,与紧密连锁标记的引物,D829-0和D1347是山东农业大学刘保申教授团队开发利用,与连锁标记的引物[21];利用K36、S221测序深度30×的重测序(北京百迈客生物科技有限公司)结果,与B73的参考基因组序列比对,采用SSRHunter软件在定位区间开发在K36、S221两者之间具有多态性的SSR标记,并根据定位区间连锁遗传图谱(QTL IciMapping version 3.2)确定与抗性位点紧密连锁的SSR标记,利用(https://primer3.ut.ee/)软件设计引物,并在MaizeGDB(https://maizegdb.org/)网站进行比对,选择单拷贝的SSR引物。6W53和6W19-95是精细定位区间内连锁标记的引物,其中,6W53为紧密连锁标记的引物。在PCR扩增时,将DNA样品浓度统一用ddH2O稀释至30 ng·μL-1,在EasyCycler扩增仪上进行扩增。以50或100 bp DNA片段为分子量标准,PCR产物用1.5%—2.0%琼脂糖凝胶法或10%变性聚丙烯酰胺凝胶分离并用银染法显示产物条带,拍照读带型。
SNP标记检测:利用中玉金标记(北京)生物技术股份有限公司开发的Maize56K SNP芯片对24份自交系进行SNP基因分型用于后续类群划分。该芯片是针对国内玉米育种而研发的芯片,基于玉米B73 RefGen_v4版本基因组设计,所有标记有物理位置信息,包含56 000个SNP位点,均匀覆盖了玉米全基因组。样品核酸准备、核酸扩增在Backman自动工作站上完成;核酸标记与芯片杂交、洗涤、扫描等步骤在GeneTitan上完成。最后,利用Affymetrix (Thermo Fisher) AxiomAnalysisSuite软件进行数据分析。
1.5 杂交组合配制与鉴定
利用与、和紧密连锁的标记,从RILs群体筛选出含有3个抗性位点的家系,于2020年冬季种植在海南三亚南繁基地,与不同类群的优良自交系测交配制杂交组合。2021年5月,在石家庄藁城试验站进行田间鉴定并筛选出抗粗缩病的优势组合,并在2022年参加小区对比试验,小区为6行区,行长5 m,行距0.6 m,每行20株,对照品种为郑单958,成熟后取中间2行考种测产。
1.6 数据统计与分析
应用软件Bio-R计算24份玉米自交系两两之间的MRD(modified Roger’s distance)遗传距离,利用MEGA11软件构建UPGMA(unweighted pair-group method with arithmetic means)聚类图,进行杂种优势群划分;采用Excel 2010软件和SPSS 25.0软件对试验数据进行统计分析。
2 结果
2.1 RILs群体的粗缩病抗性鉴定
参照抗性等级标准,对双亲及RILs群体在3个不同环境下的自然发病情况进行调查分析。因在河南原阳试点田间自然发病率极低,高感病亲本S221未表现发病症状,因此,未对此试点进一步分析。263个RILs家系的平均病情指数结果显示,河北藁城有235个家系对玉米粗缩病具有一定抗性,其中43个家系表现高抗,占比为16.3%;28个家系表现感病,其中仅2个家系表现高感,占比为0.8%。山东济宁有133个株系表现具有一定抗性,其中28个家系表现高抗,占比为10.8%;130个家系表现感病,其中53个家系表现高感,占比为20.8%(表1)。自然抗病鉴定结果表明,不同的环境对病害的发生有一定的影响。
通过对山东、河北2个环境下粗缩病发病总体情况对比分析(表1和表2),发现双亲及RILs群体在2个试点的发病趋势一致,平均病情指数均是感病亲本S221>RILs群体>抗病亲本K36,山东济宁试点的病情指数高于河北藁城试点,表明山东济宁地区比河北藁城地区粗缩病的发生更严重。
用SPSS 25.0软件对2个环境下的双亲及RILs群体的病情指数进行正态分布检验,均符合正态分布(图1),具有数量遗传的特征,表明K36对粗缩病的抗性由多基因控制。
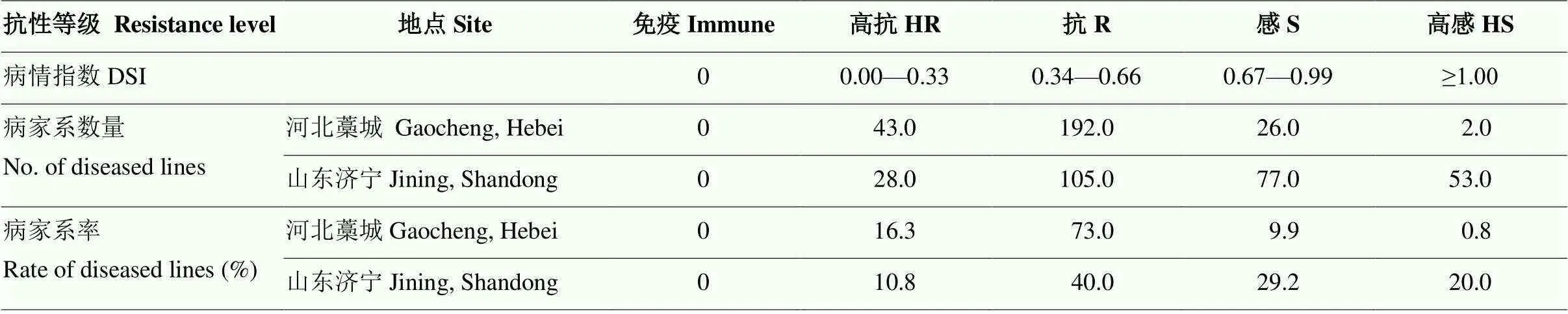
表1 263个RILs家系的抗病性鉴定结果
DSI:病情指数;HR:高抗;R:抗;S:感;HS:高感。下同
DSI:disease severity index; HR: High resistance; R: Resistantce; S: Susceptibility; HS: High susceptibility. The same as below
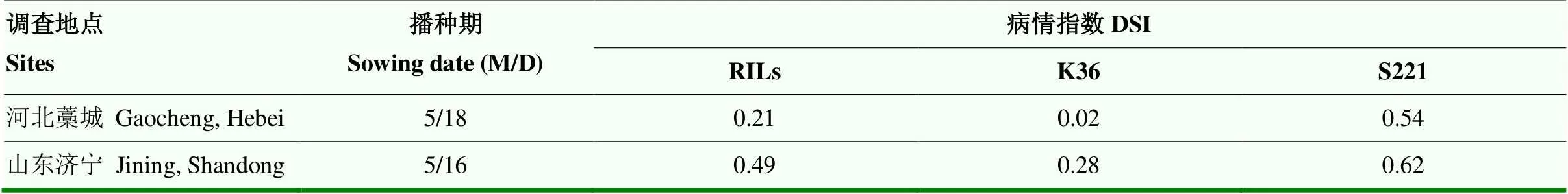
表2 2019年度山东、河北玉米粗缩病发病情况对比表
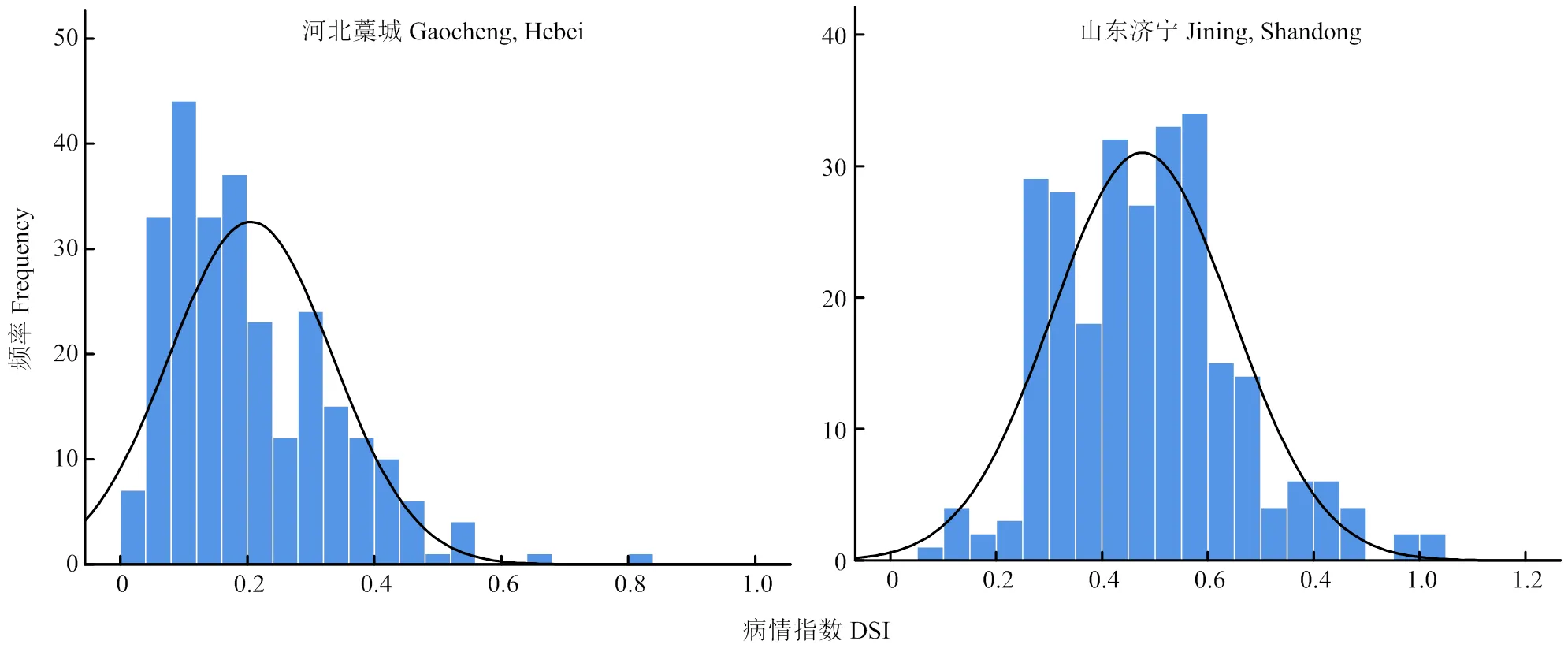
图1 河北、山东2个环境下RILs群体的病情指数分布图
2.2 双亲基因型检测
利用与3个抗性位点、和紧密连锁的分子标记,对S221、K36、JR2136、B73、X178、Ye478和Qi319等7份玉米自交系进行基因型分型(图2)。结果显示,在位点,特异性引物IDP25K与引物GMS检测的结果相同,K36、JR2136与抗病对照品种X178同为抗病性纯合基因型,而S221、Ye478和Qi319与感病对照品种B73同为感病性纯合基因型(图2-A—B);在位点,引物5FR检测到K36、JR2136、X178与抗病对照Qi319同为抗病性纯合基因型,而S221和B73与感病对照品种Ye478一致,为感病性纯合基因型(图2-C);在位点,引物6W53和6W19-95标记检测到JR2136和X178与抗病对照K36一致,都是抗病性纯合基因型,而B73、Qi319和Ye478与感病对照S221同为感病性纯合基因型(图2-D—E)。以上结果表明,在3个位点上,K36为抗病性纯合基因型,而S221为感病性纯合基因型。

A:IDP25K;B:MGS;C:5FR;D:6W53;E:6W19-95;1—8:100 bp DNA marker、S221、K36、JR2136、B73、X178、Ye478、Qi319。F:IDP25K;G:5FR;H:6W53;1—39:50 bp DNA marker、C1—C36、S221、K36
2.3 RILs群体基因型与抗病性分析
进一步利用与3个抗性位点紧密连锁或功能性分子标记,对RILs群体的263个家系进行基因型分型,并进行田间抗病性鉴定(图2-F—H,表3)。结果显示,抗病亲本K36和感病亲本S221的DSI分别为0.257和0.623。RILs群体含有21种基因型,家系的基因型不同,其DSI也不同。
在RILs群体中,3个位点均为抗病性纯合基因型家系的DSI(0.281)小于3个位点均为感病性纯合基因型家系的DSI(0.776),这与抗、感性亲本的DSI表现一致(0.257和0.623)。在2个位点为抗病性纯合基因型、一个位点为感病性纯合基因型情况下,位点为感病性纯合型的DSI(0.454)小于位点为感病性纯合型的DSI(0.622),表明当位点为感病基因型时,粗缩病的严重程度大于位点为感病基因型的品种。
2个位点为感病性纯合基因型时,一个位点为抗病性纯合基因型的DSI由小到大的位点是(0.396)、(0.478)、(0.654),结果表明,在抗病性上位点最强,次之,最弱;另外,在2个位点为感病性纯合基因型时,第三个位点为抗病性纯合基因型与杂合基因型家系的DSI比较结果显示,位点抗病性纯合型家系(0.478)明显小于杂合型家系(0.799),位点抗病性纯合型家系(0.396)略小于杂合型家系(0.475),而位点抗病性纯合型家系(0.654)与杂合型家系(0.625)差异甚小。结果表明,位点呈隐性遗传,杂合状态下表现感病;、位点呈显性遗传,并且位点的抗病性强于位点。
2.4 24份玉米自交系聚类分析
根据RILs群体263个家系的基因型分型和抗病性鉴定结果,筛选出一个3个位点均为抗性纯合基因型且农艺性状优良的家系JR2136。利用包括JR2136在内的24份玉米自交系两两之间的遗传距离构建了UPGMA聚类图(图3)。24份自交系间遗传距离的变化范围为0.0958—0.3012,平均值为0.2463,遗传距离最小的2个自交系是Ji603和Zheng58,遗传距离最大的2个自交系是Chang7-2和PBA3。JR2136与其他23份自交系的遗传距离变化范围为0.2234— 0.2895,平均值为0.2612,与之遗传距离最小的自交系是C413,而最大的自交系是Chang7-2。
R:抗病纯合型;S:感病纯合型;H:杂合型
R: disease resistant homozygote; S: disease susceptible homozygote; H: heterozygote
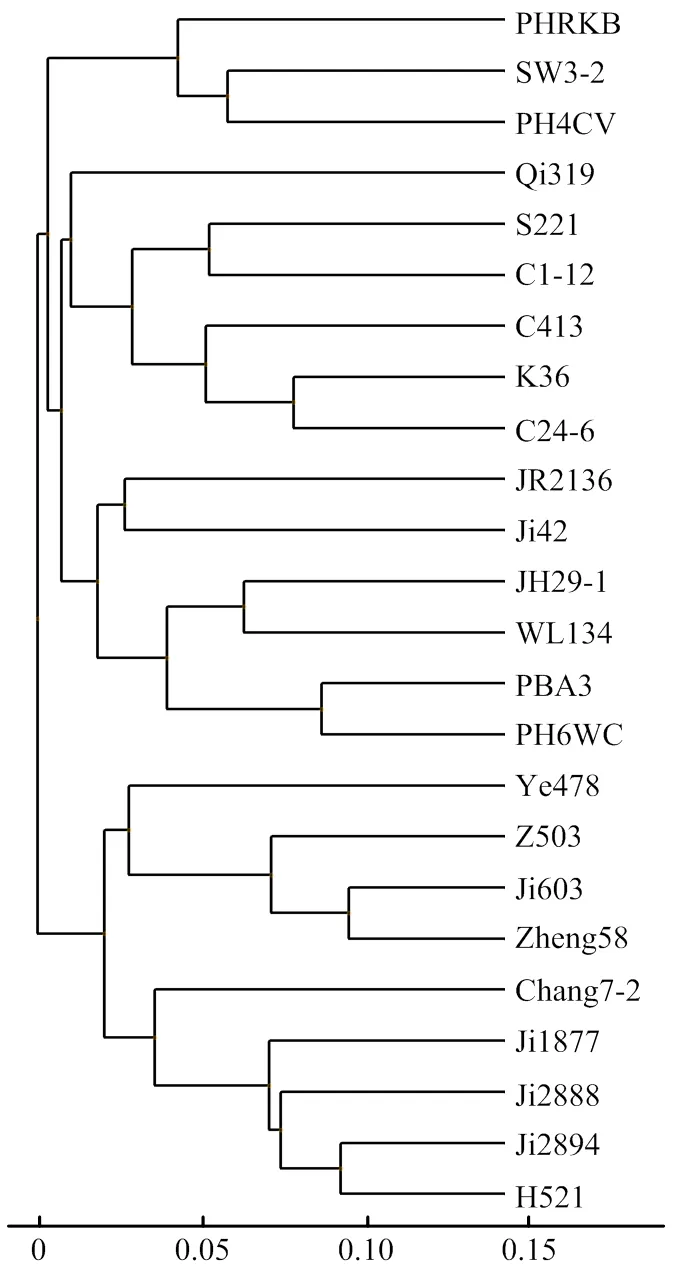
图3 24份玉米自交系基于Roger’s遗传距离构建的UPGMA聚类图
根据自交系间遗传距离和已知一些自交系所属的类群,将24份玉米自交系划分为5个类群。第Ⅰ类群由PHRKB、SW3-2和PH4CV组成,三者为先锋公司的骨干自交系或其改良系,是中国东北地区利用的重要玉米种质,可以归为先锋公司的NSS群。第Ⅱ类群包括K36、C24-6、C413、S221、C1-12和Qi319共6个自交系,K36和Qi319是分别从美国杂交种分离出来的自交系,C24-6、C413和C1-12是从K36与S221杂交选系而来(电子附表1),S221是冀15-22的变异家系,而冀15-22是本单位利用从美国商业杂交种分离出的自交系8112、掖107杂交选育出的优良自交系。这个类群具有P78599、87001等美国杂交种的血缘,可以归为P种群。第Ⅲ类群包括JR2136、Ji42、JH29-1、WL134、PBA3和PH6WC共6个自交系,其中Ji42、JH29-1、WL134和PBA3是从美国先锋杂交种中选出的母本自交系,其遗传组成偏向瑞德血缘,可以归为先锋公司的SS群或瑞德群。JR2136是从K36与S221杂交选系而来,但与具有瑞德血缘的自交系聚在同一群,间接证实S221是冀15-22开放授粉接受了具有瑞德血缘材料的花粉而产生的后代。第Ⅳ类群由Ji603、Zheng58、Z503和Ye478组成,Zheng58是Ye478的变异株,而Ji603、Z503是本单位从以Zheng58为母本的杂交种郑单958构建的母本选系群中选育的自交系,因此,四者之间血缘关系比较近,被划分在同一类群,可称为改良瑞德群。第Ⅴ类群包括Chang7-2、Ji1877、Ji2888、Ji2894和H521共5个自交系,除Chang7-2以外的4份材料是从以Chang7-2为父本的杂交种郑单958构建的父本选系群中选育的自交系,且血缘关系更倾向Chang7-2,可称为黄改群或唐四平头群。从第Ⅳ、Ⅴ两类群包含的自交系可知,它们是以杂交种郑单958为基础选系材料,按系谱法分离选育出的一系列Zheng58或Chang7-2改良系。
2.5 3个抗性位点纯合基因型家系JR2136的利用
利用JR2136与不同类群的优良自交系广泛测配,通过2年的田间测试,筛选出2个高抗粗缩病的优势组合JR2136×H92和JR2136×H521。自交系H92是由Chang7-2与自交系9801杂交2次后再与WK798-2(伟科702父本)杂交而获得的改良系,与H521同属于黄改群(电子附表1和图3),表明JR2136所在的瑞德群(SS)与黄改群的自交系之间有很好的配合力。在河北石家庄地区夏播种植,种植密度为67 500株/hm2时,这两个组合和郑单958的生育期为106—107 d,株高2.92—2.95 m,穗位1.28—1.31 m;植株均表现半紧凑型,叶色浓绿,叶片宽大上举,穗上部叶片叶尖下披,在农艺性状上差异不显著;但2个组合的产量性状优于对照郑单958,表现在果穗长5 cm左右,行粒数多8—10粒,亩产分别比对照增产7.01%和7.80%(表4)。2022年,在山东济宁粗缩病鉴定圃种植进行抗病鉴定,这两个组合均表现高抗粗缩病、无病株出现,而对照郑单958表现感粗缩病、病株率为15%。
3 讨论
3.1 玉米粗缩病的鉴定
对山东济宁、河北藁城2个环境下RILs群体的病情指数对比分析得知,不同环境对病害的发生有一定的影响。山东济宁地区每年5月中旬种植玉米,苗期正值小麦收获期,同时受气流影响,5月末到6月初大量灰飞虱迁入,加之当地越冬虫量较大,粗缩病发病较为充分。在缺少室内接种抗病鉴定的条件下,在山东济宁对抗病遗传材料和新品系进行田间自然鉴定结果更可靠。

表4 杂交组合重要农艺性状和产量性状比较对照表
3.2 K36的遗传组成和利用前景
利用与、和位点紧密连锁或功能性分子标记,对K36衍生的RILs群体的抗病性遗传组成的分析表明K36的抗性由多基因控制、且具有基因累加效应。3个位点之间,位点抗病性最强,位点次之,位点最弱,并且在抗性上呈显性、为不完全显性而为隐性,这与前人的研究结果一致[14, 22-23],显示在育种中利用价值更突出。最近已被克隆,是一个编码囊泡运输关键Rab GDP解离抑制因子基因[20]。研究发现,RBSDV侵染玉米后,病毒的P7-1蛋白与ZmGDI外显子10和C端区域紧密结合以招募病毒。利用玉米ZmGDI的囊泡运输功能帮助P7-1蛋白在胞内移动,从而有利于病毒的复制和通过胞间连丝通道在细胞间移动,导致玉米植株感病。通过基因编辑对ZmGDI敲除,显著提高了对玉米粗缩病的抗性,为培育抗粗缩病玉米品种提供了新的途径[26]。也已被精细定位并对其候选基因的功能正进行解析[21-22]。利用以K36为抗性供体和S221为受体构建的染色体片段代换系群体,对的精细定位也取得了很好进展,这对该基因的分离、功能分析和育种应用奠定了基础。
自交系K36不仅高抗粗缩病,而且对玉米蚜、玉米螟等害虫也具有良好的抗性[27]。利用K36衍生的RILs群体遗传组成比较丰富,为今后解析抗病的遗传关系,以及通过基因聚合改良优良自交系的抗病性提供了优异的遗传材料。目前,中国玉米生产上应用的粗缩病抗源主要来自美国杂交种P78599,抗源单一且抗性强度不高,制约了中国的玉米抗粗缩病育种与生产。利用与3个抗性位点紧密连锁的分子标记筛选具有抗性等位变异的优异材料,丰富玉米抗粗缩病种质资源,有望改善中国玉米抗性遗传来源单一的状况,减弱粗缩病潜在的威胁。
3.3 抗玉米粗缩病新系JR2136在育种中的应用
根据遗传进化分类分析指导玉米新自交系的杂交配组,可以增加测配的目的性,提高自交系的利用效率。从遗传进化分类树分析结果可以看出,选育的3个抗性位点纯合新系JR2136遗传组成偏向瑞德血缘,与属于黄改群的自交系H92、H521组配出了高抗粗缩病的优势组合,表明JR2136与黄改群的自交系之间具有较强的配合力,并且JR2136与划分在黄改群的其他5个自交系间遗传距离值(0.2728—0.2895)比与其他类群的数值大(0.2234—0.2795),但本研究所用自交系之间遗传距离值与前人研究的自交系间的值相比偏低[28],亲缘关系较近和遗传基础狭窄,因此,今后加强JR2136与黄改群自交系广泛配组筛选更强优势组合。
近年来,利用新育成的美国玉米杂交种和国内玉米杂交种郑单958为基础选系材料,创建了“新外杂选×国内杂选”的新杂优模式[29]。本研究选育的2个优势组合JR2136×H92、JR2136×H521和本单位自主选育的2个国审品种冀玉3421(WL34×H521)和冀玉228(Ji42×Ji1877)均属于此模式,将国外优异新种质的“多抗高产”与国内黄改群种质的“广适稳产”相结合,拓宽了遗传物质基础。本研究选育的JR2136既遗传了K36的抗粗缩病有利基因,又保留了S221的高配合力和优良的农艺性状,利用其组配的杂交组合JR2136×H92表现抗病力强、杂种优势明显,期望在生产上发挥出较大的抗病和增产效应。
4 结论
源自玉米自交系K36的粗缩病抗性由多基因控制、呈数量遗传特征且具有基因累加效应。具有、和等3个抗性纯合基因型的玉米品种抗病性最强。开发的分子标记在抗病品种选育和新抗性种质资源筛选上具有实用价值,利用分子标记辅助选择和基因聚合的方法选育抗病性强的优势组合应用于生产切实可行。
[1] XIE L, LV M F, YANG J, CHEN J P, ZHANG H M. Genomic and phylogenetic evidence that Maize rough dwarf and Rice black-streaked dwarf fijiviruses should be classified as different geographic strains of a single speciesActa Virologica, 2017, 61(4): 453-462.
[2] FANG S, YU J, FENG J, HAN C, LI D, LIU Y. Identification of rice black-streaked dwarf fijivirus in maize with rough dwarf disease in ChinaArchives of virology, 2001, 146(1): 167-170.
[3] 张恒木, 雷娟利, 陈剑平, 吕永平, 陈声祥, 薛庆中, M.J.Adams. 浙江和河北发生的一种水稻、小麦、玉米矮缩病是水稻黑条矮缩病毒引起的中国病毒学, 2001(3): 246-251.
ZHANG H M, LEI J L, CHEN J P, Lü Y P, CHEN S X, XUE Q Z, ADAMS M J. A dwarf disease on rice, wheat and maize from Zhejiang and Hebei is caused by rice black-streaked dwarf virusVirologica Sinica, 2001(3): 246-251. (in Chinese)
[4] YIN X, XU F F, ZHENG F Q, LI X D, LIU B S, ZHANG C Q. Molecular characterization of segments S7 to S10 of a southern rice black-streaked dwarf virus isolate from maize in northern ChinaVirologica Sinica, 2011, 26(1): 47-53.
[5] CHENG Z B, LI S, GAO R Z, SUN F, LIU W C, ZHOU G H, WU J X, ZHOU X P, ZHOU Y J. Distribution and genetic diversity of Southern rice black-streaked dwarf virus in ChinaVirology journal, 2013, 10: 307.
[6] 陆虎华, 孙权星, 彭长俊, 陈小晖, 薛林, 胡加如, 陈国清, 石明亮, 黄小兰, 郝德荣, 冒宇翔, 程玉静. 不同播期对玉米粗缩病发生及鲜穗产量的影响江苏农业科学, 2013, 41(9): 75-76.
LU H H, SUN Q X, PENG C J, CHEN X H, XUE L, HU J R, CHEN G Q, SHI M L, HUANG X L, HAO D R, MAO Y X, CHENG Y J. Effects of different sowing dates on the occurrence of maize rough dwarf disease and fresh ear yieldJiangsu Agricultural Sciences, 2013, 41(9): 75-76. (in Chinese)
[7] 陶永富, 刘庆彩, 徐明良.玉米粗缩病研究进展玉米科学, 2013, 21(1): 149-152.
TAO Y F, LIU Q C, XU M L. Research progress on maizerough dwarf diseaseJournal of Maize Sciences, 2013, 21(1): 149-152. (in Chinese)
[8] SHI L Y, HAO Z F, WENG J F, XIE C X, LIU C L, ZHANG D G, LI M S, BAI L, LI X H, ZHANG S H. Identification of a major quantitative trait locus for resistance to maize rough dwarf virus in a Chinese maize inbred line X178 using a linkage map based on 514 gene-derived single nucleotide polymorphismsMolecular breeding, 2012, 30(2): 615-625.
[9] 杨海龙, 付俊, 张丽丽, 高增贵. 辽宁省玉米粗缩病的发生与综合防治种子, 2014, 33(3): 116-118.
YANG H L, FU J, ZHANG L L, GAO Z G. The occurrence and integrated control of corn rough dwarf in LiaoningSeed, 2014, 33(3): 116-118. (in Chinese)
[10] 王振营, 王晓鸣. 我国玉米病虫害发生现状、趋势与防控对策植物保护, 2019, 45(1): 1-11.
WANG Z Y, WANG X M. current status and management strategies for corn pestsand diseasesin ChinaPlant Protection, 2019, 45(1): 1-11. (in Chinese)
[11] 杨兴飞, 温广波, 杨轶. 玉米不同种质对粗缩病的抗性鉴定和分析玉米科学, 2010, 18(3): 144-146.
YANG X F, WEN G B, YANG Y. Resistance identification and analysis of different maize germplasms to maize rough dwarf virusJournal of Maize Sciences, 2010, 18(3): 144-146. (in Chinese)
[12] 邸垫平, 路银贵, 张爱红, 杨菲, 田兰芝, 苗洪芹. 玉米抗粗缩病种质资源鉴定与评价植物遗传资源学报, 2021, 22(6): 1615-1623.
DI D P, LU Y G, ZHANG A H, YANG F, TIAN L Z, MIAO H Q. Identification and evaluation of maize germplasm resource against rice black streaked dwarf virusJournal of Plant Genetic Resources, 2021, 22(6): 1615-1623. (in Chinese)
[13] 薛林, 张丹, 徐亮, 金萌萌, 彭长俊, 徐辰武. 玉米抗粗缩病自交系种质的发掘和遗传多样性及其在育种中的应用作物学报, 2011, 37(12): 2123-2129.
XUE L, ZHANG D, XU L, JIN M M, PENG C J, XU C W. Mining and analyzing genetic diversity for maize rough dwarf disease resistant germplasms and its application in maize breedingActa agronomica sinica, 2011, 37(12): 2123-2129. (in Chinese)
[14] TAO Y F, LIU Q C, WANG H H, ZHANG Y J, HUANG X Y, WANG B B, LAI J S, YE J R, LIU B S, XU M L. Identification and fine-mapping of a QTL, qMrdd1, that confers recessive resistance to maize rough dwarf diseaseBMC plant biology, 2013, 13: 145.
[15] BONAMICO N C, DI RENZO M A, IBAñEZ M A, BORGHI M L, DíAZ D G, SALERNO J C, BALZARINI M G. QTL analysis of resistance to Mal de Río Cuarto disease in maize using recombinant inbred linesThe Journal of Agricultural Science, 2012, 150(5): 619-629.
[16] 王安乐, 赵德发, 陈朝辉, 王娇娟, 邵新胜, 魏国英. 玉米自交系抗粗缩病特性的遗传基础及轮回选择效应研究玉米科学, 2000, 8(1): 80-82.
WANG A L, ZHAO D F, CHEN Z H, WANG J J, SHAO X S, WEI G Y. Studies on genetic basis and recurrent selection effect of inbred line maize resistance to MRDVJournal of Maize Sciences, 2000, 8(1): 80-82. (in Chinese)
[17] 刘志增, 池书敏, 宋占权, 陈景堂, 孟义江. 玉米自交系及杂交种抗粗缩病性鉴定与分析玉米科学, 1996, 4(4): 68-70.
LIU Z Z, CHI S M, SONG Z Q, CHEN J T, MENG Y J. Identification and analysis of maize inbred lines and hybridsresistance to rough dwarf diseaseMaize Science, 1996, 4(4): 68-70. (in Chinese)
[18] 李荣改, 陆艳梅, 王月影, 王宝强, 宋炜, 张文英. 玉米粗缩病的分子研究新进展植物学报, 2017, 52(3): 375-387.
LI R G, LU Y M, WANG Y Y, WANG B Q, SONG W, ZHANG W Y. Molecular study on maize rough dwarf disease: A reviewChinese Bulletin of Botany, 2017, 52(3): 375-387. (in Chinese)
[19] LIU C L, HUA J G, LIU C, ZHANG D G, HAO Z F, YONG H J, XIE C X, LI M S, ZHANG S H, WENG J F, LI X H. Fine mapping of a quantitative trait locus conferring resistance to maize rough dwarf diseaseTheoretical and applied genetics, 2016, 129(12): 2333-2342.
[20] LIU Q C, DENG S N, LIU B S, TAO Y F, AI H Y, LIU J J, ZHANG Y Z, ZHAO Y, XU M L. A helitron-induced RabGDIα variant causes quantitative recessive resistance to maize rough dwarf diseaseNature Communications, 2020, 11: 495.
[21] ZHANG W X, DENG S N, ZHAO Y, XU W, LIU Q C, ZHANG Y Z, REN C M,CHENG Z B, XU M L, LIU B S. qMrdd2, a novel quantitative resistance locus for maize rough dwarf diseaseBMC Plant Biology, 2021, 21(1): 307.
[22] XU Z N, WANG F F, ZHOU Z Q, MENG Q C, CHEN Y P, HAN X H, TIE S G, LIU C L, HAO Z F, LI M S, ZHANG D G, HAN J N, WANG Z H, LI X H, WENG J F. Identification and fine-mapping of a novel QTL, qMrdd2, that confers resistance to maize rough dwarf diseasePlant Disease, 2022, 106(1): 65-72.
[23] LI R G, SONG W, WANG B Q, WANG J H, ZHANG D M, ZHANG Q G, LI X H, WEI J F, GAO Z Y. Identification of a locus conferring dominant resistance to maize rough dwarf disease in maizeScientific Reports, 2018, 8: 3248.
[24] 苗洪芹, 路银贵, 田兰芝, 邸垫平. 玉米粗缩病品种抗病性评价指标的初步研究西北农林科技大学学报(自然科学版), 2005, 33(S1): 255.
MIAO H Q, LU Y G, TIAN L Z, DI D P. A preliminary report on the criterion for evaluating the disease resistance of maize to the disease caused by maize rough dwarf fijivirus. Journal of Northwest A & F University(Natural Science Edition), 2005, 33(S1): 255. (in Chinese)
[25] XU Z N, HUA J G, WANG F F, CHENG Z X, MENG Q C, CHEN Y P, HAN X H, TIE S G, LIU C L,LI X H,WANG Z H, WENG J F. Marker-assisted selection ofto improve maize resistance to rough dwarf diseaseBreeding Science, 2020, 70(2): 183-192.
[26] LIU C L, KONG M, YANG F, ZHU J J, QI X T, WENG J F, DI D P, XIE C X. Targeted generation of Null Mutants in ZmGDIα confers resistance against maize rough dwarf disease without agronomic penaltyPlant Biotechnology Journal, 2022, 20(5): 803-805.
[27] 于永涛, 宋燕春, 黎裕, 石云素, 王天宇. 玉米对亚洲玉米螟抗性的QTL分析玉米科学, 2007, 15(5): 1-5, 11.
YU Y T, SONG Y C, LI Y, SHI Y S, WANG T Y. QTL associated with resistance to Asian corn borer() in maizeJournal of Maize Sciences, 2007, 15(5): 1-5, 11. (in Chinese)
[28] 吴金凤, 宋伟, 王蕊, 田红丽, 李雪, 王凤格, 赵久然, 蔚荣海. 利用SNP标记对51份玉米自交系进行类群划分玉米科学, 2014, 22(5): 29-34.
WU J F, SONG W, WANG R, WANG H L, LI X, WANG F G, ZHAO J R, WEI R H. Heterotic grouping of 51 maize inbred lines by SNP markersJournal of Maize Sciences, 2014, 22(5): 29-34. (in Chinese)
[29] 宋炜, 王立伟, 张全国, 李荣改, 张动敏, 王宝强, 郭瑞, 宋粮, 魏剑锋, 李兴华, 高增玉, 张文英, 王江浩. 玉米杂交种‘冀玉228’选育及新杂优模式讨论农学通报, 2022, 12(10): 6-9.
SONG W, WANG L W, ZHANG Q G, LI R G, ZHANG D M, WANG B Q, GUO R, SONG L, WEI J F, LI X H, GAO Z Y, ZHANG W Y, WANG J H. Maize hybrid variety‘Jiyu 228’: breeding and the new heterosis patternJournal of Agriculture, 2022, 12(10): 6-9. (in Chinese)
Molecular marker assisted identification and application of maize germplasms for maize rough dwarf disease resistance
WANG JiangHao, WANG LiWei, ZHANG DongMin, GUO Rui, ZHANG QuanGuo, LI XingHua, WEI JianFeng, SONG Wei, Wang BaoQiang, LI RongGai
Institute of Cereal and Oil Crops, Hebei Academy of Agriculture and Forestry Sciences/Hebei Laboratory of Crop Genetics and Breeding, Shijiazhuang 050035
【Objective】Molecular markers tightly linked to three maize rough dwarf disease (MRDD) resistant loci were employed to identify resistant inbred lines, then the classification of heterotic groups and analysis of combining ability of these inbred lines were carried out, which proved a highly efficient way for maize MRDD resistance breeding.【Method】A recombinant inbred lines (RILs) population consisting of 263 F9lines was developed through single seed descent method from a segregating F2population by crossing a resistant inbred line K36 to a susceptible inbred line S221. The MRDD resistances of the RILs were identified in different growing environments. Meanwhile the RILs were genotyped by employing three pairs of molecular markers, 5FR, 6W53 and IDP25K which were closely linked to the three resistant loci,,and. The excellent lines with disease resistance and good agronomic traits were selected out after field evaluation. Totally 24 maize inbred lines including the elite lines were genotyped using Maize 56K SNP array, then the genetic distances between the selected lines and other elite inbred lines were calculated according to Roger's algorithm and cluster analysis was conducted to classify the heterotic groups. Meanwhile, hybrid combinations were generated and the combining abilities were tested to screen the combinations with strong disease resistance and heterosis.【Result】The inbred line K36 were homozygous resistant at the three loci,,andwhile S221 were homozygous susceptible. All the 263 RILs were genotyped into 21 patterns in terms of genetic composition of the three resistant loci. The lowest DSI (0.281) appeared when all the three loci were homozygous resistant while the highest DSI (0.776) appeared when the three loci were homozygous susceptible, which were consistent with the resistant and susceptible parents (0.257, 0.623). The order of DSI from low to high value for one homozygous resistant locus was(0.396),(0.478) and(0.654) when the other two loci were homozygous susceptible, which showed thatandperformed the strongest and the weakest resistance whilewas in the middle. The variation range of genetic distance between JR2136 with the genotype of three homozygous resistant loci and other 23 inbred lines was 0.2234-0.2895, with an average value of 0.2612. The inbred line with the smallest genetic distance was C413, and the largest was Chang7-2. According to the results of cluster analysis, JR2136 was classified into Reid group, hybrid combinations with inbred lines H92 and H521 belonging to Huanggai group performed strong disease resistance and heterosis.【Conclusion】The resistance of K36 to MRDD was controlled by three loci,,and, and it had quantitative genetic characteristics and gene additive effect. Maize varieties with homozygous resistant genotypes demonstrated the strongest disease resistance. The developed molecular markers closely linked with the three resistant loci have proved valuable tools in disease-resistant breeding and screening of resistant germplasm resources. It is feasible to use molecular markers for assisted selection and gene aggregation to select highly heterotic combinations with strong disease resistance.
maize rough dwarf disease; resistance gene; molecular marker-assisted selection (MAS); heterotic grouping; combining ability

10.3864/j.issn.0578-1752.2023.10.002
2022-12-17;
2023-02-13
河北省重点研发计划(22326317D)、河北省农林科学院创新工程人才专项(C22R0302)、河北省重大专项(21326319D)、国家玉米产业技术体系专项(CARS-02-58)
王江浩,E-mail:wangjianghao@haafs.org。通信作者王宝强,E-mail:wbq662@126.com。通信作者李荣改,E-mail:lironggai@haafs.org
(责任编辑 李莉)
