自然衰老棉花种子的生理变化及ATP合成酶亚基mRNA的完整性
2023-05-17宋词谷丰序邢真真张峻铭赫文学王天波王雨露陈军营
宋词,谷丰序,邢真真,张峻铭,赫文学,王天波,王雨露,陈军营
自然衰老棉花种子的生理变化及ATP合成酶亚基mRNA的完整性
宋词,谷丰序,邢真真,张峻铭,赫文学,王天波,王雨露,陈军营
河南农业大学农学院,郑州 450046
【目的】种子衰老是一个复杂的生物学过程,以自然衰老的棉花种子为材料,研究种子自然储藏后的生理生化变化及种胚ATP合成酶亚基mRNA的完整性,为进一步揭示种子衰老机理提供依据。【方法】以自然储存3年、5年和新收获的新陆早74号棉花种子为试验材料(以新收获的棉种为对照(CK));分别采用纸间萌发试验、低温恒温干燥法和TTC染色法测定棉花种子的萌发率、吸水力和种子生活力;利用酸碱滴定法测定棉花种子的酸价和呼吸速率,采用植物ATP合成酶酶联免疫分析试剂盒测定种胚ATP合成酶活性,并利用反转录阻断-双引物扩增法分析棉花种胚ATP合成酶、、、和亚基mRNA的完整性。【结果】自然储藏会导致种子活力显著降低。与对照相比,自然储存3年和5年后,棉种萌发率由98.7%分别显著降低至84.0%和58.0%(<0.05);种子吸胀初期(4 h内)吸水力分别比对照显著降低了11.0%和26.9%(<0.05);TTC染色法检测结果显示种子生活力明显下降,其中,储藏5年的种子仅有胚根部位有少量着色,而子叶等器官未被染色;储藏3年和5年的种子酸价分别较对照显著升高了28.4%和40.0%,表明种子内脂肪类物质发生严重水解;吸胀期间种子呼吸速率和ATP合成酶活性表现出增加趋势(<0.05),但增幅均显著下降;其中,吸胀24 h后呼吸速率增幅分别较对照降低了33.3%和49.2%,吸胀12 h后ATP合成酶活性增幅则分别较对照降低了17.9%和73.4%;反转录阻断-双引物扩增法分析结果显示,ATP合成酶的亚基、亚基、亚基和亚基mRNA的值均显著低于对照,而亚基mRNA的值则显著高于对照(<0.05),说明这5种亚基的mRNA在自然储藏过程中出现不同程度的降解。【结论】延长贮藏时间,将导致棉花种子活力下降;种胚中ATP合成酶亚基mRNA完整性丧失,导致ATP合成酶亚基受损,ATP合成酶活性下降,进而造成ATP合成减少,影响种子萌发能力。这可能是棉花种子衰老的重要原因之一。
棉花种子;种子衰老;种子活力;ATP合成酶;mRNA完整性
0 引言
【研究意义】种子是农业的“芯片”,其活力高低直接影响作物的产量和质量。受遗传特性和环境因素的共同影响,即使在最佳条件下储存,种子的衰老也无法避免[1],这是全球种质资源保存共同面临的重要难题。不同物种的种子由于结构、成分及生理特性不同,其耐藏性也存在差异,如脂质、酚类物质组成和水平与种子衰老显著相关[2],研究发现种子衰老进程在油料种子中较为显著,如棉花种子富含的多不饱和脂肪酸在贮藏过程中极易发生氧化,导致棉花种子老化劣变[3],对棉花产量造成重要影响。【前人研究进展】种子的衰老是一个复杂的生物学过程,涉及多种理化反应及其交联,表现为发芽率降低、呼吸强度下降、关键酶类失活、基因表达紊乱等现象[4-6];通常认为活性氧引起的氧化损伤是造成种子衰老的重要原因[7-9],过量产生的ROS可与多种生物大分子(如蛋白质、不饱和脂肪酸、核酸等)作用,造成种子内部功能物质的损伤(如脂质过氧化、蛋白质变性、DNA和RNA损伤甚至断裂等),并且ROS引起的氧化应激也被证实参与调控细胞程序性死亡,这些反应可能独立发生,也可能互相交联,最终导致种子衰老直至死亡[10-14]。呼吸速率是反映种子代谢活动总体水平的一个重要指标,正常情况下,干种子的呼吸速率很低,在吸胀过程中,种子内部代谢活动增加,呼吸速率会逐渐升高[15]。而在衰老的种子中,呼吸速率和呼吸酶活性将大幅降低,如甜菜种子随老化程度的增加,三羧酸循环途径中的苹果酸脱氢酶、糖酵解途径中的磷酸己糖异构酶、磷酸戊糖途径中的葡萄糖-6-磷酸脱氢酶的活性均显著降低[16]。ATP合成酶是呼吸链复合体Ⅴ的组成成分,由多个亚基组成,能够通过合成ATP为细胞供能[17],是细胞呼吸作用的关键酶,对种子活力具有重要影响。随着种子老化劣变,ATP合成酶受损或活性降低,种子呼吸代谢能力减弱,可能导致萌发过程中供能不足,最终种子活力降低甚至丧失发芽能力[18]。干种子内部积累了大量可翻译的mRNA[19],在种子萌发期间,需要利用这些贮藏mRNA作为模板合成萌发所需的蛋白质,这一过程对于种子吸胀萌发和启动代谢过程具有重要作用[20]。Sano等[21]发现水稻种子在萌发初期,依靠贮藏mRNAs翻译支持糖酵解的初始能量产生和翻译机制的激活,并实现丙酮酸代谢、三羧酸循环等相关酶的生物合成,从而使种子能够旺盛萌发,Howell等[22]发现种子吸胀3h后大多数代谢相关的基因上调表达,拟南芥吸胀后呼吸代谢活性相关的基因特异性启动表达,说明mRNA对于维持种子的活力和寿命,调控种子的休眠和萌发等生理活动至关重要。而RNA的单链结构导致其更容易受到氧化损伤[23],包括碱基和糖基的化学修饰和链的断裂[4, 24-25],如8-oxo-7,8-二氢鸟嘌呤(8-oxo-G)是一种普遍存在的氧化损伤,当mRNA中存在8-oxo-G时将会干扰解码,影响翻译过程[26]。如Fleming等[27]发现大部分物种的RNA完整性随干燥种子储存时间的推移而下降,并且研究发现受损的RNA通常会被酶解而非修复[23]。若mRNA受损而不能正常发挥作用,种子的活力也必然将受到影响。如大豆种子在干燥储藏过程中,种胚内RNA前体物质与核糖体亚基的18S和25S核糖核酸结合可能受阻,贮藏mRNA的完整性逐渐降低,且RNA完整性与萌发潜力呈显著正相关[27]。【本研究切入点】ATP合成酶是种子呼吸代谢的关键酶,对种子活力具有重要影响,前人多围绕棉花种子衰老的生理变化规律进行研究,而对其衰老过程中的分子机理,尤其是ATP合成酶亚基mRNA的完整性研究尚未见报道。【拟解决的关键问题】本研究以不同自然衰老的棉花种子为材料,研究其萌发率、吸水能力、呼吸速率、ATP合成酶活性等变化,并采用反转录阻断—双引物扩增法,研究种胚ATP合成酶亚基mRNA完整性变化情况,以期为揭示棉花种子衰老的分子机理提供试验依据。
1 材料与方法
1.1 材料
以棉花品种新陆早74号种子为材料,在实验室内自然存放3年和5年,以2021年收获的种子为对照(CK),研究工作在河南农业大学农学院省部共建小麦玉米作物国家重点实验室内进行。
1.2 棉花种子活力评价
1.2.1 种子萌发试验 取大小均一的种子,置于120 mm口径的玻璃培养皿中,采用纸间法,在恒温培养箱中进行试验。设置温度为28 ℃[28],光照为0μmol·m-2·s-1。以胚根突破种皮1—2 mm为种子萌发完成的标志,每隔2 h观察并记录一次萌发种子数,直至吸胀48 h结束,按下列公式计算种子的萌发率。
萌发率=(萌发种子数/种子总数)×100%
1.2.2 种子含水量的测定 将种子置于发芽床上进行吸胀吸水,分别测定种子在吸胀1、2、4、6、12、18和24 h后的含水量,采用切片烘干称重法,将样品切成0.5 mm左右的薄片,置于烘箱(103±2)℃烘干(12±1)h[29],计算种子的含水量,计算公式如下。
种子含水量=(种子吸水后重量-干样重)/干样重×100%
1.2.3 种子生活力的测定 采用TTC染色法测定种子生活力,参考尹燕枰等[30]的测定方法,并稍加修改。随机选取对照和自然储存3年和5年的棉花种子各10粒,剥去种皮,沿种胚中间纵切,将种胚分成均匀2份。35 ℃恒温,黑暗条件下,用0.1%TTC溶液(pH=7.0磷酸盐缓冲溶液配制)染色30 min,用AnytyTM3R-CLSTM01(03U软件)拍照。
1.2.4 种胚酸价的测定 参照GB 5009.229-2016.的方法[31]进行种胚酸价测定,并略有改动。将棉种剥去种皮4 ℃保存15 h,然后,称取3 g种胚研磨成粉,置于30 ml提取液(300 ml乙醇和乙醚1﹕1混合液作为脂肪酸提取液,再配制浓度为0.05 mol∙L-1KOH溶液100 ml,使用酚酞指示剂,将提取液滴至中性,密封保存)中,震荡混匀12 h;低温超速离心机5 000 r/min离心2 min,取上清液,用KOH溶液滴定,至滴定终点时消耗KOH体积记为V(ml)。
酸价(mg KOH∙g-1)=(V×0.05×56.11)/m
其中,V为滴定时消耗KOH溶液的体积(ml);0.05为KOH溶液的浓度(mol∙L-1);56.11为KOH的摩尔质量;m为种子质量(g)。
1.2.5 种子呼吸速率的测定 参照徐爱东等[32]方法测定棉花种子的呼吸速率,并略有改动。称取各处理种子10 g放入网袋,悬挂于含15 mL 50 mmol∙L-1氢氧化钡溶液的广口瓶内,迅速塞紧瓶塞,反应温度为(27±0.5)℃,反应时间为4 h。以瓶内不放种子作为空白对照,每组3次重复,反应结束后,取出种子,加入酚酞指示剂,用H2C2O4溶液滴定,滴定终点即溶液恰好由粉色变为无色,记下消耗H2C2O4溶液的体积(V1)和空白对照消耗H2C2O4溶液的体积(V0)。用下列公式计算种子呼吸速率。吸胀不同时间的种子随机称取10 g,试验方法同上。
呼吸速率(mg·h-1·g-1)=(V0-V1)/(t×w)
式中,t为呼吸时间(h),W为种子重量(g)。
1.2.6 棉花种胚ATP合成酶活性的测定 用植物ATP合成酶酶联免疫分析试剂盒测定棉花种胚ATP合成酶的活性,产品编号MM-4715702(江苏酶免实业有限公司)。
将种胚液氮研磨后称0.1 g置于1.5 mL离心管中,加入1 mL PBS(磷酸盐缓冲溶液,0.01 mol∙L-1,pH=7.4),冰浴10 min,4 ℃ 3 000 r/min离心20 min,收集上清于新的离心管中待测;设置空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同),制备标准品和待测样品,37 ℃温育30 min后进行显色反应(震荡混匀37 ℃避光显色10 min),反应结束后,加入终止液50 μL终止反应(此时蓝色立转黄色),在450 nm波长依序测量各孔的吸光度。
1.3 ATP合成酶亚基mRNA完整性的检测
1.3.1 种胚总RNA的提取 采用TransZol Plant试剂盒(ET121,北京全式金生物技术有限公司)提取棉花种胚总RNA,用1%琼脂糖凝胶电泳和Nanodrop2000检测总RNA的完整度和浓度。
1.3.2 ATP合成酶基因的选择及引物设计 通过NCBI网站查找陆地棉ATP合成酶亚基的基因序列,经过基因和氨基酸序列比对,确定最终所选基因。根据选择基因查找其对应的cDNA序列,利用Beacon Designer 7.0软件设计5′和3′端特异性实时荧光定量引物(表1),由上海生工有限公司合成。

表1 基因完整性检测所用双引物
1.3.3 qRT-PCR检测及mRNA完整性分析 使用天根生化科技有限公司(北京)的FastQuant RT Kit(with gDNase)合成cDNA;采用TransStrat Top Green qPCR Supermix试剂盒进行扩增反应,反应体系为Template cDNA 5.0 µL、上下游引物各0.4 µL、2×TransStartTop Green qPCR SuperMix 10 µL,补充ddH2O至20 µL。扩增程序为95 ℃ 3 min;95 ℃ 10 s,59 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 4 min。
采用反转录阻断-双引物扩增法分析特定mRNA完整性[33]。由于逆转录是从mRNA的3′端延伸至5′端,故产物中5′端的完整cDNA低于3′端。根据这一原理,分别对待测mRNA的5′端和3′端进行扩增。扩增两端cDNA的Ct值的差异反映了逆转录产物的差异,即mRNA的氧化损伤程度。理论上,mRNA氧化损伤越严重,反向转录的产物中完整cDNA含量越低,反映RNA氧化损伤程度的值越小。计算方法如下:
=x/0,x=2-ΔCtx,(0:对照组,x:处理组)
ΔCt0=Ct0(5′)-Ct0(3′),ΔCtx=Ctx(5′)-Ctx(3′)
1.4 数据处理与分析
采用Microsoft Excel 2010进行计算与绘图,以平均值±标准差的形式表示。采用Duncan's新复极差法(DPS数据处理软件V15.10版本)进行统计与分析。
2 结果
2.1 不同衰老棉花种子活力表现
2.1.1 种子萌发率及平均萌发时间
萌发率是衡量种子活力的重要指标。对自然存放3年、5年的棉种进行萌发试验,结果(图1)显示,有少数对照种子在吸胀10 h时即完成萌发,在吸胀24 h时,萌发率为95.3%,接近最高萌发率(98.7%),萌发速度最快;自然存放3年的种子也有少数在吸胀10 h时完成萌发,在吸胀30 h时,萌发率为78.0%,接近最高萌发率(84.0%),萌发速度显著慢于对照;而自然存放5年的种子仅有极少数在吸胀16 h才完成萌发,在吸胀34 h时,萌发率为56.7%,接近最终萌发率(58.0%),萌发速度最慢;对照种子在吸胀36 h时完成萌发,最终萌发率为98.7%,自然存放3年和5年的种子均在吸胀40 h时完成萌发,最终萌发率分别为84.0%和58.0%,显著低于对照。说明自然储藏过程中,棉花种子生活力在显著下降。

3Y、5Y分别表示储存了3年和5年的种子。下同
平均萌发时间是反映种子萌发的整齐度和速度的指标。种子萌发率达到最高萌发率的一半时所用的时间为种子的平均萌发时间,图1可以看出,对照种子平均萌发时间为17.6 h,存放3年、5年的种子平均萌发时间分别是21.1和24.3 h,说明随贮存时间的延长,种子萌发速度减慢。
2.1.2 种子含水量变化 水分是种子萌发的必要条件。测定吸胀24 h内种子的含水率,结果(图2)显示,3种种子的初始含水量分别为9.93%、9.32%和9.45%,吸胀初期(前4 h),不同老化水平的种子吸水速率存在一定差异,但吸水的总体趋势接近。前4 h是种子快速吸水期,对照种子吸水量增加最快,在4 h时含水量达到36.4%,增量为26.4%,储存3年和5年的种子含水量分别为32.9%和28.7%,增量为23.5%和19.3%,分别比对照降低了11.0%和26.9%,差异达到显著水平;4 h后种子的吸水速度减慢,在18 h时基本一致,差异不显著;在24 h时,大部分种子已完成萌发,且随着萌发的进行,种子吸水量的差异逐渐减小。说明经过自然衰老的棉花种子在吸胀萌发初期相对吸水量和吸水速率显著降低。
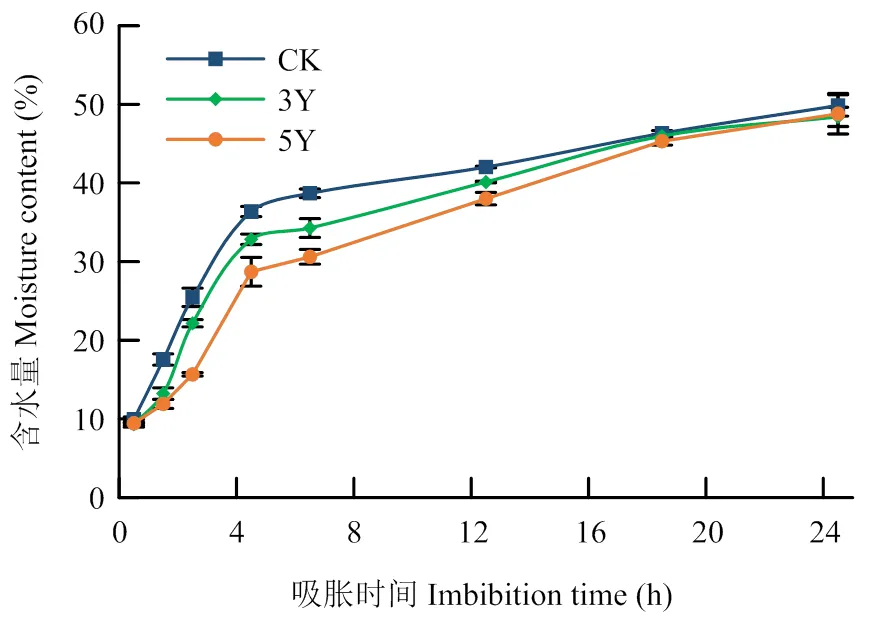
图2 不同衰老棉花种子吸胀过程中含水量变化
2.1.3 种子生活力变化 种子生活力是种子萌发的潜在能力,TTC染色法是种子生活力检测的常用方法。对存放3年、5年的棉花种胚进行TTC溶液染色,结果(图3)显示,对照种子的种胚各部位均被染成红色(图3-A),储存3年的棉花种胚着色比对照浅(图3-B),而储存5年的棉花种子子叶处未着色,仅有胚根处部分染为浅红色(图3-C)。说明自然老化会降低棉花种胚的生活力,且存放的时间越长,生活力下降越明显,并且种胚不同器官对衰老的响应也存在一定差异。
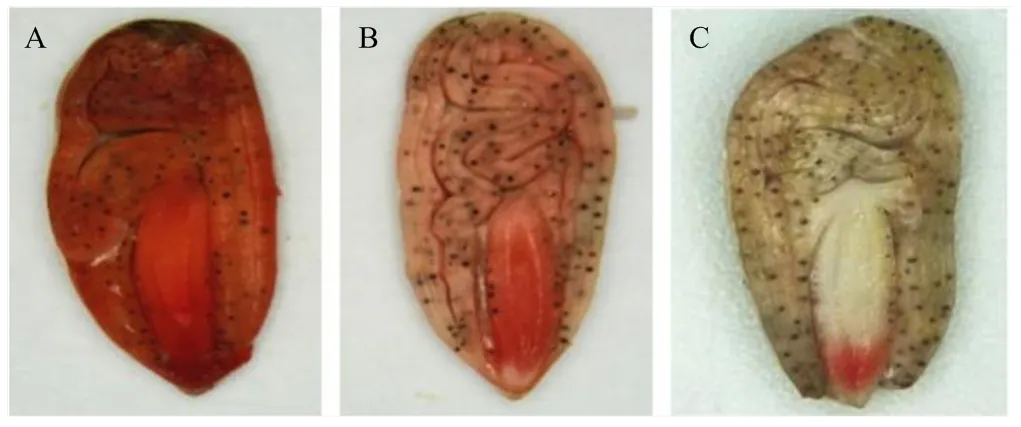
A:CK;B、C分别为贮藏3年和5年的种子
2.1.4 种子酸价变化 酸价可作为种子变质程度的指标,在储藏过程中,种子中的脂肪可能会发生水解,产生游离脂肪酸。棉花种子酸价的测定结果(图4)显示,对照种子的酸价平均为1.83 mg∙g-1,自然存放3年和5年的棉花种子的酸价分别为2.35和2.55 mg∙g-1,分别较对照种子升高28.4%和40.0%,且差异达到显著水平。说明随着自然存放的时间延长,种子脂肪发生水解,从而导致酸价显著升高。

不同小写字母表示显著差异(P<0.05)。下同
2.1.5 种子呼吸速率变化 呼吸作用与种子的生命代谢活动密切相关,呼吸作用产生的ATP是种子萌发所必需的能量来源,而呼吸速率是表示种子活力的重要指标。测定种子在不同吸胀时间的呼吸速率,结果(图5)表明,对照和自然存放3年、5年的干种子呼吸都非常微弱,呼吸速率无明显差异;而随着吸胀的进行,种子呼吸速率表现显著增加,但提高的幅度存在显著差异,自然储存3年的种子呼吸速率提高幅度较小,储存5年的种子呼吸速率提高最少;其中,吸胀24 h后,对照种子呼吸速率达到0.66 mg∙g-1∙h-1,而储存3年和5年的种子呼吸速率分别为0.44和0.34 mg∙g-1∙h-1,增幅分别是对照种子的66.7%和50.8%,说明自然贮藏会导致种子呼吸速率下降。
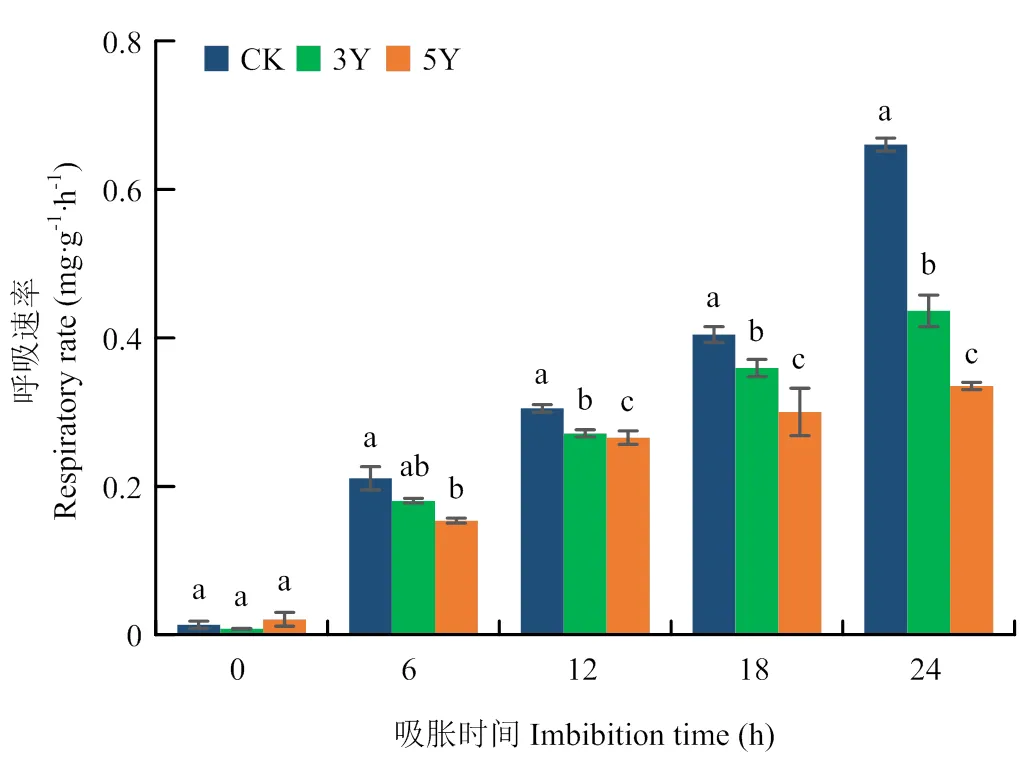
图5 自然衰老棉花种子呼吸速率变化
2.1.6 种胚ATP合成酶活性变化 ATP合成酶是ATP合成的关键酶。测定了棉花种子ATP合成酶活性的变化,结果(图6)表明,干燥状态下,对照和衰老3年和5年的种子种胚ATP合成酶的活性较低,分别为210.3、256.7和243.3 U∙g-1;吸胀12 h后,对照种胚ATP合成酶活性显著升高(783.8 U∙g-1),储存3年和5年的种子酶活性分别为727.6和396.2 U∙g-1,增幅显著低于对照。其中,衰老5年的种子酶活增幅只有对照种子的26.6%,暗示贮藏过程中棉花种胚细胞结构特别是线粒体可能受到了损伤,导致ATP合成酶活性降低,进而影响ATP合成,以至影响种子活力。

图6 自然老化棉花种子中ATP合酶活性的变化
2.2 种子ATP合成酶亚基贮藏mRNA完整性变化
通过NCBI网站查找和基因序列比对,选取陆地棉ATP合成酶5种亚基的5个基因,并用Beacon Designer 8.13引物设计软件设计了5种亚基基因的5′端和3′端定量PCR引物。对5种亚基的5个基因进行反转录—双引物扩增检测分析,结果(图7)表明,自然贮藏3年和5年后,棉花种子ATP合成酶亚基mRNA的值持续升高(分别为1.10和1.27),其他亚基mRNA的值在贮藏过程中均显著下降;其中,亚基、亚基和亚基mRNA的值随贮藏时间的延长呈持续下降趋势,且较对照相比差异达到显著水平;亚基的降幅最大,在储存5年后值降为0.05,较对照降低了95.0%;亚基mRNA的值在储存3年后骤减(为0.38),在储存5年后显著升高(为0.85),但值仍显著低于对照。
上述结果表明,在自然衰老过程中,棉花种子ATP合成酶各个亚基的mRNA受到不同程度的损伤,其中,亚基、亚基和亚基mRNA损伤较严重,值显著降低;亚基mRNA的值持续升高以及亚基值在贮藏过程中先降低后升高,可能是由于这两种亚基mRNA两端降解速度不一致,5′端降解速度过快,造成值反而升高,同样说明这两种亚基mRNA存在降解情况。

图7 不同衰老棉花种胚ATP合成酶亚基mRNA完整性变化
3 讨论
3.1 棉花种子贮藏过程中种子活力降低不可避免
种子衰老是一个不可逆的、损伤逐渐累积的、不可阻止的生物学过程[34]。即使是在最佳条件下储存,种子也会逐渐衰老,种子活力不断下降直至死亡,具体表现为种子发芽率降低、生活力下降、呼吸作用减弱、大分子物质受损和酶活性下降等生理现象[1, 4, 5,11]。BERJAK等[35]发现在贮藏过程中,玉米种胚细胞超微结构出现损伤,且随着储藏年限的延长,线粒体、染色质等细胞器损伤日益严重;Ratajczak等[36]对不同来源的山毛榉种子研究发现,即使山毛榉种子储存在最佳条件下,种子发芽力的丧失也是不可避免的;LÓPEZ-FERNÁNDEZ等[37]发现柳树种子在贮藏过程中发芽率不断降低,并认为程序性细胞死亡是种子衰老劣变的关键机制;田茜等[38]发现老化的豌豆种子活力出现下降。本研究表明,随着贮藏时间的延长,棉花种子的发芽率逐渐下降,种子生活力显著降低,酸价显著上升,这与玉米、山毛榉、柳树和豌豆种子等的结果一致。
3.2 棉花种子贮藏过程中不同器官衰老程度存在差异
种子衰老是一个非常复杂的生物学问题。迄今为止,衰老的机制仍不清楚。Harman[39]提出“活性氧引起的氧化损伤是衰老的主要诱发因素”。BERJAK等[35]发现长期贮存的玉米种胚细胞内不同亚细胞结构对老化的敏感性存在差异,其中,线粒体和染色质的损伤比种子生活力的损失要早得多,这可能是由于这些位点的含水量较高,更易受自由基攻击而导致氧化损伤;Ratajczak等[36]在自然贮藏的山毛榉种子中发现,超氧阴离子自由基和过氧化氢首先在根冠细胞中被检测到,且ROS的含量与发芽力显著相关;王天波等[40]发现人工老化处理的玉米种胚ATP合成酶活性随老化程度加深呈降低趋势,且其中胚根和胚芽ATP合成酶活性降低的幅度大于盾片。本研究经过TTC染色试验发现棉花种子的子叶生活力丧失早于胚根,这可能是与胚根位于种子内部,外被子叶严密包裹不易受到外部因素如氧气、水分等影响所致,至于种子不同器官所发生的生理生化、物质代谢以及相关分子生物学过程,需要进一步研究。
3.3 棉花种胚ATP合成酶亚基mRNA损伤可能是种子活力降低的重要原因之一
核酸是遗传信息的载体,是保证生命多样性最基本的物质基础。种子在发育过程中会积累大量的mRNA,这些mRNA对于维持种子的活力和寿命,调控种子的休眠和萌发等生理活动至关重要[41-42]。研究发现种子在吸胀时贮藏mRNA会选择性地翻译从而调控种子萌发[43],在拟南芥和水稻种子中也被证实吸胀过程中mRNA的转录和蛋白质的从头合成是种子萌发的先决条件[42, 44]。而mRNA的氧化损伤可能导致翻译过程中核糖体的移动受阻,造成翻译的提前终止或错误进行,导致蛋白质合成效率降低[25, 43],从而影响种子萌发。
种子老化过程中伴随着多种关键酶活性的降低,包括DNA聚合酶、ATP合成酶,脂氧合酶、抗氧化酶等[4, 10],从而导致种子发芽过程中能量产生和物质供应减少[6]。能量代谢是种子萌发的基础[45],ATP合成酶是种子能量代谢的核心,是呼吸链复合体Ⅴ的组成成分,负责机体90%以上的ATP合成,并且在代谢紊乱时通过调节底物代谢发挥关键作用[17]。ATP合成酶由F1和F0组成,其中F1部分由、、、和这5种亚基组成,和亚基组合成为ATP合成酶中核苷酸的结合部位,亚基是合成和水解ATP的关键部位,在质子能的驱动下,亚基通过旋转作用催化ATP的合成,当各亚基结合成完整的复合体时,才能利用质子能合成ATP[46-47],进而为细胞供能;ATP合成酶亚基受损,则会造成酶活性降低甚至丧失,影响ATP的产生。如Lee等[48]研究发现器官中ATP合成酶和亚基含量降低导致ATP含量减少;王天波等[40]发现人工老化处理的玉米种胚ATP合成酶活性随老化程度加深呈降低趋势,且ATP合成酶多个亚基的mRNA受到不同程度的损伤;Xin等[18]通过鉴定人工老化玉米种子的蛋白质表达,发现参与代谢和能量的蛋白质显著下调表达,并提出能量供应与种子老化的机制密切相关。本研究中,ATP合成酶的、、和的值均因衰老而显著下降,的值显著升高,暗示贮藏过程中棉花种胚ATP合成酶、、和的mRNA出现不同程度的损伤,的5′端出现大幅降解,这可能造成ATP合成酶亚基结构不完善[43],进而造成ATP合成酶活性降低;其中,和的mRNA严重受损,可能会造成ATP合成酶的催化部位遭到破坏;受损,ATP合成酶无法在质子能的驱动下旋转催化ATP的合成;这将导致种子萌发过程中ATP合成不足,影响种子萌发[6]。因此,ATP合成酶亚基mRNA损伤可能是种子活力下降的重要原因之一。种子贮藏过程中,ATP合成酶亚基mRNA是否存在一定的修复[2],值得进一步研究。
4 结论
随着贮藏时间的延长,棉花种子逐渐衰老,表现为萌发率下降,生活力降低,酸价显著上升,吸水能力和呼吸能力下降;ATP合成酶多个亚基的mRNA出现不同程度的损伤,造成ATP合成酶亚基结构不完善,导致种胚ATP合成酶活性下降,ATP合成不足,影响种子萌发。这可能是种子衰老的重要原因之一。
[1] Bewley J D, Bradford K, Hilhorst H W M, Nonogaki H.
Seeds: Physiologyof development, germination and dormancy. Seed Science Research, 2013, 23(4): 289-289.
[2] Sano N, Rajjou L, North H M, Debeaujon I, Marion- Poll A, Seo M. Stayingalive: Molecular aspects of seed longevity. Plant and Cell Physiology, 2016, 57(4): 660-674.
[3] 王美霞, 马磊, 杨伟华. 我国主栽棉花品种种子的脂肪酸组成与分析//中国农学会棉花分会2016年年会论文汇编. 徐州, 2016: 109.
Wang M x, Ma L, Yang W h. Composition and analysis of fatty acids in the seeds of China's main cotton varieties//Paper Compilation of the 2016 Annual Conference of the Cotton Branch of the Chinese Academy of Agriculture. Xuzhou, 2016: 109. (in Chinese)
[4] Ebone L A, Caverzan A, Chavarria G. Physiologic alterations in orthodox seedsdue to deterioration processes. Plant Physiology and Biochemistry, 2019, 145: 34-42.
[5] NARAYANA Murthy U M, Kumar P P, Sun W Q. Mechanisms of seed ageing underdifferent storage conditions for(L.) Wilczek: lipid peroxidation, sugarhydrolysis, Maillard reactions and their relationship to glass state transition. Journal of Experimental Botany, 2003, 54(384): 1057-1067.
[6] Xin X, Tian Q, Yin G K, Chen X L, Zhang J M, Ng S, Lu X X. Reduced mitochondrial and ascorbate-glutathione activity after artificial ageing in soybean seed. Journal of Plant Physiology, 2014, 171(2): 140-147.
[7] Bailly C. active oxygen species and antioxidants in seed biology. Seed Science Research, 2004, 14(2): 93-107.
[8] Bailly C, Benamar A, Corbineau F, Côme D. Free radical scavenging as affected by accelerated ageing and subsequent priming in sunflower seeds. Physiologia Plantarum, 1998, 104(4): 646-652.
[9] Kibinza S, Vinel D, Côme D, Bailly C, Corbineau F. Sunflower seed deterioration as related to moisture content during ageing, energy metabolism and active oxygen species scavenging. Physiologia Plantarum,2006, 128(3): 496-506.
[10] Møller I M, Igamberdiev A U, Bykova N V, Finkemeier I, Rasmusson A G,SchwarzlÄnder M. Matrix redox physiology governs the regulation of plantmitochondrial metabolism through posttranslational protein modifications. The PlantCell, 2020, 32(3): 573-594.
[11] Oenel A, Fekete A, Krischke M, Faul S C, Gresser G, Havaux M, Mueller M J, Berger S. Enzymatic and non– enzymatic mechanisms contribute to lipid oxidation during seed aging. Plant and Cell Physiology, 2017, 58(5): 925-933.
[12] Ciacka K, Krasuska U, Staszek P, Wal A, Zak J, Gniazdowska A. Effect of nitrogen reactive compounds on aging in seed. Frontiers in Plant Science, 2020, 11: 1011.
[13] Jeevan Kumar S P, Rajendra Prasad S, Banerjee R, Thammineni C. Seed birth to death: dual functions of reactive oxygen species in seed physiology. Annals and Botany, 2015, 116(4): 663-668.
[14] Xu L X, Xin X, Yin G K, Zhou J, Zhou Y C, Lu X X. Timing for antioxidant-primingagainst rice seed ageing: optimal only in non-resistant stage. Scientific Reports, 2020, 10(1): 1-13.
[15] Yin G K, Whelan J, Wu S H, Zhou J, Chen B Y, Chen X L, Zhang J M, He J J, Xin X, Lu X X. Comprehensive mitochondrial metabolic shift during the critical node of seed ageing in rice.PLoS One, 2016, 11(4): e0148013.
[16] 宋松泉, kenneth M F, Ian M M.高温加速老化过程中甜菜种子线粒体小分子量热激蛋白22的变化. 植物生理学报, 2001, 27(1): 73-80.
Song S q, Kenneht M F, Ian M M. Changes in low-molecular weight heat shock protein 22 of mitochon-dria during high- temperature accelerated ageing ofL. seeds. Plant Physiology Journal, 2001, 27 (1): 73-80. (in Chinese)
[17] Formentini L, Ryan A J, Gálvez-Santisteban M, Carter L, Taub P, Lapek J D Jr, Gonzalez D J, Villarreal F, Ciaraldi T P, Cuezva J M, Henry R R. Mitochondrial H+-ATP synthase in human skeletal muscle: contribution to dyslipidaemia and insulin resistance. Diabetologia, 2017, 60(10): 2052-2065.
[18] Xin X, Lin X H, Zhou Y C, Chen X L, Liu X, Lu X X. Proteome analysis of maize seeds: the effect of artificial ageing. Physiologia Plantarum, 2011, 143(2): 126-138.
[19] Davies E, Stankovic B, Vian A, Wood A J. Where has all the message gone? Plant Science, 2012, 185/186: 23-32.
[20] Sano N, Permana H, Kumada R, Shinozaki Y, Tanabata T, Yamada T, Hirasawa T, Kanekatsu M. Proteomic analysis of embryonic proteins synthesized from long-lived mRNAs during germination of rice seeds. Plant and Cell Physiology, 2012, 53(4): 687-698.
[21] Sano N, Takebayashi Y, To A, Mhiri C, Rajjou L, Nakagami H, Kanekatsu M. Shotgun proteomic analysis highlights the roles of long-lived mRNAs and de novo transcribed mRNAs in rice seeds upon imbibition. Plant and Cell Physiology, 2019, 60(11): 2584-2596.
[22] Howell K A, Narsai R, Carroll A, Ivanova A, Lohse M, Usadel B, Millar A H, Whelan J. Mapping metabolic and transcript temporal switches during germination rice highlights specific transcription factors and the role of RNA instability in the germination process. Plant Physiology, 2009, 149(2): 961-980.
[23] Shcherbik N, Pestov D G. The impact of oxidative stress on ribosomes: From injury to regulation. Cells, 2019, 8(11): 1379.
[24] Barciszewski J, Barciszewska M Z, Siboska G, Rattan S I S, Clark B F C. Some unusual nucleic acid bases are products of hydroxyl radical oxidation of DNA and RNA. Molecular Biology Reports, 1999, 26(4): 231-238.
[25] Tanaka M, Chock P B, Stadtman E R. Oxidized messenger RNA induces translation errors. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(1): 66-71.
[26] Radak Z, Boldogh I. 8-Oxo-7, 8-dihydroguanine: links to gene expression, aging, and defense against oxidative stress. Free Radical Biology and Medicine, 2010, 49(4): 587-596.
[27] Fleming M B, Richards C M, WALTERS C. Decline in RNA integrity of dry-stored soybean seeds correlates with loss of germination potential. Journal of Experimental Botany, 2017, 68(9): 2219-2230.
[28] 文卿琳, 王兴鹏. 温度对棉花种子萌发的影响. 安徽农业科学, 2008, 36(9): 3513-3515.
WEN Q L, WANG X P. Effects of temperature on the germination of cotton seeds. Journal of Anhui Agricultural Sciences, 2008, 36(9): 3513-3515. (in Chinese)
[29] 苗建伟, 魏东. 改进我国现行棉花种子水份测定方法的试验. 种子, 1996(4): 61-63.
Miao J W, WEI D. Test of improving the current method of cotton seed in China. Seed, 1996(4): 61-63. (in Chinese)
[30] 尹燕枰, 董学会. 种子学实验技术. 北京: 中国农业出版社, 2008: 167-168.
Yin Y P, dong x h. Experimental techniques of seedology. Beijing: China Agriculture Press, 2008: 167-168. (in Chinese)
[31] GB/T 5530-2005. 动植物油脂酸值和酸度测定. 北京: 中华人民共和国国家质量监督检验检疫总局, 2005.
GB/T 5530-2005. Animal and vegetable fats and oils determination of acid value and acidity. Beijing: General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, 2005. (in Chinese)
[32] 徐爱东, 张志良. 植物生理学实验指导. 植物生理学通讯, 2007, 43(6): 2.
Xu A d, Zhang Z l. Guide to plant physiology experiment. Plant Physiology Journal, 2007, 43(6): 2. (in Chinese)
[33] 马春花, 铁轶, 付汉江, 刘斌, 邢瑞云, 朱捷, 丁勇, 郑晓飞. mRNA氧化损伤检测方法的优化及p53 mRNA氧化损伤分析. 军事医学, 2013, 37(3): 180-183, 200.
MA C H, TIE Y, FU H J, LIU B, XING R Y, ZHU J, DING Y, ZHENG X F. Optimization of method to detect mRNA oxidative damage and quantification of p53 mRNA oxidative damage. Military Medical Sciences, 2013, 37(3): 180-183, 200. (in Chinese)
[34] Mcdonald M. Seed deterioration: physiology, repair and assessment. Seed Science and Technology, 1999, 27(1): 177-237.
[35] BERJAK P, DINI M, Gevers H O. Deteriorative changes in embryos of long-stored, uninfected maize caryopses. South African Journal of Botany, 1986, 52(2): 109-116.
[36] Ratajczak E, MAŁECKA A, Bagniewska-Zadworna A, Kalemba E M. The production, localization and spreading of reactive oxygen species contributes to the low vitality of long-term stored common beech (L.) seeds. Journal of Plant Physiology, 2015, 174: 147-156.
[37] López-Fernández M P, Moyano L, Correa M D, Vasile F, Burrieza H P, Maldonado S. Deterioration of willow seeds during storage. Science Reports, 2018, 8(1): 1-11.
[38] 田茜, 辛霞, 卢新雄, 陈晓岭, 张金梅. 植物种子衰老与线粒体关系的研究进展. 植物遗传资源学报, 2012, 13(2): 283-287.
Tian Q, Xin X, Lu X X, CHEN X L, ZHANG J M. Research progress on plant seed aging and mitochondria. Journal of Plant Genetic Resources, 2012, 13(2): 283-287. (in Chinese)
[39] Harman D. Aging: a theory based on free radical and radiation chemistry. Journal of Gerontology, 1956, 11(3): 298-300.
[40] 王天波, 赫文学, 张峻铭, 吕伟增, 梁雨欢, 卢洋, 王雨露, 谷丰序, 宋词, 陈军营. 人工老化玉米种胚ROS产生及ATP合成酶亚基mRNA完整性研究. 作物学报, 2022, 48(8): 1996-2006.
Wang T B, He W X, Zhang J M, Lü W Z, Liang Y H, Lu Y, Wang Y L, Gu F X, Song C, Chen J Y. ROS production and ATP synthase subunit mRNAs integrity in artificially aged maize seed embryos. Acta Agronomica Sinica, 2022, 48(8): 1996-2006. (in Chinese)
[41] Nakabayashi K, Okamoto M, Koshiba T, Kamiya Y, Nambara E. Genome-wide profiling of stored mRNA inseed germination: epigenetic and genetic regulation of transcription in seed. The Plant Journal, 2005, 41(5): 697-709.
[42] Rajjou L, Gallardo K, Debeaujon I, Vandekerckhove J, Job C, Job D. The effect of alpha-amanitin on the Arabidopsis seed proteome highlights the distinct roles of stored and neosynthesized mRNAs during germination. Plant Physiology, 2004, 134(4): 1598-1613.
[43] Galland M, Huguet R, Arc E, Cueff G, Job D, Rajjou L. Dynamic proteomics emphasizes the importance of selective mRNA translation and protein turnover duringseed germination. Molecular & Cellular Proteomics, 2014, 13(1): 252-268.
[44] Sano N, Rajjou L, North H M. Lost in translation: Physiological roles of stored mRNAs in seed germination. Plants, 2020, 9(3): 347.
[45] Nonogaki H, Bassel G W, Bewley J D. Germination—Still a mystery. Plant Science, 2010, 179(6): 574-581.
[46] Capaldi R A, Aggeler R. Mechanism of the F1F0-type ATP synthase, a biological rotary motor. Trends in Biochemical Sciences, 2002, 27(3): 154-160.
[47] Schmidt M, Luff M, Mollwo A, Kaminski M, Mittag M, Kreimer G. Evidence for a specialized localization of the chloroplast ATP-synthase subunits,, andin the eyespot apparatus of chlamydomonas reinhardtii (chlorophyceae). Journal of Phycology, 2007, 43(2): 284-294.
[48] Lee J, Welti R, Roth M, Schapaugh W T, Li J R, Trick H N. Enhanced seed viability and lipid compositional changes during natural ageing by suppressing phospholipase Din soybean seed. Plant Biotechnology Journal, 2012, 10(2): 164-173.
Physiological Changes and Integrity of ATP Synthase Subunits mRNA in Naturally Aged Cotton Seeds
Song Ci, Gu FengXu, Xing ZhenZhen, Zhang JunMing, He WenXue, Wang TianBo, WangYuLu, CHEN JunYing
College of Agronomy, Henan Agricultural University, Zhengzhou 450046
【Objective】Seed aging is a complex biological process, previous studies have been used to elucidate the events. However, the mechanism of seed aging is still unclear. The naturally aged cotton seeds were used as experimental materials, and the physiological and biochemical changes as well as the changes in ATP synthase mRNA integrity that occurred in cotton seed during storage were investigated in order to provide a foundation for further illuminating the aging mechanism of cotton seeds. 【Method】In this study, a collection of seeds (cultivar Xinluzao 74) that had been stored for 3 and 5 years served as the experimental materials, the newly harvested seeds were used as the control (CK). The germination percentage, water absorption and viability of cotton seeds were valued by germination test between paper, low constant temperature over method, and TTC staining method, respectively; The acid value and respiratory rate of cotton seeds were determined by the acid-base titration method, and the ATP synthase activity was detected with plant ATP synthase ELISA kit. The mRNA integrity of ATP synthase subunit,,,, andin cotton embryo was analyzed by reverse transcription blocking-double primer amplification method. 【Result】Our data suggest that seed vigor dramatically decreased over storage time. After 3 and 5 years of storage, the germination percentage of cotton seeds was significantly decreased from 98.7% to 84.0% and 58.0%, respectively (<0.05). At the initial stage of seed imbibition (the first 4 h), the water absorption rate of seeds was significantly decreased by 11.0% and 26.9%, respectively. The results of TTC staining showed that only the radicle was slightly stained in seeds preserved 5 years but not the cotyledons and other organs stained; The acid value of seeds was significantly increased by 28.4% and 40.0%, respectively (<0.05), this indicated that severe hydrolysis of lipid occurred in seeds. Seed respiration rate and ATP synthase activity showed an increasing trend during imbibition, but the increasement was significantly decreased (<0.05); The respiration rate of seeds was reduced by 33.3% and 49.2% after 24 hours of imbibition, and the activity of ATP synthase was decreased by 17.9% and 73.4% after 12 hours of imbibition, respectively. The results of reverse transcription blocking-double primer amplification showed that thevalue of ATP synthase subunits,,, andmRNAs stored in seeds were significantly decreased, but the subunitmRNA was significantly increased. These results indicated that the integrity of the ATP synthase subunits mRNA decreased to varying degrees during the natural storage process. 【Conclusion】These results showed that a prolonged storage time could reduce seed vigor; The integrity loss of ATP synthase subunit mRNAs stored in seed embryos would cause ATP synthase subunit to be impaired and ATP synthase activity declined, thus lead to a decreased production of ATP and affect seed germination capacity. This might be one of the important reasons for cotton seed aging.
cotton seed; seed senescence; seed vigor; ATP synthase;mRNA integrity

10.3864/j.issn.0578-1752.2023.10.001
2022-12-20;
2023-02-17
国家自然科学基金(31971998,31571761)、国家重点研发计划(2018YFD0101000-03)
宋词,E-mail:sc17836952689@126.com。通信作者陈军营,E-mail:chenjunying3978@126.com
(责任编辑 李莉)
