超声引导经皮微波消融治疗症状性子宫腺肌病患者的疗效和安全性
2023-05-16邓尔雅李秋燕朱菁莪李嘉欣李小龙张会丽余松远
邓尔雅,李秋燕,朱菁莪,李嘉欣,李小龙,4,张会丽,余松远
1. 安徽理工大学医学院,安徽 淮南 232001;
2. 同济大学附属第十人民医院医学超声科,上海 200072;
3. 上海超声诊疗工程技术研究中心,上海 200072;
4. 复旦大学附属中山医院超声科,上海 200032
子宫腺肌病是一种子宫内膜腺体和间质侵入子宫肌层并呈浸润性生长,同时伴有周围平滑肌的肥大和增生的妇科良性病变[1]。子宫腺肌病可引起严重痛经、子宫增大继发盆腔压迫、月经量大继发顽固性贫血,并引起生育能力下降甚至不孕不育,严重影响妇女生活质量与生殖健康[2]。目前,其发病机制主要包括异位子宫内膜的侵袭和组织损伤的修复,胚胎多能干细胞的增殖和分化,以及炎症因子和神经源性介质的相互作用等[3]。据研究[4-5]报道,子宫腺肌病常见于30~50岁的女性,发病率为10.00%~65.00%。但近30年来,随着国内生育观念的改变及工作压力的增加,子宫腺肌病的发病率逐渐上升。
传统针对子宫腺肌病的一线治疗方式为长期药物维持治疗,其次为子宫切除术[3]。药物治疗期间出现的长期点滴出血、体重增加等不良反应会导致相当一部分患者因不能耐受而中断治疗。子宫切除术则直接导致部分育龄期女性失去生育能力。目前,保留子宫的非侵入性或微创性医疗干预措施正在逐渐取代传统疗法[6]。保留子宫的手术包括腺肌瘤切除术、病灶减少术、子宫内膜消融或切除术、子宫动脉栓塞术(uterine artery embolization,UAE)及热消融等[7]。尽管无法完全切除病灶是所有保守性治疗必须考虑的因素,但其对月经和痛经症状的显著改善效果已得到相关回顾性研究[8-9]的支持。其中,热消融因其微创性、操作灵活性、治疗后并发症少、临床症状缓解率高等特点,在临床应用中逐渐受重视并被接受[10-12]。
目前,微波消融(microwave ablation,MWA)治疗子宫腺肌病的临床研究有限,缺乏具有可重复性和可靠性的临床研究[13-15]。本研究旨在全面研究超声引导经皮MWA治疗有症状的子宫腺肌病的可行性、安全性,以及短期临床疗效。
1 资料和方法
1.1 研究对象
收集2020年7月—2021年6月于上海市第十人民医院就诊的38例子宫腺肌病患者,患者中位年龄为38岁。纳入标准:① 患者拒绝接受子宫切除术或其他非侵入性治疗方法;② 经超声和磁共振成像(magnetic resonance imaging,MRI)检查证实的子宫腺肌病患者;③ 患者有临床症状且生活质量受到很大影响;④ 痛经视觉模拟评分(visual analog scale,VAS)>4或非经期血红蛋白(hemoglobin,Hb)水平<110 g/L。排除标准:① 有严重盆腔炎症的患者(n=1);② 没有完整的临床和影像学资料(n=3)。最终,本研究纳入34例绝经前的症状性子宫腺肌病患者。
1.2 设备
采用南京长城医疗设备有限公司的MTI-5A肿瘤微波治疗仪,微波输出频率为(2 450±50)MHz;微波热凝消融针(XR-A2018W)的直径为2 mm,长度为18 cm,驻波比不大于3.0,匹配阻抗50 Ω。采用单极水冷MWA系统,通过内部液体循环,以减少电极周围的组织碳化,从而提高凝固性坏死的效率。
采用美国GE公司的Logiq E9彩色多普勒超声诊断仪,使用频率为1~5 MHz的凸阵探头进行检查、监测超声造影(contrast-enhanced ultrasound,CEUS)和超声引导下的MWA。
1.3 术前评估
在了解病史和患者诉求后,术前对血常规、尿常规、凝血功能、肝功能、肾功能、电解质、血清肿瘤标志物、性激素、心电图、超声等进行评估,排除治疗禁忌证。在MRI和超声等影像学检查的帮助下,详细了解病变位置与周围毗邻组织的关系,确定最佳穿刺路径。
1.4 治疗方案
除9例患者强烈要求行全身麻醉外,其余25例(73.53%)患者进行静脉镇静镇痛。所有局部麻醉参与者,都通过左上肢周围静脉给予1.00 mg咪达唑仑和0.05 mg芬太尼的起始剂量,此外额外单次补充0.012 5 mg芬太尼缓慢泵入静脉以缓解术中疼痛。
经常规消毒、铺巾后,以2%利多卡因进行局部浸润麻醉。在超声引导下用18 G自动活检针经腹腔行穿刺活检,将单极MWA天线沿活检路径插入目标病变中完成消融。为避免穿刺操作造成的肠道穿孔,在插入单极MWA天线之前,必须用超声探头将肠道从腹壁上推开。其中,6例局部麻醉患者因无安全穿刺路径,需额外通过腹腔内注入500~1 000 mL的生理盐水将肠道与子宫分开至少0.5 cm。
微波发射功率设定为50~60 W。在消融过程中,采用“移动消融”技术来处理目标病灶[13]。首先对病变底部进行消融,然后将天线逐步拔出,直到病变的边缘部分。一般来说,在进行单点消融后,天线被拔出2 cm进行下一次消融,直到穿刺路径被汽化反应引起的云雾状高回声所覆盖。之后,将天线从另一个方向再次引入病灶。重复上述程序,直到整个病变边缘被汽化高回声云覆盖。对于个别有生育要求的患者,另外设定的终点是消融边界离子宫内膜至少1 cm[16-17]。
术后采用CEUS评估消融是否完全(图1),造影剂使用意大利Bracco公司生产的声诺维(SonoVue)。CEUS上的无灌注区被确定为消融后的组织坏死区。如果拟定的消融目标仍有造影剂存在,则有必要在CEUS引导下直接进行额外的消融。
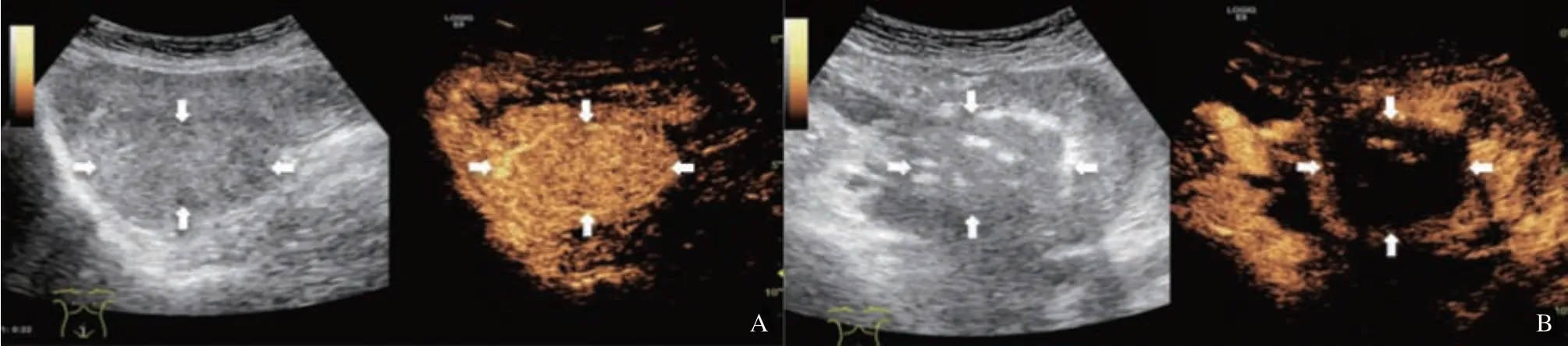
图1 典型病例1(患者,女性,35岁,子宫腺肌病史36个月)常规超声和CEUS图像
1.5 临床疗效判定及随访指标
34例患者被建议在MWA后1、3、6 和12个月进行疗效评估。评估内容包括子宫体积缩小率(volume reduction rate,VRR)、病灶VRR、痛经程度、经期血量、Hb水平、症状严重程度评分(symptom severity score,SSS)和健康生活质量评分(health-related quality of life score,HRQL)。在每次随访中,通过超声检查评估子宫和治疗后的腺肌症的体积。MRI复查被安排在术后2 d和术后1年(图2)。
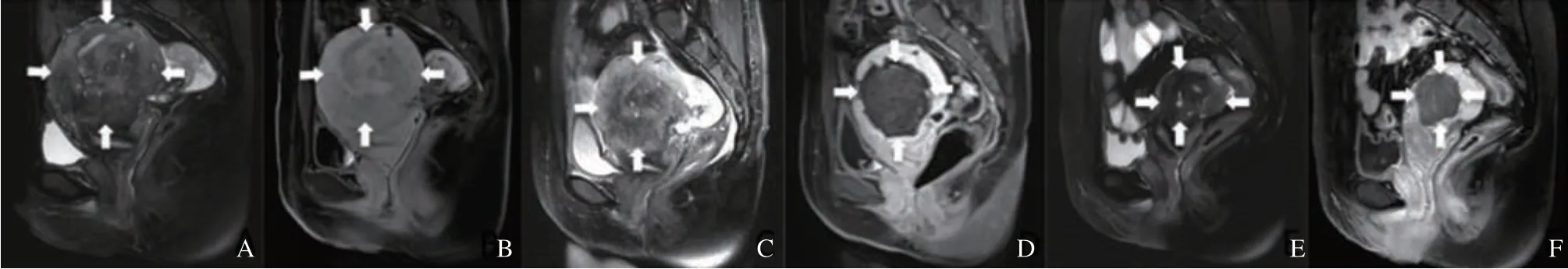
图2 典型病例2(患者,38岁,子宫腺肌病)在MWA前后的MRI图像
采用椭球模拟体积公式评估靶病灶和子宫体积:V=π/6×高×长×宽。VAS和月经失血图(pictorial blood loss assessment chart,PBAC)评分分别用于评估痛经程度和月经血量。前者的评分范围为0~10,其疼痛程度随着评分的增加而依次增加[18]。后者评分大于100时,认为是月经量过多[19-20]。此外,SSS和HRQL分数从0~100不等。对于SSS来说,分数越高表示临床症状越严重,而HRQL分数越高则倾向于表示不理想的生活质量[21]。
1.6 并发症评价
轻度并发症界定标准:发热、腹痛、恶心、呕吐、阴道流液、阴道出血等;严重并发症界定标准:子宫穿孔、肠道损伤或梗阻、膀胱穿孔、腹腔内大出血、弥漫性腹膜炎等。
1.7 统计学处理
采用SPSS 26.0软件进行统计学分析。使用Shapiro-Wilk检验来评估正态性。连续变量(即子宫体积、病灶体积、VAS、PBAC评分、SSS、HRQL和Hb水平)呈偏态分布,以M(P25,P75)表示,并使用Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
34例有症状的子宫腺肌病患者接受了经腹部超声引导的MWA评估。中位随访时间为12.00(10.50,12.00)个月。在随访期间,术后1、3、6、12个月于医院复查的患者分别为34例(100.00%),34例(100.00%),33例(97.06%)和27例(79.41%)。为了保护子宫内膜,对8例(23.53%)有生育要求的患者采用谨慎的保守消融策略。
2.2 术后子宫和病灶体积变化
MWA后12个月,中位子宫体积从基线体积148.45(92.08,215.62)mL减少至87.62(55.90,132.97)mL(P<0.001),中位病灶体积从61.08(31.28,93.38)mL直接减少至13.33(7.95,43.20)mL(P<0.001)。与基线水平相比,中位子宫VRR为37.91%。与术前测量值相比,子宫腺肌病病灶体积呈现下降趋势,在1、3、6和12个月的随访中中位病灶VRR分别达到44.40%、65.07%、69.67%和72.81%(表1)。
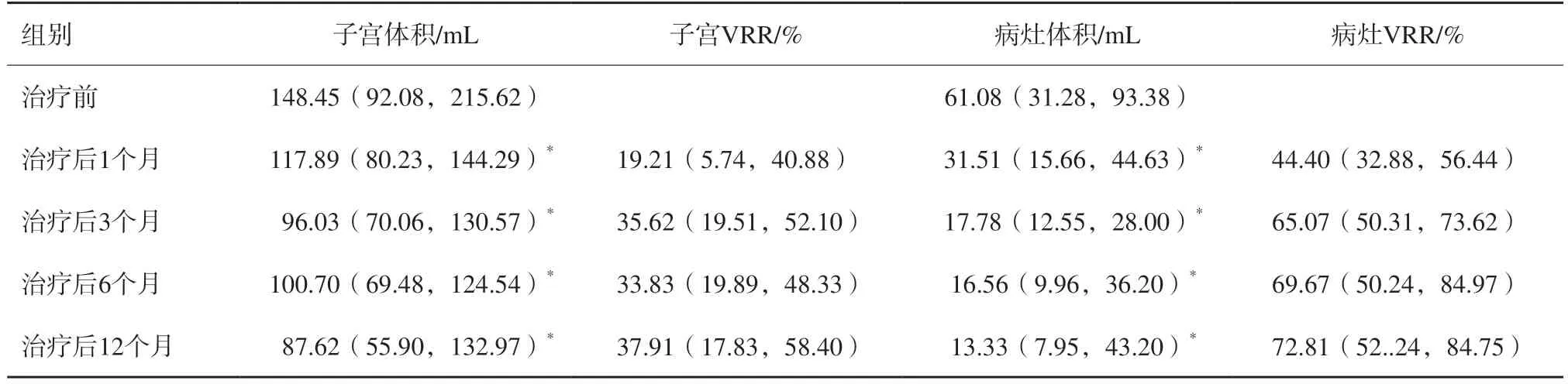
表1 术后子宫和病灶体积变化M(P25,P75)
2.3 Hb水平及各类临床相关评分
在12个月的随访中,31例痛经患者VAS从治疗前的8.00(7.00,9.25)明显下降到治疗后的0.00(0.00,3.25)(P<0.001)。在月经血量方面,27例月经血量过多的患者中位PBAC评分降至正常范围内(即PBAC评分<100),尽管11例(40.74%)患者报告通过PBAC评估,月经血量仍高于正常值。Hb水平从117.00(112.25,138.25)g/L增加到130.00(118.75,135.50)g/L(P=0.001)。同时,在每次随访中,SSS和HRQL也显示出统计学上的明显改善。SSS从基线水平28.18(21.88,35.16)降至12.50(6.25,19.53)(P<0.001),HRQL在术后最后一次随访时从57.33(43.10,65.30)上升至77.16(62.50,89.22)(P<0.001,表2)。
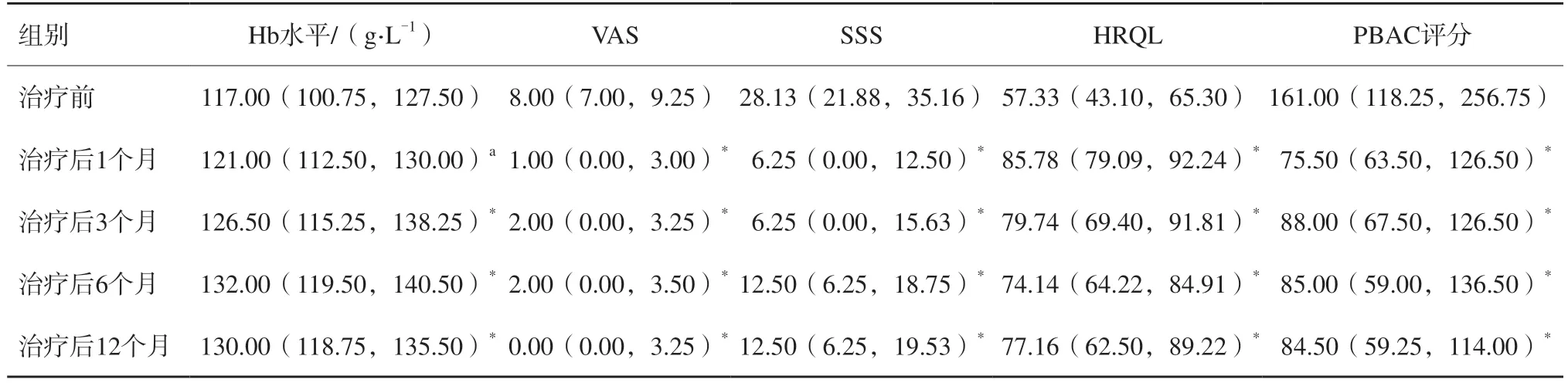
表2 治疗前后Hb水平和各类临床相关评分结果M(P25,P75)
Hb水平、VAS、SSS、HRQL和PBAC评分在术后随访过程中差异均有统计学意义(P<0.001)。临床结果在治疗后6个月最佳,其中一些评价指标,如VAS、SSS、HRQL和PBAC评分显示改善优势直接持续到术后12个月。
2.4 并发症
无重大并发症发生,且所有的微小并发症均为自限性。最常见的轻微并发症为阴道流液,52.94%(18/34)的患者出现阴道流液现象,在治疗后40 d内完全消失。值得一提的是,大多数患者可以在MWA后3 d内恢复工作(表3)。
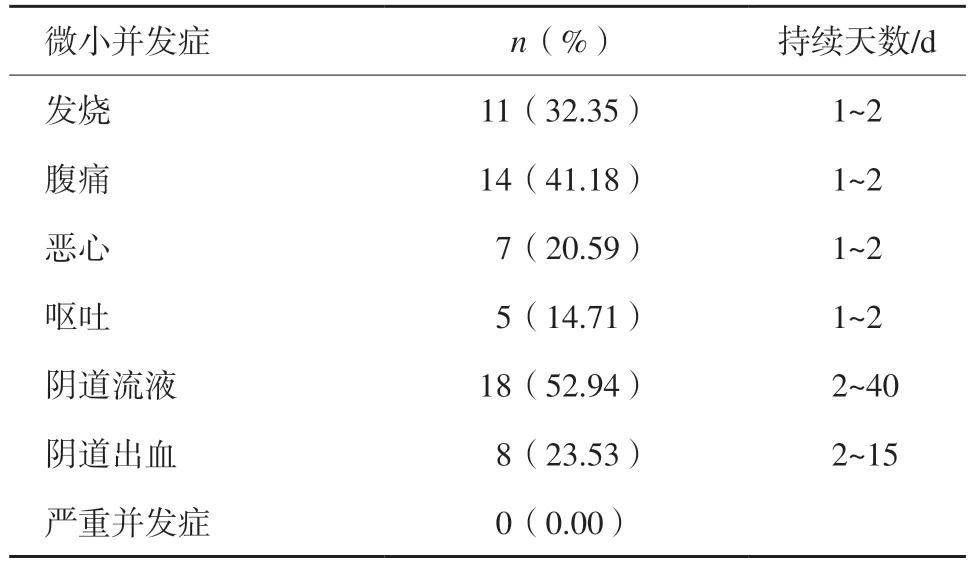
表3 并发症
3 讨 论
本研究通过比较MWA治疗前后的实验室检验、影像学检查、各类评分和临床结果,发现超声引导下MWA可缩小子宫和病灶的体积,有效地缓解女性子宫腺肌病患者的临床症状,并且无严重并发症,表明有症状的子宫腺肌病患者可以从超声引导下MWA中获益。
本研究结果显示,子宫中位VRR和病灶中位VRR在术后1年随访期间分别为37.91%和72.81%。在术后3、6和12个月的随访中,病灶中位VRR至少为50.00%。根据国内专家建议[22],MWA被认为治疗效果显著。本研究结果与Hai等[23]报道的接受射频消融(radiofrequency ablation,RFA)治疗的患者(子宫VRR和病灶VRR分别为41.20%和54.70%)和Guo等[24]报道的接受高强度聚焦超声(high intensity focused ultrasound,HIFU)治疗的患者(子宫VRR和病灶VRR分别为30.42%和43.96%)相比,子宫的改善情况在消融治疗后1年相似,且在病灶VRR方面甚至获得了更好的结果。这可能是由于术中超声动态监测、“移动消融”技术和术后即时CEUS评估的完美协调。
另外,治疗有症状的子宫腺肌病最重要的目标是缓解临床症状,从而提高患者的生活质量。本研究中评估痛经程度和月经血量的VAS和PBAC明显下降,并在术后保持在较低水平。而在Scarperi等[25]的研究中,经12个月随访,VAS从9.1下降至2.6。手术前后VAS与本研究一致明显下降。同时,本研究患者在MWA治疗后,通过PBAC评分评估的月经血量有所改善,也与Huang等[26]的结果一致。与此同时,Hb水平在随访期间也有所增加。SSS和HRQL是评估子宫腺肌病临床症状和生活质量的工具。HRQL和SSS的变化在本研究中表现出明显的改善,但是与Ma等[27]报告的UAE研究(SSS从56.00下降到13.00,HRQL从39.00上升为94.00)和Liang等[28]报告的UAE研究(SSS从57.00下降到17.00,HRQL从45.00上升为90.00)相比,UAE在改善症状和生活质量方面比本研究结果更胜一筹。然而,在De Bruijn等[29]发表的关于UAE的meta分析中,6项研究显示术后子宫结合带减少率为13.70%~38.00%,在12项研究中,413例患者中共有361例(87.41%)报告持续腹痛长达2周,13项研究中共有445例患者中28例(6.29%)报告持续闭经。
无论采用何种保守治疗方式,临床症状未完全改善的情况都可能存在,与其病因、发病机制、生理结构等因素密切相关。在本研究中,40.74%(11/27)的痛经患者通过PBAC评估显示月经量没有减少至正常水平。其中有8例患者由于有生育意愿而尽量避免或减少对子宫内膜的热损伤。众所周知,月经血量与子宫内膜厚度息息相关。事实上,对于希望保留生育能力的患者进行介入治疗一直存在争议。但Nam[30]和周春艳等[31]的研究结果显示,热消融有望成为确保良好临床结果的有效方式。Nam[30]的研究显示58例接受RFA治疗后积极尝试受孕的患者中,29例(50.00%)成功妊娠,并且无子宫破裂发生。周春艳等[31]认为HIFU消融也可能有助于改善子宫腺肌病患者的妊娠结局。
可能出现的并发症是患者抗拒消融方案的重要原因。在Chen等[32]的研究中,有2例患者在HIFU治疗后20 d内出现了肠穿孔,另1例患者在HIFU治疗1年半后被发现有侧腹综合征。幸运的是,在本研究中没有出现需要进一步干预或其他重大的并发症,并且所有的微小并发症都具有自限性。超声监测下经皮引入人工腹水可有效地提供安全的穿刺路径,并避免子宫相邻结构热损伤。
本研究存在一定的局限性。首先,这是一项样本量相对较小的回顾性研究,需要进一步设计前瞻性、多中心、更大样本量和更长随访时间的研究。其次,随访时间太短,无法总结要求保留生育能力的患者的最终妊娠结局。第三,超声引导MWA技术没有与HIFU、RFA或切除手术直接比较。
总之,根据本研究结果,MWA是治疗症状性子宫腺肌病的一种可行的选择。接受超声引导MWA治疗的子宫腺肌病患者在子宫体积和腺肌症体积减少的同时,能明显改善患者的痛经和月经过多等症状。
