非诺贝特酸胆碱缓释胶囊生产设备的UV法清洁验证
2023-05-16朱家乐姜庆伟金学军
朱家乐 姜庆伟 金学军


摘要:為验证清洁操作完成后生产设备表面非诺贝特酸的残留量是否低于安全指标,建立了紫外可见分光光度法测定擦拭棉签的提取溶液中非诺贝特酸的含量。使用286 nm检测波长,1 cm吸收池,50%甲醇的溶剂。非诺贝特酸在0.95 ~14.25 µg/mL 浓度范围内线性关系良好。316不锈钢板、有机玻璃和硅胶的取样回收率分别为82.2%、75.8%和、76.9%,RSD分别为 9.47%、4.41%和、4.06%。方法回收率为101.5%,RSD为1.05%。该UV法可用于生产设备上非诺贝特酸胆碱缓释胶囊残留物的清洁控制分析。
关键词:非诺贝特酸 清洁验证 紫外可见分光光度法 残留物
【中图分类号】:R917 【文献标识码】:A中图分类号:R917
Validation of UV Cleaning of Manufacturing Equipment of Choline
Fenofibrate Sustained-Release Capsules
ZHU Jiale 1 JIANG Qingwei 2* JIN Xuejun 1
(1.College of Integration Science, Yanbian University, Yanji, Ji’lin Province, 13300’2 2 China ;
2.Jilin Tianheng Pharmaceutical Co., Ltd., Meihekou, Ji’lin Province, 135000 China )
Abstract: In order to verify whether the residue of fenofibrate acid on the surface of manufacturing equipment is lower than the safety index after the cleaning operation is completed, Ultraviolet-visible (UV) spectrophotometry is established to determine the content of fenofibrate acid in swab extraction solution. A solvent with 286 nm detection wavelength, 1 cm absorption cell and 50% methanol is used. Fenofibric acid shows a good linearity in the concentration range of 0.95 ~ 14.25 µg/mlmL. The extraction recovery of 316 stainless steel plate, plexiglass and silica gel is 82.2%, 75.8% and 76.9%, and RSD is 9.47%, 4.41% and 4.06%, respectively. The recovery of the method is 101.5% and RSD is 1.05%. This UV method can be used for the analysis of cleaning control for the residue of Choline Fenofibrate Sustained-release Capsules on manufacturing equipment.
Key Words: Fenofibrate acid; Cleaning verification; Ultraviolet-visible spectrophotometry; Residue
非诺贝特胆碱(Choline fenofibrate)是非诺贝特酸的胆碱盐,在肠道内解离为游离的非诺贝特酸,不通过首过效应代谢。非诺贝特酸在胃肠道内有很好的吸收[1]。同时非诺贝特酸胆碱缓释胶囊的有效活性成分是非诺贝特酸。
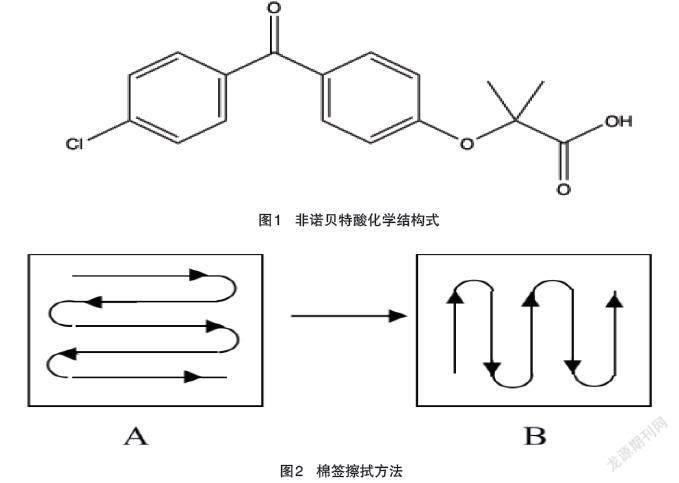
非诺贝特酸化学式为2-(4-(4-氯苯甲酰)苯氧基)-2-甲基丙酸,相对分子质量为318.75,为白色或类白色结晶性粉末,无臭,无味,几乎不溶于水,溶于甲醇,其化学结构见图1。如图1所示。
非诺贝特酸是一种合成的苯氧异丁酸衍生物,具有抗高血脂活性,是过氧化物酶体增殖物激活受体α(PPARα)激动剂。非诺贝特酸可使总甘油三酯(TG)水平降低25%~59%, ,使高密度脂蛋白-胆固醇 (HDL-C) 水平升高1%~34%,总胆固醇(TC)水平下降6%~27%[2], 临床医学常用于TG升高,或以TG升高为主的混合型高脂血症及低HDL-C的高脂血症治疗[3]。已上市的有45mg、和135 mg规格的口服制剂。
药品的生产过程中,由于不同产品共用一条生产线,因此在更换产品时如不注意极易造成微量交叉污染,需要对生产条线重新进行清洁验证,其前提是需要有合适的方法对目标化合物进行检验,即检验分析方法学验证[4]。从目检、化学检的角度进行测试,验证在使用该产品相关设备进行生产,生产结束后存放一定时间,铵设备清洁标准操作程序进行清洁,能够将设备部件上药物活性成分残留量清洁至合格标准,以达到防止发生污染与交叉污染的目的,并证明此清洁程序具有稳定性和重现性符合生产工艺和 GMP 的要求[5]。清洁验证前需考察被生产设备材质、密封部位和最可能导致交叉污染的关键部位。取样程序和残留物的分析方法必须经过验证,且有适当的回收率。根据验证结果建立清洁规程,以确保设备在清洗后药物的残留量符合生产工艺和 GMP 的要求[5]。
已报道的从血浆中检测非诺贝特酸含量的方法有高效液相色谱(HPLC)法[6],、液相色谱质谱联用法,、液相色谱-紫外检测(LC-UV)法[7],和、超高效液相色谱-串联质谱法[8]等。,其中HPLC[9]和UV[10]是清洁验证中最常用的两种方法。借鉴非诺贝特在中国药典[11],、美国药典[12]和欧洲药典[13]中含量测定项下HPLC法检测波长286 nm和非诺贝特酸在LC-UV法的检测波长288 nm[14],和与UV法具有灵敏度高,、设备普及,、耗时短,、操作简单,、出错率低和及节省试液等优势。,且还能满足生产线清洗后取样检测要尽快出结果的要求。本该研究意以在开发出用UV紫外分光光度法在286 nm波长下,检测出清洁验证中残留量非诺贝特酸的方法。
1建立快速检验生产设备表面非诺贝特酸残留量的方法。
仪器、试药与材料
1.1仪器
UV-26001紫外-可见分光光度计(岛津仪器有限公司),、BP211D 型电子天平( 德国赛多利斯公司,精度为 0.01 mg) ,、KQ-500DE型超声波清洗机(昆山市超声仪器有限公司,功率为 500 W,频率为40 kHz)。
1.2试药
非诺贝特酸胆碱缓释胶囊(吉林天衡药业有限公司,批号20211001)。,非诺贝特酸对照品(纯度为99.47%,北京天衡药物研究院有限公司,批号: 200521);,甲醇(色谱纯,赛默飞世尔科技有限公司,批号 204512);水为纯化水。TX® 715型棉签(美国Itw Texwipe Philippines 公司,Alpha® Swab with long handle,Clean Tips® Swabs,批号 213811201811)。
1.3材料
10 cm×10 cm的316不锈钢板,有机玻璃和硅胶。
2方法与结果
2.1色谱条件
检测波长:为286 nm;吸收池:为1 cm;溶剂:为50%甲醇。
2.2 溶液的配制
2.2.1 对照品溶液
精密称取非诺贝特酸对照品,加50%甲醇配制出0.19 mg/mlL的精密称取非诺贝特酸对照品19 mg,置100 mL量瓶中,加50%甲醇使溶解并稀释至刻度,摇匀,作为对照品贮备液。精密量取对照品贮备液加5 mL,置100 mL量瓶中,用50%甲醇配制出稀釋至刻度,摇匀。得9.5 µg/mL的对照品溶液。
2.2.2 供试品溶液
擦拭棉签预先用水超声(40 kHz)2次,每次30min,擦拭前将棉签头部水分尽量挤干。精密称定20粒非诺贝特酸胆碱缓释胶囊内容物,研细,精密称取细粉适量(约相当于非诺贝特酸19 mg),加50%甲醇,配制成9.5 µg/mL溶液(以非诺贝特酸计),离心,精密量取上清液40 mL,置于100 mL具塞试管中,将用空白棉签擦拭过不同生产设备材质(316不锈钢板,、有机玻璃,、硅胶)表面后,将的棉签头部剪下向下浸泡液面内,加塞,边超声边振荡边超声55 min左右,,离心,取上清液作为供试品溶液。
2.2.3 空白辅料贮备液
取空白辅料约28.4 mg(相当于盐酸文拉法辛19mg),置25 mL量瓶中,加50%甲醇,,超声5min,,p配制成1.136 mg/mlL溶液15mL,超声5min,取出,放冷至室温,用50%甲醇稀释至刻度,摇匀,滤过,取续滤液,作为空白辅料贮备液。
2.3棉签擦拭方法
待不同生产设备表面涂布的溶液完全干燥后,用纯化水润湿药签,并将药签头靠在溶剂瓶上挤压以除去多余的溶剂,按擦拭棉签用力在取样表面上擦拭,按照“S”形擦拭取样表面。保障取樣面积等同,用力均匀。用三3个棉签取样,保障取样的完整性[15]。见下图2具体如图2所示。其擦拭面积100 cm2。擦拭取样应始终固定一人,应尽可能采用固定的力度、擦拭速度和线路。取1个棉签,用将棉签头按在取样表面上,用力使其弯曲,平稳而缓慢地按照图2A所示擦拭取样表面。在向前移动的同时将其从一边移到另一边。擦拭过程应覆盖整个表面。翻转棉签,让棉签的另一面按照图2B所示也进行擦拭。但与前次擦拭移动方向垂直。然后取另两个棉签分别重复擦拭一遍[15]。擦拭面积100 cm2。
2.4 专属性试验
将清洁剂棉签预处理溶液(水)、空白预浸出溶溶剂液(50%甲醇)、空白棉签浸出液(将预处理过的棉签3根浸入50%甲醇40 mL中边超声边震荡5 min)、空白辅料溶液(将空白辅料贮备液加50%甲醇稀释成0.0284 mg/mL溶液)、空白不同生产设备材质溶液(316不锈钢板,有机玻璃,硅胶)溶液(用预处理过空白的棉签擦拭空白不同设备材质,擦拭方法见“2.3”,然后将棉签头部剪下浸泡40 mL放入50%甲醇溶剂40 mL中边超声边振荡边超声5 min左右)、空白擦拭棉签浸出液(将3根空白擦拭棉签头浸入40 mL溶剂中边超声边震荡5 min)及供试品溶液,分别进样检测(色谱条件见“2.1”),测得各溶液的吸收值A。非诺贝特酸化学性质较稳定,在制备过程中基本无降解。供试品溶液的吸收值A与对照品溶液相比基本一致,其他溶液的吸收值A均不大于对照品溶液的2%。表明50%甲醇、水、空白棉签、空白辅料及不同设备材质均不干扰非诺贝特酸的测定。
2.5 最高可接受残留限度
根据食品药品监督管理局(FDA)的要求,残留限度的制定是由所涉及材料的性质来决定的。并且应是合乎逻辑的、实用的、可实现的和可验证的。任何限度的制定都应该是科学合理的。
根据《药品GMP指南》与《药品生产验证指南》推荐的两种方式进行计算,分别为:生物学活性限度-最低日治疗剂量的1/1000法和残留物浓度限度的10×10-6法,非诺贝特酸胆碱的日剂量较大,通常为135 mg/d,换入产品的批量很大,采用最低日治疗剂量的1/1000法和残留物浓度限度的10×10-6法来分别计算,取其最小为最高可接受残留限度。其中上游的产品为非诺贝特酸胆碱缓释胶囊与下游的产品为盐酸文拉法辛缓释胶囊。
2.5.1最低日治疗剂量的1/1000法
清洁的目的是保证在使用下游产品时,不出现上游产品的生理作用。基于药物活性的残留限度标准主要为药物最低治疗剂量的千分之一,通常认为当药物的摄入量低于其最低治疗剂量的1/1000千分之一时不会给患者带来不利影响[16]。下游产品批量越大被稀释的倍数越大,风险越小。因此需要计算最大残留限度L1/1000(,单位为µg/cm2),和最高可接受残留量(Maximum Acceptable Carryover,MAC),计算公式为[17]:
2.5.2残留物浓度限度的10×10-6法
上游产品使用前设备中残留在设备中的物质活性成分浓度不得高于全部溶流入当前使用设备的解进入下游产品的中所致的浓度不得高于10×10-6,除了高活性、高敏感性药品,该限度是足够安全的。因此,有必要进一步考察该方法。L=10B/((SA⋅F)(mg/cm2)。取安全因子F=10,则L=103B/SA(µg/cm2),结果及参数见表1。
以上两种计算方法计算结果分别为:最低日治疗剂量的1/1000法:0.716 mg/ cm²、残留物浓度限度的10×10-6法:3.80 μg/cm²。应选用残留量最小的计算结果作为最大清洁后单位面积的残留限度,即3.80 μg/cm²。擦拭面积100 cm2,棉签浸入溶液40 mlmL,故棉签擦拭提取的最大允许清洁残留浓度为9.50 µg/mL。
2.6线性试验
精密量取适量的上述“2.2.1”对照品贮备液用50%甲醇依次稀释成14.25 µg/mL、11.40 µg/mL、9.50 µg/mL、7.60 µg/mL、4.75 µg/mL、1.90和、0.95 µg/mL的系列浓度溶液,每个浓度平行进样2次。其中,0.95 µg/mL对应的吸收值A为0.043 µg/mL,,14.25 µg/mL对应的吸收值A为0.691,以设纵坐标为吸收值Ay为纵坐标,横坐标为浓度Cx为横坐标,对数据画进行线性回归,得到线性回归方程,得到Ay=0.0486Cx-0.0027,r=0.9954。r≥0.99,结果表明该线性实验的非诺贝特酸在0.95~14.25 µg/mL浓度范围内线性关系良好。
2.7定量限试验
精密量取适量的上述“2.2.1”对照品贮备液用50%甲醇依次稀释成0.95 µg/mL溶液,重复配制6份,分别测定吸光度A,定量限溶液(n=6)浓度为对照品溶液的1/10。吸收值均大于对照品溶液的2%,RSD为0.83%。故定量限为0.95 µg/mL。
2.8棉签回收率试验
精密称取非诺贝特酸对照品,加溶剂配制出0.76 mg/mlL的溶液约19mg,置于25mL量瓶中,用甲醇稀释至刻度,摇匀。精密量取0.5mL于滴于空白擦拭棉签上,常温吹干,将棉签置于试管中,精密加入10mL 50%甲醇,密封,超声5 分钟min,摇匀,精密量取5 mL,置20 mL量瓶中,用50%甲醇稀释至刻度,摇匀,,滤过,取续滤液。同法重复配制备6份。,棉签回收率溶液(n=6)与对照品溶液,分别按“2.1”项下的色谱条件进样检测测定,按外标法计算棉签回收率。结果表明棉签回收率(n=6)为96.4%,RSD为4.42%
2.9方法回收率试验
精密量取“2.2.1”项下对照品贮备液,分别加入空白辅料贮备液5 mL,用溶剂稀释, 配制出非诺贝特酸0.007 6 mg/mlL、0.009 5 mg/mL mg/ml和/0.011 4 mg/mL mg/ml溶液4 mL、5 mL、6 mL各3份,份,分别置于100 mL量瓶中,分别加入空白辅料贮备液5 mL,加50%甲醇稀释至刻度,摇匀,每个浓度各配制3份,共制备9份,。取续滤液,与对照品溶液,分别测定吸光度A,按“2.1”项下的色谱条件进样检测,按外标法计算方法回收率溶液。结果表明方法回收率(n=9)为101.5%,RSD为1.15%。
2.10取样回收率试验
擦拭取样是清洁验证中使用最广泛最常见的方法,适用于特定表面的残留物分析[18]。棉签擦拭的力度和方法影响取样回收率,取样回收率即棉签擦拭法擦拭相不同设备材质表面残留药物成分的百分率。配制系列浓度非诺贝特酸溶液,即最高残留物限度的50%、100%、150%,将已知浓度对照品溶液浓度的50%、100%、150%的非诺贝特酸溶液,溶液定量分别滴加在面积为100 cm2的不同生产设备材质表面。待自然干燥后,316不锈钢板,有机玻璃,硅胶表面。用空白棉签按“2.3”项下方式擦拭,并配制回收溶液,进样检测吸收值A,用外标法计算回收率。
精密称取非诺贝特酸对照品约76 mg,置于50 mL量瓶中,加甲醇40 mL,振荡溶解并定容,即配制成得1.52 mg/mL 0 µmg/ml的溶液。量取适量上述溶液,用甲醇依次稀释至0.38 mg/mL 0、0.76 mg/mL 、0和1.140 μmg/mL。精密量取0.5 mL上述溶液各20 µL,取25次,共0.5 mL,分别均匀滴在100 cm2的316不锈钢板,、有机玻璃,、硅胶材质上,每个浓度平行涂布3份,。待自然干燥后,按5×5方式排列。用润湿的棉签擦拭后,剪取棉签头浸泡在40 mL溶液,边超声置100 mL具塞试管中,加入40 mL浸出溶液,边振荡边超声5 min左右,分别进样行检测,每份平行检测2次。
在4.75~14.25 μg/mL考察范围内,得到3个不同浓度溶液,每个浓度平行配制3份,每份进样2次。结果见表2。测得316不锈钢板的平均回收率82.2%,RSD为9.47%;有机玻璃的平均回收率75.8%,RSD為4.41%;硅胶的平均回收率76.9%,RSD为4.06%;硅胶对非诺贝特酸吸附性比316不锈钢板强,平均回收率低。
2.11样品溶液稳定性
取“2.2.1”项下对照品溶液和“2.2.2”项供试品溶液各一份,于避光,冷藏放置,分别于 0 h、4 h、8 h、12 h 取样进行测定。结果显示对照品溶液含量相对于0 h,变化分别为-0.4%、-0.5%和、-0.7%,表明12 h内稳定可用。供试品溶液含量相对于0 h,变化分别为-0.5%、-0.7%和、-0.8%。均不大于2%,表明12 h内稳定性良好。
3结论
结果表明,UV法适用于远低于最高可接受残留限度的生产设备上残留的非诺贝特酸胆碱的定量测定,并具有高效性和灵敏度。棉签擦拭法来提取回收药物常用于常规清洁验证。清洁验证样品中溶剂和辅料均不干扰测定,表明该方法具有专属性,样品制备简单,可快速、高效地定量测定非诺贝特酸胆碱缓释胶囊的残留物。
紫外分光光度法操作简便,适用于清洁后生产设备表面非诺贝特酸胆碱的常规分析,可作为生产现场清洗工序合格或不合格的评判方法。
参考文献
[1] [1] PETER H. Jones and Michael H. Da vidson and Moti L. Kashyap and Maureen T. Kelly and Susan M. Buttler and Carolyn M. Setze and Da rryl J. Sleep and James C. Stolzenbach. Efficacy and Safety of ABT-335 (fenofibric acid) in Combination with Rosuvastatin in Patients with Mixed Dyslipidemia: A Phase 3 Study[J]. Atherosclerosis, 2009, 204(1):208-215.
[2] [2] KEATING GM, CROOM KF. Fenofibrate: A Review of Its Use in Primary Dyslipidaemia, the Metabolic Syndrome and Type 2 Diabetes Mellitus [J]. Drugs, 2007, 67(1): 121-153.
[3] [3] STRAIN J D, DEBRA F. A Review on the Rationale and Clinical Use of Concomitant Rosuvastatin and Fenofibrate/fenofibric Acid Therapy[J]. Clinical Pharmacology Advances & Applications, 2010, 2: 95-104.
[4] [4] 张友冬.TOC法测定清洁验证中盐酸林可霉素残留量[J].上海医药,2021,42(9): 67.
[5] [5] 张波,李旭娇,刘庆元,等.一种控制纽莫康定B0清洁残留的高效液相色谱法[J].中国医药工业杂志,2021,52(9):1241.
[6] [6] 徐帆,,冯恩富,,余昉. HPLC法测定血浆中非诺贝特活性代谢物非诺贝酸的濃度[J]. 中国药师,,2007,,89(6):530-532.
[7] [7] ARAFAT T, ARAFAT B, AWWAD A A, et al. Determination of Fenofibric Acid in Human Plasma by LC–MS/MS and LC–UV[J]. Chromatographia, 2016, 79(11-12):1-8.
[8] [8] WEI X, LI P, LIU M, et al. Absolute Oral Bioavailability of Fenofibric Acid and Choline Fenofibrate in Rats Determined by Ultra‐performance Liquid Chromatography Tandem Mass Spectrometry[J]. Biomedical Chromatography Bmc, 2017, 31(4): e3832~-e3833.
[9] [9] 顾林,张志才,罗亮,等.HPLC法测定清洁验证中残留物孟鲁司特钠的含量[J].中国处方药,2021,19(4):39-40.
[10] [10] FAZIO T T, SINGH A K, KEDOR-HACKMANN E R M, et al. Quantitative Determination and Sampling of Azathioprine Residues for Cleaning Validation in Production Area[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, ,43(4): ):1495-1498.
[11] [11] 国家药典委员会. 中华人民共和国药典;二部[S]. ].北京: :中国医药科技出社,,2020: :788-789.
[12] [12] The United States Pharmacopeial Convention. The United States Pharmacopeia 42: Vol 1[S].Baltimore: United Book Press, 2019: 1793.
[13] [13] Council of Europe. European Pharmacopoeia: Vol III [S]. 10th edition. Strasbourg: Convention on the Elaboration of a European Pharmacopoeia, 2016: 2617.
[14] [14] ROZET E , MERTENS B , DEWE W , et al. The Transfer of a LC-UV Method for the Determination of Fenofibrate and Fenofibric Acid in Lidoses: Use of Total Error as Decision Criterion[J]. J Pharm Biomed Anal, 2006, 42(1): 64-70.
[15] [15] 張振,申京建,赵明.总有机碳分析方法用于复方氨基酸(19)丙谷二肽注射液清洁验证效果考察[J].中国药业,2021,30(11):53-55.
[16] [16] 叶笑,王立杰,颜若曦.清洁验证中活性物质残留限度标准探讨[J].中国药物评价,2022,39(3):227-231.
[17] [17] 白慧良,,李武臣主编. 药品生产验证指南[M].北京::化学工业出版社,,2003.
[18] [18] 王亚蕊.多产品共线生产清洁验证评估及实施研究[D].成都::西华大学制药工程系,2021.
