血清IgM、凝血因子Ⅷ与IgA肾病患者肾脏预后的关系
2023-05-15邢明旭李艳萍付冬梅
邢明旭,李艳萍,付冬梅,赵 敬
河南省安阳市第三人民医院肾病内科,河南安阳 455000
IgA肾病是一种临床上常见的原发性肾小球疾病,占原发性肾小球疾病的15%~40%,其发病机制尚不明确,目前认为其与IgA1糖基化异常诱发自身抗体形成免疫复合物,并沉积于肾小球系膜有关[1]。IgA肾病患者经过规律治疗后,治愈率较高,部分患者由于治疗不及时,病情持续性恶化,容易诱发肾脏衰竭,进而威胁患者的生命安全[2]。因此,对IgA肾病患者的肾脏预后进行早期评估并给予干预治疗,对延缓肾脏功能进一步恶化具有重要的临床意义。免疫球蛋白M(IgM)是一种免疫球蛋白抗体,其血清水平能够反映机体的感染程度[3]。相关研究发现,IgM沉积能够促使肾脏基底膜组织区域补体富集,诱导免疫复合物形成,进而损伤基底膜内皮细胞、系膜细胞[4]。凝血因子Ⅷ(FⅧ)是人体一种重要的凝血因子,能够与血小板共同参与机体的凝血过程,近年来相关研究发现,FⅧ与慢性肾病患者的肾功能异常及预后密切相关[5-6]。但是目前关于血清IgM、FⅧ与IgA肾病患者肾脏预后的相关报道尚少。因此,本研究主要探讨血清IgM、FⅧ与IgA肾病患者肾脏预后的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2017年6月至2019年6月本院收治的112例IgA肾病患者作为观察组,另外选取120例同期来本院体检的健康人作为对照组。观察组年龄22~65岁,平均(34.58±4.16)岁;男73例,女39例;体质量指数(BMI)18.5~28.0 kg/m2,平均(23.23±1.58)kg/m2。对照组年龄22~65岁,平均(34.12±4.12)岁;男79例,女41例;BMI 19.0~27.0 kg/m2,平均(23.16±1.75)kg/m2。两组一般资料比较差异均无统计学意义(P>0.05),具有可比性。所有受试者知情并签署知情同意书。本研究已获得本院医学伦理委员会批准。
1.2纳入及排除标准 纳入标准:(1)符合IgA肾病的诊断标准[7];(2)肾活检估算肾小球滤过率(eGFR)>15 mL/(min·1.73 m2)。排除标准:(1)狼疮性肾小球肾炎、肾病综合征、紫癜性肾小球肾炎等继发性肾病者;(2)合并恶性肿瘤或重要器官功能不全者;(3)肾活检病理肾小球总数不超过10个者;(4)临床资料不完整者;(5)不能配合本次研究者。
1.3仪器与试剂 迈瑞BC-2600全自动血球分析仪、欧宝XL600全自动生化分析仪、普朗酶联免疫分析仪、IgM试剂盒、FⅧ试剂盒(赛默飞世尔科技有限公司)。
1.4方法
1.4.1资料收集 收集IgA肾病患者临床资料,包括收缩压,舒张压,牛津病理分型,ACEI/ARB用药史,糖皮质激素用药史,免疫抑制剂用药史,eGFR,24 h尿蛋白定量,血红蛋白、血清清蛋白、血肌酐、尿素氮、尿酸、总胆固醇、甘油三酯水平等。
1.4.2血清指标检测 对照组于体检当天、观察组于进行肾活检前,分别用2 mL EDTA-K2抗凝采血管采集清晨空腹肘静脉血3份。1份采用全自动血球分析仪检测血红蛋白水平。另外2份室温下静置半小时,然后3 000 r/min离心15 min,取上清液,置于-80 ℃冰箱内保存,其中1份采用全自动生化分析仪检测血肌酐、尿素氮、尿酸、总胆固醇、甘油三酯、血清清蛋白水平,另1份采用酶联免疫吸附试验检测血清IgM、FⅧ水平,具体操作按照使用说明书进行。IgM试剂盒、FⅧ试剂盒批内和批间变异系数均小于10%。计算eGFR=175×血肌酐-1.234×年龄-0.179(如果是女性×0.79)[7]。
1.4.3尿蛋白测定 收集患者肾活检前24 h尿液,采用邻苯三酚散射比浊法进行24 h尿蛋白定量测定。
1.4.4IgA肾病严重程度 根据患者的肾小管间质损害程度来判断疾病的严重程度,肾小管间质损害包括间质纤维化、间质性炎症、肾小管萎缩,其中无损害计0分,病理区域累及范围<50%计1分,病理区域累及范围≥50%计2分,肾小管间质损害评分总分为0~6分。根据得分情况不同分为轻度组(总分≤1分)、中度组(总分为2分)和重度组(总分≥3分)。
1.4.5肾脏病理诊断 根据牛津病理分型标准[8]进行病理诊断:系膜细胞增生评分≤0.5分为M0,>0.5分为M1;有无毛细血管内皮细胞增多(E0/E1);有无节段性硬化或粘连(S0/S1);肾小管萎缩或间质纤维化程度,≤25%为T0,25%~50%为T1,>50%为T2;新月体病变占比:无新月体为C0,<25%为C1,≥25%为C2。
1.4.6肾脏预后 连续随访3年,随访截止时间为2022年6月。肾脏预后不良定义:eGFR下降≥50%或进入终末期肾脏病或需要接受连续性肾脏替代治疗或患者死亡。根据患者肾脏预后情况分为预后良好组和预后不良组。

2 结 果
2.1两组血清IgM、FⅧ水平比较 观察组血清IgM水平低于对照组,FⅧ水平高于对照组,差异均有统计学意义(P<0.05)。见表1。
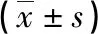
表1 两组血清IgM、FⅧ水平比较
2.2不同程度IgA肾病患者血清IgM、FⅧ水平比较 根据肾小管间质损害评分情况,IgA肾病患者分为轻度组36例、中度组49例及重度组27例。重度组血清IgM水平低于中度组和轻度组,血清FⅧ水平高于中度组和轻度组,且中度组血清IgM水平低于轻度组,血清FⅧ水平高于轻度组,差异均有统计学意义(P<0.05)。见表2。
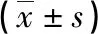
表2 不同程度IgA肾病患者血清IgM、FⅧ水平比较
2.3IgA肾病患者肾脏预后情况的单因素分析 随访期间,112例IgA肾病患者中,有81例(72.32%)肾脏预后良好(预后良好组),31例(27.68%)肾脏预后不良(预后不良组)。两组患者的年龄、性别、收缩压、舒张压、牛津病理分型、ACEI/ARB用药史、糖皮质激素用药史、免疫抑制剂用药史、总胆固醇、甘油三酯水平比较,差异无统计学意义(P>0.05);预后不良组eGFR、血红蛋白、血清清蛋白、IgM水平低于预后良好组,24 h尿蛋白定量、血肌酐、尿素氮、尿酸、FⅧ水平高于预后良好组,差异均有统计学意义(P<0.05)。见表3。

表3 IgA肾病患者肾脏预后影响因子的单因素分析或n(%)]或M(P25,P75)]

续表3 IgA肾病患者肾脏预后影响因子的单因素分析或n(%)]或M(P25,P75)]
2.4影响IgA肾病患者肾脏预后的多因素Logistic回归分析 本研究将IgA肾病患者的肾脏预后是否不良作为因变量(否=0、是=1),将单因素分析中差异有统计学意义的指标作为自变量进行多因素Logistic回归分析,结果显示,血红蛋白<120.0 g/L、24 h尿蛋白定量≥1.5 g/24 h、血肌酐≥106 μmol/L、IgM<0.81 g/L和FⅧ≥174.24%是IgA肾病患者肾脏预后不良的危险因素(P<0.05)。见表4。

表4 影响IgA肾病患者肾脏预后的多因素Logistic回归分析
2.5血清IgM、FⅧ对IgA肾病患者肾脏预后的预测价值 血清IgM、FⅧ预测IgA肾病患者肾脏预后的曲线下面积(AUC)分别为0.786、0.847,二者联合预测的AUC为0.916。见表5、图1。
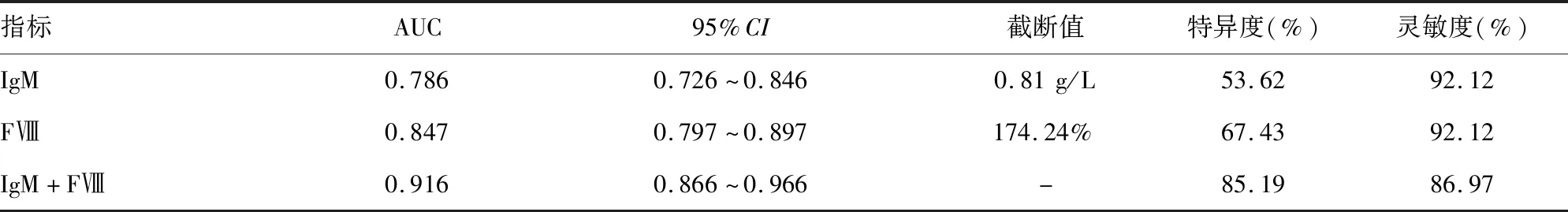
表5 血清IgM、FⅧ对IgA肾病患者肾脏预后的预测价值

图1 血清IgM、FⅧ预测IgA肾病患者肾脏预后的ROC曲线
3 讨 论
IgA肾病是由自身抗体结合的半乳糖缺陷型IgA1组成的循环免疫复合物在肾小球系膜发生沉积,进而引起的肾小球肾炎,临床表现为发作性的肉眼血尿、无症状的镜下血尿、蛋白尿等,如果不及时进行治疗,则会导致不同程度的肾脏衰竭[9]。目前,临床上主要通过肾活检对IgA肾病及预后进行判断,但是肾活检是一种侵入性操作,对机体创伤大,且难以重复进行[10]。因此,寻找合适的生物学指标用于IgA肾病患者肾脏预后的评价具有重要的临床指导意义。
IgM是一种免疫球蛋白抗体,主要由脾脏、淋巴结中浆细胞合成与分泌,可分为IgM1、IgM2两个亚型,常用来评估机体的体液免疫。相关研究发现,IgM能够在细胞因子的作用下转化为IgG,但是受到T淋巴细胞功能障碍的影响,IgM转化IgG受阻,导致大量的IgM沉积,进而诱发机体的免疫炎症反应[11]。赵庆雨[12]研究发现,IgA肾病患者IgM沉积可促进患者的肾功能进一步损伤,加重肾脏的病理学损伤程度。PANZER等[13]研究发现,向非硬化性肾小球疾病小鼠体内注射IgM后,IgM能够与受损的肾小球表面抗原结合,加重肾损伤程度。本研究结果显示,观察组的血清IgM水平低于对照组(P<0.05);重度组血清IgM水平低于中度组和轻度组(P<0.05),中度组低于轻度组(P<0.05);预后不良组的血清IgM水平低于预后良好组(P<0.05)。这表明血清IgM在IgA肾病患者中表达水平降低,并且与疾病严重程度、肾脏预后有关。多因素Logistic回归分析显示,IgM<0.81 g/L是IgA肾病患者肾脏预后不良的危险因素(P<0.05),表明患者IgM水平越低肾脏预后越差。原因是IgA肾病患者的肾小球滤过屏障功能受损严重,循环内的IgM与受损的肾小球表面抗体结合,进而导致血清IgM水平降低[14]。同时,IgM能够激活补体系统,促使IgM在肾脏组织沉积,加重对基底膜内皮细胞、系膜细胞的损伤,并且能够激活巨噬细胞,引起肾脏纤维化改变,进而促使疾病进展。
FⅧ是一种重要的凝血因子,主要由血管内皮细胞、肾小球细胞、肾小管上皮细胞合成,能够参与机体的血管内皮损伤和凝血过程[15]。既往研究发现,FⅧ的表达与白细胞介素-6(IL-6)与肿瘤坏死因子-α(TNF-α)密切相关,IL-6能够与von Willebrand因子结合,促使血浆FⅧ合成增多,而TNF-α能够降低灭活蛋白C水平,导致血清FⅧ失活减少,活性增强[16-17]。孙景毅等[18]研究发现,在IgA肾病患者中,血清FⅧ水平与临床指标密切相关,且高FⅧ水平与患者不良预后有关。本研究结果显示,观察组血清FⅧ水平高于对照组(P<0.05);重度组血清FⅧ水平高于中度组、轻度组(P<0.05),中度组高于轻度组(P<0.05);预后不良组血清FⅧ水平高于预后良好组(P<0.05)。这表明血清FⅧ水平在IgA肾病患者中升高,并且与疾病严重程度、不良预后有关。多因素Logistic回归分析结果显示,FⅧ水平≥174.24%是IgA肾病患者肾脏预后不良的危险因素(P<0.05),这表明血浆FⅧ水平越高患者的肾脏预后越差,可能原因是IgA肾病患者受到低糖化IgA1的影响,促使系膜细胞的分化加快,机体的炎症反应剧烈,导致IL-6、TNF-α等炎症因子释放入血液,使血清IL-6、TNF-α水平升高,进而促使血浆FⅧ合成增多,活性增强,且血清FⅧ水平越高,体内的炎症反应越剧烈,病情进展越快,肾功能损害越严重,发生肾脏预后不良的风险越高。本研究结果显示,血清IgM、FⅧ预测IgA肾病患者肾脏预后的AUC分别为0.786、0.847,二者联合预测的AUC为0.916。这表明血清IgM、FⅧ联合预测IgA肾病患者肾脏预后的效能更好,且与传统实验室指标比较,具有更高的效能,但应用于临床还需要多中心大样本的数据验证。
综上所述,血清IgM、FⅧ水平与IgA肾病患者的疾病严重程度和肾脏预后显著相关,IgM水平越低、FⅧ水平越高,患者的病情越严重,预后越差,且二者联合检测有利于IgA肾病患者肾脏预后的判断,有临床推广应用价值。
