新型冠状病毒核酸非配套检测系统性能确认方法的建立*
2023-05-15黄韵,王秋,夏勇
黄 韵,王 秋,夏 勇
北京大学深圳医院检验科,广东深圳 518036
新型冠状病毒(SARS-CoV-2)核酸检测是确诊SARS-CoV-2感染首要标准[1],完整配套的检测系统是分析质量的重要保障。由于SARS-CoV-2核酸检测试剂种类很多,且涉及不同核酸提取和扩增试剂,实验室需要对由提取试剂、提取仪、扩增试剂、扩增仪等组成的检测系统进行必要的性能验证,一旦出现阳性结果,应采用另外1~2种更为灵敏且扩增不同区域的核酸检测试剂进行复核检测[2],因而实验室必需使用2种以上的扩增试剂。
有不少学者报道了SARS-CoV-2核酸检测的性能验证评估及不同核酸提取和检测试剂比较分析[3-6],但是鲜有对实验室内非配套检测系统在多台仪器设备上进行性能确认的相关研究。本研究根据ISO15189要求,对北京大学深圳医院实验室的非配套检测系统进行性能确认,为实验室建立非配套SARS-CoV-2检测系统提供参考。
1 材料与方法
1.1样本来源 选取2022年国家卫生健康委临床检验中心3月28日(样本号:C1-C5)和2022年广东省卫生健康委临床检验中心4月20日(样本号:C6-C10)的SARS-CoV-2核酸检测室间质量评价标本各5份;第三方弱阳性质控品(广州邦德盛SARS-CoV-2 RNA)(试剂盒检测限1.5~3.0倍);上海伯杰SARS-CoV-2核酸检测试剂盒阳性对照;中国计量科学研究院SARS-CoV-2核酸(低浓度)标准物质;SARS-CoV-2核酸检测分析特异性参考品(广州邦德盛SARS-CoV-2 RNA)。
1.2仪器与试剂 3台7500实时荧光定量PCR仪及1台Quant Studio 5实时荧光定量PCR仪均购自美国Applied Biosystems公司;核酸提取或纯化试剂盒(批号:2022066)购自中山大学达安基因股份有限公司(以下简称达安),SARS-CoV-2核酸检测试剂盒(批号1:20211101N;批号2:20220309P)购自上海伯杰医疗科技有限公司(以下简称伯杰)。
1.3方法
1.3.1检测方法 根据伯杰扩增试剂盒说明书操作,扩增反应条件为50 ℃ 10 min;95 ℃ 5 min;95 ℃ 10 s,55 ℃ 40 s,共45个循环,在55 ℃条件下采集荧光信号。
1.3.2性能确认方法及指标 (1)方法符合率。又叫阴阳符合率。10例SARS-CoV-2室间质量评价标本分别在4台实时荧光定量PCR仪上进行检测,统计阴、阳性符合率。符合率100%,则判断试剂盒一致性符合要求。(2)精密度确认。使用第三方弱阳性质控品和试剂盒配套阳性质控品进行评价。参考《定量测量程序精度的评定》[7],每批做1个弱阳性质控品和1个试剂盒配套阳性质控品,试剂为同一批号,实验室4台实时荧光定量PCR仪每天检测1次,连续检测20 d,弱阳性质控品和阳性质控品各80个数据一起计算双靶标基因循环数阈值(Ct值)重复性(每日不精密度)和实验室内(总不精密度)变异系数(CV),若CV≤5%,则认为该试剂盒不精密度符合要求。(3)检出能力的确认。使用无核酸酶水将SARS-CoV-2核酸标准物质稀释到500 copy/mL。使用伯杰2个不同批号的扩增试剂,在4台实时荧光定量PCR仪上对提取的标本进行扩增,分3 d实验,共120个结果,判定要求参照《临床检验方法检出能力的确立和验证》[8]中测量结果总数与临界值观察比例对照表。(4)交叉反应。使用邦德盛分析特异性参考品,对与其感染部位相同,感染症状相似5种病毒(甲型流感病毒、乙型流感病毒、人副流感病毒、呼吸道合胞病毒和腺病毒)阳性而SARS-CoV-2阴性的非定值质控品进行检测。每个样本重复测量3次,记录循环数Ct值评价试剂特异性。
1.4统计学处理 采用Excel 2020和GraphPad Prism 8.0软件进行数据分析和图表绘制,不精密度以标准差(s)和CV表示,计数资料以例数或百分率表示。
2 结 果
2.1方法符合率 根据国家卫生健康委临床检验中心、广东省卫生健康委临床检验中心室间质量评价回报结果显示,3例阴性质量评价样本(C4、C7和C8)双靶标基因未检出,阴性符合率为100.00%;7例阳性质量评价样本ORF1ab靶标基因检出率为100.00%(28/28),N靶标基因检出率为96.43%(27/28),有效检出率100.00%(28/28),阳性符合率为100.00%。10例室间质量评价样本的ORF1ab和N基因的检测结果和Ct值的分布见图1。
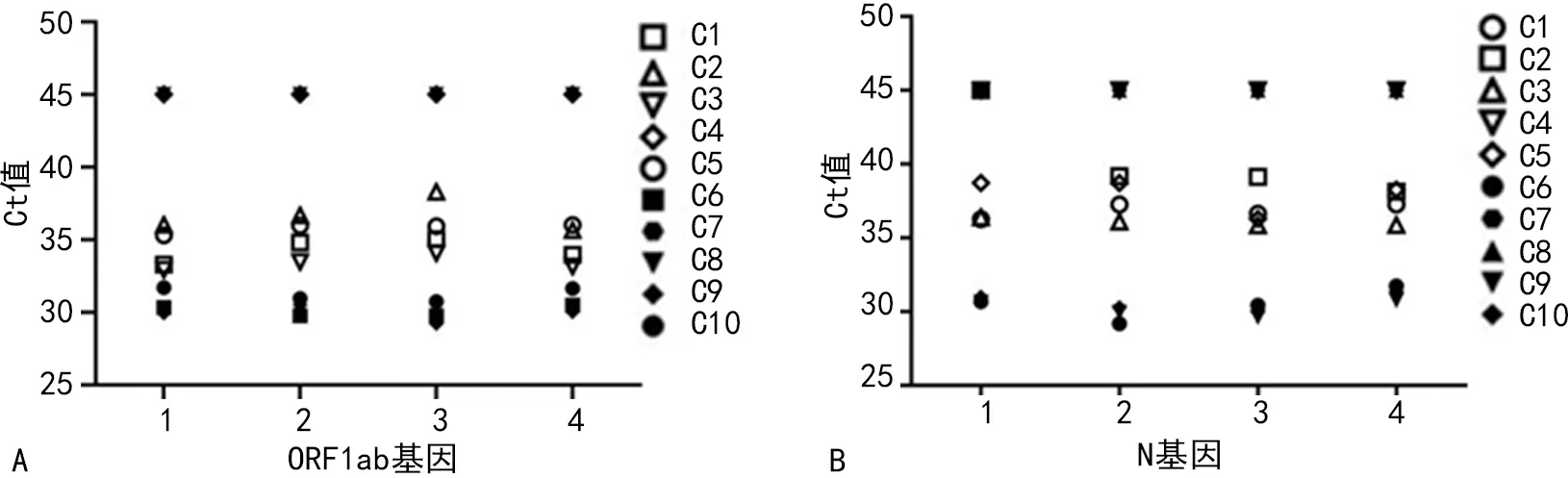
注:A为伯杰试剂对10例室间质量评价样本ORF1ab基因的检测结果;B为伯杰试剂对10例室间质量评价样本N基因的检测结果。
2.2精密度确认 弱阳性质控品和阳性质控品在实验室内4台实时荧光定量PCR仪上检测,共160个数据Ct值,计算其标准差和CV,见表1,ORF1ab基因和N基因重复性、实验室内总不精密度CV均<5%,结果符合要求。
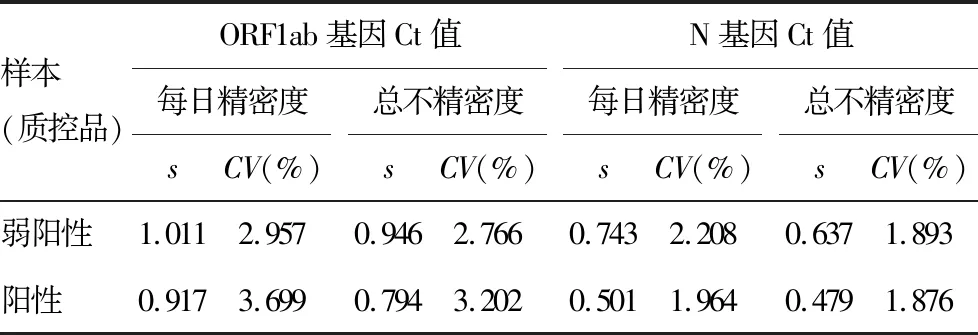
表1 弱阳性质控品和阳性质控品ORF1ab基因、N基因精密度情况
2.3检出限能力的确认 伯杰扩增试剂批号20211101N有1例ORF1ab基因未检出和6例N基因未检出;伯杰扩增试剂批号20220309P有1例ORF1ab基因未检出和4例N基因未检出。2个不同批号扩增试剂检出率结果见表2,ORF1ab基因检出率为98.33%(118/120),N基因检出率为91.67%(110/120),有效检出率为100.00%(120/120),检出限满足要求。
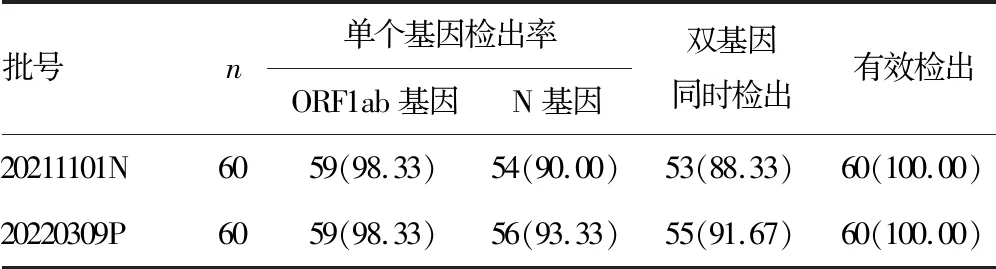
表2 2个不同批号扩增试剂检出率[n(%)]
2.4交叉反应 5例分析特异性质控品3次检测结果ORF1ab和N基因均为阴性,表明5种病毒间不存在交叉反应,该试剂盒特异性良好。
3 讨 论
《医学实验室质量和能力认可准则》[9]要求实验室应对非标准方法检验程序进行确认,方法确认应尽可能全面,来证实满足检验预期用途的特定要求。本研究通过对达安提取仪器、提取试剂及伯杰扩增试剂组成的非配套SARS-CoV-2核酸检测系统进行性能确认。性能确认结果显示,伯杰扩增试剂在4台扩增仪与达安提取试剂组成的非配套检测系统的方法符合率、精密度、检出限及特异性均能够满足实验室检测性能要求。
方法符合率结果显示ORF1ab基因阳性符合率达100.00%,N基因阳性符合率约为96.43%,总阳性符合率可达100.00%,其双靶标基因阴性符合率均为100.00%,满足要求。本研究中上海伯杰试剂盒的N基因阳性符合率并未完全检出。蔡侃儒等[10]研究发现,核酸Ct值>36时,提示病毒载量较低,任意试剂检测都可能出现假阴性风险。郭元元等[11]研究也显示,国产试剂对弱阳性样品的检出率参差不齐,少部分试剂只能检测出其中一个靶基因。由此可见,实验室使用2种或2种以上试剂进行结果复核,除可针对实验室假阳性标本进行复核外,在一定程度上是避免病毒载量较低的样本出现假阴性结果的重要措施。
检测系统良好的精密度是进行其他方法学验证实验的前提[12-13]。本实验室前期采用CLSI EP15-A3方案(同一台仪器每天重复5次,连续5 d)对达安配套系统进行性能验证,结果与何吕芬等[14]研究一致,ORF1ab基因和N基因Ct值的CV值均<5%,说明达安试剂盒重复性好。而针对达安提取试剂与伯杰扩增试剂组成非配套检测系统,则参考CLSI EP5-A3进行精密度性能确认。本研究并未在1台扩增仪进行4次重复试验,而是使用质控品在实验室内4台扩增仪分别进行检测的数据作为每日数据,由实验室不同工作人员常规检测过程累计20 d数据,能更加真实地反映日常检测样本随机分配不同仪器的实际情况,重复性、实验室总不精密度CV均<5%,精密度性能确认结果满足要求。
本研究同时使用2个不同批号伯杰扩增试剂对500 copy/mL检出限性能确认结果显示,ORF1ab基因未检出各有1例,N基因未检出分别有6例和4例,但未发现ORF1ab基因和N基因同时漏检情况。这也提醒实验室需密切关注单基因检出复核流程及试剂批号的性能验证(确认)方案应采用更为灵敏且扩增不同区域的核酸检测试剂进行复核[2],以降低实验室假阴性漏检风险。
核酸检测在方法学上特异性强,是确定SARS-CoV-2感染的“金标准”,本研究中伯杰扩增试剂对常见5种呼吸道病毒无交叉反应,满足要求。本研究也存在以下不足:(1)本研究中方法符合率、交叉反应等性能确认方法均为室间质量评价或质控等样品来源,缺乏真实的临床样本验证;(2)由于SARS-CoV-2核酸检测为定性试验,精密度确认方案采用Ct值作为精密度来源并非传统意义上的绝对定量;(3)实验室4台实时荧光定量PCR仪均来自美国ABI公司,其他实验室应用的仪器设备种类和数量可能会更多,性能确认方案会更加复杂。
综上所述,实验室应尽量选用配套检测系统,如选用非配套检测系统,实验室应完善性能验证和性能确认程序,合理选择试剂盒及扩增仪,加强人员培训,严格对非配套检测系统进行性能确认,确保SARS-CoV-2核酸检测结果质量。
