丁苯酞对帕金森细胞模型保护作用的实验研究
2023-05-13郭宝娟杨晓帆
郭宝娟,王 慧,梁 军,杨晓帆,陈 培
(牡丹江医学院 1.基础医学院病理学与病理生理学教研室;2.基础医学院组织与胚胎学教研室;3.附属红旗医院康复科,黑龙江 牡丹江 157011)
帕金森病(Parkinson’s Disease,PD)是一种常见的成人发病的进行性神经退行性疾病,典型的病理表现为中脑黑质多巴胺能神经元的选择性丢失和α-突触核蛋白(α-synuclein)在路易体内聚集[1]。由于具有起病隐匿,误诊率高和无法治愈的特点,且目前未能做到早发现、早诊断和早治疗,现有的药物治疗仅能减轻临床症状,几乎不能有效阻止或延缓疾病进展,甚至长期用药会出现耐药性和不良反应[2]。所以寻求保护多巴胺能神经元或延缓疾病进程的药物迫在眉睫。近年来研究发现,目前由我国自主研发且临床上广泛用于缺血性脑卒中治疗的药物——NBP,是一种从芹属种子中提取分离的化合物,已实验证明具有神经保护作用且对PD治疗有一定的积极作用[3],但药理作用的分子机制尚不明确。因此着手研究NBP保护作用的分子机制,可能发现防治PD的潜在靶点,对临床上PD的治疗具有重要指导意义。
1 材料与方法
1.1 细胞与试剂大鼠嗜铬细胞瘤细胞(上海酶研生物有限公司)、NBP(中国食品药品检定研究所,药物纯度>99.8%)、MPP+(美国阿拉丁公司)、ML385(美国MCE公司)、CCK-8试剂盒(北京普利莱公司)、Nrf2、α-syn及TH一抗(affinity生物公司)、GAPDH一抗(CST生物公司)。
1.2 主要仪器CO2恒温培养箱、-80 ℃冰箱、水浴恒温箱、4 ℃低温离心机、低温高速离心机、酶标仪、微量移液器、分析天平、倒置显微镜、蛋白电泳和转膜设备、凝胶成像系统。
1.3 实验方法
1.3.1 细胞培养 将PC12细胞置于RPMI-1640(含10%FBS,1%双抗)完全培养基培养,并放置于含5%CO2,37 ℃恒温培养箱内培育。每2~3 d替换新鲜培养液,保持细胞长势及活性良好,待密度达80%~90%时可进行传代及后续相关实验。
1.3.2 倒置显微镜观察各组细胞形态 采用前期实验中最适药物浓度处理细胞。control组:无血清培养基培养24 h;MPP+组:含1 mM MPP+无血清培养基培养24 h;MPP++ML385组:含5 μM ML385的1 mM MPP+无血清培养基培养24 h;NBP组:含20 μM NBP无血清培养基培养24 h;NBP+MPP+组:含1 mM MPP+无血清培养基培养24 h后,再用20 μM NBP培养4 h;MPP++NBP+ML385组:含1 mM MPP+无血清培养基培养24 h后,再用含5 μM ML385的20 μM NBP培养4 h。
1.3.3 CCK-8检测细胞存活率 将生长状态良好的PC12细胞以5×103个/孔接种于96孔板中,100 μL/孔,置于CO2恒温培养箱中培养24 h。次日弃上清后按上述分组处理,每组设置3个复孔。药物作用结束后加入CCK-8试剂,10 μL/孔,放入培养箱继续培养2 h后,立即用酶标仪在λ=450 nm测定OD值。使用公式细胞存活率=[(实验孔—空白孔)/(对照孔—空白孔)]×100%计算。
1.3.4 Western blot检测蛋白表达 将生长状态良好的PC12细胞以1×106个/孔接种于6孔板中,2 mL/孔,置于CO2恒温培养箱中培养24 h。次日弃上清后按上述分组处理后弃去上清,无菌PBS轻缓冲洗2遍,用RIPA∶PMSF=100∶1裂解液冰上裂解30 min,提取胞内总蛋白并用BCA法测定蛋白浓度。据蛋白分子量配制适宜浓度的分离胶,80 V至浓缩胶尾部转120 V进行蛋白分离。湿转法将蛋白转移至PVDF膜,用5%BSA封闭60~120 min,加入一抗4 ℃孵育过夜。次日PBST洗膜3次后二抗室温孵育1 h。PBST再次洗膜后使用ECL发光液进行显影,GAPDH作为内参。采用Image J软件对条带灰度值进行测定比较。实验重复三次。
1.4 统计学方法采用Graphpad prism 7.0软件进行统计学分析,实验数据以“均数±标准差”表示。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 倒置显微镜观察各组细胞形态镜下观察细胞形态变化,Control组为正常细胞,分布均匀且数量较多,细胞突起明显且数目不等,突触较长,似神经元轴突,贴壁能力强;与Control组相比,MPP+组细胞总数减少、体积变小,部分胞体皱缩变圆,贴壁能力减弱;而NBP组无明显变化;与MPP+组相比,MPP++ML385组中细胞总数明显减少,胞体皱缩,甚至出现漂浮死亡细胞;而MPP++NBP组加入丁苯酞保护后细胞损伤有一定程度逆转,细胞数量增多,贴壁能力增强;与MPP++NBP组相比,MPP++NBP+ML385组使用抑制剂ML385后,细胞数量和突触明显减少,胞体皱缩成球形,贴壁能力减弱,出现漂浮死亡细胞。见图1。

图1 各组细胞形态学特点
2.2 CCK-8法检测各组细胞存活率CCK-8检测结果表明,与Control组相比,MPP+组细胞存活率明显下降(P<0.000 1),而NBP组细胞存活率明显增高(P<0.000 1);与MPP+组相比,MPP++ML385组细胞存活率明显下降(P<0.000 1),而MPP++NBP组细胞存活率增高(P<0.000 1);与NBP+MPP+组相比,MPP++NBP+ML385组细胞存活率有所下降(P<0.01)。见图2。
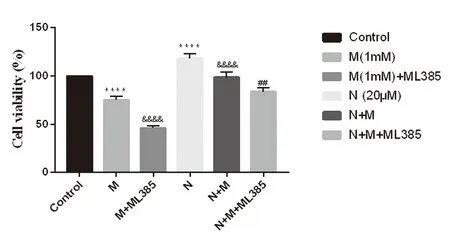
图2 ML385处理后NBP对MPP+诱导的PC12细胞存活率的影响
2.3 Western blot检测各组细胞内T-Nrf2、TH及α-syn的蛋白表达Western blot实验结果显示,与Control组相比,MPP+组Nrf2(P<0.05)及TH的表达减少,α-syn表达增加(P<0.000 1);与MPP+组相比,NBP+MPP+组逆转了Nrf2(P<0.001)、TH(P<0.001)和α-syn(P<0.000 1)的表达;与NBP+MPP+组相比,MPP++NBP+ML385组Nrf2及TH(P<0.01)表达减少,α-syn的表达增多(P<0.01)。见图3。

图3 ML385处理后NBP对MPP+诱导的PC12细胞Nrf2、TH及α-syn相对水平表达的影响
3 讨论
PD是全球第二大神经退行性疾病,发病率逐年增高,预测未来患病人数仍会上升[4]。PD发病与年龄、遗传、环境及某些生理因素等多因素相互作用有关,同时人口老龄化剧增也提示我们未来需要更多关注PD的防治问题。PD曾被认为是运动性疾病的传统观念被打破,防治非运动症状是未来临床面临的一项巨大的挑战[5]。PD现有的常规治疗方法不能延缓或终止疾病进程,引起非多巴胺能症状和药物副作用,甚至导致残疾。尽管随着科技和医疗的发展,逐步发现研究出脑深部电刺激、细胞疗法、营养因子和基因疗法等治疗手段,不同程度上取得了阶段性成果,但PD临床表型具有复杂的异质性,需要进行个性化治疗[6]。目前,基础性研究广泛关注PD确切的发病原因和机制,其中氧化应激与神经变性及PD其他发病机制存在一定关联。
NBP是芹菜油的化学成分之一,在缺血性脑卒中的临床治疗中已见成效,基础研究中也证实其神经保护作用[7]。NBP的某些作用靶标与PD的主要病理路径一致,探究其作用分子机制有助于从PD的发病机制着手发现更有效的治疗方法。
大鼠肾上腺嗜铬细胞瘤细胞(PC12)是一种非神经元性肿瘤细胞系,主要分泌儿茶酚胺类递质,经神经生长因子诱导可分化为具有神经元形态和功能的细胞。高分化型PC12在生理、生化方面发生改变,且易于培养,可用于神经科学的基础性研究[8]。MPP+是一种能够抑制线粒体呼吸的神经毒性物质,加入后会引起类似PD的病理表现,常用于构建PD模型,是研究PD发病机制及筛选神经保护药物的良好模型之一[9]。
TH参与催化生物体自身合成多巴胺的限速步骤,缺失或表达减少直接影响多巴胺的合成和分泌,间接反应多巴胺能神经元的存活状态,常用黑质TH的表达量反应PD多巴胺能神经元受损情况[10-11]。α-syn异常聚集引起神经毒性破坏多巴胺能神经元,在PD发病机制中起着核心作用[12]。Nrf2广泛参与调节对抗氧化应激的途径。大量研究发现Nrf2在氧化应激性疾病进展中起到关键作用,与神经系统疾病密切相关[13-14],氧化应激是PD发病机制的核心环节[15]。ML385是一种Nrf2的特异性抑制剂,通过减少转录活性来抑制Nrf2下游靶基因的表达[16]。
前期实验通过CCK-8法获得MPP+最适造模浓度和NBP最佳治疗浓度,并用ELISA法测得细胞上清中多巴胺(dopamine,DA)浓度确认PD细胞模型构建成功,在此基础上进一步探讨NBP治疗的分子机制。本实验结果显示,MPP+处理后PC12细胞形态改变且细胞存活率下降,抑制了Nrf2表达,催化合成多巴胺的限速酶TH表达减少及PD主要病理性标志物α-syn水平增加;NBP治疗后,逆转了MPP+对PC12细胞数量、形态和活性以及蛋白表达的影响,提示NBP能够使PC12免受MPP+诱导的神经损害;ML385处理抑制了NBP部分保护作用,说明NBP通过上调Nrf2对MPP+诱导的PC12细胞发挥保护作用。
综上所述,NBP可能通过上调Nrf2发挥抗氧化作用,对帕金森细胞模型发挥神经保护作用。结合既往研究,NBP可能通过多种途径发挥神经保护作用,探索关键靶点有待进一步研究,对未来临床上PD的治疗和PD患者生活质量的提高具有重要意义。
