乳酸菌发酵猕猴桃汁的工艺优化
2023-05-13刘晓翠李仲巧朱慧君艾青雪李佳敏熊月刘清康永琪
刘晓翠,李仲巧,朱慧君,艾青雪,李佳敏,熊月,刘清,康永琪
(西华大学食品与生物工程学院,四川 成都 610039)
猕猴桃富含有机酸、游离氨基酸、维生素、糖类、膳食纤维及人体所需的多种矿物质[1]。猕猴桃果实不仅能够降低血液中胆固醇和甘油三酯含量,在治疗坏血病、冠心病、高血压以及动脉粥样硬化等方面也有一定的功效[2],而且猕猴桃还有提高免疫力,美容养颜等多种保健作用[3]。研究[4]表明,猕猴桃与橙、葡萄柚相比较具有更强的抗氧化作用,能够抑制人体中生物物质的氧化[5]。猕猴桃可以抑制早期脂质氧化,可以防止由氧化应激引起的疾病的发展和恶化[6]。
功能性食品能对人体的生物功能产生积极影响,降低食用者患疾病的风险,这一食品类别包括所有含有益生菌微生物的产品[6]。目前,应用于果蔬发酵的益生菌大约有20种,主要有嗜酸乳杆菌、植物乳杆菌和明串珠菌等[7]。发酵后的果蔬汁不但口感醇厚,而且还存在很多活性乳酸菌,有助于肠道环境的改善[8-10]。最初是将果汁和牛奶混合后用乳酸菌进行发酵,当仅为果汁发酵时,就需要选取适合发酵的菌株[11]。
红心猕猴桃属浆果类水果,其果肉细嫩、口感香甜清爽、酸度极低,但易腐烂变质,不易长期贮藏。将红心猕猴桃榨汁,用乳酸菌发酵,再用发酵猕猴桃汁为原料生产果酒、果醋等产品,是解决红心猕猴桃贮藏问题的有效途径之一。因此,对乳酸菌发酵猕猴桃汁的工艺进行优化,从而提高发酵猕猴桃汁品质具有十分重要的意义。
1 材料与方法
1.1 试验材料与试剂
新鲜红心猕猴桃购于四川蒲江;嗜酸乳杆菌、干酪乳杆菌、保加利亚乳杆菌购于郑州百益宝生物技术有限公司;果胶酶购于晟发生物科技有限公司;福林酚、2,6-二氯靛酚购于源叶生物科技有限公司;抗坏血酸购于天津市致远化学试剂有限公司;草酸购于天津市津东天正精细化学试剂厂;氯化钾、盐酸、乙醇(体积分数为95%)购于成都市科隆化学品有限公司;无水乙酸钠、氢氧化钠、偏磷酸购于天津市风船化学试剂科技有限公司;1,1-二苯基-2-苦基肼自由基(DPPH)购于梯希爱(上海)化成工业发展有限公司。
UV-2600 型紫外可见分光光度计购于尤尼柯(上海)仪器有限公司;G154DWs 型高温灭菌锅购于上海赛海洋生物科技实业有限公司;A610 型数字阿贝折射仪购于济南海能股份有限公司;pHs-320 型pH 计购于成都世纪方舟科技有限公司;SH-3 加热磁力搅拌器购于天津泰斯特有限公司;902-ULTS 超低温冰箱购于赛默飞世尔;万分之一天平购于赛多利斯公司。
1.2 实验方法
1.2.1 样品制备
选择新鲜饱满,无虫害无腐烂的猕猴桃,放入60 ℃热水中清洗去皮后榨汁,再加入3%的果胶酶,在30 ℃条件下保持4 h,然后用双层细纱布过滤,除去滤渣,同时做空白对照。然后加入适量的维生素C 进行护色处理。然后将进行65 ℃、20 min巴氏灭菌后的样品装入经121 ℃、20 min 高温灭菌的发酵罐。将嗜酸乳杆菌(R2)、保加利亚乳杆菌(R3)、干酪乳杆菌(R4)、嗜酸乳杆菌+保加利亚乳杆菌(R5)、嗜酸乳杆菌+干酪乳杆菌(R6)、保加利亚乳杆菌+干酪乳杆菌(R7)按猕猴桃质量的3%的接种量(复配组复配比为1∶1)接种于1 000 mL猕猴桃汁中,自然发酵编号为R1。将发酵罐放置于阴暗处,自然避光发酵0、4、8、12、16、20、24 d。
1.2.2 理化指标
1.2.2.1 总酚含量的测定
总酚含量的测定采用的是福林酚法。将发酵猕猴桃汁先用蒸馏水稀释40倍,然后取稀释后的发酵猕猴桃汁样品1 mL 与0.5 mL 福林酚试剂混合,再加入6.5 mL 10%的Na2CO3溶液,摇匀,避光静置1 h后,测定发酵猕猴桃汁在700 nm 处的吸光值。
1.2.2.2 抗坏血酸含量的测定
抗坏血酸含量参照GB5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》中的2,6-二氯靛酚滴定法进行测定。
1.2.2.3 花色苷含量的测定
本试验采用pH 示差法测定发酵猕猴桃汁中花色苷的含量。
1)缓冲液的配制。pH1.0 缓冲液:使用电子分析天平准确称量186 g 氯化钾,加蒸馏水约980 mL,用盐酸和酸度计将pH 调至pH1.0,再用蒸馏水定容1 000 mL。
pH4.5 缓冲液:使用电子分析天平准确称量32.81 g 无水乙酸钠,加蒸馏水约980 mL,用盐酸和酸度计将pH 调至pH4.5,再用蒸馏水定容1 000 mL。
2)花色苷含量的测定。取待测样品溶液0.5 mL,分别用4.5 mL pH1.0 缓冲液(0.025 mol/L)、4.5 mL pH4.5 缓冲液(0.4 mol/L)稀释,混匀后,室温避光放置15 min后,以蒸馏水作为对照,分别在516 nm和700 nm 处测吸光值,计算花色苷含量。花色苷含量以mg/L计,按照公式(1)、(2)进行计算。
式中:C,花色苷含量,mg/L;A0,pH1.0 时吸光值;A1,pH4.5 时吸光值;Mw,以矢车菊素-3-葡萄糖苷为标准,为449.2;ε,26 900;D,样品稀释倍数。
1.2.2.4 DPPH 自由基清除率的测定
将发酵猕猴桃汁稀释到50 mg/mL,取样液1.0 mL 及浓度为0.12 mmoL/L 的DPPH-乙醇溶液(乙醇体积分数为95%)4.00 mL,混匀,室温下避光反应30 min,如有沉淀可在5 500 r/min 条件下离心5 min。用95%(体积分数)乙醇溶液参比,在517 nm 测定吸光值。根据公式(3)计算每种样品DPPH 自由基的清除率[12]:
式中:Ai,加样品液后溶液的吸光值;Aj,样品液的吸光值;Ac,未加样品液时溶液的吸光值。
1.2.2.5 猕猴桃汁发酵过程中pH 的测定
量取50 mg/mL 的发酵猕猴桃汁50 mL 样品于100 mL 烧杯中(发酵猕猴桃汁足够浸没电极),用pH 计测定样品,并记录pH 值。
1.2.2.6 猕猴桃汁发酵过程中果实TSS 质量分数的测定
果实TSS 质量分数参照NY/T 2 637—2014《水果和蔬菜可溶性固形物含量的测定 折射仪法》进行测定。
1.2.2.7 猕猴桃汁发酵过程中TA 含量的测定
TA 含量参照GB 12456—2021 《食品安全国家标准 食品中总酸的测定进行测定》。
1.3 数据分析
使用IBM SPSS Statistics 26 进行理化因子显著性分析,显著性水平设置为α=0.05,单因素ANOVA检验方法选择图基(T),用不同的小写字母表示处理之间存在的显著差异(P<0.05 或P<0.01)。柱状图用Origin 2022 软件绘制。相关性分析使用IBM SPSS Statistics 26 进行,方法选择Pearson 分析方法。
2 结果与分析
2.1 猕猴桃汁发酵过程中总酚含量的变化
由图1 可知,与R1 相比,添加了乳酸菌的猕猴桃汁中的总酚含量保持在较高的水平。发酵初测得的猕猴桃汁总酚含量为94.57 mg/100 mL,发酵结束后测得自然发酵R1 的总酚含量为69.54 mg/100 mL,相比发酵前降低了26.47%;添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的总酚含量分别为80.41、80.56、73.32、90.26、80.77、90.66 mg/100 mL,而R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁在发酵24 d后,测得总酚的含量高达90.66 mg/100 mL,与发酵初期测得的总酚含量相比较,仅下降了4.13%。

图1 发酵期间发酵猕猴桃汁总酚含量的变化Fig.1 Changes of total phenol content in fermented kiwifruit juice during fermentation
植物中的酚类物质一般都具有较强的抗氧化活性,是植物中重要的功能性成分,它因为具有氧化还原性质,可以用作还原剂、氢供体和金属螯合剂[13-14]。随着发酵时间的变长,猕猴桃果汁中总酚的含量变化呈先上升然后再下降的趋势。总酚含量上升的原因可能有两个:一是因为在猕猴桃发酵期间,乳酸菌在猕猴桃汁中产生的各种有机酸、酮、醇等可抑制PPO 活性物质,有利于防止酚类物质的氧化;二是因为乳酸菌在代谢过程产生了很多酚酸酯酶等酶类,这些酶能够释放猕猴桃汁中的酚类物质[15-16],从而使得猕猴桃汁中酚类含量得到补偿,因此在发酵初期总酚的含量能够上升[17]。总酚含量变化可能是发酵期间,因乳酸菌的应激作用而对酚类物质进行的生物代谢导致发酵结束后猕猴桃汁中酚类物质的减少引起的[18-19]。
2.2 猕猴桃汁发酵过程中抗坏血酸含量的变化
由图2 可知,随着发酵时间的延长,抗坏血酸含量呈现出下降的趋势。猕猴桃汁发酵初抗坏血酸含量为0.214 mg/L,猕猴桃汁在发酵24 d后,R1的抗坏血酸含量为0.084 mg/L,下降了60.75%左右;添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的抗坏血酸含量分别为0.101、0.102、0.112、0.094、0.105、0.136 mg/L,R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁在发酵24 d后,抗坏血酸的含量达到0.136 mg/L,高于其他发酵组。新鲜猕猴桃汁中含有丰富的抗坏血酸,但该化合物不稳定,在加工过程中容易变质。蔡丽琴[20]发现猕猴桃在发酵过程中抗坏血酸的含量逐渐下降且接种发酵组比自然发酵组含量更高。刘洪[21]的研究结果也表明在泡菜的发酵过程中抗坏血酸的含量逐渐下降且接种发酵组比自然发酵组含量更高。综合对比表明实验结果与已有研究结果具有一致性。因此能够得到保加利亚乳杆菌与干酪乳杆菌复配更适合猕猴桃汁的发酵的结论。

图2 发酵期间发酵猕猴桃汁抗坏血酸含量的变化Fig.2 Changes of ascorbic acid content in fermented kiwifruit juice during fermentation
2.3 猕猴桃汁发酵过程中花色苷含量的变化
猕猴桃中富含花色苷,花色苷是猕猴桃的主要呈色物质和功能性成分,红心猕猴桃果实中有5 种花色苷,分别是未知矢车菊素(Cy.)、矢车菊素-3-O-木糖(1-2)-半乳糖苷(Cy-xyL.gaL.)、矢车菊素-3-O-半乳糖苷(Cy-gaL.)、飞燕草-3-O-木糖(1-2)-半乳糖苷(Dp-xyL.gaL.)和飞燕草-3-O-半乳糖苷(DpgaL.)。植物源花色苷具有丰富的生理活性,如抗癌、抗氧化、抗衰老等,还没有毒副作用,因此可作为天然色素直接使用,也可以经过乳化或以粉末形式广泛用于食品添加剂等领域[22-24]。
由图3 的变化趋势可知,R1 自然发酵的猕猴桃汁变化最大,其他的猕猴桃汁因为添加了乳酸菌延缓了花色苷的降解速度。发酵前猕猴桃汁的花色苷含量为62.08 mg/L,猕猴桃汁在发酵24 d后,R1 花色苷含量为5.58 mg/L,下降率达到了91%;添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的花色苷含量分别为15.48、19.34、10.80、10.23、10.71、26.79 mg/L,R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁在发酵24 d后,花色苷的含量高于其他发酵组。随着发酵时间的延长,花色苷的含量也随之减少。花色苷含量降低原因有两个:一是因为发酵环境中氧气和微生物的代谢使得花色苷发生了氧化降解;二是由于发酵期间花青素的聚合和降解反应以及花色苷与其他酚类物质的相互作用造成了花色苷含量的减少[25-26]。
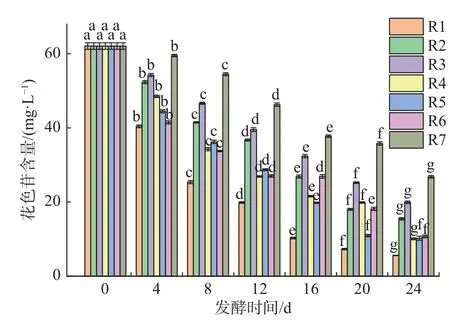
图3 发酵期间发酵猕猴桃汁花色苷含量的变化Fig.3 Changes of anthocyanin content in fermented kiwifruit juice during fermentation
2.4 猕猴桃汁发酵过程中DPPH 自由基清除率的变化
DPPH 为商业合成的自由基,一般溶于有机溶剂,用于有机相内的抗氧化反应。本次试验通过监测DPPH 自由基清除率的变化情况来评价发酵过程中猕猴桃汁抗氧化活性的变化。由图4 可知,随着发酵时间延长,DPPH 自由基清除率是先上升再下降的趋势。发酵4 d 左右,各猕猴桃汁的抗氧化活性有小幅度上升的趋势。发酵8 d后,各组猕猴桃汁的抗氧化活性开始显著下降。猕猴桃汁发酵前DPPH 自由基清除率为77.52%,猕猴桃汁在发酵24 d后,R1 自然发酵组的DPPH 自由基清除率为44.15%,下降了43.05%;添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的DPPH 自由基清除率分别为:35.69%、41.51%、38.04%、38.75%、36.62%、29.75%,分别下降了52.69%、46.45%、50.93%、50.01%、52.76%、61.62%,抗氧化活性普遍下降比较厉害。DICR 等[27]应用戊糖片球菌和植物乳杆菌混合发酵甜樱桃果泥,提高了抗氧化能力;同时也有文献[28-30]指出,乳酸菌发酵能降低果蔬对自由基的清除能力。DPPH自由基清除能力与总酚有很大的关系,酚类物质经过乳酸菌发酵后分解成鞣花酸,提高了它的生物利用率和抗氧化活性[30]。
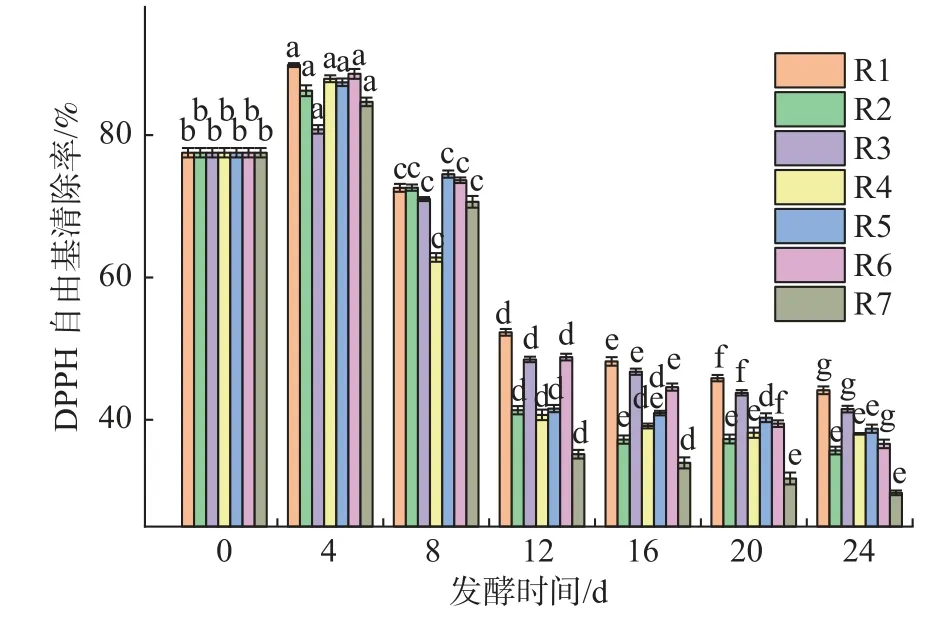
图4 发酵期间发酵猕猴桃汁DPPH 自由基清除率的变化Fig.4 Changes of DPPH free radical scavenging rate in fermented kiwifruit juice during fermentation
2.5 猕猴桃汁发酵过程中pH、TSS 质量分数、TA 含量的变化
由图5 可知,整个发酵期间,各组猕猴桃汁的pH 都呈现出下降并达到稳定的趋势。这是因为乳酸菌在发酵初期,pH 适宜,生长速度最快,能够进行糖酵解作用产生大量的乳酸使得pH 下降;到发酵后期各组发酵猕猴桃汁的pH 趋于稳定,是因为发酵后期乳酸量过多抑制了乳酸菌的活动,并且发酵环境碳源较少,使得发酵液中的pH 达到平衡,趋于稳定。由图5 可知,R7 保加利亚乳杆菌与干酪乳杆菌复配的发酵猕猴桃汁pH 下降最快,表明保加利亚乳杆菌与干酪乳杆菌可以更快速地代谢产生乳酸菌,因此可以得到保加利亚乳杆菌与干酪乳杆菌复配更适合猕猴桃汁的发酵的结论。

图5 发酵期间发酵猕猴桃汁pH 的变化Fig.5 Changes in pH of fermented kiwi juice during fermentation
由图6 可知,随着发酵时间的延长,各组猕猴桃汁TSS 的质量分数随之下降,发酵前猕猴桃汁的TSS 质量分数为21.4%,猕猴桃汁在发酵24 d后,R1 的TSS 质量分数为10.53%,添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的TSS 质量分数分别为9.27%、8.2%、8.17%、10.2%、8.77%、5%,而R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁在发酵24 d后,TSS 的质量分数低于其他发酵组,并且添加了R2-R7 组的TSS 质量分数下降速度明显高于自然发酵组R1。这是因为乳酸菌利用猕猴桃汁中丰富的糖类物质进行了代谢,促进了TSS 的分解,因此提高了TSS 的转化利用率。但由于在发酵后期乳酸菌的累积使得pH 下降,抑制了乳酸菌的代谢,从而使得糖转化率下降,TSS 质量分数下降趋势减缓。据数据分析,由图6 也可得到,R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁的TSS 质量分数(5.00%)低于其他组的TSS 质量分数,表明保加利亚乳杆菌与干酪乳杆菌的代谢速度较快,与pH 变化趋势相同,因此可以得到保加利亚乳杆菌与干酪乳杆菌复配更适合猕猴桃汁的发酵的结论。

图6 发酵期间发酵猕猴桃汁TSS 质量分数的变化Fig.6 Changes in TSS of fermented kiwi juice during fermentation
由图7 可知,发酵期间,各组猕猴桃汁的TA 含量总体呈上升的趋势。发酵前猕猴桃汁的TA含量为0.73 mg/L,猕猴桃汁在发酵24 d后,R1 的TA 含量为1.35 mg/L;添加乳酸菌的猕猴桃汁R2-R7 在发酵24 d 后的TA 含量分别为:2.28、2.08、2.66、2.64、2.85、3.04 mg/L。添加了乳酸菌的R2-R7 组的TA 含量的增加速度明显大于自然发酵组R1,并且R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁在发酵24 d后,TA 的含量高于其他发酵组。猕猴桃汁中的TA 主要是有机酸,如柠檬酸、苹果酸等,是发酵猕猴桃汁主要的呈味物质之一[31-32]。通过实验数据可知,乳酸菌发酵过程中产生了大量的乳酸,TA 的含量逐渐增加,因此乳酸菌发酵比自然发酵能够增加更多的TA。据数据分析,R2-R7 的TA 含量都明显高于R1,R7 保加利亚乳杆菌与干酪乳杆菌复配的猕猴桃汁的TA 含量高于其他组的TA 含量,R7 的TA 含量能够达到3.04 mg/L,表明保加利亚乳杆菌与干酪乳杆菌的代谢速度较快,能产生更多的乳酸,与pH 变化趋势相同,因此可以得到保加利亚乳杆菌与干酪乳杆菌复配更适合猕猴桃汁的发酵的结论。

图7 发酵期间发酵猕猴桃汁TA 含量的变化Fig.7 Changes of TA in fermented kiwi juice during fermentation
2.6 相关性和显著性分析
对R7 发酵猕猴桃汁的各项指标进行分析,结果见表1。发酵猕猴桃汁的花色苷含量、DPPH 自由基清除率、pH、TSS 质量分数均与抗坏血酸含量的变化呈极显著正相关(P<0.01)。DPPH 自由基清除率、pH 均与花色苷含量的变化呈极显著正相关(P<0.01),TSS 与花色苷含量的变化呈显著正相关(P<0.05)。pH 与TSS质量分数的变化呈极显著正相关(P<0.01)。TA 含量与花色苷含量、pH、TSS质量分数、抗坏血酸含量的变化呈显著负相关(P<0.01),DPPH 自由基清除率与总酸含量的变化呈显著负相关(P<0.05)。

表1 R7 发酵猕猴桃汁各项指标的相关性分析Tab.1 Correlation analysis of indexes of kiwifruit fermentation juice
对猕猴桃汁的R7 组不同发酵时间和各项指标进行分析,结果见表2。发酵猕猴桃汁的总酚含量第0 天和第20 天不显著,其余均有显著性差异。抗坏血酸在第0 天和第4 天、第12 天和第16 天、第20 天和第24 天的含量差异不显著。花色苷含量、pH、TSS 质量分数、TA 含量从发酵开始到发酵结束均有显著性差异。DPPH 自由基清除率第12 天和第16 天差异不显著,其余时间均有显著性差异。
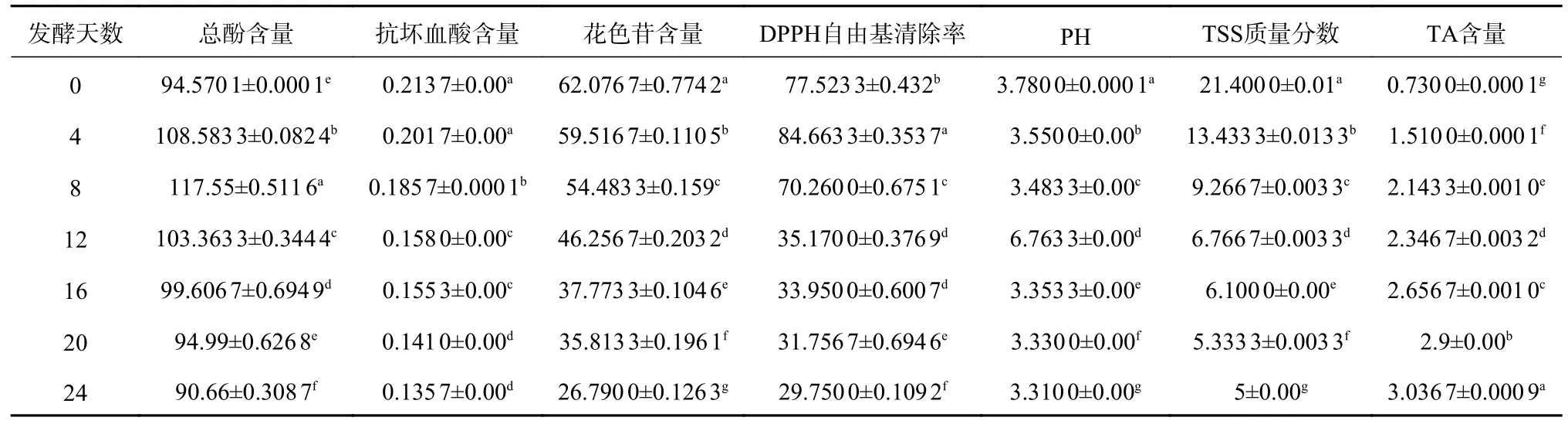
表2 R7 发酵猕猴桃汁各项指标的显著性分析Tab.2 Significance analysis of various indexes in kiwifruit fermentation juice
3 结论
本试验用自然发酵、3 种乳酸菌单独发酵以及这3 种乳酸菌按照1∶1 复配发酵的形式发酵猕猴桃汁,得到了7 组发酵汁。在整个发酵过程中,因为添加的菌种不同,发酵猕猴桃汁产生的气味,以及测定的指标结果都不相同。与自然发酵相比,乳酸菌能够利用糖类物质进行代谢,促进TSS的分解,从而提高TSS 的转化利用率,也能促进乳酸的产生,使得pH 降低,使得发酵猕猴桃汁的TA 含量升高。在整个发酵期间,由于乳酸的产生,TSS 质量分数呈下降趋势,使得总酚含量、抗坏血酸含量、花色苷含量和DPPH 自由基清除率呈下降状态,乳酸菌发酵猕猴桃汁可使TA 含量增加到3.04 mg/L,总酚含量能保持在90.66 mg/100 mL,抗坏血酸含量能达到0.136 mg/L,花色苷含量保持在26.79 mg/L。通过相关性分析可知,发酵猕猴桃汁的花色苷含量、DPPH 自由基清除率、pH、TSS 质量分数均与抗坏血酸的变化呈显著正相关(P<0.01)。DPPH 自由基清除率、pH 均与花色苷含量的变化呈显著正相关(P<0.01),TSS 质量分数与花色苷含量的变化呈显著正相关(P<0.05)。pH 与TSS 质量分数的变化呈显著正相关(P<0.01)。TA 与花色苷含量、pH、TSS 质量分数、抗坏血酸的变化呈显著负相关(P<0.01),DPPH 自由基清除率与TA 的变化呈显著负相关(P<0.05)。与自然发酵相比,添加乳酸菌的发酵猕猴桃汁品质更佳,其中保加利亚乳杆菌与干酪乳杆菌的复配对猕猴桃汁的发酵效果最好,适用于猕猴桃汁的发酵,为猕猴桃汁加工提供了一定的参考依据。
