增生性糖尿病视网膜病变行玻璃体切割术后发生新生血管性青光眼的风险因素
2023-05-12代光政林铁柱
祖 雪,代光政,林铁柱
0 引言
糖尿病(diabetesmellitus, DM)是一种全球广泛流行的慢性代谢性疾病,2021年全球患病率为10.5%[1],在我国高达12.4%[2]。糖尿病视网膜病变(diabetic retinopathy, DR)是DM的主要并发症之一,是工作人群视力丧失的主要原因。2020年,全球DR的患病数量约为1.031亿,预计到2045年将增至1.605亿[3]。增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)是DR的终晚期病变,占DM人群的6%,DR人群的17%[4]。玻璃体切割术(pars plana vitrectomy, PPV)是治疗PDR的主要方法,可以清除玻璃体积血、解除视网膜增殖牵拉而使视网膜复位,从而维持和提高视力[5]。新生血管性青光眼(neovascular glaucoma,NVG)是PDR患者PPV术后常见的一种严重并发症,难治且失明几率极高[6-7]。在既往的研究报道中,PDR患者PPV术后NVG发生率为6%~23.6%[8-12]。本研究将进一步评估PPV治疗PDR后NVG发生的累积风险,同时分析其相关风险因素。
1 对象和方法
1.1 对象回顾性研究。收集2015-10/2020-09在沈阳何氏眼科医院行23G PPV治疗的PDR患者151例169眼。纳入标准:(1)初次PPV手术;(2)PPV术后随访至少12mo或在术后12mo内发生NVG。(3)PDR行PPV干预的适应证符合《我国糖尿病视网膜病变临床诊疗指南(2014)》[13]。排除标准:(1)病历资料不完整;(2)既往青光眼病史,或基线眼压(intraocular pressure, IOP)>21mmHg;(3)除PDR外无其他玻璃体视网膜疾病;(4)术后视网膜未解剖复位。NVG的诊断标准为虹膜和/或房角明确可见新生血管且IOP>21mmHg[14]。本研究符合《赫尔辛基宣言》并获得沈阳何氏眼科医院伦理委员会批准,所有患者知情并签署知情同意书。
1.2 方法在PPV术前共有61眼3~5d行玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factors, VEGF)药物(雷珠单抗或康柏西普)0.5mL,伴有虹膜红变的患者术前均行玻璃体腔注射抗VEGF药物[15]。常规消毒铺单后,使用盐酸奥布卡因滴眼液行表面麻醉,2%利多卡因和0.5%布比卡因等比混合4mL行球后麻醉。开眼睑后,常规经睫状体平坦部做23G巩膜三通道套管切口,固定灌流管,打开灌流液,行中轴部玻璃体切割,制作后玻璃体脱离,切除周边部玻璃体,若存在纤维血管膜则行分离切除,切除牵拉,眼内行视网膜激光光凝,术者根据患者眼底状态自行决定玻璃体腔填充物(硅油、C2F6、平衡液),7-0可吸收缝线间断缝合巩膜切口3针,结膜下妥布霉素注射液2mL,纱布包盖术眼。根据眼内填充物指导患者术后体位(硅油、C2F6填充保持面下位,平衡液填充保持面上位)。共有133眼术中联合行白内障手术,PPV前先行白内障超声乳化并人工晶状体植入术,过程包括制作角膜主侧切口,前房内注入黏弹剂,环形撕囊,水分离分层,超声乳化吸除晶状体,I/A吸除皮质,再次注入黏弹剂,植入人工晶状体,密闭角膜切口。共有18眼在术中密闭手术切口后行玻璃体腔注射雷珠单抗或康柏西普0.5mL。术后常规使用氧氟沙星滴眼液(qid,7d)、醋酸泼尼松滴眼液(q4h,7d;qid,7d;bid,7d;q.d,7d)对术眼进行抗感染及抗炎治疗[15]。所有手术均由3位有熟练PPV手术经验的高年资医生完成。

2 结果
2.1 纳入患者一般资料纳入患者151例均为2型糖尿病,其中男89例99眼,女62例70眼,年龄24~76(平均51.7±11.4)岁,平均随访时间18.07±12.55(1~79)mo。随访期间发生NVG 30眼(17.8%),术后NVG平均发生时间为6.27±4.01(1~17)mo;未发生NVG 139眼(82.2%)。
2.2 两组患者临床资料比较NVG组患者的术前及终末BCVA(LogMAR)显著差于非NVG组,差异有统计学意义(1.83±0.60vs1.58±0.58,P=0.038;1.96±0.83vs0.79±0.65,P<0.001)。NVG组术前有虹膜红变、对侧眼有NVG及术中硅油填充眼数均多于非NVG组,差异均有统计学意义(13.3%vs2.2%,P=0.020;10%vs0.7%,P=0.018;83.3%vs55.4%,P=0.010)。NVG组术中视网膜激光数量明显少于非NVG组,差异有统计学意义(696±389vs986±479发,P=0.002),见表1。

表1 两组患者临床资料比较
2.3 多因素逻辑回归分析PPV治疗PDR后NVG发生风险因素多因素逻辑回归分析发现:术前BCVA(LogMAR)(OR=3.077,95%CI:1.203~7.869,P=0.019)、术前对侧眼发生NVG(OR=22.108,95%CI:1.562~312.861,P=0.022)、术前虹膜红变(OR=7.897,95%CI:1.313~47.498,P=0.024)是术后NVG发生的危险因素;术中视网膜激光数量(OR=0.772,95%CI:0.666~0.893,P=0.001)是术后NVG发生的保护因素(表2)。
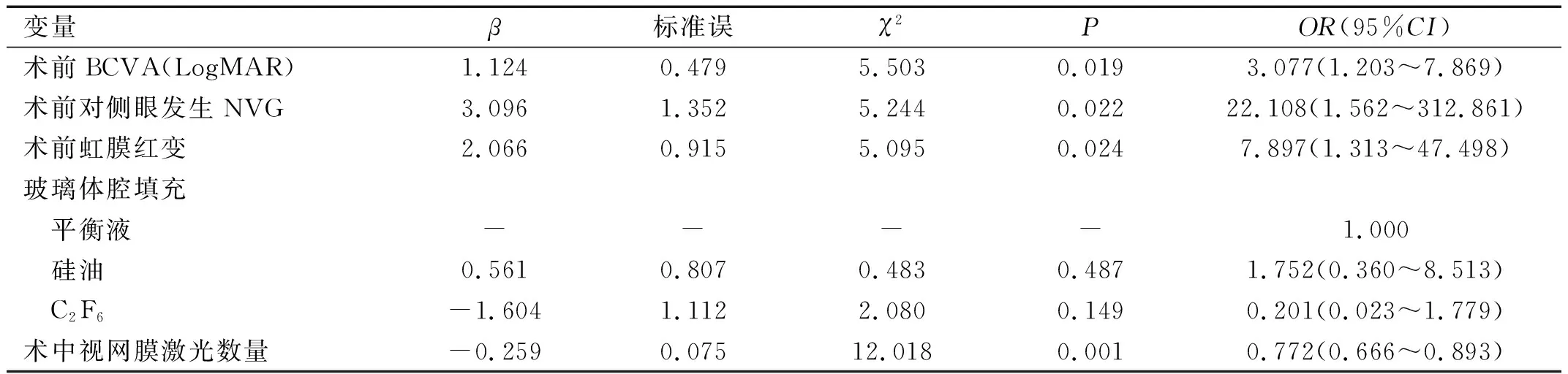
表2 多因素逻辑回归分析PPV治疗PDR后NVG发生风险因素
2.4 建立预测模型根据多因素逻辑回归分析建立预测模型,绘制Nomogram曲线显示模型的预测效果(图1A)。通过校准图以及ROC曲线预测模型的准确性,绘制决策曲线评价模型的临床效益。校准图显示实际曲线与理想的预测效能基本一致(图1B);模型预测效能较好(AUC=0.864,图1C);决策曲线分析显示当阈值概率为0~75%时具有良好的临床实用性(图1D)。
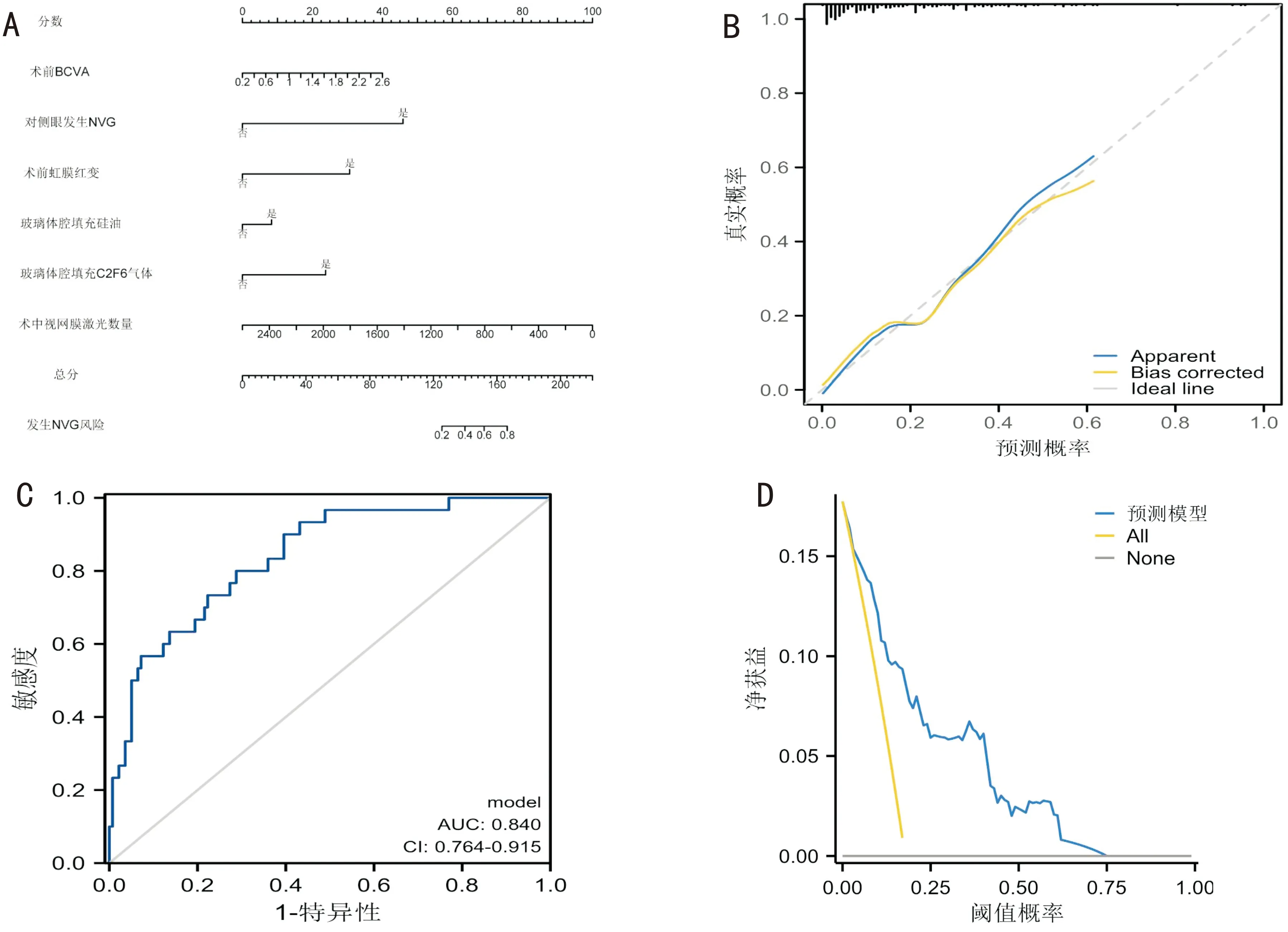
图1 建立预测模型 A:Nomogram图;B:校准图;C: ROC曲线;D:决策曲线。
2.5PPV治疗PDR后发生NVG的累积风险比Kaplan-Meier生存分析曲线显示50%的NVG发生在PPV术后5mo内,术后3、6、12mo NVG发生的累积风险比分别为4.8%、12.6%和18.1%(图2)。
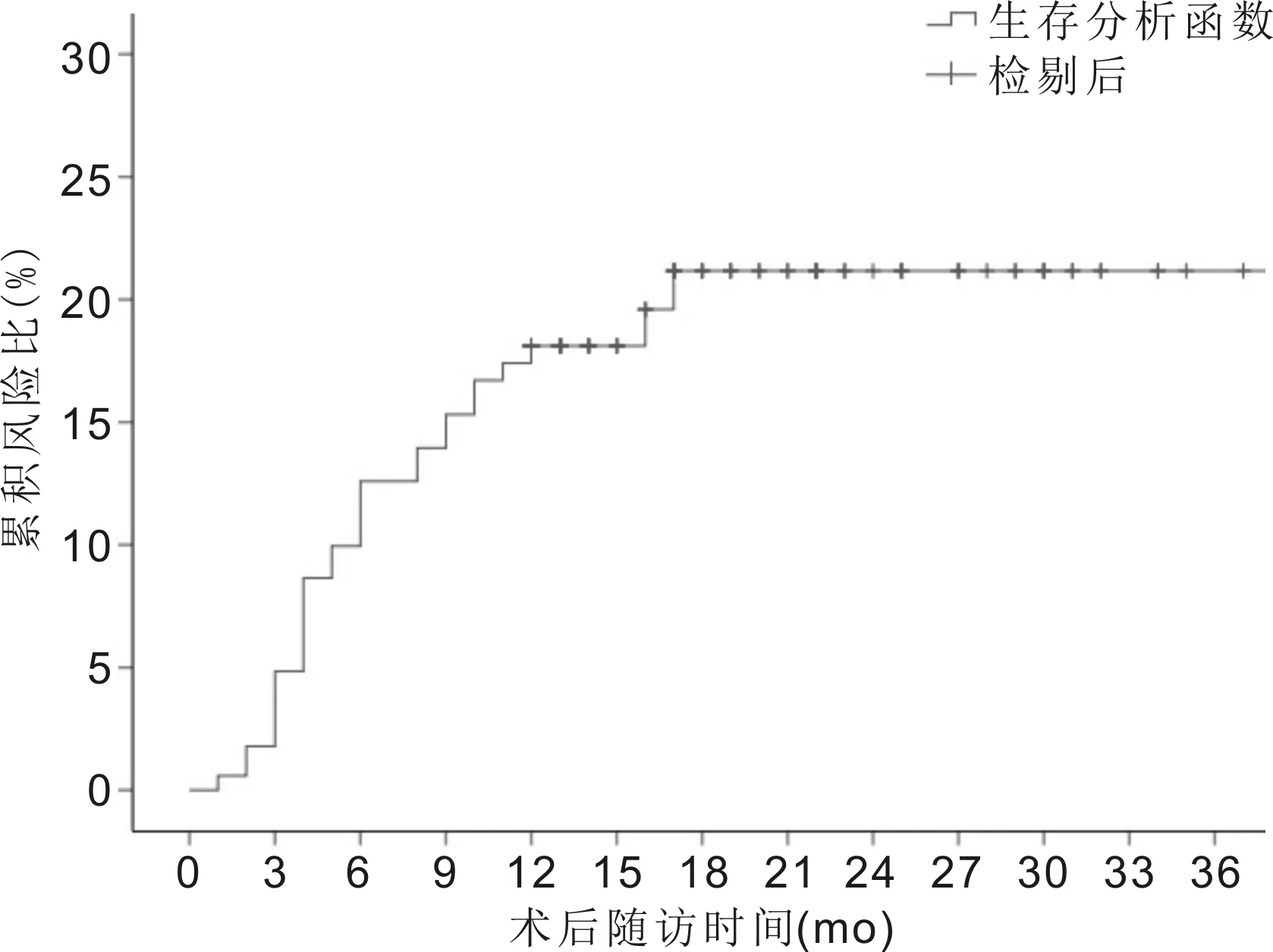
图2 Kaplan-Meier生存分析曲线分析NVG发生的累积风险比。
2.6 两组患者治疗前后BCVA比较NVG组患末次随访时BCVA(LogMAR)较术前轻度降低,差异无统计学意义(1.96±0.83vs1.83±0.60,t=0.69,P=0.49);非NVG组患者末次随访时BCVA(LogMAR)较术前明显提高,差异有统计学意义(0.79±0.65vs1.58±0.58,t=10.72,P<0.001)。
3 讨论
在本研究平均随访时间18.07±12.55(1~79)mo的观察中,PDR行PPV治疗后NVG的发生率为17.8%,与既往的一些研究结果一致[9-13]。在Kwon等[16]研究中,NVG的平均发生时间为PPV术后5.8±6.9mo,73.3%的NVG发生在PPV术后6mo内。盖春柳等[17]研究中,71.4%患者NVG发生在PPV术后3~6mo。在本研究中,NVG的平均发生时间为6.27±4.01(1~17)mo,50%患者NVG发生在术后5mo内,与之前所报道的研究结果一致。此外,本研究通过Kaplan-Meier生存曲线分析发现,NVG在PPV术后3、6、12mo发生的累积风险比逐渐升高(分别为4.8%、12.6%和18.1%),故建议PPV治疗PDR后至少密切随访1a,前6mo尤为重要。
随着玻璃体切割微创技术的发展,PPV治疗PDR的有效性已经得到证实,术后平均视力可明显提高[15]。但在本研究中,PPV术后发生NVG的PDR眼终末平均BCVA轻度下降,这说明NVG会对视功能产生严重损伤。关于NVG的危险因素,本研究在多因素回归分析中发现,术前BCVA差、存在虹膜红变和对侧眼发生NVG是NVG发生的危险因素,尤其术前对侧眼NVG的危险系数高达22倍,而术前虹膜红变的危险系数达7倍。术前视力更差的PDR眼一般病情更重一些,而既往研究表明PDR的进程与眼内VEGF浓度呈正相关[18],眼内VEGF浓度的增加会加剧NVG发生的风险[19]。虹膜红变常提示眼前部缺血缺氧严重及眼内VEGF浓度较高,新生血管已经向房角蔓延,手术导致的眼内炎症介质及VEGF释放会加速这一进程[20]。陶勇等[21]也发现术前虹膜红变是术后NVG的危险因素。对于术前虹膜红变的患者,本研究在术前均进行抗VEGF药物玻璃体腔注射治疗,尽管其可以在短期内快速消退新生血管,但是在长期观察中,并不能减少NVG的发生。一眼发生NVG提示其眼内高度缺血缺氧及VEGF浓度升高,基于双眼病理生理的高度趋同性,这也奠定了另一眼的发病基础。
外周血的炎症标志物包括白细胞、中性粒细胞、淋巴细胞、血小板、单核细胞、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL),而中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、单核细胞/高密度脂蛋白比值(monocyte to high-density lipoprotein ratio, MHR)和血小板/淋巴细胞比值(platelet to lymphocyte ratio, PLR)常被用于炎症性/血栓性相关疾病的标记物[22-23]。Zhang等[24]发现NLR升高增加了视网膜中央静脉阻塞继发NVG的风险。在我们之前的研究也发现NLR、PLR及MHR与视网膜静脉/动脉阻塞高度相关,是潜在的生物标记物[25]。本研究并没有发现PDR患者的术前NLR、PLR及MHR与PPV术后NVG的发生相关,说明相对于VEGF,炎症在其中可能不占主导作用,但尚需进一步研究。
视网膜激光光凝是治疗重度NPDR及PDR的重要手段[26]。视网膜激光的光热效应通过破坏缺血区域的视网膜色素上皮及光感受器而降低视网膜的氧消耗,同时促进了脉络膜的氧供,减轻了视网膜的缺氧状态,从而抑制了VEGF的产生[27]。多因素回归分析发现术中充分的视网膜激光光凝可以降低术后NVG的发生,每增加100发激光,可将风险降低约30%。
本研究有一些局限性:(1)单中心的回顾性研究设计可能会存在一定的样本选择偏倚,同时缺乏视网膜脱离范围、虹膜及房角新生血管累积范围的准确评估资料,患者术后没有常规行荧光造影检查进行缺血程度评估;(2)偏小的样本量可能导致结果有一定的偏差。但本研究在PDR眼PPV术后的长期随访中描述了NVG的发生率及累积风险比,同时还发现了相关的危险因素(术前BCVA较差、虹膜红变、对侧眼发生NVG)及保护因素(充足的视网膜激光光凝)。最后,建议PDR行PPV治疗后需密切随访1a以观察NVG的发生。
