5株植物内生真菌生物转化柠檬烯和月桂烯产物分析
2023-05-12杨道茂王奇志裴真巧
杨道茂, 王奇志, 裴真巧
(华侨大学 化工学院, 福建 厦门 361021)
萜类化合物的基本结构是由不同个数的异戊二烯首尾相连而成.根据异戊二烯规则,由2个异戊二烯构成的化合物称为单萜.单萜类物质主要存在于挥发油中,广泛应用于医药工业、香料工业、昆虫信息素及昆虫驱避剂等方面[1].某些单萜类化合物,如柠檬烯[2]、月桂烯、哌烯等,由于结构简单、价格低廉,一直是理想的生物转化底物模型,均可用细菌、真菌、酵母菌和植物细胞完成转化[3].在已报道的微生物催化剂中,细菌占41%,真菌占33%[4].
在用于生物转化的细菌中,有关假单胞属细菌(Pseudomonassp.)的报道最多.该属细菌能以柠檬烯[5-6]、酪醇[7-8]和月桂烯[9-10]为转化底物.2013年,Molina等[11]总结了假单胞属细菌生物转化萜类物质的研究.真菌中,黑曲霉[12-13]、尖孢镰刀菌[14-15]、指状青霉菌[16-17]、解脂耶氏酵母[18-20]等微生物都有转化单帖类化合物的相关报道.随着生物转化研究的深入,植物内生真菌在生物催化领域的作用开始受到重视.植物内生真菌因为需要与宿主植物一起共进化来适应环境的变化,从而显示它们可能会产生丰富的酶以适应宿主[21].现有多种植物内生真菌应用于生物转化,如海藻(Bostrychiaradicans)来源内生真菌Botryosphaeriasp.[22],植物内生真菌(Phomopsissp.,Glomerellacingulata,Diaporthephaseolorum,Aspergillusfumigatus)[23],火炬松来源植物内生真菌(Phomopsissp.)[24].因此,采用植物内生真菌生物转化单萜类化合物理论上是可行的[25].
本文选取单环单萜中的(+)-柠檬烯和(-)-柠檬烯、无环单萜的月桂烯为转化底物,以假臭草来源5株植物内生真菌为转化菌株,采用气相色谱-质谱联用技术(GC-MS)分析转化产物,以期为工业生物催化寻找合适的微生物菌种.
1 材料与方法
1.1 药品与仪器
(+)-柠檬烯、(-)-柠檬烯、月桂烯,日本东京化成工业株式会社;无水乙醇、石油醚(60~90 ℃)、乙酸乙酯,国药试剂有限公司;(1S,2S,4R)-(+)-二戊烯-1,2-二醇(柠檬烯-1,2-二醇,CAS号:38630-75-0),美国Sigma-Aldrich公司.以上试剂均为分析纯.0.22 μm滤膜,天津市津腾实验设备有限公司;GF254型薄层层析硅胶板(50 mm×200 mm),山东青岛海洋化工厂分厂.
ZQZY-75CN型振荡培养箱,上海支楚仪器有限公司;XH-C型旋涡混合器,江苏省金坛市白塔新宝仪器厂;SW-CJ-1FD型洁净工作台,江苏省苏州安泰空气技术有限公司;H1650型医用离心机,湖南湘仪实验室仪器开发有限公司;Angilent 8860 GC System-5977B型气质联用仪器(带G4513A型自动进样器),美国安捷伦科技有限公司;EYELA N-1100型旋转蒸发仪,日本东京理化器械株式会社.
1.2 微生物与培养基
植物内生真菌(AlternariaNeesPS01,AlternariaNeesPS06,AlternariaNeesPS07,DiaportheNitschkePS10,AlternariaNeesPL14),分离自假臭草茎干部位,由王奇志博士馈赠.
发酵及转化培养基:蛋白胨10 g·L-1,葡萄糖40 g·L-1,pH值为4.0~6.0.
1.3 检测方法
薄层层析(TLC)方法:展开剂采用体积比V(石油醚)∶V(乙酸乙酯)=10∶1;显色剂采用体积分数为1%的香草醛浓硫酸.
气相色谱-质谱联用检测采用Agilent HP-5ms型色谱柱(30 m×250 μm×0.25 μm),载气为氦气,进样量为1 μL.升温程序:60 ℃保持1 min,20 ℃·min-1升温到300 ℃,保持13 min.MS离子源温度为230 ℃,MS四极杆温度为150 ℃,质谱扫描范围(m/z)为60~800.
2 实验步骤
2.1 液体发酵法生物转化单萜类化合物
实验过程参考Rottava等[13]的做法并进行略微调整.菌种在马铃薯葡萄糖琼脂培养基中活化6 d后,挑取一接种环菌丝接种于装有100 mL培养基的250 mL锥形瓶中,在30 ℃,200 r·min-1下培养6 d;然后,在培养基中加入1 mL经0.22 μm滤膜过滤除菌的(+)-柠檬烯-乙醇溶液(柠檬烯与乙醇的体积比为1∶1)使柠檬烯的体积分数为0.5%,继续培养4 d完成转化过程;转化结束,将发酵液过滤,取3 mL滤液到15 mm×150 mm玻璃试管中,用等体积乙酸乙酯萃取;接着,将有机相转移到干燥玻璃试管中,并用无水硫酸钠脱水;最后,取1 mL有机相进行TLC和GC-MS检测.
(-)-柠檬烯和月桂烯的转化及代谢产物处理操作与(+)-柠檬烯的处理步骤一致.
2.2 建立柠檬烯-1,2-二醇标准曲线
用色谱纯乙酸乙酯溶解标准品配制质量浓度为8.6 g·L-1的母液,采用逐步稀释法配制成不同质量浓度的样品.采用GC-MS检测方法建立柠檬烯-1,2-二醇的峰面积-质量浓度的标准曲线.
3 实验结果与讨论
3.1 有机相的TLC检测
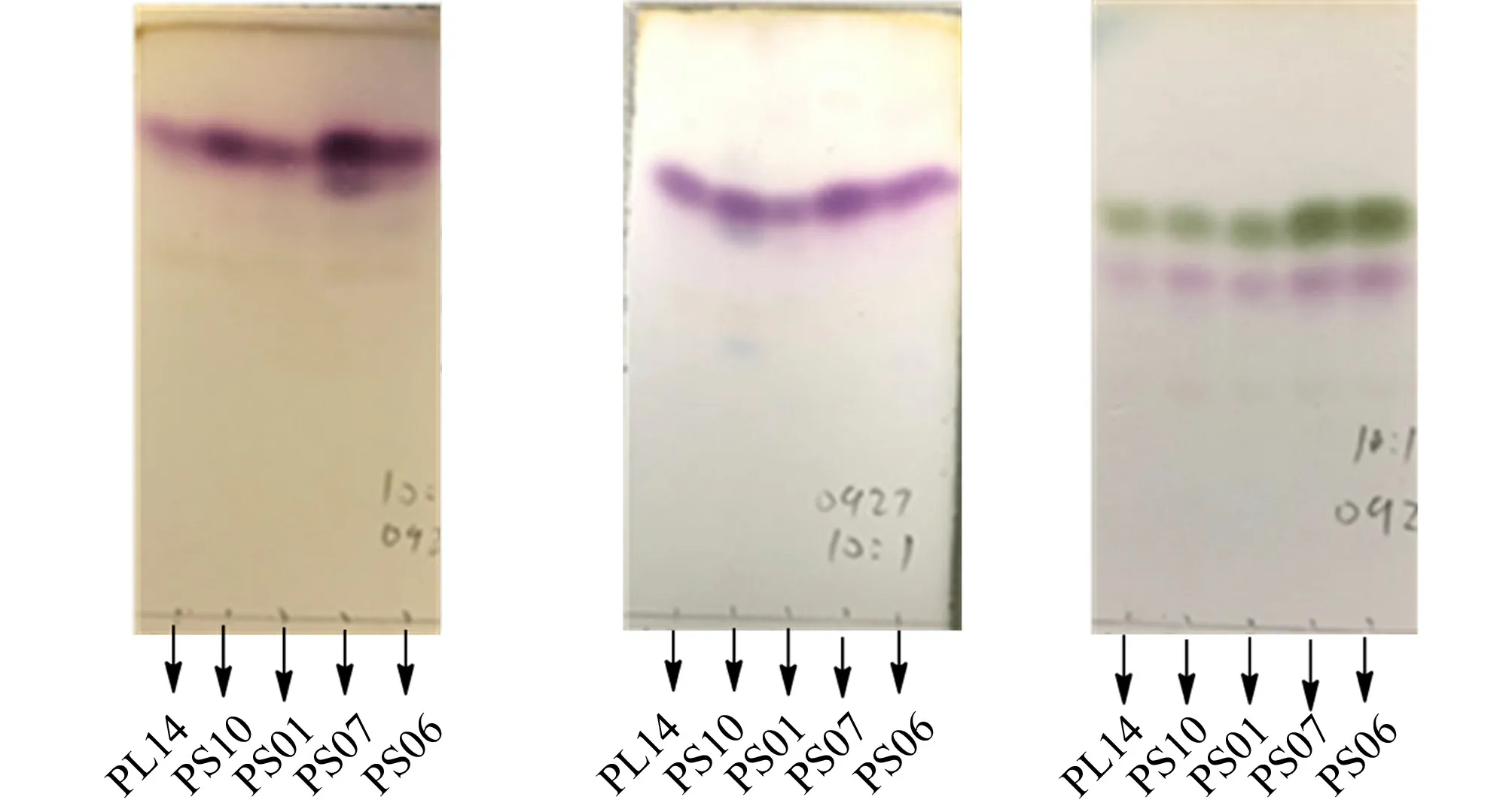
5株植物内生真菌分别转化(+)-柠檬烯、(-)-柠檬烯和月桂烯,取其萃取相进行TLC检测,结果如图1所示.
(a) (+)-柠檬烯 (b) (-)-柠檬烯 (c) 月桂烯
由图1可知:5株植物内生真菌对2种手性构型的柠檬烯底物均具有良好的转化能力,且其产物比较单一,这有利于后期的产物分离,转化结果比较理想;特殊的是,菌株PS07转化(+)-柠檬烯时,与其他菌株相比,其产物多出了1个斑点,而菌株PS10转化(-)-柠檬烯时,与其他菌株相比,其产物多出了2个浅蓝色斑点;5株真菌对月桂烯均具有转化能力,且转化斑点的比移值(Rf)相同,推测转化产物是相同的.
从菌株测序的结果可知,菌株PS01,PS06,PS07和PL14归属于AlternariaNees,菌株PS10归属于DiaportheNitschke.结果表明,同一种属的真菌在转化实验时,其转化产物一般是一致的,如菌株PL14,PS01,PS07,PS06在转化柠檬烯、月桂烯的表现一样,但菌株PS07在转化(+)-柠檬烯时多出1个斑点.因此,各菌株在完成生物转化实验时,可以套用一般规律,但是不能忽视个别菌株的特殊性.
3.2 植物内生真菌对(+)-柠檬烯的转化行为
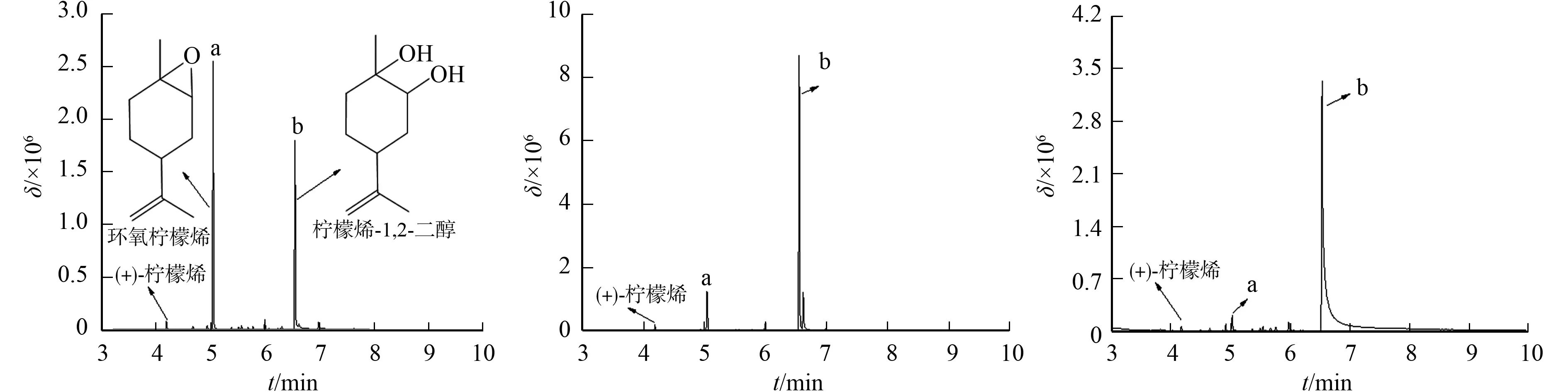
5株植物内生真菌完成(+)-柠檬烯转化后,其有机相的总离子色谱(TIC)图,如图2所示.图2中:δ为绝对丰度;t为时间.
(a) 菌株PS01 (b) 菌株PS06 (c) 菌株PS07
由图2可知:各峰信号主要为峰a(环氧柠檬烯)和峰b(柠檬烯-1,2-二醇),该结果与Bier等[24]报道的一致.从转化机理上看,环氧柠檬烯是柠檬烯-1,2-二醇的前体,属于已知的6条柠檬烯代谢路线之一[26],因此,该实验结果是合理的.
3.3 植物内生真菌对(-)-柠檬烯的转化行为
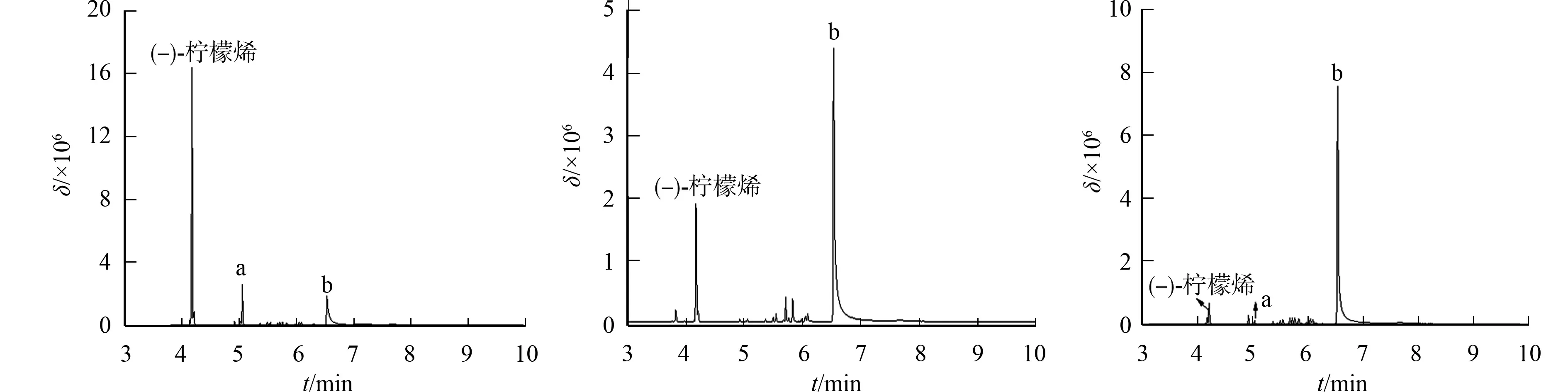
5株植物内生真菌转化(-)-柠檬烯后,其有机相的TIC图,如图3所示.
(a) 菌株PS01 (b) 菌株PS06 (c) 菌株PS07
由图3可知:5株植物内生真菌的主要产物均为柠檬烯-1,2-二醇,且底物(-)-柠檬烯的信号强度较高,只有菌株PS07的信号强度低,而图2中底物(+)-柠檬烯的信号强度普遍都低,推测菌株可能更倾向于利用(+)-柠檬烯,原因在于该构型的底物为柑橘精油的主要成分.对比图2和图3发现,虽然底物手性不同,但是产物一样,推测负责转化的双羟基加氧酶对底物无立体特异性要求.
3.4 柠檬烯-1,2-二醇标准曲线
建立柠檬烯-1,2-二醇标准曲线,如图4所示.图4中:S为峰面积;ρ为柠檬烯-1,2-二醇的质量浓度.由图4得到标准曲线方程为Y=129 971.734 13X-15 963.437 46,R2=0.993.
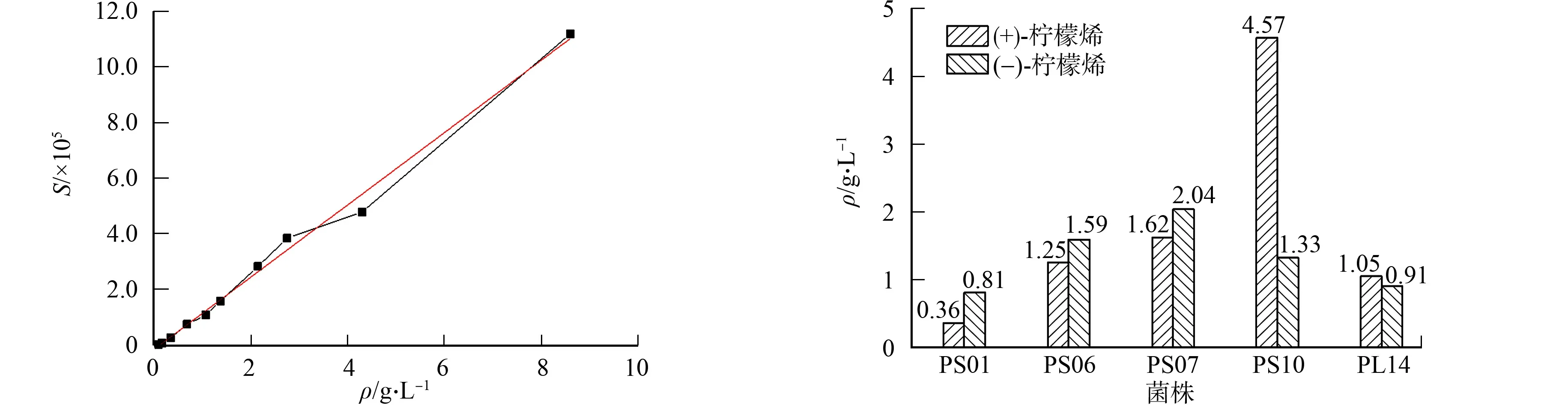
图4 柠檬烯-1,2-二醇标准曲线 图5 不同菌株生成柠檬烯-1,2-二醇的质量浓度
根据该标准曲线,结合图2,3的柠檬烯-1,2-二醇峰的峰面积,计算出5株植物内生真菌转化2种构型柠檬烯形成的柠檬烯-1,2-二醇的质量浓度,结果如图5所示.
由图5可知:5株植物内生真菌转化2种手性柠檬烯生成柠檬烯-1,2-二醇的质量浓度差异较大.以(+)-柠檬烯为例,菌株PS10的产量最高,为4.57 g·L-1,是菌株PS01产量的12.7倍.如果底物为(-)-柠檬烯,则各菌株生成柠檬烯-1,2-二醇的质量浓度范围为0.81~2.04 g·L-1.
3.5 植物内生真菌对月桂烯的转化行为
考察5株植物内生真菌对月桂烯的转化结果,其有机相的TIC图,如图6所示.
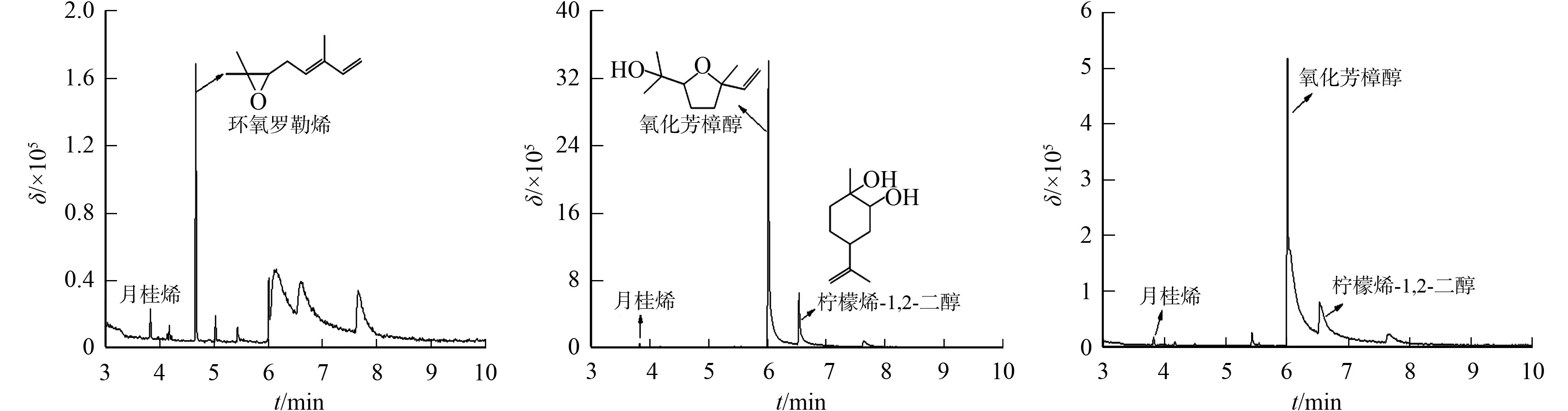
(a) 菌株PS01 (b) 菌株PS06 (c) 菌株PS07
由图6可知:5株植物内生真菌转化月桂烯后,与柠檬烯底物相比,其转化产物更多样;菌株PS01的主要产物为环氧罗勒烯,菌株PS06和PS07的主要产物为氧化芳樟醇,菌株PS10的产物为苯乙醇等化合物,菌株PL14则未检索到相匹配的化合物.不同菌株转化月桂烯后的产物复杂多样,与Esmaeili等[9]的结果一致.Esmaeili等[9]采用铜绿假单胞菌转化月桂烯,在反应1.5 d时的代谢产物为二氢芳樟醇和2,6-二甲基辛烷,反应3 d后的主要产物为2,6-二甲基辛烷和α-松油醇.由此可以看出,转化月桂烯的产物多样可能与转化时间有关.
4 结论
实验采用的5株植物内生真菌均具有生物转化3种单萜化合物的能力.5株植物内生真菌转化(+)-柠檬烯和(-)-柠檬烯的主要产物为柠檬烯-1,2-二醇,菌株PS10转化(+)-柠檬烯生成柠檬烯-1,2-二醇的产量最高,为4.57 g·L-1.5株植物内生真菌转化月桂烯的产物多样,包含环氧罗勒烯、氧化芳樟醇等,未找到产物单一的转化菌株.
柠檬烯-1,2-二醇具有抗癌活性[27-28],不仅能抑制CD4+和CD8+T淋巴细胞的促炎活性[29]并作为调味剂[14],还可以用来合成Prevezol C[30],是一种很重要的柠檬烯含氧衍生物.从价值上看,以Sigma-Aldrich的报价为例,底物(+)-柠檬烯的价格为1 584.8 元·L-1, 而产物柠檬烯-1,2-二醇的价格为530.09 元·g-1,转化后的产物价值得到了极大的提升.柠檬烯-1,2-二醇理论上具有4种构型[31],用酶法转化的产物具有单一手性的这一特性是化学合成方法无法具备的.因此,生物转化柠檬烯合成具有更高附加值的衍生物的思路是可行且有意义的.
实验结果表明:植物内生真菌是一种很有发展潜力的绿色生物催化剂,值得扩大底物筛选范围并分离出更多的内生真菌用于生物转化研究.
