老年女性绝经后骨质疏松患者血清IL-33水平和骨转换标志物表达水平与骨折风险的关联性研究
2023-05-12张豪杰张平超凌中华
殷 乐, 张豪杰, 张平超, 凌中华
绝经后女性受年龄及雌激素变化的影响,易发生骨质疏松,而骨质丢失和骨微结构破坏是增加脆性骨折风险的主要因素[1-2]。目前,最常用的骨折风险评估方法是应用双能X线骨密度仪测量骨密度(bone mineral density,BMD)。然而,很难及时通过BMD来筛查小的骨微结构的变化[3]。骨免疫学是一门跨学科的研究领域,主要研究骨骼与免疫系统之间的关系。有研究表明,骨骼重塑受到严格的免疫控制[4]。白细胞介素-33(interleukin-33,IL-33)是近些年发现的白细胞介素-1(interleukin-1,IL-1)家族一员,具有多效免疫调节作用,在炎症刺激或环境应激反应下表达上调[5]。有研究证实,IL-33具有抗破骨细胞作用,并通过诱导细胞凋亡来减少破骨细胞的形成和活性,其表达水平升高可影响骨病理学改变[6]。但迄今为止,关于IL-33在骨免疫学中所获得的大多数信息都来自体外研究和动物模型,对于人体样本的适用性尚不清楚。鉴此,本研究旨在探讨绝经后骨质疏松(post-menopausal osteoporosis,PMO)女性患者血清IL-33水平和骨转换标志物(bone turnover markers,BTMs)与骨折风险的关联性,揭示IL-33在骨代谢中的作用。
1 对象与方法
1.1研究对象 招募2019年6月至2021年3月我院收治的277例因跌倒发生脆性骨折的老年女性PMO患者作为骨折组,包括腕关节骨折53例,周围骨折(骨盆、胫骨、腓骨、肱骨、踝骨、髌骨或跖骨骨折)141例,髋关节骨折53例,椎体骨折30例。另外纳入同期无骨折记录的老年女性PMO患者作为对照组(250例)。纳入标准:(1)年龄≥60岁,绝经妇女;(2)符合骨质疏松临床表现,且经影像学检查和骨密度仪测量(T-值≤-2.5),诊断为骨质疏松者[7];(3)临床检查资料完善;(4)对于骨折组患者,骨折至入院时间≤72 h,且损伤原因为非暴力、非病理性的低能量跌倒,经电子计算机断层扫描(computed tomography,CT)或X光检查确诊。排除标准:(1)年龄<60岁,体质量指数(body mass index,BMI)>30 kg/m2;(2)合并内分泌疾病(如糖尿病等)、代谢性骨病(如骨软化症、Paget病或原发性甲状旁腺功能亢进等)或其他影响骨代谢疾病者;(3)合并纽约心脏协会(New York Heart Association,NYHA)分级>2级的心力衰竭、肾功能不全、恶性肿瘤者;(4)卵巢摘除者;(5)近6个月内服用抗骨质疏松药物、钙片和维生素D补充剂者;(6)高能量损伤(如车祸、高空坠落)致骨折,或病理性骨折(继发于肿瘤或原发性甲状旁腺功能亢进)。所有研究对象签署知情同意书,研究获医院医学伦理委员会批准(批号:2019-037)。
1.2一般资料收集 通过医院电子病历系统收集研究对象的年龄、BMI、吸烟史(每天吸烟1支以上,吸烟时间1年以上)、饮酒史(酒精摄入量达到每周30 g以上,且饮酒时间超过1年)等一般信息。
1.3血清学指标检测 于患者入院次日清晨(上午7~9点)收集静脉血液标本5 ml,静置30 min后离心,收集血清,-80 ℃保存待检。应用日立H7600型生化分析仪对当天采集的血清标本进行钙、磷水平的检测。应用罗氏电化学发光系统(E602型,瑞士罗氏诊断)和电化学发光免疫试剂盒(瑞士罗氏诊断)测定血清25-羟基维生素D[25-hydroxyvitamin D,25(OH)D]、1型胶原蛋白C末端肽(C-terminal telopeptide of type 1 collagen,CTX-1)、1型前胶原氨基端肽(procollagen type 1 N-terminal propeptide,P1NP)、骨钙素(osteocalcin,OC)、甲状旁腺激素(parathyroid hormone,PTH)水平。应用LIAISON全自动化学发光分析仪和Liaison BAP Ostase CLIA试剂盒(意大利索灵公司)检测血清骨特异碱性磷酸酶(bone-specific alkaline phosphatase,BALP)水平。应采用双抗体夹心酶联免疫吸附法检测血清IL-33水平,试剂盒购自美国USCN LIFE SCIENCE公司。
1.4BMD测定 于患者入院时采用Lunar Prodigy双能X线骨密度仪(美国GE公司)以扇形束阵列的方式测量腰椎(L1~4)、股骨颈和全髋的BMD(T-值,g/cm2)。

2 结果
2.1两组临床资料及骨转换标志物水平比较 两组年龄、BMI、吸烟史、饮酒史及血钙、血磷水平比较差异均无统计学意义(P>0.05)。骨折组患者血清PTH、CTX-1、P1NP、OC、BALP水平高于对照组,血清25(OH)D水平和BMD(T-值)低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组临床资料及骨转换标志物水平比较
2.2两组患者血清IL-33水平比较 骨折组患者血清IL-33水平低于对照组,差异有统计学意义[4.17(3.22,5.48)pg/ml vs 10.58(7.89,12.51)pg/ml;Z=-18.870,P<0.001]。
2.3骨折组患者血清IL-33水平与其他血清学指标的相关性分析结果 Spearman秩相关分析结果显示,骨折组患者血清IL-33水平与血清25(OH)D水平呈正相关(rs=0.158,P=0.009),与血清CTX-1(rs=-0.233,P<0.001)、OC(rs=-0.357,P<0.001)、PTH(rs=-0.326,P<0.001)水平呈负相关,与血清PINP、BALP、血钙、血磷水平的相关性不显著(P>0.05)。见图1。
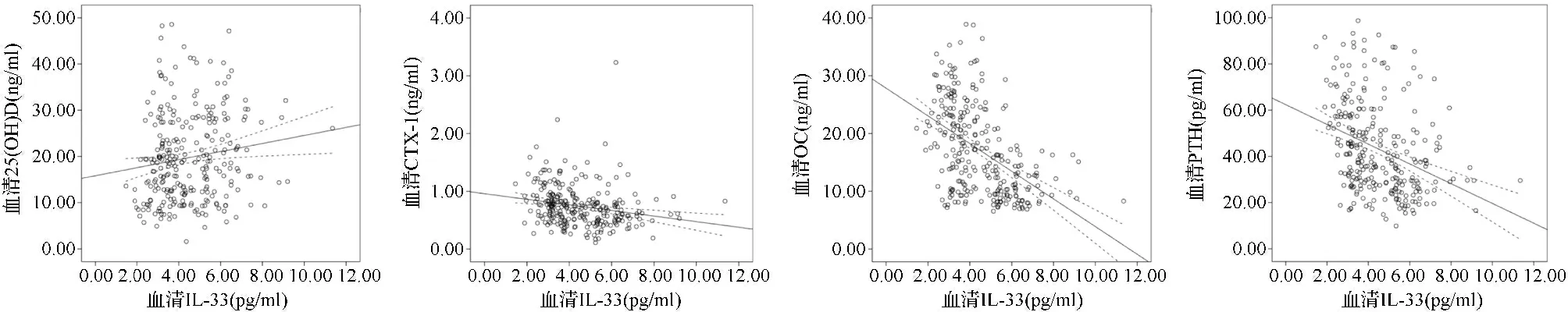
图1 骨折组患者血清IL-33水平与血清25(OH)D、CTX-1、OC、PTH水平间的散点图
2.4影响PMO女性发生骨折的多因素logistic回归分析结果 以PMO女性骨折情况作为因变量(骨折=1,未骨折=0),将表1中存在统计学差异的指标及血清IL-33作为自变量纳入多因素logistic回归分析模型,结果显示,较高水平的血清IL-33和BMD是抑制PMO女性发生骨折的保护因素(P<0.05)。见表2。

表2 影响PMO女性发生骨折的多因素logistic回归分析结果
2.5BMD及血清IL-33水平预测PMO女性发生骨折的效能分析结果 ROC曲线分析结果显示,BMD和血清IL-33水平均可有效预测PMO女性发生骨折,且以血清IL-33的预测效能更高(AUC:0.976 vs 0.908)。见表3,图2。
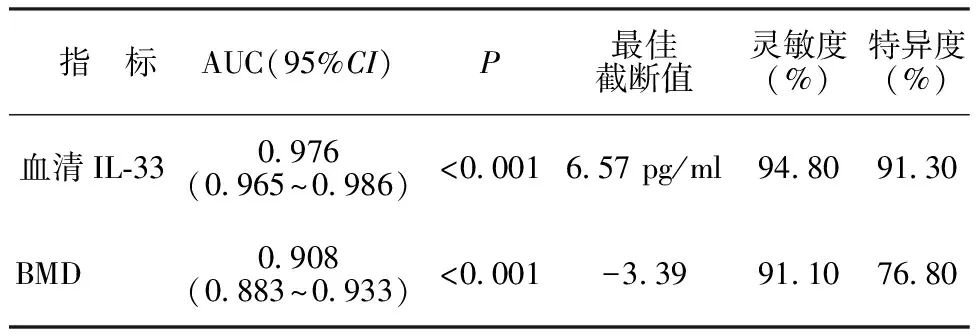
表3 BMD及血清IL-33水平预测PMO女性发生骨折的ROC曲线分析结果

图2 BMD及血清IL-33水平预测PMO女性发生骨折的ROC曲线图
3 讨论
3.1骨质疏松症作为以全身性骨量减少、BMD降低、骨微架构破坏为核心特征的骨骼系统疾病,其主要后果是骨骼脆弱性增加,使患者面临更大的骨折风险[8-9]。女性绝经后雌激素缺乏可引起骨吸收亢进,破坏骨代谢平衡,造成钙磷代谢失调,出现骨质疏松,严重影响绝经后女性的生命健康[10-11]。本研究调查了非肥胖、非糖尿病且年龄超过60岁的PMO女性人群骨折风险与血清IL-33水平的关系,在没有接受抗骨质疏松药物及其他治疗干预的情况下,骨折组血清IL-33水平较非骨折组低;进一步进行多因素logistic回归分析结果显示,较高水平的血清IL-33是抑制PMO女性发生骨折的保护因素。
3.2IL-33主要由基质细胞表达,在炎症刺激下表达上调。IL-33最初被描述为辅助性T细胞2(T helper 2,Th2)免疫反应的诱导因子,通过与其受体肿瘤抑制素2(suppression of tumorigenicity 2,ST2)和IL-1受体辅助蛋白(IL-1 receptor accessory protein,IL-1 RAcP)相结合发挥生物学效应,而这两种受体大量表达于天然免疫细胞和Th2表面[12-13]。近期有研究发现,在辅助性T细胞1(T helper 1,Th1)、调节性T细胞(regulatory T cell,Treg)和自然杀伤细胞上也发现了IL-33的相关受体[14]。越来越多的研究表明,IL-33作为一种多功能免疫调节细胞因子,在调节适应性和先天性免疫、炎症过程和环境应激反应方面发挥着重要作用[15]。绝经后妇女由于雌激素缺乏诱发的骨质流失和骨质疏松症,主要是通过增加炎症细胞因子和免疫调节分子的产生,从而发挥破骨特性[16]。同样,与衰老相关的细胞衰老和免疫系统重塑会影响骨重塑,导致骨质疏松症[17]。有研究表明,雌激素调节的细胞因子是绝经时骨质流失加速的主要介质,参与骨质疏松症的发病机制[18]。IL-33是近年发现的IL-1细胞因子家族成员,其作为一种警报蛋白在骨骼疾病中发挥双重作用。例如,IL-33在类风湿性关节炎患者血清中升高,并且与骨质侵蚀呈正相关[19];而在IL-33缺乏小鼠的研究中,IL-33对骨病的发展具有显著的调节甚至保护作用[20]。
3.3在本研究中,笔者首先对患者相关骨代谢物水平进行了检测,结果显示骨折组PTH、CTX-1、OC水平较对照组显著升高;进一步的相关性分析结果发现,IL-33水平与CTX-1、OC呈负相关,提示IL-33可能与这些标志物共同参与了疾病进展,影响骨转化。此外,有研究认为疾病的发展阶段及激素水平均有可能影响IL-33对骨重建的作用。PTH可调节骨骼重塑和钙代谢,防止软骨变性和(或)软骨下骨的恶化,诱导骨关节炎中的软骨再生或软骨细胞增殖,并刺激局灶性软骨缺损的软骨下骨和关节软骨修复[21]。本研究结果显示,血清IL-33水平与PTH水平也呈负相关,提示IL-33及其受体是PTH的重要调节目标之一。Saleh等[22]研究表明,PTH干预可显著提高颅骨成骨细胞的IL-33表达水平,这与本研究结果相似,证实了PTH相关的成骨细胞合成代谢效应可能与IL-33有关。Th1可诱导和分泌促炎细胞因子,包括IL-1、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α等,这些细胞因子的大量分泌使原始骨质疏松和继发性骨质疏松的发生风险上升。相反,调节性细胞因子,如白细胞介素-10(interleukin-10,IL-10)和白细胞介素-4(interleukin-4,IL-4)则发挥骨合成作用,从而被认为具有预防骨质疏松的作用[23]。而IL-33能有效增强Th2的免疫反应,因此在骨质疏松症中也起到普遍的保护作用。
综上所述,IL-33可能是影响骨细胞活性的关键内源性调节因子,通过发挥抗破骨细胞作用参与骨质疏松过程。PMO女性人群血清IL-33水平降低可能会增加骨折的发生风险,值得临床医师关注,对目标患者可进行早期干预,以预防骨折的发生。
