1 例异基因造血干细胞移植后继发肠道急性移植物抗宿主病患儿肠外营养治疗药学监护实践*
2023-05-11吴石威宁丽娟
吴石威,宁丽娟,刘 湘△
(1. 湖南省湘潭市中心医院,湖南 湘潭 411100; 2. 中国科学技术大学附属第一医院,安徽 合肥 230061)
近年来,随着供体和受体选择、移植前处理、感染、移植物抗宿主病(GVHD)等并发症防治方法的不断改善,患者移植后存活率升高。异基因造血干细胞移植(allo-HSCT)成为各种血液、肿瘤和先天性疾病的重要治疗方法[1-2]。根据国际血液和骨髓移植研究中心的提供数据,行造血干细胞移值(HSCT)术患者每年超60 000例[3]。来自供体的免疫细胞攻击健康的受体组织如胃肠道、肝脏、皮肤和肺,导致GVHD,表现为急、慢性,是主要的致死性并发症之一,极大地限制了HSCT的有效性[4]。急性GVHD(aGVHD)的发病率因若干临床变量而存在差异,HSCT 受者累计发病率为40%~80%,其中胃肠道aGVHD 的累计发病率为60%[5]。除严重腹泻和呕吐外,临床症状还包括腹痛、痉挛、恶心、胃肠道出血和吞咽困难,可导致营养吸收不良、脱水、严重的电解质损失和体质量减轻[6]。使用免疫抑制剂产生的营养相关不良反应,严重恶化HSCT 受者的营养状况,影响存活[7-8]。故营养治疗对改善HSCT 患者的预后至关重要。本研究中分析了临床药师参与1 例allo -HSCT 后继发肠道aGVHD 患儿营养治疗的药学监护实践。现报道如下。
1 临床资料
1.1 病例资料
患儿,6 岁,身高112 cm,体质量18.2 kg,体质量指数14.51 kg/ m2。因“急性粒细胞性白血病部分分化型(M2型)化疗后1.5年,拟行脐血移植”于2019年4月19日入院。入院予“氟达拉滨+ 白消安+ 环磷酰胺”强化清髓预处理后,4月27日行脐带血移植,移植后出现重度植入前综合征(PES),给予糖皮质激素等治疗后好转,中性粒细胞植入(简称粒系植入)后仍有重度胃肠道aGVHD,表现为恶心呕吐、反复腹泻、消化道出血、肠梗阻等。6月8日,患儿粒系植入可,经对症治疗后皮疹、腹泻、消化道出血等症状均较前好转,遂转出HSCT 病房行下一阶段治疗。转出时,体格检查示,患儿目前仍有不全性肠梗阻及消化道出血,持续胃肠减压中,神志清,精神一般,全身皮肤未见可见陈旧性皮疹,咽部无充血,双肺听诊呼吸音清,未闻及明显干湿罗音,腹部无压痛。转入诊断:急性粒细胞性白血病;脐血移植术后;急性移植物抗宿主病;消化道出血;巨细胞病毒感染;肠梗阻。
1.2 治疗经过
患儿入驻HSCT 病房期间,临床医师制订肠外营养配方1,对患儿进行全肠外营养支持。其中,总能量625 kcal(1 kcal ≈4.184 kJ),氨基酸21.25 g,糖脂比63∶37,总液量607 mL,输注方式为单瓶输注(表1)。6月8日,转入普通病房,患儿体质量16.3 kg、较前下降,白蛋白32.6 g/L,前白蛋白165 mg/L,低于正常值。针对患儿营养不良等问题,6月10日。临床医师请临床药师会诊,临床药师对患儿进行综合评估后,予调整肠外营养支持配方2。其中,总能量927 kcal,氨基酸29.25 g,糖脂比63∶37,总液量797 mL,输注方式为全合一输注(表1)。临床医师采纳。在肠外营养治疗过程中,临床药师定期对患儿的营养治疗情况进行监护,关注营养相关监测指标(表2)。7月14日,患儿经营养支持、免疫抑制、抗感染、止血、输血小板、调节肠道菌群、止吐护胃等对症治疗后,腹泻、消化道出血较前明显好转,胃肠道功能逐步恢复。复测体质量17.5 kg,较前升高,白蛋白较前恢复(34.5 g/L)、前白蛋白正常(215 mg/L)。表明经临床药师给予营养干预后,患儿营养状况改善,且未发生营养相关不良反应,指标较前改善,开始由肠外营养向肠内营养过渡。HSCT患儿营养治疗时间轴见图1。
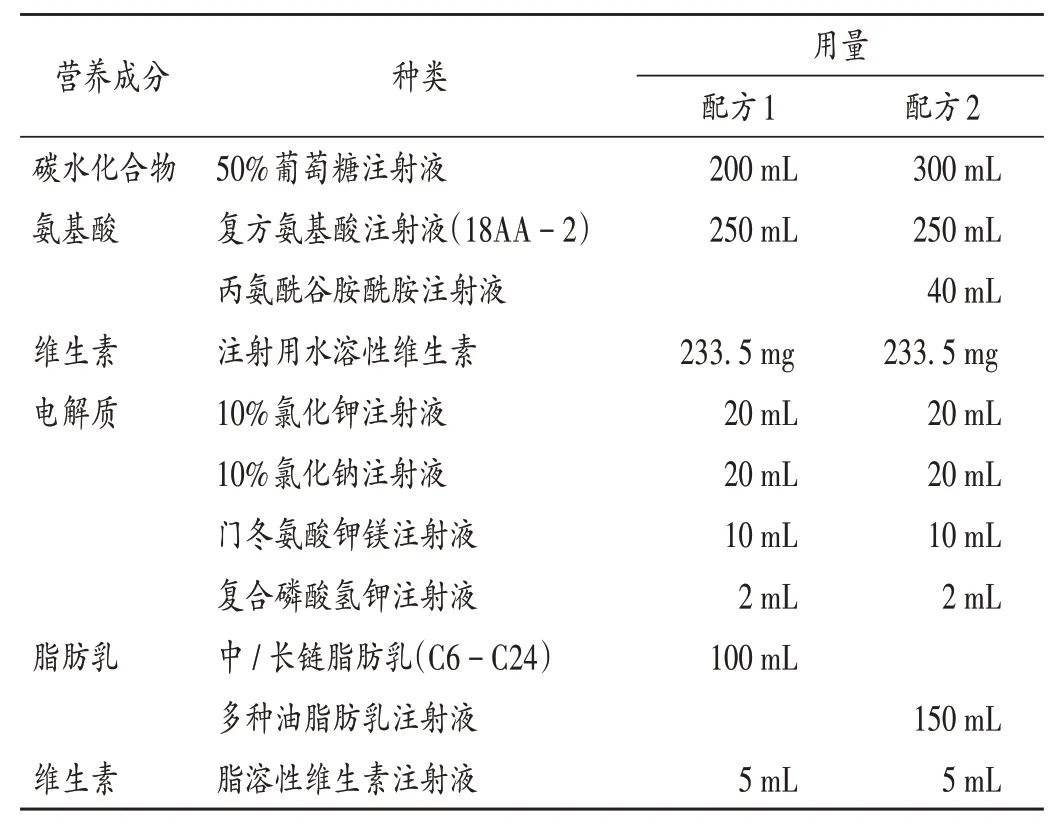
表1 患儿肠外营养支持方案Tab.1 Parenteral nutrition support plan for the child

表2 HSCT患儿肠外营养治疗时监测指标Tab.2 Monitoring indicators of parenteral nutrition in the child with HSCT
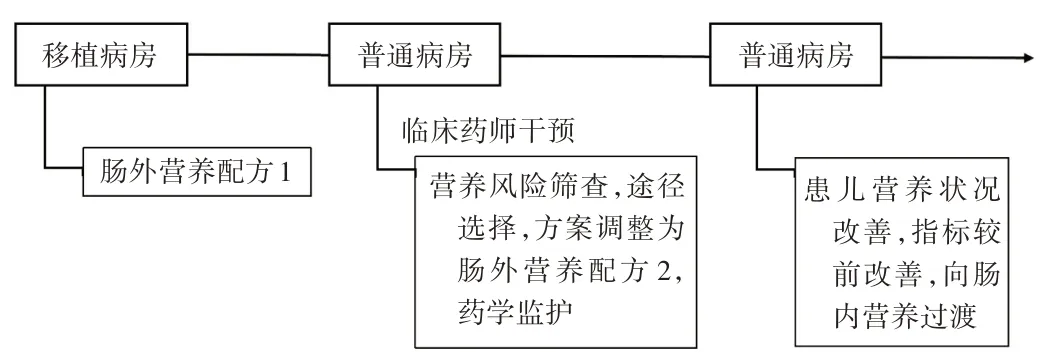
图1 HSCT患儿营养治疗时间轴Fig.1 Timeline of nutritional therapy for the child with HSCT
2 讨论
2.1 HSCT 患儿的营养风险筛查
HSCT 患儿常需接受高剂量化学治疗(简称化疗),化疗引起的系列不良反应(如恶心、呕吐、黏膜炎、腹泻、感染等)会影响患儿的营养摄入,导致临床不良结局。《肿瘤患者营养支持指南》指出,HSCT 患者入院时应行营养筛查,入院后每周监测营养状况、营养摄取及消耗情况,保证每日充分的营养素摄入,对营养不足患者应及时给予营养支持,避免体质量进一步丢失[9]。对于成年患者,如营养风险筛查2022(NRS2002)工具在成年患者临床应用中效果良好,获得美国肠内肠外营养学会(ASPEN)、欧洲肠内肠外营养学会(ESPEN)、中华医学会肠外肠内营养学分会(CSPEN)等多个权威机构认可。考虑儿童生长发育的动态评价等问题,目前尚无世界公认的儿童营养风险筛查工具[10]。欧洲儿科胃肠肝病及营养学会于2010年推出重症儿童营养调查(STAMP)量表[11-12],以评估住院儿童是否存在营养不良风险,目前临床应用较为广泛。因此,临床药师首先采用STAMP 量表对患儿进行营养风险筛查,结果评分>4分,提示患儿转入普通病房时仍为营养不良高风险,仍需继续进行积极的人工营养干预,以改善临床结局。
2.2 初始肠外营养治疗方案的分析
2.2.1 营养治疗途径选择
营养支持治疗时,在肠道功能基本正常情况下,应优先考虑口服营养补充(ONS)或肠内营养。越来越多的证据表明,肠内营养在儿童HSCT 期间是可行的,较肠外营养更能降低GVHD 发病率、住院时间、血小板计数恢复时间,产生更多临床获益[9,13-14]。但ESPEN 指南指出,对于HSCT 患者,当有严重的黏膜炎、顽固性呕吐、肠梗阻、严重吸收不良、长期腹泻或有症状的GVHD时,可选择肠外营养,且allo-HSCT 患者可能需要更频繁和更长时间的肠外营养治疗[14]。一项随机对照和对照试验表明,与标准肠外营养支持相比,由药师参与调控的个体化肠外营养方案在体质量增加和缩短住院时间方面具有优势[14]。本例患儿存在严重急性肠道GVHD、消化道出血、不完全性肠梗阻、反复腹泻,故选用全肠外营养支持(TPN)途径进行营养治疗。转入普通病房后,临床药师综合评估患儿的临床状况,选择继续进行个体化的全肠外营养支持,同时调整营养支持配方。
2.2.2 给予全合一方式肠外营养
全合一方式给予肠外营养是指将人体需要的碳水化合物、氨基酸、脂肪乳、电解质、微量元素、维生素等营养素按一定比例配制于输液袋中成为全营养混合液(TNA),经肠外途径用于患者。较单瓶输注或多瓶串输更有利于营养管理,可减少代谢并发症,降低感染风险,提高营养物质的利用,同时可整合静脉用药,有助于液体管控[15]。本例患儿转入普通病房前肠外营养支持方案将脂肪乳、脂溶性维生素与其他营养素分开输注,不利于营养素的有效利用,且易增加不良风险;临床药师询问患儿前期肠外营养用药史,结合近期实验室营养相关检查指标(如血糖、血脂、肝肾功能、电解质等)无明显异常,判断患儿近段时间肠外营养治疗耐受可,故将营养方案调整为全营养混合液,经中心静脉以全合一的方式滴注。临床医师采纳。
2.2.3 能量和氨基酸目标需要量分析
少量证据显示,肠道GVHD 患者的能量消耗有所增加[8]。但指南推荐,对于allo-HSCT 患儿接受肠外营养支持时的目标能量需要量少,大多针对成年患者。ASPEN 在儿科重症患者的营养支持指南中建议,通过间接量热法(IC)确定能量需求,并指导每日能量目标的处方,若IC 不能实施,则建议使用Schofield 方程式来估算能量消耗。但多项队列研究表明,大多数公布的预测方程都不准确,可能导致意外的过度喂食或喂食不足[16]。《中国儿科肠内肠外营养支持临床应用指南》(以下简称《儿科指南》)指出,对于6岁儿童,每日能量推荐用量为40~60 kcal/(kg·d),脂肪用量为1~2 g/(kg·d),建议使用20%脂肪乳剂,选择中长链脂肪乳剂,如有条件,也可选择橄榄油/大豆油混合制剂),碳水化合物8~10 g/(kg·d),且葡萄糖摄入应占非蛋白热卡的60%~75%,同时注意电解质、维生素等微量营养素的补充[17]。该患儿转入时体质量16.3 kg,初始营养方案提供的能量为625 kcal/(kg·d),已不能满足患儿的能量需要,需调整配方。
根据《儿科指南》,6 岁儿童氨基酸每日用量为1~2 g/(kg·d),可使用成人平衡型氨基酸[17]。文献[8]指出,肠道GVHD 患者的蛋白质需求可能增加,如长期使用大剂量的糖皮质激素可导致增加对蛋白质的需求,以及由于黏膜表面损害或发炎可造成黏膜渗出而失去蛋白质,建议存在营养不良和严重并发症(如GVHD)的患者蛋白质目标需要量为1.8~2.5 g/(kg·d);症状轻微、无严重营养不良则为1.5~1.8 g/(kg·d)。肠外营养配方1 中氨基酸供应量为21.25 g,对于存在严重肠道GVHD、低蛋白血症的患儿,氨基酸供应量可能不足。
2.3 肠外营养治疗方案调整
转入普通病房后,临床药师会诊协助,调整肠外营养支持方案,临床医师采纳会诊意见。肠外营养配方2提供的能量为927 kcal,氨基酸为29.25 g,葡萄糖用量为9 g/(kg·d),脂肪用量为1.8 g/(kg·d),葡萄糖提供的热量占非蛋白热卡的63%,同时继续补充电解质、维生素等微量营养素,能满足患儿需要[17]。
多种油脂肪乳是由大豆油、中链脂肪乳、橄榄油、鱼油(ω-3多不饱和脂肪酸)和维生素E 物理混合成的脂肪乳剂,通过添加ω-3多不饱和脂肪酸调整ω-3与ω -6 脂肪的比例。研究表明,ω -3 多不饱和脂肪酸可作为免疫调节因子,通过抑制炎性细胞因子和血管内皮损伤的产生及通过改善总体免疫功能来下调炎性反应,减轻细胞因子风暴,有助于降低HSCT 后并发症的发生率。因此,对于allo - HSCT 患者使用ω - 3 脂肪酸可能在减少严重GVHD方面获益。此外,添加ω-3脂肪酸还可能有助于维持脂质摄入热量的比例和三酰甘油的最佳水平,维持肝功能,减少感染并发症等[8,18]。因此,临床药师将原方案中的脂肪乳替换成添加了含ω - 3多不饱和脂肪酸的多种油脂肪乳,使患儿获益。
尽管ESPEN 指南中指出,缺乏充分且一致的临床数据来提出使用谷氨酰胺改善HSCT 肿瘤患者临床结局的建议[14]。但已有研究证明,补充谷氨酰胺可恢复胃肠黏膜的完整性并减少肿瘤治疗期间的细菌移位,调节免疫系统在消化道中的功能,还可促进肠道愈合,并减轻GVHD的严重程度[8]。对于本例存在肠道aGVHD的患儿,补充谷氨酰胺可能有助于促进其肠道黏膜修复,减少肠道蛋白丢失,改善消化道出血。因此,临床药师在调整肠外营养配方时加入丙氨酰谷胺酰胺注射液,由于丙氨酰谷氨酰胺提供的氨基酸量不应超过全部氨基酸供给量的20%。最终加入40 mL丙氨酰谷胺酰胺。
患儿的微量营养素供给可参考《儿科指南》。存在肠道GVHD 的患者由于经历营养和代谢紊乱,对微量营养素的需求和代谢可能会改变,HSCT 中尚未确定微量营养素的最佳剂量,应根据监测结果个体化调整。对于allo-HSCT 受者,尤其需要关注维生素C、维生素D、维生素B12、锌、镁和铁的缺乏情况[8,18]。
2.4 营养治疗中的药学监护要点
临床药师在营养支持中应对患儿进行积极的药学监护。监护要求:评估疾病状态、生理状态的变化;核实营养液的配比合理性、安全性及具体使用情况;关注患儿的耐受性及潜在不良反应,做好用药教育和心理疏导,避免营养相关导管和代谢相关并发症的发生。HSCT患者肠外营养的常规监测指标至少应包括能量和蛋白质摄入、液体平衡、体质量、电解质、血糖、三酰甘油、肝肾功能等[19]。
2.5 小结
经过调整肠外营养治疗方案,本例患儿体质量、前白蛋白、白蛋白等营养指标较前明显改善,且未发生相关药品不良反应。目前,患儿allo - HSCT 后继发肠道aGVHD 后营养治疗的相关案例报道较少,未见相关临床指南。陆姗姗等[20]采用全肠外营养对1 例HSCT 后继发肠道GVHD 的2岁患儿行肠外营养治疗,营养状况改善。本例患儿的营养治疗药学监护不同之处在于,临床药师综合分析相关文献,首先选择STAMP 量表对患儿进行营养筛查,制订个体化肠外营养方案,同时选择具有调节炎症作用的含ω - 3 多不饱和脂肪酸的多种油脂肪乳、谷氨酰胺配方,以及维生素、电解质、微量元素等微量营养素,以全合一的方式给予,最大限度地保证了营养用药的合理化与规范化,有助于营养素的吸收利用,减轻不良风险,提高患儿获益。但存在一定局限和不足,未对后续肠内营养进行全程营养管理,仍需多样本、多中心研究数据进行论证,以及添加特殊营养配方对此类患儿的获益程度,缺乏从药物经济学角度对此类患儿的营养治疗进行成本-效益分析等。
