基于网络药理学和生信分析探讨紫苏醛抗慢性粒细胞白血病的潜在作用机制
2023-05-11王金凤江荣松艾尼娃尔艾克木张伟怡
王金凤,江荣松,艾尼娃尔·艾克木, ,张伟怡*
(1. 新疆医科大学 药学院,新疆 乌鲁木齐 830011;2. 新疆维吾尔医学专科学校,新疆 和田 843000)
慢性粒细胞白血病(chronic myeloid leukemia,CML)起源于髓系祖细胞,其特点是异常的造血祖细胞不受控制的增殖,是一种罕见的骨髓增生性肿瘤[1-2]。其特征是9号染色体上的ABL1基因和22号染色体上的BCR基因融合形成融合基因BCRABL,由其编码的BCR/ABL融合蛋白可持续增强酪氨酸激酶的活性[3-4],进一步激活下游增殖、分化等相关信号通路,引起疾病的恶化,导致肿瘤的发生与发展。随着酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)在国内广泛应用,极大改善了CML的治疗效果,患者生存时间和生活质量都得到了明显改善,10年生存率由20 %左右提高到80 %~90 %[5]。但仍有20 %~30 %的患者存在原发药物反应不良或出现继发耐药[6-8]。
紫苏醛(perillaldehyde,PAE)是从紫苏[Perilla frutescens(L.)Britt.][9]中提取的主要活性成分之一,可作为食品添加剂,也是生产香精和香水的主要原料[10]。由于良好的抗氧化活性,可作为有机水果和食品保鲜剂[11]。药理研究表明,PAE具有较强的抗肿瘤[12-13]、抗抑郁[14]、抗炎[15-16]等多种药理作用。然而,PAE在治疗CML中的作用尚未见报道。本研究采用网络药理学和分子对接方法,以PAE为研究对象,预测分析抗CML的潜在靶点,借助GEO数据库分析CML患者和健康人群的差异基因,并通过体外试验加以验证。
1 仪器与材料
1.1 仪器
VD-650超净工作台(上海尚道);Infinite-EPlex全波长酶标仪(Tecan Trading公司);BKQZ75I立式压力蒸汽灭菌器(山东博科);37XB倒置显微镜(上海豫光);PowerPac Basic凝胶电泳仪(美国Bio-Rad公司);690BR031901半干转电转仪(美国Bio-Rad公司);EDGE V.070化学发光成像仪(法国Vilber公司)。
1.2 材料
紫苏醛(纯度≥98 %,Solarbio);二甲基亚砜(DMSO,Solarbio);蛋白裂解液(RIPA,Solarbio);苯甲基磺酰氟(PMSF,Solarbio);蛋白上样缓冲液(Solarbio);脱脂奶粉(Solarbio); IMDM基础培养基(Procell);磷酸盐缓冲溶液(PBS,Servicebio);胎牛血清(FBS,Biological Industries);青霉素和链霉素混合液(Biological Industries);胰蛋白酶(VivaCell);蛋白定量试剂盒(Biosharp);聚偏氟乙烯(PVDF)膜(Millipore);ECL发光试剂盒(Millipore);白介素8(IL-8)试剂盒(南京建成生物工程研究所);IL-8抗体(Abcam);β-actin抗体(Bioss);羊抗鼠HRP二抗(Bioss)。
1.3 数据库
采用的数据库及其网址信息见表1。
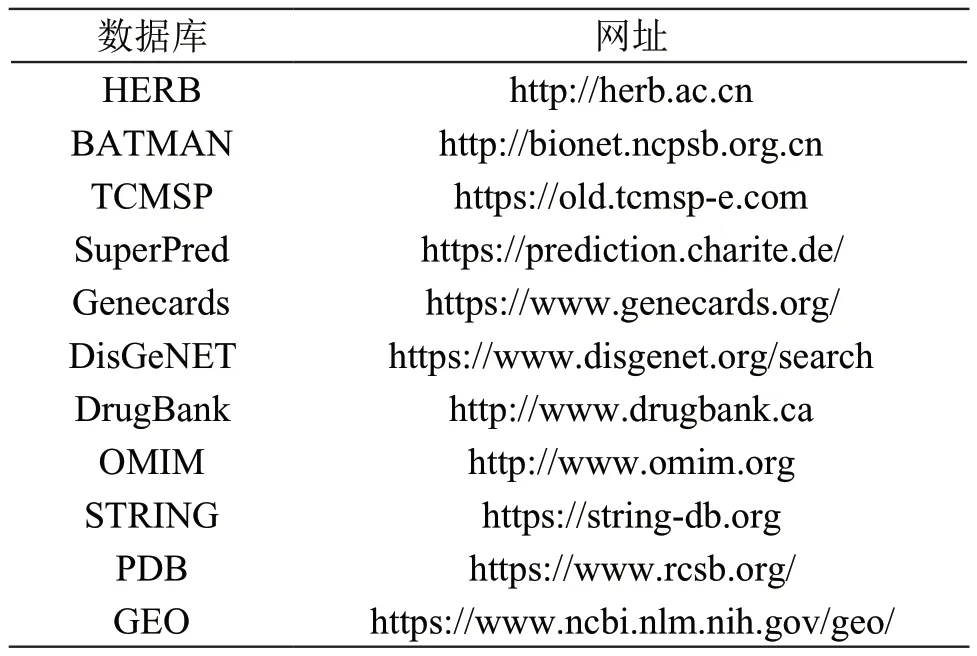
表1 数据库
2 方法
2.1 药物靶点获取
通过检索HERB(http://herb.ac.cn)、BATMAN(http://bionet.ncpsb.org.cn)、TCMSP(https://old.tcmsp-e.com)、SuperPred(https://prediction.charite.de/)数据库分别获取PAE的作用靶点。
2.2 疾病靶点获取
通过检索Genecards(https://www.genecards.org/)、DisGeNET (https://www.disgenet.org/search)、DrugBank (http://www.drugbank.ca)和OMIM (http://www.omim.org)数据库预测CML的相关疾病靶点。
2.3 PAE-CML交集靶点筛选
对上述获得的药物靶点、疾病靶点使用R包(VennDiagram,version 1.7.3)获得交集基因并制作韦恩图,得到PAE抗CML的潜在靶点。
2.4 富集分析
将上述获得交集基因使用R包(clusterProfiler,version 4.4.1)进行基于GO及KEGG的富集分析,并使用enrichplot包(version 1.16.0)绘制条形图及气泡图。
2.5 交集靶点-功能-通路的调控网络图
使用Cytoscape(version 3.8.2)利用GO富集的交集靶点构建交集靶点-功能的调控网络图;利用KEGG途径富集的交集靶点构建交集靶点-通路的调控网络图。
2.6 交集靶点的PPI调控网络图
将潜在靶点导入STRING(https://string-db.org)数据库,以置信度为0.4(Confidence=0.4)作为筛选条件构建蛋白互相作用(PPI)网络。其中节点代表靶点蛋白,边代表蛋白相互作用。
2.7 分子对接
选择交集靶点PPI网络中degree最高的蛋白,与PAE进行分子对接。从PDB(https://www.rcsb.org/)数据库中下载靶点对应的蛋白质晶体结构,再从TCMSP数据库下载活性成分的三维结构,利用AutoDockvina进行分子对接。通常对接结合能小于-1.2 kcal/mol时,证明配体与受体可较好结合。
2.8 生物信息学分析
对GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库中的GSE138883[17]和GSE5550[18]数据集进行整合分析,使用R包(limma:3.40.2)研究mRNA的差异表达。在GEO中分析调整后的P值以纠正假阳性结果并绘制火山图。运用R软件包pheatmap绘制表达热图。通过boxplot绘制正常组与CML患者组差异基因表达箱线图。
2.9 酶联免疫吸附测定(ELISA)
取对数生长期K562细胞,以4.0×105个/孔铺于6孔板。实验组分别加入200 μl紫苏醛使其终浓度为0,25,50,100,200 μmol/L,空白对照组加入等体积的PBS,5 % CO2、37 ℃恒温培养箱培养24 h。使用人白介素8(IL-8)ELISA试剂盒测定细胞上清中CXCL8(又称IL-8)的含量。
2.10 蛋白质印迹(Western blot)检测
细胞按2.9项下方法给药干预。收集细胞,1000 r/min离心5 min,用PBS清洗细胞两次,离心弃上清后每组加入裂解液(RIPA:PMSF=100:1)150 μl,转移至1.5 ml EP管,冰上静置裂解15 min,12 000 r/min,4 ℃离心15 min,取上清,转移至新的1.5 ml EP管中备用。制备15 %分离胶和5 %浓缩胶。将其固定于电泳槽上,槽内装满1×电泳缓冲液,按空白对照,0,25,50,100,200 μmol/L顺序每孔上样10 μl。电泳电压设置为80 V,待分子量标记物(marker)明显分开后再将电压设置为120 V,直至蓝色指示条带靠近玻璃板底部结束。裁剪尺寸合适的PVDF膜,提前使用甲醇活化5 min使其被激活,取下玻璃板裁剪含蛋白的凝胶部分,按滤纸、PVDF膜、凝胶、滤纸顺序压紧,置于半干转仪中,确保每层都不留下气泡,设置电流为0.5 A,电转35 min。使用5 %脱脂奶粉封闭2 h,加入IL-8抗体(1:500)或内参(β-actin)抗体(1:2000),4 ℃摇床孵育过夜。TBST洗涤5次,加入二抗,室温孵育(1:2000)1 h,TBST洗涤5次,将PVDF膜在发光液中浸润后使用曝光仪进行曝光,保存图片并进行定量分析。
3 结果
3.1 药物靶点获取结果
HERB、BATMAN、TCMSP和SuperPred数据库分别预测得到10,30,7,8个可能作用的靶点,合并4个数据库得到的药物靶点,最终共得到53个药物靶点。
3.2 疾病靶点获取结果
在Genecards数据库中以相关分数(relevance score)≥7获得1178个疾病靶点,在DisGeNET、DrugBank及OMIM数据库中分别获得1234个、6个及1个靶点,合并4个数据库得到的疾病靶点,最终共得到2415个疾病靶点。
3.3 PAE-CML交集靶点筛选
将上述获得的药物靶点和疾病靶点运用R包(VennDiagram,version 1.7.3)绘图取得交集,共获得18个交集靶点,见图1。
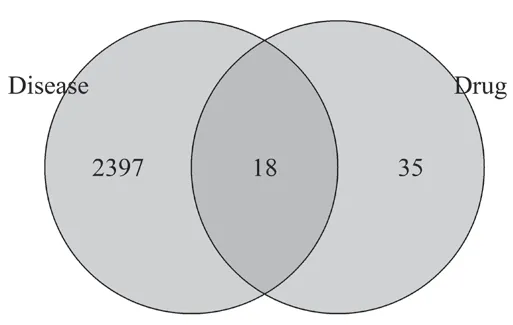
图1 PAE药物靶点与CML疾病靶点Venn图
3.4 富集分析
GO共富集到193条GO相关通路(调整后P<0.05),其中GO-BP目录156个,GO-CC目录0个,GO-MF目录37个,主要包括对类固醇激素的反应、细胞对类固醇激素刺激的反应、血管相关平滑肌收缩的调节等,见图2。KEGG富集到18条通路(调整后P<0.05),主要包括NOD样受体信号通路(NOD-like receptor signaling pathway)、趋化因子信号通路、脂质与动脉粥样硬化等,见图3。
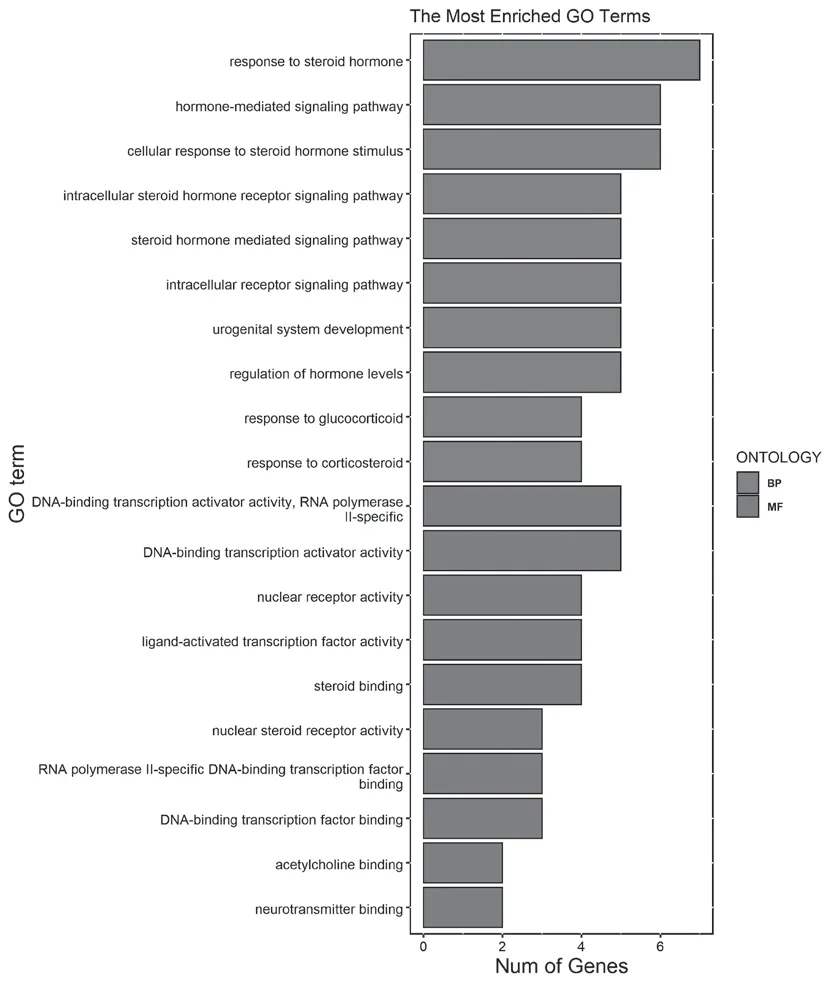
图2 PAE抗CML交集靶点GO分析

图3 PAE抗CML交集靶点KEGG分析
3.5 交集靶点-功能-通路的调控网络图
使用Cytoscape(version 3.8.2)将GO(GOBP、GO-CC和GO-MF)富集结果按P值从小到大排序,分别取排名靠前的15个交集靶点构建交集靶点-功能调控网络图,网络中包含30个GO关系项(term),15个交集靶点,共106个关系对,见图4。使用Cytoscape(version 3.8.2)将KEGG富集结果按P值从小到大排序,构建了交集靶点-通路的调控网络图,网络包含18条KEGG途径,8个交集靶点,共54个关系对,见图5。

图4 PAE和CML交集靶点-功能的调控网络图
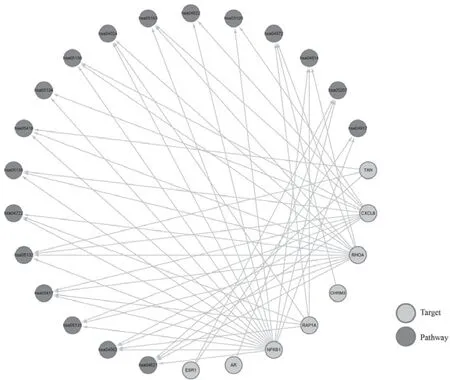
图5 PAE和CML交集靶点-通路的调控网络图
3.6 交集靶点的PPI调控网络图
为了探究这18个交集靶点之间是否存在互相作用关系,将其导入到STRING(https://string-db.org)数据库进行PPI网络构建,得到14个蛋白的互作网关系,包括14个节点,31条边,根据节点大小和颜色深度反应其连接度(degree)大小,见图6。

图6 PAE和CML交集靶点PPI调控网络图
3.7 分子对接
PPI网络中连接度(degree)最高的靶点CXCL8与PAE进行分子对接,结果表明,ARG-47残基与PAE之间存在氢键相互作用,对接亲和力为-5.2 kcal/mol,见图7。
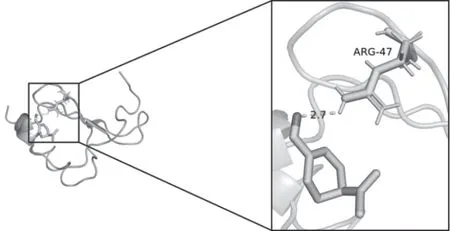
图7 蛋白质分子对接构象图
3.8 生物信息学分析
对GSE138883与GSE5550数据集整理合并得到14例正常样本和15例CML患者样本,对合并后的数据进行基因差异表达分析,得到其上调及下调基因,见图8。热图中明显观察到正常组和CML组之间有多个基因有表达差异,见图9。再对CXCL8单独进行表达差异比较,发现CXCL8在正常组和患者组之间有显著表达差异,见图10。
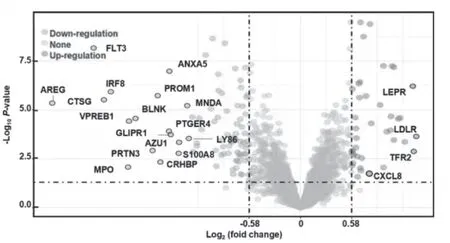
图8 正常组与CML患者组差异基因表达的火山图谱分析
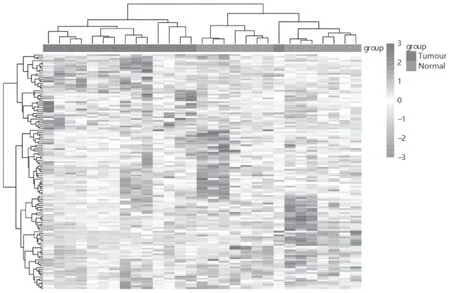
图9 正常组与CML患者组差异基因表达的热图
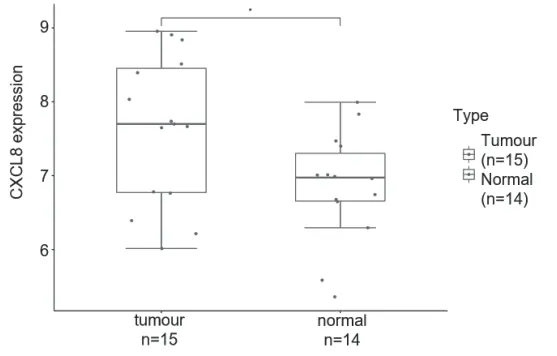
图10 正常组与CML患者组CXCL8表达差异
3.9 ELISA
根据核心靶点筛选结果,CXCL8的连接度值最高,因此采用ELISA验证PAE对K562细胞中CXCL8含量的影响,结果见图11。与正常组比较,药物干预组CXCL8(IL-8)蛋白表达量显著下降,并呈浓度依赖趋势。
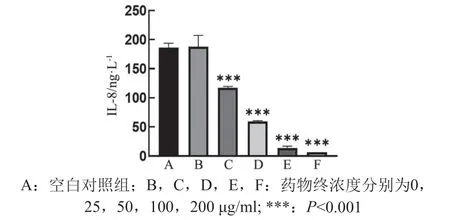
图11 PAE对IL-8蛋白表达量的影响
3.10 Western blot
采用Western blot验证PAE对K562细胞中CXCL8(IL-8)含量的影响,结果见图12。与正常组比较,药物干预组CXCL8蛋白表达量显著下降且呈浓度依赖趋势,与ELISA结果一致。

图12 PAE对IL-8蛋白表达量的影响
4 讨论
网络药理学是以系统生物学和多向药理学为基础的研究方法。通过构建药物-靶点-疾病多层次相互作用网络[19],研究药物和疾病的共同靶点及其生物活性和信号通路。本研究通过PPI网络分析PAE抗CML潜在靶点共涉及CXCL8、NR3C1、ESR1、CRP、REN、TXN、AR、NFKB1、RHOA、NR3C2等14个核心靶点,对其进行GO及KEGG生物通路富集分析主要涉及类固醇激素的反应(response to steroid hormone)、激素介导的信号通路(hormone-mediated signaling pathway)及趋化因子信号通路(chemokine signaling pathway)等。此外,生信分析结果表明CXCL8在CML患者和健康人群之间有显著差异表达。
CXCL8与其受体(CXCR1/2)结合,激活多种信号通路,通过促进肿瘤细胞增殖、上皮-间质转化促血管生成、抑制抗肿瘤免疫和影响肿瘤微环境成分[20]促进肿瘤进展。本文研究结果表明PAE能显著降低CXCL8在慢性粒细胞白血病K562细胞中的表达,且作用呈浓度依赖性,表明PAE可通过调控CXCL8抑制K562细胞的生长,改善慢性粒细胞白血病的发生与发展。
综上,本研究运用分子对接和生物信息学分析初步验证网络药理学筛选出的最有潜力的靶点CXCL8,并通过实验验证CXCL8可能是PAE治疗CML过程中的重要靶点。这为PAE抗CML提供了新的思路,也为天然小分子抗肿瘤药物的研究与开发提供理论依据。
