支链氨基酸与心血管疾病的研究进展
2023-05-10史文轲谢赛阳邓伟
史文轲 谢赛阳 邓伟
(武汉大学人民医院心血管内科 代谢与相关慢病湖北省重点实验室,湖北 武汉 430000)
1 支链氨基酸概述
支链氨基酸(branched-chain amino acid,BCAA)是机体中一类必需氨基酸,包括缬氨酸、亮氨酸和异亮氨酸,在人体内不能合成,只能从外界食物中获取[1]。BCAA在哺乳动物营养物质中含量丰富,分别占肌肉蛋白质必需氨基酸的35%和总氨基酸的21%[2]。BCAA在机体生命活动和维持正常生长发育方面起着重要的作用,在机体内发挥重要的生理功能,可以直接或间接地影响机体内各种组织器官的代谢过程。
BCAA作为一大营养素,主要在肝脏、肌肉、心脏和大脑中被分解代谢。BCAA的完全分解代谢需要多种酶的参与,其中大多数反应发生在线粒体中。在生物化学角度BCAA代谢步骤如下:所有三种BCAA首先经过支链氨基转移酶(branched-chain amino acid transaminase,BCAT),包括BCAT1和BCAT2的转氨基作用,形成各自的支链α-酮酸[3],然后通过线粒体支链α-酮酸脱氢酶(branched-chain α-keto acid dehydrogenase,BCKDH)复合物进行不可逆的氧化脱羧,释放CO2,并将辅酶A基团共价添加到氧化的支链α-酮酸(branched-chain α-ketoacids,BCKA)产物中[4],同时将所有中间代谢物(除外3-HIB——缬氨酸分解代谢途径中的3-羟基异丁酸[5])截留在线粒体内。 随后BCAA代谢产物进入三羧酸循环被一系列酶反应分解为最终产物(亮氨酸转化为α-酮异氰尿酸酯,缬氨酸转化为α-酮异戊酸酯,异亮氨酸转化为α-酮-β-甲基戊酸酯)。
BCKDH复合物受到磷酸化/去磷酸化的严格调控[6-7]。这一通量控制步骤是一个关键的调节点:营养、运动和激素可以通过BCKDH激酶调节BCAA代谢,该激酶磷酸化BCKDH(BCKDHA)的e1亚基以抑制其活性[8],相反,蛋白磷酸酶1K去除这种磷酸化以促进BCKDH活性,进而调控体内BCAA的代谢[9]。 既往研究表明,BCAA(特别是亮氨酸[10])是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的激活剂[11],可引起下游通路4E结合蛋白1和 p70核糖体蛋白S6激酶磷酸化,促进转录翻译过程,增加细胞内蛋白质的合成[12],升高的BCAA浓度也会使氧化应激增加[13]。BCAA酮酸脱氢酶激酶抑制剂和雷帕霉素通过干扰 mTOR 信号通路可有效缓解BCAA代谢紊乱[14]。总的来说,BCAA参与脂肪酸代谢、葡萄糖运输、蛋白质合成、氧化应激等过程。
2 BCAA与心血管疾病
2.1 BCAA与心力衰竭
Sun等[15]通过对压力负荷诱发的小鼠心力衰竭进行转录组学和代谢组学分析发现,BCAA分解代谢缺陷对心力衰竭有重要的影响。对衰竭心脏中下调基因的分析显示,有超过20种特定的代谢途径显著富集,其中缬氨酸、亮氨酸和异亮氨酸分解代谢途径与心力衰竭相关的变化最为显著,且独立于高血压、血脂异常和体重指数等因素,这表明BCAA的代谢异常是心力衰竭的心脏代谢中最明显的变化。心脏具有代谢灵活性,心肌BCAA水平的升高一方面会减少衰竭心脏中的葡萄糖氧化,损害心脏丙酮酸脱氢酶复合物活性,加重心脏的衰竭;另一方面是BCAA,而不是BCKA,通过激活mTOR并以 mTOR依赖性方式加重衰竭心脏的肥大和功能障碍[16]。此外,还有分子和遗传学证据表明,BCAA分解通路的协同抑制受转录因子Krüppel-like factor15(KLF15)调控[17-18],KLF15对心脏具有保护作用[19],抑制KLF15会使BCAA氧化分解障碍,导致BCAA的积累,加重心功能障碍。而增强BCAA的代谢氧化和/或降低循环BCAA水平则可以改善心功能[20]。另有临床试验[21]收集300例射血分数降低的心力衰竭患者的血浆进行代谢物质谱分析,发现数种血浆代谢物因子与心力衰竭相关,其中就包括BCAA。
以上结果表明,BCAA与心力衰竭关系逐步加深,BCAA的分解代谢缺陷参与了心力衰竭的形成以及疾病发展过程,监测血浆BCAA的水平为以后心力衰竭的诊断和预后提供了可能。
2.2 BCAA与急性心肌梗死发生和预后
血管新生和心肌细胞凋亡影响心肌梗死预后[22],心肌梗死后血管新生可以明显改善心肌细胞的缺氧环境,减少心肌梗死后心力衰竭的发生。Du等[23]通过研究证明高水平的BCAA导致血管内皮细胞增殖能力减弱、内皮细胞功能障碍,从而影响了心肌梗死后血管新生,最终导致心肌梗死预后不良。Shah 等[24]证明 BCAA与冠状动脉疾病和心肌梗死的存在呈正相关且独立相关。Fan等[25]表明血浆亮氨酸水平在急性心肌梗死中上调。还有临床研究[23]表明血浆 BCAA 水平升高与ST段抬高心肌梗死和急性心力衰竭患者的长期心血管不良事件有关,并显著提高了脑利尿钠肽和全球急性冠状动脉事件登记(GRACE)评分的预测价值。BCAA代谢紊乱可能是与心肌梗死后临床结果相关的病理生理机制的一个新方面。Wang 等[26]发现了两种有效的策略来阻断破坏的 BCAA:(1)通过使用支链酮酸脱氢酶激酶抑制剂改善心脏BCAA分解代谢缺陷;(2)通过雷帕霉素治疗中断心肌mTOR信号转导。这为医生利用BCAA代谢和靶点治疗心肌梗死和改善预后提供了可能。
2.3 BCAA与心肌缺血再灌注损伤
在心肌缺血再灌注过程中,短期使用BCAA可缩小梗死面积并发挥心脏保护作用[27],机制为BCAA通过增加丙酮酸脱氢酶复合物活性来增加线粒体丙酮酸利用,加上己糖胺生物合成途径的激活提高了蛋白O-GlcNAc修饰[28],导致葡萄糖氧化显著增强,此外还可通过增加亮氨酸的氧化,维持组织三磷酸腺苷,减少心肌凋亡,使心脏不易受缺血再灌注损伤。相反,长期持续服用BCAA可导致BCAA高浓度聚集,会加重心肌梗死后的心功能障碍和心肌重构,并通过增强糖酵解和脂肪酸氧化进一步增加心肌缺血再灌注损伤的易损性。BCAA一方面通过使活性氧(reactive oxygen species,ROS)产生显著增加,超氧化物歧化酶活性显著降低来增加心脏氧化应激[29];另一方面激活AMPK-ULK1通路,增加ULK1磷酸化[30],增强心肌组织的自噬[31-32],最终加重心功能的损伤。综上,BCAA 触发了时间依赖性效应,急性给药具有潜在的益处,而长期暴露对心脏功能有害。
2.4 BCAA与心律失常
早期研究[33]表明短期升高的L-亮氨酸和 L-缬氨酸水平可减轻心律失常并降低其影响。而近期研究[34]表明普通人群长期升高的血浆BCAA水平与心电图传导、复极化指标呈正相关,这一结论数据源自德国环境健康研究中心KORA F4队列研究的2 304例参试者。长期升高的BCAA水平可致心律失常:间接、直接致心律失常效应以及额外途径。BCAA水平升高的间接致心律失常效应是由mTOR通路激活介导的。这种间接致心律失常效应在随后的人源心肌细胞的研究中进一步得到证实[34]。
Portero等[34]通过详细的电生理学研究揭示了受影响小鼠的一个稳定的致心律失常表型,具体表现为QT、QTc和PR间期明显延长及离体心脏下房室传导时间的显著增加和钙稳态失调,可直接诱导钙失调和心律失常事件。
BCAA也被证明可以独立于mTOR之外调节AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)[30],BCAA水平升高可降低AMPK活性、减少AMPKα 磷酸化[35-36],而AMPK在心肌细胞中是一种代谢传感器,能直接调节肌膜离子通道和转运体,这为心律失常提供一个额外的途径。BCAA代谢水平的失调与心律失常的产生和诱发有着较强的因果关系,这可能为心律失常的治疗及预防提供了一个新的研究方向。
2.5 BCAA与糖尿病心肌病
目前认为糖尿病心肌病患者的心脏功能异常是由多种机制引起的,包括糖化终产物的过量产生[37]、己糖胺生物合成途径的激活[38]、脂毒性、线粒体功能障碍[39]及氧化应激增加[40]。BCAA的异常代谢会促进人体胰岛素抵抗。相反,胰岛素抵抗也可能促进BCAA积累,导致恶性循环[41]。有临床研究[42]表明降低 BCAA 水平可以改善葡萄糖耐量,而机制研究表明BCAA可能通过激活 mTORC1反馈抑制胰岛素信号通路,从而促进胰岛素抵抗的发生。BCAA(特别是亮氨酸)导致mTOR通路激活,还可能使异常脂质积累,产生脂毒性[43]。BCAA浓度升高增加ROS产生,超氧化物歧化酶活性也降低,增加心脏氧化应激。BCAA 协同激活炎症信号可能会干扰线粒体生物合成和能量代谢,线粒体功能障碍和炎症可进一步导致 BCAA 的积累,加重线粒体损伤[44]。虽然越来越多的动物和人群试验表明,血浆BCAA浓度的上升与胰岛素抵抗紧密相关,但仍有许多基础研究表示BCAA有益于健康,例如:BCAA增加了中年小鼠原代心脏中的线粒体生物合成和SIRT1表达(SIRT1,sirtuin家族的成员,与寿命延长、线粒体生物合成增加以及ROS的产生减少有关)。电子显微镜分析证实,补充BCAA后,小鼠心脏的线粒体质量增加[45]。这些因果矛盾的代谢结果背后的机制仍不明确,可能与疾病的阶段及BCAA的浓度相关联,这在很大程度上反映了对整个系统关于BCAA代谢的处理的理解仍然有限。BCAA在代谢系统中的功能可能是多因素多方位综合作用的结果,还需要更多的深入研究。
2.6 BCAA与高血压
高血压是一种多因素疾病,广泛涉及遗传、环境、神经内分泌等因素[46]。最近的一些流行病学研究调查了BCAA与高血压的关系,但公布的数据显示出了差异和不一致的结果。有研究者发现BCAA与高血压呈一致的正相关。Yang等[47]观察到个体血清BCAA与舒张压显著正相关,而血清缬氨酸与收缩压显著正相关。Siomkajo等[48]发现血浆BCAA与收缩压和舒张压之间存在显著的正相关。Mahbub等[49]也为高浓度BCAA与高血压之间存在关系提供了依据。这些大量的证据表明高浓度的BCAA可诱导ROS产生和线粒体功能障碍[50],这被认为与高血压的发病机制有关。此外还有报道称循环BCAA通过核转录因子-κB诱导促炎症反应,导致细胞间黏附分子-1和E选择素释放,有助于高血压的发展[51]。也有与之相矛盾的结果,在一项中国人群的横断面研究[51]中,BCAA水平与收缩压和舒张压没有相关性。虽有一定的矛盾性,但显示存在关联性的结果居多,而且BCAA水平的改变对细胞信号、基因表达和神经内分泌功能有着深远的影响,这都与高血压相关联。这表明BCAA作为高血压相关可获得的生物标志物的应用前景,并为降低血浆BCAA水平在高血压预防和管理中的干预提供了新的路径。
3 小结与展望
综上所述,BCAA的代谢在心血管疾病中发挥作用,见图1。BCAA的代谢障碍与心血管疾病的高风险密切相关。因此,验证BCAA在心血管疾病中的作用和探究其分子生物学机制显得尤为重要。从19世纪中期发现BCAA以来,它一直是被研究的主题,以往关于BCAA的研究主要集中在营养和能量代谢等方面,而今对于BCAA在心血管方面的研究有了新的发现,新的治疗策略有赖于对新事物的发现及对传统事物的新认识。目前BCAA在心血管方面的研究仍然较少,相信在可预见的未来,了解BCAA代谢改变影响心血管疾病的机制及其对疾病病理生理学的贡献将使研究人员忙碌起来。
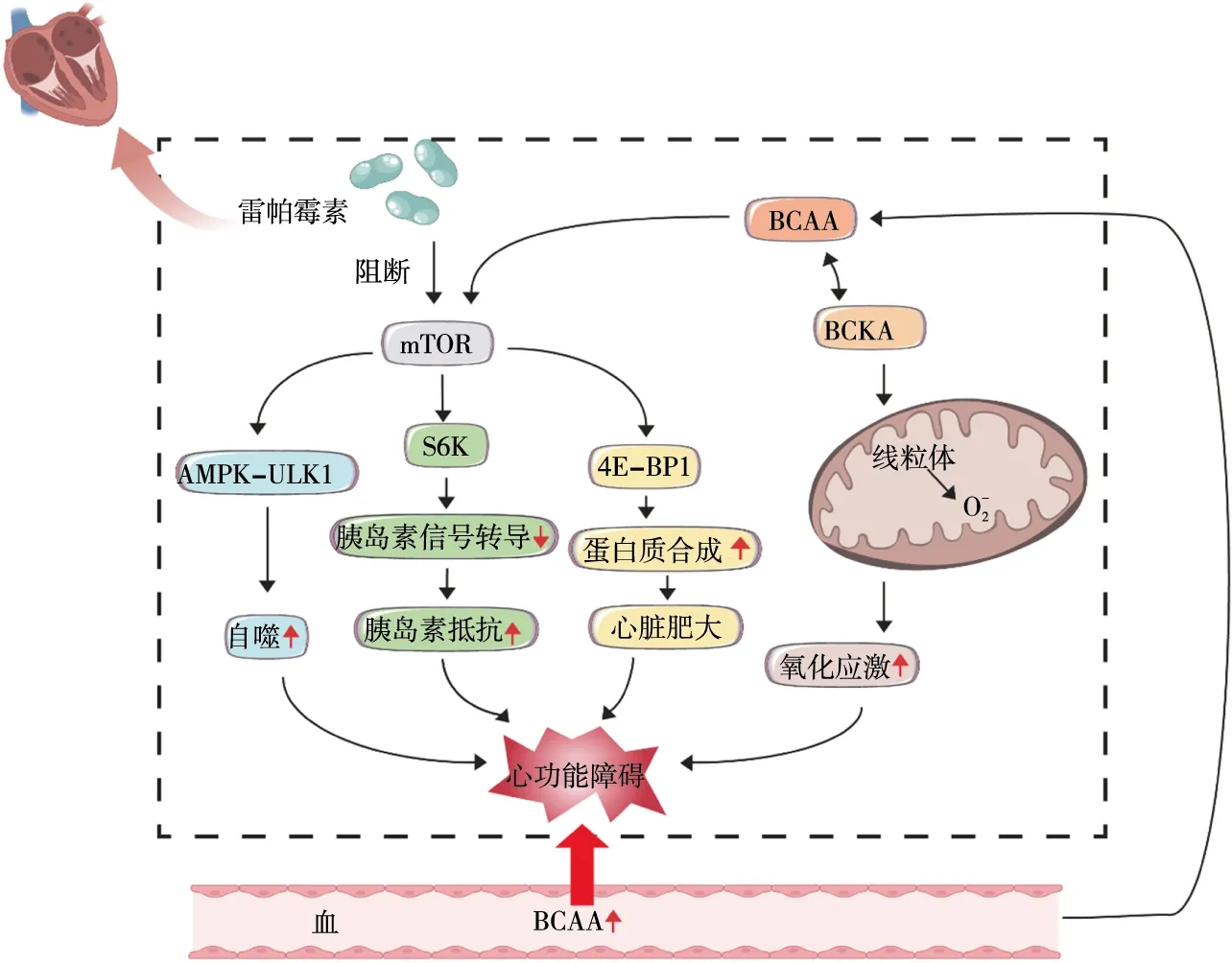
注:AMPK-ULK1,腺苷酸活化蛋白激酶-unc-51样自噬激活激酶1通路;S6K,核糖体蛋白 S6 激酶,介导的胰岛素受体底物1的丝氨酸磷酸化促进胰岛素抵抗;4E-BP1,4E结合蛋白1。
