跑台运动对T2DM小鼠海马Aβ及PI3K/AKT/IDE通路的影响
2023-05-09李忠堂张宪亮崔莉莉
李忠堂 张宪亮 崔莉莉
跑台运动对T2DM小鼠海马Aβ及PI3K/AKT/IDE通路的影响
李忠堂1张宪亮2崔莉莉1
(1.江苏第二师范学院 体育学院, 江苏 南京 211200;2.山东大学体育学院, 山东 济南 250061)
【目的】探讨跑台运动对T2DM小鼠海马Aβ含量及PI3K/AKT/IDE通路的影响。【方法】8周高脂膳食联合STZ注射造T2DM小鼠模型,造模成功后随机分为对照组(C)、T2DM对照组(TC)和T2DM运动组(TE),TE进行8周跑台运动。第1周进行适应性训练,第2~8周进行正式运动(速度为0.8 km/h,每天50 min,每周6天)。运动后取海马,用RT-PCR和Westernblotting检测小鼠海马内PI3K、AKT、IDE的mRNA和蛋白表达水平,用Elisa检测小鼠海马内Aβ42含量。【结果】与C组比较,TC组小鼠Aβ42含量极显著增多(<0.01),PI3K、IDE的mRNA(<0.05),PI3K、AKT、IDE的蛋白表达水平显著降低(<0.05);与TC组比较,TE组小鼠海马内Aβ42含量显著降低(<0.05),PI3K的mRNA显著增多(<0.05),PI3K、AKT、IDE的蛋白表达水平显著增多(<0.05)。【结论】跑台运动激活了PI3K/AKT通路,增加了IDE蛋白表达,抑制了T2DM小鼠海马内Aβ沉积。
跑台运动;2型糖尿病;PI3K/AKT通路;胰岛素降解酶;β-淀粉样蛋白
阿尔茨海默病(Alzheimer’s disease,AD)是一种渐进性神经退行性疾病,以Aβ沉积、神经纤维缠结、神经元丢失和突触障碍为主要病理特征。越来越多的证据表明,肥胖、糖尿病等是AD的主要危险因素。研究发现糖尿病晚期患者患AD的风险是未患糖尿病老年人的2倍[1]。虽然说AD的发病机制复杂,但是胰岛素抵抗(insulin resistance,IR)是其最常见的诊断因素[2]。另外,有研究发现,外周的IR可导致神经系统紊乱、损害认知功能[3]。
研究证实,长期暴露于高胰岛素血症环境可导致神经退行性变化,认知功能降低[4]。此外,外周组织长期的IR可能导致脑IR,抑制脑胰岛素摄入,加剧脑内Aβ42集聚[5]。进一步研究发现,胰岛素与胰岛素受体结合,可启动一系列级联反应,如启动PI3K/AKT通路[6]。特异性敲除胰岛素受体基因可抑制神经元胰岛素信号诱导AD,其机制可能与AKT与GSK3磷酸化异常有关[7]。此外,IDE是PI3K/AKT下游靶基因,其与Aβ结合可促进Aβ降解,减少脑内 Aβ含量[8]。
运动作为一种积极有效的干预方式,可以有效缓解AD认知功能下降,抑制Aβ沉积。人体实验也证实运动可以增强糖尿病和AD患者认知功能,提高其胰岛素敏感性,同时减少血液内Aβ含量[9]。但是,目前大多数有关运动对糖尿病的研究均为人体研究,部分动物实验仅研究了运动对糖尿病大鼠认知功能的积极效应,其具体的分子机制还不清楚[10, 11]。
因此,本实验拟通过高脂膳食结合STZ注射建立2型糖尿病(type 2 diabetes mellitus,T2DM)小鼠模型,随后进行8周跑台运动干预,以PI3K/AKT/IDE作为作用靶点,探讨运动对T2DM小鼠脑内Aβ的影响。
1 材料与方法
1.1 实验动物与造模
30只6周龄雄性C57BL/6小鼠(上海西普尔-必凯公司),体重19 g左右,适应性饲养1周,随机分为正常对照组(10只,标准饲料喂养)和T2DM组(20只,高脂饲料喂养。每100 g饲料含14 g蔗糖,16.9 g猪油,10.2 g酪蛋白,2.2 g麦芽糊精, 2.1 g预混料,54.6 g繁殖鼠料),自由饮水,自然光照。实验过程严格遵守《实验动物伦理委员会章程》和《实验动物管理委员会章程》。
按照先前研究[12]描述进行T2DM造模。6周高脂膳食喂养后,T2DM组按80 mg/kg体重注射1%STZ;正常对照组按80 mg/kg体重等剂量注射柠檬酸-柠檬酸钠溶液。注射2周后,空腹12 h,血糖仪检测小鼠空腹血糖水平,血糖浓度高于8 mmol/L时,造模成功,即为T2DM小鼠,造模成功率为93.1%。
1.2 动物分组与运动方案
将T2DM小鼠随机分为T2DM对照组(TC,=6)和T2DM运动组(TE,=6),同时选取6只正常对照组小鼠作为对照组(C,=6)。TE组进行有氧跑台运动,C组和TC组小鼠安静饲养。具体运动方案为:第1周:第1-2天每天运动30 min,第3-4天每天运动 40min,第5-6天每天运动50 min,第2周-第8周每天固定运动50 min;每周运动6天,周日休息,运动速度为0.8 km/h。运动干预期间C组继续用普通饲料饲养,TC组和TE组继续用高脂饲料喂养。
1.3 取材
8周运动结束后24 h,断颈椎处死,打开颅顶,分离双侧海马,-80℃冰箱保存,用于RT-PCR、Western blotting、Elisa等相关指标检测。
1.4 RT-PCR
Trizol法提取适量海马组织总RNA,检测OD260/OD280,介于1.80-2.00之间者进行反转录。37 ℃,15 min,98 ℃,5 min逆转录得到稳定的cDNA(20μl体系)。据RT-PCR试剂盒(TOYOBO):加入SYBR green PCR MasterMix,10μL;cDNA, 2μL;ROX,0.4μL;上、下游引物各0.04μL;补充dH2O至20 μL。PI3K:上游引物:5’-CAT TGA CCT ACA CCT GGGGG -3’,下游引物:5’- TCC TGG AAA GTC TCC CCTCT -3’;AKT:上游引物:5’-TCC GAG GAT GCC AAG GAGAT -3’,下游引物:5’-TAG GAG AAC TTG ATC AGG CGG -3’;IDE:上游引物:5’-CAA TAC ATT CAG AAG CTA CGTG -3’,下游引物:5’-CAG GGT ATG GTG TTG CAT CTT -3’; GAPDH上游引物:5’-ATG GTG AAG GTC GGT GTG-3’,下游引物:5’- AAC TTG CCG TGG GTA GAG -3’。预变性95 ℃,60 s;以95 ℃,15 s;60 ℃,30 s;72 ℃,45 s为一循环,扩增45个循环,72 ℃延伸5 min。60 ℃-95 ℃,每升高1 ℃收集一次荧光,制作溶解曲线。记录Ct值,据2-△△Ct法计算相对表达量。
1.5 Western blotting
取适量海马组织,RIPA裂解液(加入蛋白酶-磷酸酶抑制剂)裂解,匀浆仪匀浆3次,静置20 min后4 ℃12000 g离心20 min,取上清液即为总蛋白。BCA法检测蛋白浓度(碧云天),并加入相同体积 2×溴酚蓝Loading buffer,95 ℃,10 min,蛋白变性。计算蛋白上样量,上样,80 V恒压电泳将蛋白压缩至1条线,120 V恒压跑胶。100 V恒压转膜90 min,牛奶封闭2 h。一抗(PI3K,兔抗,1:1000,cst3811;Akt,兔抗,1:1000,cst9272;IDE,兔抗, 1:1000,ab133561;GAPDH,兔抗,1:5000,Goodhere)4 ℃孵育过夜,二抗(HRP标记的山羊抗兔,Jackson 111-035-003)室温孵育2 h,ECL显影,Alpha凝胶成像,FluorChem FC2数据分析。
1.6 Elisa
根据Aβ42试剂盒,取适量海马组织,加入PBS,匀浆仪匀浆,4 ℃3000 g离心20 min,取上清液。酶标板分别设置空白孔、标准孔和样品孔,标准孔依次加入7.5μg/L、15μg/L、30μg/L、60μg/L、120μg/L标准品50μL;样品孔加入样品50μL(稀释液4:1比例稀释)。封膜,37 ℃水浴锅孵育30 min,洗涤液洗涤5次。加入显色剂,37 ℃水浴锅孵育 10 min,加入终止液终止显色。450 nm波长检测OD值,据标准品浓度和OD值计算标准曲线,根据标准曲线计算样品浓度。
1.7 数据处理
Excel录入数据,SPSS17.0处理数据,GraphPad5.0作图。数据使用平均数±标准差表示,数据统计使用单因素方差分析,<0.05表示显著性差异,<0.01表示极显著性差异。
2 结果
2.1 各组小鼠海马Aβ42含量
Aβ42在脑内集聚可诱导氧化应激、炎症反应以及细胞凋亡等,引起细胞毒性,诱发AD。本实验通过Elisa检测了各组小鼠海马Aβ42含量,结果如图1所示。与C组比较,TC组小鼠海马Aβ42含量极显著增加(<0.01);与TC组比较,TE组小鼠海马Aβ42显著下降(<0.05)。
2.2 各组小鼠海马IDE基因表达水平
Aβ异常沉积是由Aβ生成增多或清除减少所致。而在散发性AD中,Aβ含量的增加多是由Aβ清除减少所致。IDE可通过与Aβ结合,促进其降解来清除Aβ。因此本实验通过RT-PCR和Westernblotting检测海马内IDE的mRNA表达水平和蛋白表达水平,结果如图2所示。与C组比较,TC组IDE的mRNA水平和蛋白表达水平均显著下降(<0.05);与TC组比较,TE组海马内IDE的蛋白表达水平显著增加(<0.05)。
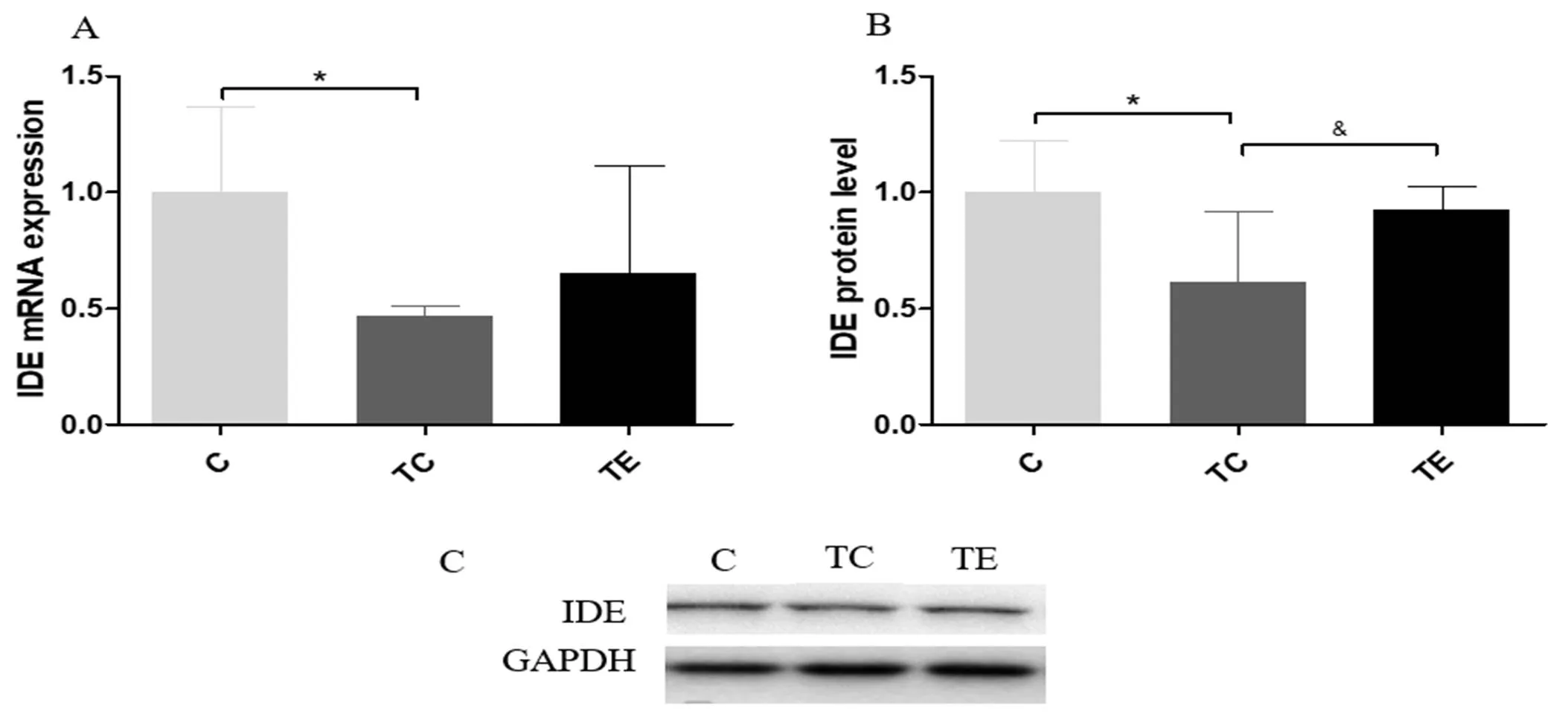
注:A:IDE mRNA表达水平;B:IDE蛋白表达水平;C:IDE蛋白条带图。与C组比较,*表示P<0.05;与TC组比较,&表示P<0.05。
2.3 各组小鼠海马PI3K、AKT基因表达水平
IDE是PI3K/AKT信号通路的下游靶蛋白,T2DM中PI3K/AKT通路异常可能是IDE减少的机制之一。因此,本实验通过RT-PCR和Westernblotting检测了小鼠海马内PI3K和AKT的mRNA水平和蛋白表达水平,结果如图3所示。与C组比较,TC组小鼠海马内PI3K的mRNA和蛋白表达水平均显著降低(<0.05),AKT的蛋白表达水平显著降低(<0.05);与TC组比较,TE组小鼠海马内PI3K的mRNA水平极显著增加(<0.01),PI3K的蛋白表达水平和AKT的蛋白表达水平显著增加(<0.05)。
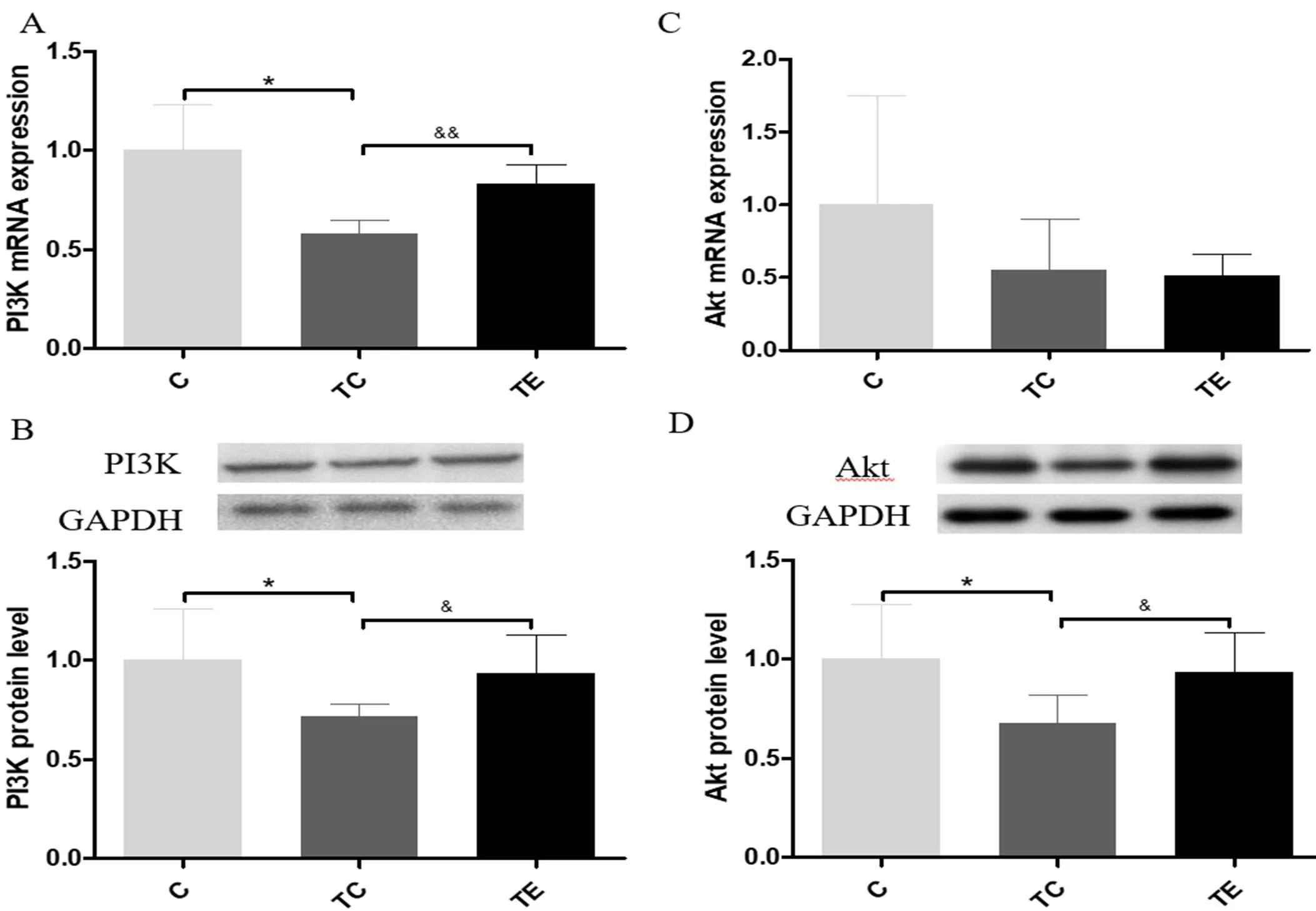
注:A:PI3K mRNA表达水平;B:PI3K蛋白表达水平;C:AktmRNA表达水平;D:Akt蛋白表达水平。与C组比较,*表示P<0.05;与TC组比较,&表示P<0.05,&&表示P<0.01
3 分析讨论
先前研究证实,长期高脂膳食联合STZ造T2DM小鼠模型认知功能显著下降,而且运动可以缓解T2DM小鼠认知功能的下降,但是其分子机制还不清楚[13]。近来有研究发现,T2DM小鼠认知功能的下降与脑内Aβ含量增加有关[14],且 T2DM小鼠脑内Aβ含量增加伴随有 PI3K、AKT、IDE等蛋白表达的降低[15, 16]。但是目前并无运动对T2DM小鼠海马内Aβ及PI3K/AKT/IDE通路影响的研究。本实验发现跑台运动通过激活PI3K/AKT通路,增加IDE蛋白表达,减少Aβ42含量。
3.1 跑台运动对T2DM小鼠海马Aβ42含量的影响
临床前期和临床证据表明糖尿病是AD的主要风险因素。代谢障碍、炎症和IR可能是两种疾病的共病机制[17]。IR可以加剧Aβ42/40以及tau蛋白表达增加,同时AD模型中也表现出IR[18]。本实验发现在8周高脂膳食联合STZ注射诱导的T2DM小鼠模型海马内Aβ42含量增加。Tang等[14]发现T2DM大鼠海马内Aβ水平显著增多,另外,Busquests等[19]也发现高脂膳食可以增加C57BL/6小鼠Aβ沉积。以上实验结果与本实验一致,提示T2DM小鼠海马内Aβ增多。但是有研究将db/db糖尿病小鼠与APP/PS1转基因AD小鼠杂交得到患糖尿病的AD小鼠,令人惊奇的是,与AD小鼠比较,糖尿病AD小鼠认知功能下降,但皮层内Aβ并没有显著增多,提示糖尿病增加了AD认知功能的下降,但这似乎并不依赖于Aβ沉积的增多[20]。结果与本实验结果不一致,原因可能是Niedowicz等选用的糖尿病小鼠模型与本实验小鼠模型不同。
另外,本实验发现跑台运动可以抑制T2DM小鼠海马内Aβ42含量的增加。目前研究证实,运动可以抑制糖尿病认知功能下降,其机制与细胞增殖[21]、炎症反应[22]、以及wnt3/GSK-3β通路[23]有关,但是目前并无运动对T2DM小鼠海马Aβ沉积影响的研究。因此,本实验通过Elisa检测了小鼠海马内 Aβ42的含量,提示运动可以抑制T2DM小鼠海马内 Aβ42含量,推测其可能是运动缓解T2DM小鼠认知能力的原因,但是本研究并没有检测小鼠空间记忆能力。另外,有实验发现,游泳运动并没有减少四氧嘧啶(Alloxan,ALX)诱导的糖尿病大鼠海马内Aβ蛋白表达水平[24]。该结果与本实验不一致,对比分析发现,两个实验在动物模型、运动模式、以及检测方法的选择上均不一致,这可能是导致结果不同的原因之一。
3.2 跑台运动对T2DM小鼠海马IDE的影响
IDE是一种高度保守的Zn2+-依赖的内肽酶,可以降解胰岛素并调节周围的胰岛素水平,是脑内 Aβ降解的关键酶之一[25]。基因敲除IDE可增加血浆Aβ42水平,增加AD发病风险[26]。研究发现在T2DM大鼠脑内IDE低表达,Aβ42含量增多[18]。此外,STZ诱导的T2DM动物海马和皮层内IDE水平下降,Aβ水平增多[27]。本实验也发现,T2DM海马内IDE蛋白表达水平和mRNA表达水平均出现显著性下降,提示T2DM海马IDE蛋白表达降低的原因可能与基因转录降低有关。本实验中,跑台运动增加了IDE的蛋白表达,降低了Aβ42含量,提示跑台运动抑制Aβ42增加的机制与IDE蛋白表达增多有关。目前多数研究仅探讨了高脂膳食、STZ等诱导的糖尿病模型脑内IDE蛋白及Aβ含量的变化,有关运动对糖尿病海马内IDE影响的研究并不多见,仅有Kim等[28]发现运动可以增加GK糖尿病大鼠肝脏内IDE表达。但是该实验并没有检测糖尿病大鼠脑内IDE的表达水平,因此本实验首次发现跑台运动可能通过增加IDE蛋白表达,降低T2DM小鼠海马内Aβ42含量。
3.3 跑台运动对T2DM小鼠海马PI3K/AKT信号通路的影响
本实验发现跑台运动可以通过增加IDE蛋白表达,减少T2DM小鼠海马内Aβ42含量,但是IDE上游通路并不清楚。T2DM主要表现是胰岛素抵抗,外周胰岛素主要通过PI3K/AKT信号通路介导糖代谢,该通路异常导致胰岛素抵抗,诱导T2DM。在中枢神经系统内,胰岛素也可以通过PI3K/AKT通路调控神经细胞功能。正常情况下,胰岛素可通过PI3K/AKT通路抑制GSK-3α活性,从而减少Aβ沉积。因此本实验同时检测了PI3K/AKT信号通路的影响,结果发现T2DM小鼠海马内PI3K和AKT的蛋白表达水平显著降低,而跑台运动可以增加PI3K和AKT的蛋白表达水平。先前研究证实,T2DM脑内PI3K和Akt的蛋白水平和磷酸化水平被抑制,提示T2DM可以抑制PI3K/Akt通路的激活[29]。Xu等[30]研究也发现STZ诱导的T2DM小鼠脑内PI3K、Akt活性被抑制。以上研究结果与本实验基本一致。而有关运动对T2DM动物PI3K/Akt通路的影响主要集中于肌肉等其他组织中,如Cheng等[31]发现运动可以激活T2DM心肌内PI3K/AKT通路。Cao等[32]发现运动激活了T2DM骨骼肌内的PI3K/AKT通路。而仅有Kim等[28]通过STZ造模T2DM大鼠,并采用跑台运动进行干预,发现跑台运动可以增加T2DM大鼠脑内p-PI3K/PI3K的比率以及p-AKT/AKT的比率,提示跑台运动激活了T2DM大鼠脑内PI3K/AKT通路。IDE是PI3K/AKT通路下游靶基因,因此推测运动可以通过激活PI3K/AKT通路增加海马内的IDE表达水平。
4 结论
T2DM小鼠海马内PI3K/AKT通路被抑制,IDE蛋白表达下降,Aβ含量增加;而8周有氧跑台运动可以激活PI3K/AKT通路,增加IDE蛋白表达,抑制T2DM小鼠Aβ含量增加。
[1]TODA N, AYAJIKI K, OKAMURA T. Obesity-induced cerebral hypoperfusion derived from endothelial dysfunction: one of the risk factors for Alzheimer's disease[J]. Curr Alzheimer Res,2014,11(8):733-744.
[2]CRAFT S. Insulin resistance syndrome and Alzheimer disease: pathophysiologic mechanisms and therapeutic implications[J].Alzheimer Dis Assoc Disord,2006, 20(4):298-301.
[3]WANG F, SONG Y F, YIN J, et al. Spatial memory impairment is associated with hippocampal insulin signals in ovariectomized rats[J]. PLoS One,2014,9(8): 104450.
[4]GRASSO G, MIELCZAREK P, NIEDZIOLKA M, et al. Metabolism of cryptic peptides derived from neuropeptide FF precursors: the involvement of insulin-degrading enzyme[J]. Int J Mol Sci,2014,15(9): 16787-16799.
[5]PARK S A. A common pathogenic mechanism linking type-2 diabetes and Alzheimer's disease: evidence from animal models[J]. J Clin Neurol,2011,7(1):10-18.
[6]BAKER L D, CROSS D J, MINOSHIMA S, et al. Insulin resistance and Alzheimer-like reductions in regional cerebral glucose metabolism for cognitively normal adults with prediabetes or early type 2 diabetes[J]. Arch neurol,2011,68(1):51-57.
[7]SCHUBERT M, GAUTAM D, SURJO D, et al. Role for neuronal insulin resistance in neurodegenerative diseases[J]. Proc Natl Acad Sci U S A,2004,101(9): 3100-3105.
[8]YIN K, JIN J, ZHU X, et al. Cart modulates beta-amyloid metabolism-associated enzymes and attenuates memory deficits in APP/PS1 mice[J]. Neurol Res,2017,39(10):885-894.
[9]BAKER L D, FRANK L L, FOSTER-SCHUBERT K, et al. Aerobic exercise improves cognition for older adults with glucose intolerance, a risk factor for Alzheimer's disease[J]. J Alzheimers Dis,2010,22(2): 569-579.
[10]KIM D Y, JUNG S Y, KIM K, et al. Treadmill exercise ameliorates Alzheimer disease-associated memory loss through the signaling pathway in the streptozotocin-induced diabetic rats[J]. J Exerc Rehabil,2016,12(4):276-283.
[11]DE SENNA P N, BAGATINI P B, GALLAND F, et al. Physical exercise reverses spatial memory deficit and induces hippocampal astrocyte plasticity in diabetic rats[J]. Brain Res,2017(1655):242-251.
[12]STRAPAZZON G, DE TONI L, FORESTA C. Serum undercarboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus[J]. Osteoporos Int,2011, 22(5):1643-1644.
[13]REISI P, ALAEI H, BABRI S, et al. Effects of treadmill running on spatial learning and memory in streptozotocin-induced diabetic rats[J]. Neurosci Lett,2009,455(2):79-83.
[14]TANG Y, YU C, WU J, et al. Lychee seed extract protects against neuronal injury and improves cognitive function in rats with type II diabetes mellitus with cognitive impairment[J]. Int J Mol Med, 2018,41(1):251-263.
[15]BALBAA M, ABDULMALEK S A, KHALIL S. Oxidative stress and expression of insulin signaling proteins in the brain of diabetic rats: role of nigella sativa oil and antidiabetic drugs[J].PLoS one,2017,12(5): e172429.
[16]GAO C, HOLSCHER C, LIU Y, et al. GSK3: a key target for the development of novel treatments for type 2 diabetes mellitus and Alzheimer disease[J]. Rev Neurosci,2011,23(1):1-11.
[17]NAJEM D, BAMJI-MIRZA M, CHANG N, et al. Insulin resistance, neuroinflammation and Alzheimer's disease[J]. Rev Neurosci,2014,25(4):509-525.
[18]YANG S, CHEN Z, CAO M, et al. Pioglitazone ameliorates Abeta42 deposition in rats with diet-induced insulin resistance associated with AKT/GSK3beta activation[J]. Mol Med Rep,2017,15(5): 2588-2594.
[19]BUSQUETS O, ETTCHETO M, PALLAS M, et al. Long-term exposition to a high fat diet favors the appearance of beta-amyloid depositions in the brain of C57BL/6J mice. A potential model of sporadic Alzheimer's disease[J]. Mech Ageing Dev,2017(162):38-45.
[20] NIEDOWICZ D M, REEVES V L, PLATT T L, et al. Obesity and diabetes cause cognitive dysfunction in the absence of accelerated beta-amyloid deposition in a novel murine model of mixed or vascular dementia[J]. Acta Neuropathol Commun,2014(2):64.
[21]KIM Y H, SUNG Y H, LEE H H, et al. Postnatal treadmill exercise alleviates short-term memory impairment by enhancing cell proliferation and suppressing apoptosis in the hippocampus of rat pups born to diabetic rats[J]. J Exerc Rehabil,2014,10(4): 209-217.
[22]SANCHEZ-SARASUA S, MOUSTAFA S, GARCIA-AVILES A, et al. The effect of abscisic acid chronic treatment on neuroinflammatory markers and memory in a rat model of high-fat diet induced neuroinflammation[J].Nutr Metab (Lond),2016(13):73.
[23]KIM D Y, JUNG S Y, KIM K, et al. Treadmill exercise ameliorates Alzheimer disease-associated memory loss through the signaling pathway in the streptozotocin-induced diabetic rats[J]. J Exerc Rehabil,2016,12(4):276-283.
[24]DIEGUES J C, PAULI J R, LUCIANO E, et al. Spatial memory in sedentary and trained diabetic rats: molecular mechanisms[J].Hippocampus,2014,24(6):703-711.
[25]FARRIS W, MANSOURIAN S, CHANG Y, et al. Insulin-degrading enzyme regulates the levels of insulin, amyloid beta-protein, and the beta-amyloid precursor protein intracellular domain in vivo[J]. Proc Natl Acad Sci U S A,2003,100(7):4162-4167.
[26]BERTRAM L, BLACKER D, MULLIN K, et al. Evidence for genetic linkage of Alzheimer's disease to chromosome 10q[J].Science,2000,290(5500):2302-2303.
[27]LIU Y, LIU L, LU S, et al. Impaired amyloid beta-degrading enzymes in brain of streptozotocin-induced diabetic rats[J]. J endocrinol invest,2011,34(1):26-31.
[28]KIM M S, GOO J S, KIM J E, et al. Overexpression of insulin degrading enzyme could greatly contribute to insulin down-regulation induced by short-term swimming exercise[J].Lab Anim Res,2011,27(1):29-36.
[29]LIU Y, LIU F, GRUNDKE-IQBAL I, et al. Deficient brain insulin signalling pathway in Alzheimer's disease and diabetes[J]. J Pathol,2011,225(1): 54-62.
[30]XU Z P, GAN G S, LIU Y M, et al. Adiponectin attenuates streptozotocin-Induced Tau hyperphosphorylation and cognitive deficits by rescuing PI3K/Akt/GSK-3beta pathway[J]. Neurochem Res, 2018,43(2):316-323.
[31]CHENG S M, HO T J, YANG A L, et al. Exercise training enhances cardiac IGFI-R/PI3K/Akt and Bcl-2 family associated pro-survival pathways in streptozotocin-induced diabetic rats[J]. Int J Cardiol,2013,167(2):478-485.
[32]CAO S, LI B, YI X, et al. Effects of exercise on AMPK signaling and downstream components to PI3K in rat with type 2 diabetes[J]. PLoS One,2012,7(12):51709.
Effects of Treadmill Exercise on Aβ and PI3K/AKT/IDE Signaling Pathway on the Hippocampus of T2DM Mice
LI Zhongtang, etal.
(Jiangsu Second Normal Uinversity,Nanjing 211200, Jiangsu, China)
李忠堂(1973—),博士,教授,研究方向:体育教育训练理论与实践、运动人体科学。
