不同浓度龙血竭总黄酮对大鼠MIRI心肌细胞PI3K/AKT通路的影响
2023-05-08周尚刘燕罗文琳黄兰松黄照河
周尚,刘燕,罗文琳,黄兰松,黄照河
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院,广西 百色 533000)
随着社会经济水平、科技的发展,人们饮食习惯的改变,心血管疾病的发病率不断上升,心血管病死亡占我国居民总死亡原因的首位[1]。急性心肌梗死(AMI)是一种严重威胁生命的心血管疾病,由冠状动脉闭塞导致的长期缺血和缺氧损害心脏功能。急性心肌梗死的早期治疗可恢复缺血心肌的血液供应并降低死亡风险,但当中断的心肌供血在一定时间内恢复时,对原有缺血心肌造成更严重的损伤,这被称为心肌缺血再灌注损伤(MIRI)[2-3]。尽管对MIRI的研究已经很久,但是MIRI作为一个重要的临床问题至今没有有效的治疗手段。对MIRI损伤的发生和发展相关的详细分子机制仍未完全阐明。因此,了解MIRI的潜在分子机制并为其预防和治疗制定新的治疗策略至关重要。
龙血竭做为我国传统中药,是龙舌兰科植物剑叶龙血树的乙醇提取物。龙血竭总黄酮(sanguis draconis flavones,SDF)是从龙血竭中提取得到的主要成分,包括黄酮、二氢黄酮、黄烷、查耳酮、二氢查耳酮等多种化合物。研究显示它具有抑制血小板活性和血栓形成,对心肌缺血有改善等作用[4]。大量研究实验证实SDF对MIRI具有保护作用[5-6]。PI3K/AKT信号通路是调节多种细胞功能的重要通路之一,在许多生理过程和病理反应中发挥重要作用,参与调控细胞增殖、细胞周期阻滞、抑制细胞凋亡、调节组织炎症等[7-9]。研究发现,PI3K/AKT信号通路与MIRI密切相关,激活PI3K/AKT信号通路可以减少心脏MIRI[10]。细胞凋亡是由细胞内基因及其产物调节的程序性细胞死亡的一种方式,其中线粒体凋亡通路是细胞凋亡的主要通路。线粒体通路涉及Bcl-2家族的促凋亡成员与线粒体的联合,诱导细胞色素C及其其他细胞凋亡因子释放入细胞质,继而激活Caspase-3导致细胞凋亡[11],Caspase-3是细胞凋亡关键的调控因子[12]。PI3K/AKT通路的活性对MIRI有多种影响,特别是,它对与线粒体相关的I/R损伤具有抗凋亡作用[8],因此,激活PI3K/AKT信号通路已成为减少MIRI的有效策略[13-14]。课题组前期研究表明龙血竭总黄酮可以保护MIRI[15],但其保护作用是否通过激活PI3K/AKT信号通路以减少细胞凋亡尚不清楚。本研究通过建立大鼠MIRI模型,探讨龙血竭总黄酮对大鼠MIRI心肌细胞PI3K/AKT通路的影响,为SDF治疗MIRI提供新的见解,并可能为MIRI治疗提供新的靶点。
1 材料
1.1药材及试剂 SDF由广西中医药研究院提供。用紫外分光光度法测定其中总黄酮含量在70%以上,使用前用0.5%羧甲基纤维素钠溶液配制成浓度分别为9 mg/mL、18 mg/mL、27 mg/mL、36 mg/mL的SDF混悬液备用。56只SD雄性大鼠(6~8周龄,250~350 g)由北京维通利尔动物实验有限公司提供[证书编号:SCXK(粤)2022-0063,广东,中国],可自由获得食物和水,室温保持在20~25℃。本次研究得到了右江民族医学院伦理委员会的批准。苏木素染色液及伊红染色液(长春赛默瑞特科技有限公司);2%TTC染色液(北京雷根生物有限公司);PI3K抗体、AKT抗体、甘油醛-3-磷酸脱氢酶(GAPDH)、羊抗兔IgG-HRP(四川正能生物公司);Caspase-3抗体(英国Abcam公司);RIPA裂解液、蛋白酶抑制混合物、抗体稀释液、电泳液、转膜液、TBST洗膜液、BCA(bicinchoninicacid)蛋白定量试剂盒、超敏ECL化学发光检测试剂盒(中国上海碧云天生物技术公司);硝酸纤维素膜(PVDF)(美国Millpore公司)。
1.2仪器 DW3000型小动物人工呼吸机(上海玉研仪器设备有限公司);小动物心电图机(广州三锐电子科技有限公司);冷冻离心机(上海中康仪器有限公司);显微镜(上海仪圆光学器有限公司);恒温烘箱(日本松下公司);石蜡切片机(美国赛默飞公司);摊片机(美国赛默飞公司);冰冻切片机(美国赛默飞公司);脱水机(美国赛默飞公司);Western blot系统(美国Bio-Rad公司);通用凝胶成像系统(美国通用公司);高通量组织研磨器(宁波新芝生物科技公司);酶标仪(德国珀金埃尔默公司)等。
1.3MIRI大鼠建立模型、分组和处理 大鼠被随机分为7组(每组8只):①Control组;②Sham组;③缺血/再灌注组(I/R组);④龙血竭总黄酮低剂量+缺血再灌注组(SDF-L组);⑤龙血竭总黄酮中剂量+缺血再灌注组(SDF-M组);⑥龙血竭总黄酮高剂量+缺血再灌注组(SDF-H组);⑦龙血竭总黄酮大剂量+缺血再灌注组(SDF-B组)。适应性喂养1周后,龙血竭总黄酮混悬液按低剂量用药组(90 mg/kg)、中剂量用药组(180 mg/kg)、高剂量用药组(270 mg/kg)、大剂量用药组(360 mg/kg)灌胃预处理14 d,Sham组和I/R组给予等体积0.5%羧甲基纤维素钠溶液灌胃14 d,Control组正常喂食。灌满14 d后I/R组及不同剂量龙血竭用药组大鼠开始建立MIRI模型,MIRI模型是根据梁丽梅等[16-17]的研究建立的。简而言之,腹腔注射10%乌拉坦(0.5 mL/100 mg)麻醉大鼠。麻醉后,予气管插管连接小动物呼吸机机械通气后,切开大鼠胸壁,用6-0丝线,结扎冠状动脉左前降支,缺血30 min后,松开绳结进行再灌注2 h。Sham组的小鼠穿针但不结扎冠状动脉左前降支,用药组的大鼠与I/R组的操作相同。心肌缺血再灌注造模成功标准:结扎后,心尖组织发白或呈暗灰色,心电图ST段明显抬高,T波高耸为缺血成功;松开绳结后,心尖缺血区颜色变红,ST回落1/2为再灌注成功。大鼠相关组织取材后立即予放置-80℃冰箱存放。共有56只大鼠进行造模取材,在造模取材过程中,Sham组、SDF-L组大鼠因室颤和其他原因导致死亡4只,剩余52只大鼠。
1.4心电图监测 使用小动物心电图机的电极插入大鼠右上、下肢及左下肢皮下,观察心电图Ⅱ导联。观察并记录大鼠心电图ST段变化。
1.5血清乳酸脱氢酶(LDH)和肌酸激酶同工酶(CK-MB)的测定 将血清于-80 ℃冰箱取出后,4 ℃溶解后适当稀释,按照相应试剂盒说明书严格操作,根据ELISA制造商的说明书测定血清LDH和CK-MB含量。
1.6心肌梗死面积大小测量 三苯基氯化四氮唑(TTC)染色被用来确定大鼠MIRI损伤后的梗塞大小。在MIRI后,大鼠心脏被切除,并切成2 mm的片状。用2%TTC对组织切片进行染色,在37 ℃下避光孵育30 min,期间予多次翻面,达到充分浸润,后用4%多聚甲醛固定,然后检测心肌梗死面积。白色区域表示心肌梗死的大小;红色区域表示非缺血区域。最后,用ImageJ软件计算梗死的大小。
1.7苏木素-伊红(HE)染色检测心肌组织形态学变化 取血后,迅速分离大鼠心脏1/3到2/3的尖部进行石蜡切片。切片经脱水处理后, 用苏木素和伊红进行染色之后,对切片进行脱水、清理、密封。在显微镜下观察心脏病理学改变。
1.8Western Blot检测PI3K、AKT的蛋白含量 大鼠腹主动脉取血后,分离心脏,提取左心室心肌组织总蛋白,BCA法测定蛋白浓度,调整各组蛋白浓度。等量蛋白(30 μg)进行SDS-PAGE凝胶电泳分离,湿法将蛋白转移至PVDF膜上,5%BSA室温封闭2 h,接着加入相应的一抗抗体(稀释比例1∶1000),4 ℃孵育过夜,1×TBST洗膜3次,每次10 min,加入HRP标记的二抗(稀释比例1∶5000)室温孵育2 h。洗膜3次,每次10 min后,在GE凝胶成像系统中采用超敏ECL化学发光液检测蛋白条带,以GAPDH为内参,使用ImageJ软件对目的条带进行灰度分析,以目的蛋白条带灰度值/GAPDH灰度值表示目的蛋白相对表达量。
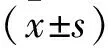
2 结果
2.1大鼠心电图变化情况 冠状动脉结扎前开始连续监测并记录大鼠心电图至再灌注2 h后,观察Ⅱ导联T波和ST段的变化。比较冠脉结扎前后的心电图,结扎后ST段可见弓背向上抬高,再灌注时的ST段逐渐向下回落,最终接近基线水平,说明大鼠心肌缺血再灌注损伤模型建立成功。见图1。

图1 大鼠心电图
2.2龙血竭总黄酮对MIRI大鼠血清LDH和CK-MB含量的影响 与Sham组相比,I/R组、SDF-L组、SDF-M组、SDF-H组及SDF-B组大鼠血清LDH和CK-MB含量显著升高,差异有统计学意义(P<0.01);与I/R组相比,SDF-L组、SDF-M组、SDF-H组及SDF-B组大鼠血清LDH和CK-MB含量显著降低,差异有统计学意义(P<0.01)。见表1。

表1 各组大鼠血清LDH和CK-MB水平的比较 单位:U/L
2.3龙血竭总黄酮对MIRI大鼠心肌梗死面积的影响 Control组与Sham组相比,大鼠心肌梗死面积差异无统计学意义(P>0.05);与Sham组相比,I/R组、SDF-L组、SDF-M组、SDF-H组、SDF-B组大鼠心肌梗死面积显著升高,差异有统计学意义(P<0.05);与I/R组相比,SDF-L组、SDF-M组、SDF-H组、SDF-B组大鼠心肌梗死面积显著减轻,差异有统计学意义(P<0.05);各用药剂量组之间相比,大鼠心肌梗死面积差异无统计学意义(P>0.05)。见图2、图3。

图2 TTC染色法测定各组大鼠心肌梗死范围图

注:与Sham组比较,*P<0.05,与I/R组比较,**P<0.01。
2.4龙血竭总黄酮对MIRI大鼠心肌病理形态学的影响 光镜下观察Control组和Sham组大鼠心脏切片,心肌细胞排列整齐致密,细胞结构完整,边界清晰,心肌纤维排列整齐,未见变性、坏死、炎性细胞浸润,心肌细胞分布有序。相反,I/R组心肌细胞结构不完整,心肌细胞紊乱,细胞变性、坏死和炎症细胞浸润程度明显。SDF-L组心肌纤维排列紊乱,细胞水肿,可见炎性细胞浸润。SDF-M组心肌细胞肿胀,无空泡样变性,细胞核完整,心肌细胞排列轻度紊乱,间质轻度水肿。SDF-H组心肌纤维排列规则,少量心肌纤维化,胞浆染色不均匀,心肌纤维间隙未见明显炎性细胞浸润。SDF-B组肌纤维排列规则,可见心肌纤维化,胞浆染色不均匀,肌纤维间隙无明显炎性细胞浸润。与I/R组比较,各剂量组大鼠心肌细胞肿胀减轻,细胞变性、坏死和炎性细胞浸润也减少损伤症状明显减轻。见图4。

图4 各组大鼠HE染色图(×400)
2.5龙血竭总黄酮对MIRI大鼠心肌组织PI3K、AKT、Caspase-3蛋白表达的影响 Control组与Sham组PI3K、AKT蛋白含量无差异(P>0.05);与Sham组比较,I/R组PI3K、AKT蛋白含量均降低,差异有统计学意义(P<0.05);与I/R组比较,SDF-M组、SDF-H组及SDF-B组PI3K、AKT蛋白含量明显升高,且差异有统计学意义(P<0.05),与Sham组比较,I/R组大鼠心肌组织Caspase-3表达明显增高,差异有统计学意义(P<0.05);与I/R组比较,SDF-M组、SDF-H组及SDF-B组Caspase-3蛋白含量出现减少,差异有统计学意义(P<0.05),各剂量组之间相比,差异无统计学意义(P>0.05)。见图5A、图5B。

注:A.Western Blot法检测各组大鼠PI3K、AKT、Caspase-3蛋白水平情况;B.各组大鼠蛋白表达水平的比较。*P<0.05,**P<0.01。
3 讨论
MIRI的机制极其复杂,迄今为止,人们都未能阐明其作用的机制。主流的观点认为,自由基和促炎细胞因子的过量产生,细胞凋亡的增加和内质网应激都参与了MIRI的发生和发展[18]。心肌I/R损伤可导致心力衰竭和心肌炎症等预后不良,触发室性心律失常可能导致心肌梗死加重[19]。细胞凋亡是由细胞内基因及其产物调节的程序性细胞死亡的一种方式[20]。细胞凋亡参与MIRI的病理生理过程,研究表明,MIRI以多种方式诱导细胞凋亡,包括Bax水平升高,Bcl-2水平降低以及抑制PI3K/AKT途径的激活[21]。防止心肌细胞凋亡作为保护心肌免受MIRI损害的新靶点,引起了越来越多的关注。
PI3K/AKT信号通路调节体内多种细胞活动,大量研究发现PI3K/AKT信号通路的激活对于抑制MIRI期间心肌细胞凋亡至关重要[22]。能够对Bax、Bad、Caspase-3等促凋亡基因的表达产生抑制作用,而对抗凋亡基因Bcl-2的表达产生促进作用[23-24],从而发挥抗凋亡作用,减轻心肌损伤。而当缺血缺氧、缺血再灌注等病理因素作用于细胞时,内源性途径启动线粒体介导的细胞凋亡,激活Bcl-2家族蛋白,促使线粒体释放细胞色素C,进一步激活Caspase-3,Caspase-3通过直接切割细胞核和细胞质中的结构蛋白和调节蛋白来完成细胞凋亡的过程,诱导细胞凋亡,是细胞凋亡中的一个重要的调控因子[25]。因此,抑制Caspase-3蛋白的表达可以显著减轻MIRI,当出现MIRI时,PI3K/AKT通路受到抑制并使其抗凋亡作用减弱。大量研究证实龙血竭总黄酮具有抗炎、抗血小板聚集、抑制细胞凋亡等作用[4,15,26-27]。其在MIRI时通过激活PI3K/AKT信号通路抑制细胞凋亡。MIRI过程中,蛋白水解酶活性发生变化,细胞膜通透性增加,影响心肌细胞代谢的关键酶LDH和CK-MB从胞浆进入血液,增加其在血清中的含量。因此,常将其作为反映心肌细胞损伤程度的敏感指标。本实验结果显示,使用SDF预处理后,大鼠LDH和CK-MB水平下降、心肌梗死面积减少,TTC染色结果提示梗死面积缩小,均能显著证实SDF对MIRI具有保护作用。与Sham组比较,I/R组的PI3K、AKT、蛋白含量下降,Caspase-3蛋白含量上升,说明在MIRI时,细胞凋亡通路被激活,大量细胞凋亡,并抑制了PI3K/AKT信号通路;相比于I/R组,SDF各剂量组PI3K、AKT蛋白表达明显上升,且高剂量组PI3K、AKT蛋白上升显著,Caspase-3蛋白表达下降,说明心肌细胞凋亡受到抑制,这可能与SDF激活PI3K/AKT信号通路途径有关。综上,SDF的抗凋亡作用在心脑血管疾病治疗中具有独特优势,但其有效化学成分复杂,目前的研究热点依旧是有效成分的分析和提取。本实验表明,SDF可激活PI3K/AKT通路,发挥抗凋亡作用,减少细胞凋亡,产生心肌保护功效。当然,MIRI发病机制较多,并且各通路间相互协同,目前对其具体保护机制尚不能明确。本实验仅从PI3K/AKT信号通路角度,探讨SDF与MIRI的关系,其具体机制还需进一步论证。
本研究表明SDF能改善大鼠MIRI,以龙血竭高剂量组疗效最佳。SDF可降低心肌损伤标志物LDH、CK-MB的活性,减少心肌梗死面积,抑制心肌细胞凋亡,减轻心肌组织的病理损伤。综上所述,SDF通过激活PI3K/AKT信号通路抑制心肌细胞凋亡,从而对MIRI大鼠心肌细胞发挥保护作用。
