超声弹性成像技术联合血清TSH检测对PTMC的诊断价值
2023-05-08谢丹虹陈廷财陈娟燕
谢丹虹,陈廷财,陈娟燕
普宁市人民医院超声科,广东 普宁 515300
甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)主要指原发肿瘤病灶直径<10 mm 的甲状腺癌,由于病灶较小且发病较为隐匿,早期也无特异性症状,同时常伴有甲状腺良性结节,常规超声诊断效果不甚理想[1]。超声弹性成像技术是在常规超声上发展而来的一种通过成像色彩差异辨别肿瘤组织硬度的检测技术,临床能通过分析弹性参数和分级确定肿瘤性质[2]。血清促甲状腺激素(TSH)与机体甲状腺功能变化密切相关,其水平分泌受甲状腺疾病的影响[3]。有研究指出,TSH水平变化与甲状腺癌的发生、进展关系密切[4]。本研究主要探讨超声弹性成像技术联合血清TSH检测对PTMC患者的诊断价值,现将结果报道如下:
1 资料与方法
1.1 一般资料 选取2020 年3 月至2021 年2 月普宁市人民医院收治的50 例(共137 个结节)行手术治疗的甲状腺微小结节患者作为观察组。纳入标准:(1)均行甲状腺切除手术且经病理证实为微小甲状腺占位病变者;(2)肿瘤病灶直径<10 mm者;(3)经患者或(且)家属知情同意,签署知情同意书者。排除标准:(1)既往有甲状腺术史者;(2)甲状腺囊肿者;(3)检查时超声弹性图像无法调节至2倍及以上者。观察组中男性34例,女性16例;年龄22~75岁,平均(35.24±1.74)岁;甲状腺微小结节3.50~10.00 mm,平均(6.50±2.81)mm。另选取50例同期健康体检者作为对照组,对照组中男性31 例,女性19 例;年龄23~76 岁,平均(35.36±1.77)岁。两组受检者的性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会批准。
1.2 检查方法
1.2.1 超声弹性成像技术检查 应用日立阿洛卡彩超二郎神超声诊断仪(HI VISION Preirus)进行检查,线阵探头配备频率范围为6~15 MHz。所有受检查者均取仰卧位,首先使用常规超声进行检查,主要观察结节的一般情况;之后调整为弹性成像模式,利用探头与肿瘤部位间的微小振动进行检查,探查区以病灶范围为中心向外扩展2~3 倍,随时观察并注意仪器屏幕上所显示的压力指标,满格为适宜压力;弹性图像和二维图像均显示于屏幕上,对弹性图像进行彩色编码用以区分组织的不同弹性,组织较硬显示为蓝色,硬度平均显示为绿色,组织较软显示为红色。
1.2.2 血清TSH 检测 所有患者于清晨(入院次日)空腹抽取外周静脉血4 mL,离心(半径为8 cm,转速为3 500 r/min,时间为10 min)分离血清后送检,采用化学发光法进行检测,全部操作均严格按照说明书进行。TSH水平正常范围为0.34~5.60 mIU/L。
1.2.3 术后病理学检查 所有受检查者均经术后病理学检查确诊。术后病理检查内容包含:结节最大直径、病理分型、有无淋巴转移、有无包膜外侵犯、淋巴结位置及数目。恶性肿瘤分期采用美国癌症联合委员会制定的TNM分期标准[5]。
1.3 弹性图像评分标准[6]弹性图像显示肿瘤周围组织与肿瘤病灶全部呈绿色为1 级,评分1分;弹性图像显示周围组织与病灶大部分是绿色(面积>50%)为2级,评分2 分;弹性图像显示周围组织与病灶主要是蓝色(面积50%~90%)为3级,评分3分;弹性图像显示周围组织与病灶基本是蓝色(面积>90%)为4级,评分4 分。其中结节硬度越高评级越高,良性结节:0~2 级(0~2分);恶性结节:3~4级(3~4分)。
1.4 统计学方法 应用SPSS19.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较进行LSD-t 检验,计数资料比较采用χ2检验,绘制超声弹性成像、血清TSH 以及两者联合检测的受检者工作特征曲线(ROC)(横坐标:1-特异度,纵坐标:敏感度)并计算曲线下面积。以P<0.05为差异具有统计学意义。
2 结果
2.1 病理结果与超声弹性成像技术比较 经术后病理检查,50例患者共检出137个结节,其中良性结节80 个,占58.39%;恶性结节57 个,占41.61%。超声弹性成像技术检出111 个结节,其中65 个良性结节,46 个恶性结节,检出率为81.02%(111/137),与病理结果具有较高一致性。良性结节的超声弹性成像评分为(1.47±0.11)分,明显低于恶性结节的(3.19±0.26)分,差异有统计学意义(t=52.949,P=0.000)。
2.2 两组受检者的血清TSH 检测水平比较 观察组患者中良性结节患者的血清TSH 水平为(2.28±0.33)mIU/L、恶性结节患者为(2.91±0.24)mIU/L,对照组为(1.83±0.35)mIU/L,三组比较差异有统计学意义(t=7.351,P=0.025),其中观察组患者中恶性结节血清TSH水平明显高于良性结节和对照组,差异有统计学意义(t1=10.917,P=0.000;t2=17.995,P=0.000),观察组患者中良性结节血清TSH水平也明显高于对照组,差异有统计学意义(t=6.615,P=0.000)。
2.3 联合检测对PTMC 的诊断价值 绘制血清TSH、超声弹性成像以及两者联合检测的ROC曲线,结果显示,联合检测最佳截点的TSH水平为2.16 mIU/L,其曲线下面积、检测敏感度、特异度以及约登指数明显高于单独检测,差异均有统计学意义(P<0.05),见表1和图1。

图1 三种检测方法诊断PTMC的ROC曲线图Figure 1 ROC curve of three detection methods for diagnosing PTMC
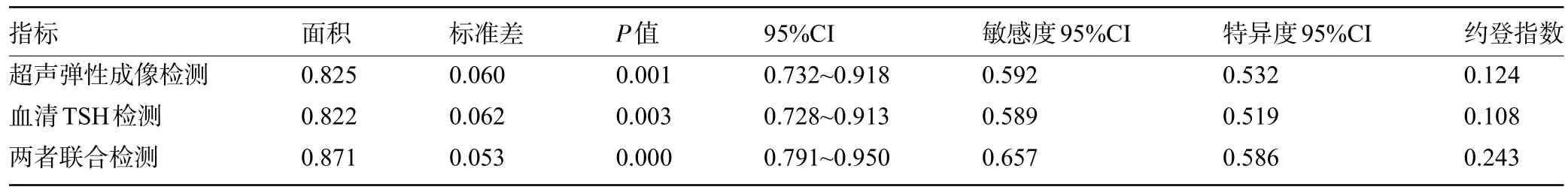
表1 各指标曲线下面积及其他参数比较Table 1 Comparison of the area under the curve of each index and other parameters
2.4 甲状腺乳头癌的影像学表现 PTMC 超声弹性成像技术检查能清晰可见病灶边界不清晰且呈现不均匀低回声,周围血流、肿块内部信号较为丰富(图2);弹性评分为4分,超声弹性系数3.3(图3)。
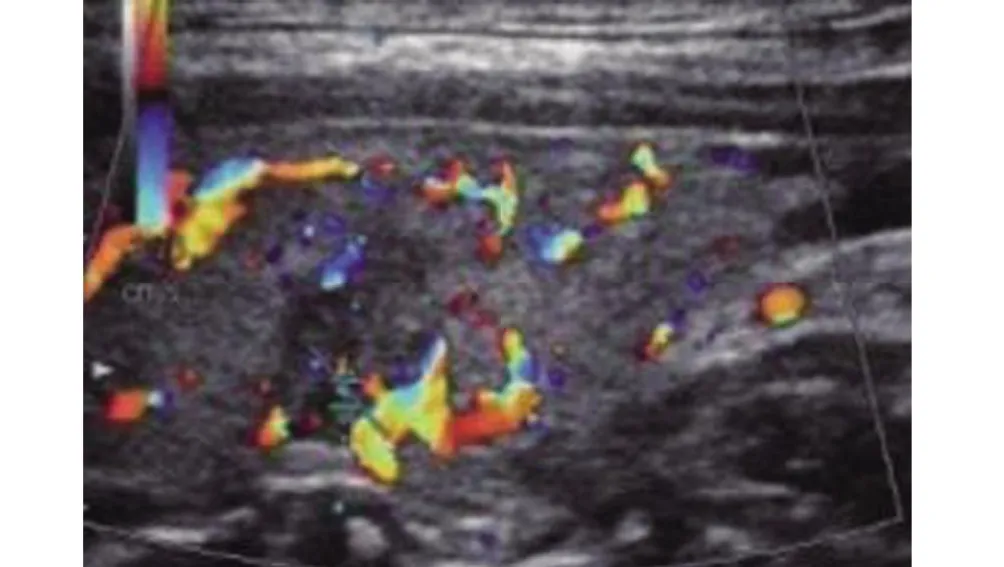
图2 甲状腺乳头癌超声影像学表现Figure 2 Ultrasound imaging findings of papillary thyroid microcarcinoma

图3 超声弹性评分为4分的甲状腺乳头癌Figure 3 Papillary thyroid microcarcinoma with ultrasound elasticity score of 4
3 讨论
PTMC 临床病情进展较为缓慢,但其在年轻患者中侵袭性较强,且随着时间推移癌细胞不仅在腺体内扩散,同时逐渐转移至相邻的淋巴结,故该病具有易远处转移和易复发的特点[7]。因此,尽早诊断、及时治疗对于提高患者临床疗效、生活质量及改善预后具有重要意义。
PTMC 临床检出率为35%左右,近年来随着影像技术的发展其检出率呈现逐年增长的趋势。超声技术由于价格低廉、方便快捷且甲状腺疾病检出率效果显著,逐渐成为临床首选的检测甲状腺疾病的方法。常规超声用于检测PTMC 因病灶较小且浸润范围较小等原因使得图像边界清晰、形态规则,无法反映恶性特征而导致诊断效果不甚理想,甚至引发临床漏诊、误诊。
超声弹性成像技术自常规超声发展而来,其主要通过对病灶及周围组织施压后所产生的扭曲变形程度以及组织间弹性系数差异状况达到反映恶性特征的目的,很好地弥补了常规超声检测的局限性,实现诊出微小病灶并对病灶良、恶性准确鉴别[8-9]。因PTMC常并发其他甲状腺疾病,合并病灶中纤维、钙化组织含量升高,使得结节弹性出现波动[10]。另因分布于甲状腺峡部或近下级的结节受到周围骨质影响,所以检查存在一定误差。对于部分太小的病灶,其弹性成像显示无差异硬度较难,其弹性分级低,检测准确性存疑。因此,单独应用超声弹性成像技术检测PTMC也易发生漏诊、误诊情形[11-12]。
相关研究结果显示,血清TSH参与甲状腺癌的发生、进展,可能是甲状腺癌发生的预测因子之一,其水平异常与甲状腺功能障碍密切相关[13]。故本研究将超声弹性成像技术联合血清TSH对PTMC进行检测,结果显示,超声弹性成像技术检出111 个结节(共137 个结节),其中良性结节和恶性结节的检出率为81.02%,这与病理结果具有较高一致性,且良性结节的超声弹性成像评分显著低于恶性结节的评分,表明超声弹性成像技术能有效区分良性和恶性甲状腺结节,具有较高诊断价值,这可能是因为滤泡和胶质构成良性结节主要的组织学部分,因而硬度较低,而受到炎性因子长期浸润的恶性结节则纤维血管及乳头状分支较多,同时伴随纤维血管间质及砂砾样钙化,致使肿瘤硬度变强,因此其硬度高[14-15],因此通过超声弹性成像技术检测能有效区分恶性结节和良性结节。
同时,本研究发现,与对照组血清TSH比较,观察组中恶、良性结节患者水平均明显更高,且与恶性结节患者比较,良性结节患者水平显著更低,差异均有统计学意义(P<0.05)。以上结果提示PTMC患者甲状腺功能均存在一定程度异常,且恶性结节患者异常程度更甚。此外,通过绘制血清TSH、超声弹性成像以及两者联合检测PTMC的ROC曲线发现,超声弹性成像诊断PTMC 的曲线下面积明显低于联合检测的曲线下面积,提示联合检测具有更高的临床诊断价值。
综上所述,超声弹性成像技术联合血清TSH检测诊断PTMC 有较高临床价值,且联合诊断的价值更高,可将其作为诊断PTMC的重要技术和指标。
