急性髓系白血病患者血清外泌体中miR-92a-3p 的表达及其意义
2023-05-06张亚丽全海薇母润红邹雨彤
王 涵, 张亚丽, 全海薇, 母润红, 邹雨彤, 夏 薇
(1.北华大学医学技术学院血液检验教研室,吉林 吉林 132013;2.北华大学基础医学院免疫学教研室,吉林 吉林 132013)
急性髓系白血病(acute myeloid leukemia,AML)是一类骨髓中髓系原始或幼稚细胞恶性增殖抑制骨髓正常造血功能的造血系统恶性肿瘤。目前,AML 的临床诊断主要应用骨髓细胞学检查,因其影响因素较多,需开发一种灵敏度高、特异度强的诊断指标用以辅助急性白血病的早期诊断。外泌体是细胞内溶酶体微粒内陷形成的多囊泡体,直径为30~150 nm,与细胞膜融合后释放到胞外基质中并发挥作用,可在细胞间进行物质传递及细胞间通讯。作为近年研究热点,外泌体独特的分子特征可以改变正常或恶性受体细胞的细胞功能。同时,外泌体能够影响白血病细胞的生长和分化,该能力使其可作为诊断白血病的生物标志物[1]。微小RNA(microRNA,miRNA)是真核生物中一类内源性非编码RNA,可调控细胞的多种生物学功能[2]。miRNA 在肿瘤细胞中的调节作用也同样影响癌症的发生、发展及预后[3]。一些miRNA 已被证实在AML 中明显表达失调,但其具体调控机制尚未明确。因此,靶向miRNA 分子可能是一个很有前景的肿瘤诊断和治疗方向。研究[4-5]表明:在一些肿瘤疾病中,miR-92a-3p 表达与正常人比较会有不同程度的升高或降低。有研究者通过组蛋白去乙 酰 酶2 (histone deacetylase 2,HDAC 2)构 建U937 白血病细胞株,评估其miRNA 调控网络,预测miR-92a-3p 为AML 中 的 潜 在 调 节 因 子[6]。研究[7]显示:circ_0002232 的表达水平与磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)表达水平呈正相关关系,与miR-92a-3p 表达水平呈负相关关系,并预测circ_0002232/miR-92a-3p/PTEN 可能是AML 中的潜在关联网络。但目前对于miR-92a-3p 为AML 中的调节因子的预测尚未被证实。因此,本研究结合外泌体中miRNA 稳定存在和不易降解的特征[8],对AML 患者血清外泌体中miR-92a-3p 表达水平进行分析,以期为AML 的发病机制、病程进展和作用靶点的研究提供依据,也为AML的临床诊断和治疗提供方向。
1 资料与方法
1.1 临床资料收集的血清标本来自2020 年2 月—2021 年9 月期间北华大学附属医院门诊及住院的AML 患者51 例(AML 组),以同期健康体检志愿者34 名作为对照组。AML 纳入标准:①经骨髓细胞形态学和免疫学等检查确诊;②初诊和初治患者;③患者签署知情同意书。排除标准:①并发其他恶性肿瘤或血液疾病;②肝肾功能异常;③年龄<18 岁。AML 组:男性24 例,女性27 例,年龄18~60 岁,平均年龄(41.29±11.70)岁;对照组:男性19 例,女性15 例,年龄18~69 岁,平均年龄(42.26±10.42)岁;2 组研究对象性别构成和年龄分布等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究通过北华大学附属医院医学伦理委员会批准。
1.2 主要试剂和仪器抗CD63 抗体和抗CD9 抗体 购 于 英 国 Abcam 公 司,TRIzol 试 剂、Mir-X miRNA First-Strand Synthesis 和TB Green Premix Ex TaqⅡ试剂盒购于日本TaKaRa 公司,引物购于生工生物工程(上海)有限公司;实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)仪(型号:5100)和超速离心机(型号:26616)购于美国Thermo 公司,透射电子显微镜(型号:HT7700)购于日本Hitachi 公司,台式高速微量离心机(型号:D3024)购于美国Scilogex 公司,纳米粒度分析仪(型号:Nanotrac wave Ⅱ)购于美国Microtrac 公司,化学发光凝胶成像系统(型号:MicroChemi 4.2)购于美国MicroChemi 公司。
1.3 标本处理采集AML 患者及志愿者静脉血缓慢滴于EP 管中,4 ℃放置析出血清;4 ℃、5 000 r·min-1离心10 min,取上清;4 ℃、3 000 r·min-1离心10 min,取上清,于-80 ℃条件下冻存。
1.4 外泌体提取采取差速离心法[9]提取外泌体。取出经过处理的血清样本,冰上融化。4 ℃、2 000 g 离心 30 min,取上清。4 ℃、12 000 g 离心45 min,转移上清至无菌超离管。4 ℃、110 000 g,离心2 h,弃上清留沉淀。用1 mL PBS 缓冲液重悬沉淀并使用快速振荡器充分混匀,经0.22 μm 滤膜过滤。过滤后的悬液4 ℃、110 000 g 离心70 min,弃上清。100 μL PBS 缓冲液重悬外泌体,使用快速振荡器充分震荡混匀,于-20 ℃条件下保存。
1.5 透射电子显微镜观察外泌体超微结构将外泌体吸取适量滴加在铜网上,室温环境下静置1 min,滴加磷钨酸钠溶液负染5 min,使用滤纸轻轻吸去余液,透射电子显微镜观察外泌体超微结构。
1.6 纳米粒度分析仪检测外泌体粒径纳米粒度分析仪样品室注入无气泡纯水200 μL 清洗,清洗后吸出擦干,PBS 缓冲液调零;加入经PBS 缓冲液 1∶10 稀释的外泌体溶液200 μL 进行粒径检测。
1.7 Western blotting 法检测外泌体中CD63 和CD9 蛋白表达情况采用Western blotting 法检测外泌体中。采用RIPA 裂解液将外泌体膜裂解,加入5×Loading Buffer 混合,100 ℃水浴15 min。上样后设置电压,4%浓缩胶电压80 V、10%分离胶部分设置电压100 V 电泳;采用半干转法转膜后,5%脱脂奶粉室温环境放置摇床封闭2 h;5%脱脂牛奶稀释一抗(1∶1 000),4 ℃摇床过夜;加入5%脱脂奶粉开启摇床清洗20 min,重复3 次;将膜放入配制好的5%脱脂牛奶稀释二抗(1∶2 000)中,充分混匀,室温环境开启摇床孵育1 h;加入5%脱脂牛奶开启摇床清洗5 min;开启摇床PBS缓冲液清洗5 min,重复2 次;配制发光底物,利用成像系统进行显影,观察CD63 和CD9 蛋白表达情况。
1.8 外泌体中miR-92a-3p 提取在含外泌体的EP 管中加入1 mL TRIzol,充分混匀后于冰上静置5 min;转移至无酶EP 管中,加入200 μL 预冷氯仿,颠倒混匀,冰上静置15 min;4 ℃、12 000 r·min-1离心15 min;吸取上层无色水相至无酶EP 管,加入500 μL 预冷异丙醇,轻轻颠倒混匀,冰上静置20 min;4 ℃、12 000 r·min-1离心10 min;弃上清,加入75%乙醇(DEPC 配制)1 mL 洗涤管内白色胶状沉淀,4 ℃、7 500 r·min-1离心5 min;弃上清加DEPC 水充分混匀,利用反转录试剂盒将提取的样本外泌体总RNA 逆转录,反应结束后加入90 μL ddH2O 补足至100 μL,分装后-20 ℃条件下保存。
1.9 RT-qPCR 法检测外泌体中miR-92a-3p 表达水平使用RT-qPCR 仪,以U6 为内参基因,检测miR-92a-3p 表 达 水 平,引 物 序 列 见 表1。miR-92a-3p 表 达 水 平 采 用2-ΔΔCt法 计 算。ΔΔCt=(实验组目的基因Ct 值-实验组内参基因Ct 值)-(对照组目的基因Ct 值-对照组内参基因Ct 值)。
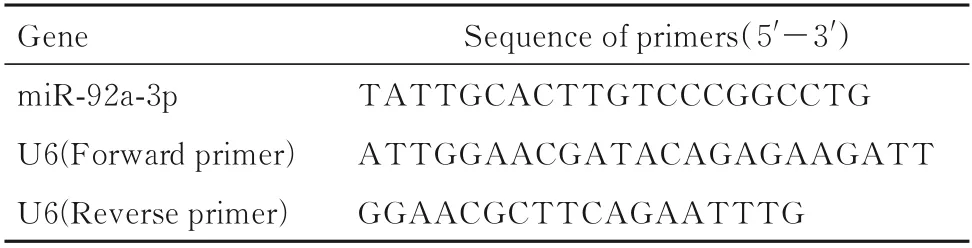
表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.10 统计学分析采用GraphPad Prism 8.0 软件进行统计学分析。2 组研究对象血清外泌体中miR-92a-3p 表达水平呈非正态分布,以中位数[四分位数][M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评价诊断效能。以P<0.05 为差异有统计学意义。
2 结 果
2.1 外泌体超微结构透射电子显微镜下观察到外泌体呈圆形且中间凹陷的膜状结构,粒径分布30~150 nm。见图1。
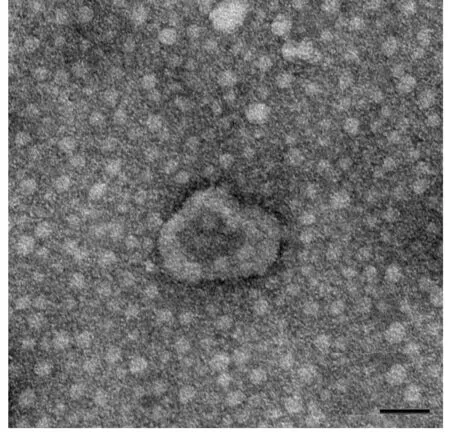
图1 透射电子显微镜下外泌体形态表现(Bar=100 nm)Fig.1 Morphology of exosomes under transmission electron microscope(Bar=100 nm)
2.2 外泌体的粒径通过纳米粒度分析仪检测得到的外泌体样品粒径为30~100 nm,与透射电子显微镜所观察到的平均粒径基本相同。见图2。
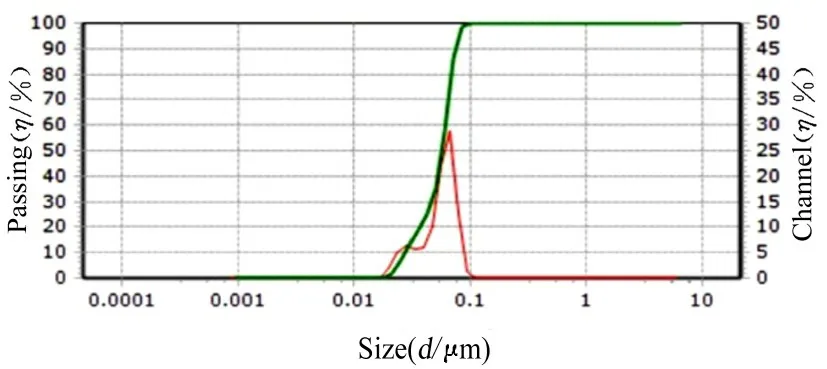
图2 纳米粒度分析仪检测提取的外泌体粒径Fig.2 Sizes of extracted exosomes detected by nanoparticle analyzer
2.3 Western blotting 法检测2 组研究对象血清外泌体中CD63 和CD9 蛋白表达应用Western blotting 法检测所提取外泌体中蛋白表达水平,所提取外泌体中出现条带,证明所提取外泌体中有CD63 和CD9 蛋白表达。见图3。
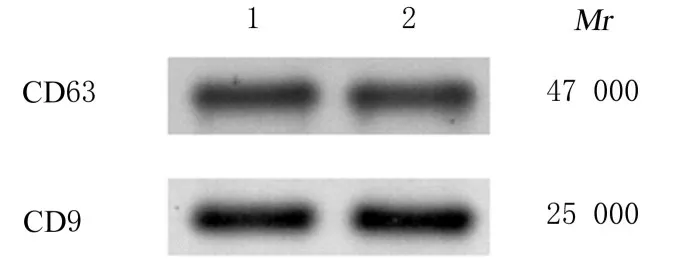
图3 Western blotting 法检测2 组研究对象血清外泌体中CD63 和CD9 蛋白表达电泳图Fig.3 Electrophoregram of expressions of CD63 and CD9 proteins in serum exosomes of subjects in two groups detected by Western blotting method
2.4 2 组研究对象血清外泌体中miR-92a-3p 表达水平AML 组患者血清外泌体中miR-92a-3p 表达水平[0.273(0.128,0.476)]明显低于对照组[1.061 (0.704,1.554)],差异有统计学意义(Z=-6.427,P<0.01)。
2.5 AML 患者血清外泌体中miR-92a-3p 表达水平在AML 中的诊断价值根据AML 患者血清外泌体miR-92a-3p 表达水平构建ROC 曲线,选取灵敏度和特异度总和最高时所对应的血清外泌体miR-92a-3p 表达水平为最佳临界值,结果显示:血清外泌体中miR-92a-3p 表达水平对AML 诊断的最佳临界值为0.51,其灵敏度为76.47%,特异度为94.12%,ROC 曲 线 下 面 积(area under curve,AUC)为0.913 (95%CI:0.856,0.971)(P<0.001),诊断效能良好,见图4。
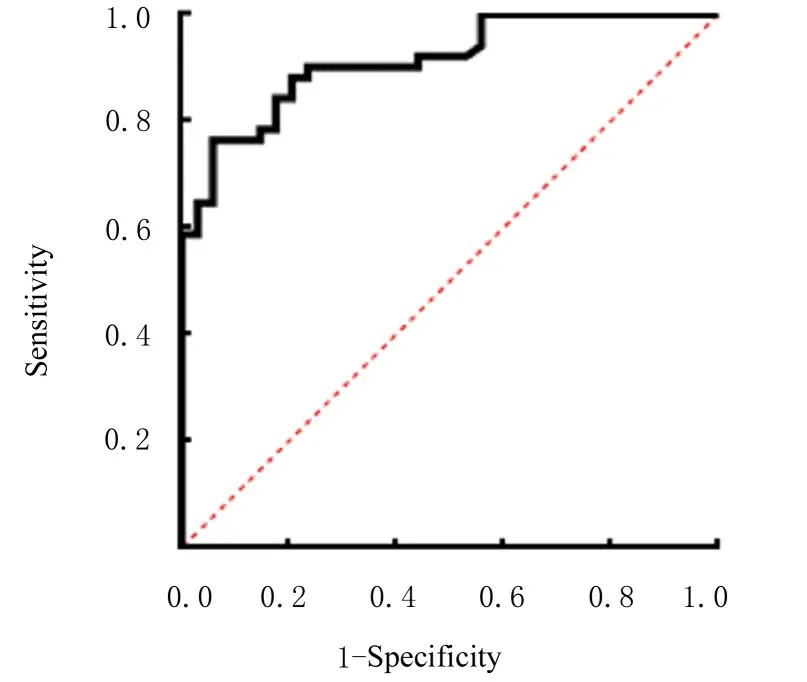
图4 AML 患者血清外泌体中miR-92a-3p 表达水平诊断AML 的ROC 曲 线Fig.4 ROC curve of AML diagnosed by expression level of miR-92a-3p in serum exosomes of AML patients in diagnosis of AML
3 讨 论
AML 是一类造血系统的恶性肿瘤,影响正常髓系细胞分化、增殖和凋亡等,并且伴随着细胞遗传学异常和突变[10]。AML 发病率和死亡率极高,因此对其早期诊断和早期治疗策略尤为重要。脱离细胞和蛋白水平的局限,一些miRNA 表达上调或下调也影响AML 的发生和发展进程[11-12],miRNA也将成为对AML 诊断、治疗和预后判断的重大突破。
外泌体具有多种生物学功能和独特的遗传特征,可影响白血病细胞生长和分化,调节骨髓微环境,抑制骨髓造血等,可作为白血病的临床诊治靶点[13-14]。外泌体源miRNA 由外泌体包裹转移至细胞外,能够稳定地存在于体液和组织中,不易降解,同时拥有较高水平[15-17]。血清miRNA 和外泌体miRNA 的结合也成为研究热点,血清中提取的外泌体miRNA 也具有良好的诊断价值。
本研究采用RT-qPCR 法检测51 例AML 和34 名同期健康体检志愿者血清外泌体中miR-92a-3p 表达水平,结果显示:AML 组患者血清外泌体中miR-92a-3p 表达水平明显低于对照组,提示血清外泌体中miR-92a-3p 在AML 的发生过程中为抑癌基因,与miR-92a-3p 在其他肿瘤疾病中的表达呈下调的研究结果一致[18-21]。
外泌体中富集miRNA,且外泌体膜能够使miRNA 免受RNA 酶的降解[22-24]。血清外泌体衍生的miRNA-532 可 作 为AML 新 的 生 存 预 测 因 子[25]。在血清中采用外泌体miRNA 作为生物标志物基于其高稳定性和特异性。在AML 中可能存在Circ_0002232/miR-92a-3p/PTEN 的潜在关联网络[7];miR-92a-3p 也影响白血病的耐药机制,血清外泌体中miR-92a-3p 可能是白血病患者伊马替尼耐药的潜在生物标志物[25]。血清中miR-150 和miR-342 的组合是临床诊断AML 的新的候选生物标志物[26]。通过干扰受体细胞对外泌体miRNA 的摄取,从而调控靶基因,可以提高白血病细胞的药物敏感性,扩展白血病治疗的概念,为白血病早期诊断、病程发展、治疗及预后提供了新方向[27-29]。
综上所述,AML 患者血清外泌体中miR-92a-3p 表达水平降低,有抑癌作用,可能成为AML 潜在的诊治靶点,为其临床推广应用提供了理论依据。今后,可进一步研究AML 细胞来源的外泌体在蛋白质及RNA 等内含物的表达谱,探讨其关系网络,以AML 特异性外泌体miRNA 为靶点,探讨其信号传导途径,寻找灵敏度高的血清外泌体miRNA 作为非侵袭性生物标志物,进一步论证外泌体miR-92a-3p 在AML 治疗及预后中的意义。
