通络糖泰方治疗糖尿病周围神经病变作用机制的网络药理学和分子对接分析
2023-05-06李周泉杨莉君姜迎宏殷丽平
李周泉, 李 慧, 唐 莹, 杨莉君, 姜迎宏, 殷丽平,2
(1.成都中医药大学临床医学院中医内科学,四川 成都 610075;2.成都中医药大学附属医院内分泌科,四川 成都 610075)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病常见的慢性并发症,60%~90%的糖尿病患者会在10 年后出现不同程度的神经功能损害,其中半数为DPN[1],与创伤性相关的截肢患者比较,其5 年生存率低于50%[2],现已成为患者非创伤性截肢最主要的危险因素,严重影响患者的生活质量[3]。目前关于DPN 的发生机制尚未完全清楚,可采用控制血糖、饮食及生活方式干预、手术及对症治疗和病因治疗等方法治疗DPN[4-6]。针对DPN 中涉及的潜在分子和细胞机制的诸多治疗,包括醛糖还原酶抑制剂、苯酞胺和蛋白激酶C 抑制剂等,虽然已在临床应用40 余年,但因其皆为针对DPN 单一发病机制的治疗,疗效有限[7-9]。中医药治疗DPN 具有整体调节、毒副作用小和临床效果好等特点。通络糖泰方(Tongluo Tangtai Power,TLTT)由黄芪、当归、地骨皮、水蛭、蚕沙、川牛膝、玄参、白芥子和赤芍等药物组成,是本院内分泌科谢春光教授的临床经验方,主要用于治疗DPN。中药具有多成分、多靶点和多通路的特点,网络药理学[10]是探索药物成分与靶点相互作用的新兴研究方法。本研究通过探讨TLTT 的主要活性化合物及其作用靶点,借助网络药理学的方法从系统生物整体的角度阐明TLTT 治疗DPN 的作用机制,为TLTT 的进一步应用提供科学依据。
1 材料与方法
1.1 TLTT 有效成分筛选
在中药系统药理学数据库与分析平台(https://tcmsp-e.com/)[11]以口服生物利用度(oral bioavailability,OB)≥30%、类 药 性 (druglikeness,DL)≥0.18 为筛选条件,筛选TLTT 有效成分。
1.2 靶点预测
在TCMSP 数据库中将成分Mol ID 号输入相关靶点信息栏进行预测,再通过蛋白质序列数据库(https://www.uniprot.org/)进行核对。
1.3 疾病靶点搜集
在基因卡片数据库(https://www.genecards.org/)中以“diabetic peripheral neuropathies”为检索词,搜集疾病靶点。
1.4 核心靶点筛选及构建蛋白-蛋白互作(proteinprotein interaction,PPI)网络
将成分靶点与疾病靶点交集得到的数据,输入 STRING 数据库(https://string-db.org/),物种选择“人类”,置信度调整为“较高”,隐藏无联动靶点,在线导入Cytoscape 3.9.1 软件进行分析,在软件工具箱中选择“统计信息生成模式”,根据度值筛选出核心靶点。
1.5 TLTT-活性化合物-核心靶点网络构建
将以上数据导入 Cytoscape 3.9.1 软件,构建中药-活性成分-核心靶点的网络。
1.6 基因本体分析及基因组通路富集
将交集靶点导入基因富集分析库(https://metascape.org/)中,物种选择“人类”,选择基因本体论(Gene Ontology,GO)模式,完成生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3 个层面的富集分析,在京都基因与基因组百 科 全 书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)(https://www.kegg.jp/)进行富集分析,将数据表格保存,结果以柱状图和气泡图的形式输出。
1.7 分子对接
从蛋白质结构数据库(http://www.rcsb.org/)中获取靶点的蛋白结构,使用分子对接软件将核心靶点与活性成分进行对接验证。
1.8 核心靶点的验证
1.8.1 实验动物、细胞、试剂和主要仪器 30 只SPF 级SD 大鼠(成都森威实验动物有限公司,动物生产与使用许可证号:2021DL-020)。大鼠雪旺细胞(上海赛佰康生物技术股份有限公司,货号:RSC96)。TLTT 由黄芪、当归、地骨皮、水蛭、蚕沙、川牛膝、玄参、白芥子和赤芍等药物组成,由成都中医药大学附属医院制剂科制作,1 g 浸膏相当于生药4.3 g,批号:20201108。弥可保(甲钴胺片)购自卫材(中国)药业有限公司(批准文号:国药准字H20143107)。Cell Counting Kit 8 检测盒(型号:ab228554),重组Anti-丝氨酸/苏氨酸激酶1(serine/threonine kinase 1,AKT1)抗体(型号:ab81283),重组Anti-TP53 抗体(型号:ab241566)(英国Abcam 公司),辣根过氧化物酶标记兔二抗(型号:A0208)和极超敏ECL 化学发光试剂盒(型号:P0018FS)(南京碧云天生物公司)。荧光显微镜(型号:Leica DM IL LED,德国徕卡公司),多功能酶联免疫分析仪(型号:BK-EL10C,山东博科生物产业有限公司),化学发光成像仪(型号:MiniChem,广州合众生物有限公司)
1.8.2 含药血清制备 大鼠适应期结束,将其随机分为对照组、弥可保组和TLTT 组,每组10 只,TLTT 组大鼠按人体等效剂量灌胃,每日2 次,连续给药3 d;对照组和弥可保组大鼠采用同等剂量的生理盐水和弥可保溶液灌胃。末次灌胃2 h 后,各组大鼠在药物麻醉后于腹主动脉取血,离心得到血清并将其置于无菌离心管。经灭活和灭菌处理后封口膜密封,标记后冻存备用。
1.8.3 实验建模 将雪旺细胞培养至第3 代后接种于6 孔细胞培养板和96 孔细胞培养板进行分组干预:10%弥可保组大鼠血清+50 mmol·L-1葡萄糖培养基(弥可保组),10%TLTT 组大鼠血清+50 mmol·L-1葡萄糖培养基(TLTT 组),10%对照组大鼠血清+5.6 mmol·L-1葡萄糖培养基(对照组),10%对照组大鼠血清+50 mmol·L-1葡萄糖培养基(高糖模型组)。
1.8.4 实验方法 ①CCK-8 法检测雪旺细胞存活率:在96 孔细胞培养板上培养各组细胞并更换含药血清进行干预,48 h 后每孔滴加CCK-8 试剂,继续放在孵育箱等待1 h,最后应用多功能酶联免疫分析仪测定吸光度(A)值,计算各组细胞存活率。②Western blotting 法检测关键靶点AKT1 和抑癌基因TP53 蛋白表达水平:将6 孔细胞培养板中培养状态良好的各组雪旺细胞中加入裂解液,收集上清液采用BCA 法进行蛋白定量后,经电泳后切取目的条带转印至PVDF 膜上,隔夜进行一抗和二抗孵育,再采用ECL 法显色,将ECL 的AB 混合液体滴在PVDF 膜上,将膜放置于化学发光成像仪中,在电脑上操作扫描,采用Image J 软件分析计算条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值,每个实验重复3 次。
1.8.5 统计学分析 采用SPSS 26.0 统计软件进行统计学分析。各组细胞存活率符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,方差齐时采用多重比较法(Turkey),方差不齐时采用Dunnett T3 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 TLTT 的活性成分及靶点预测
TLTT 中共检索出95 种活性成分,463 个靶点,再将预测出的靶点蛋白名称转换为基因名称。
2.2 TLTT 有效成分及靶点网络构建
将检索的TLTT 有效成分与靶蛋白导入Cytoscape 3.9.1 软件构建“成分-靶点”网络,得到479 个节点和1 256 条相互作用关系,其中药物间共有成分8 个,记为A、B、C、D、E、F、G 和H,见图1。
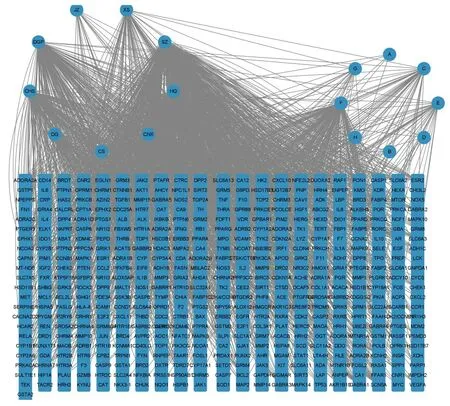
图1 药物成分的靶点网络Fig.1 Target networks of drug components
2.3 TLTT 与DPN 共 同 作 用 靶 点
从基因卡片数据库中获得1 187 个DPN 的相关靶点。将463 个TLTT 的共有作用靶点与1 187 个DPN 相关靶点输入Bioinformatics & Evolutionary Genomics 平台,在线获取交集韦恩图,得到TLTT 与DPN 共同作用靶点137 个。见图2。

图2 药物和疾病靶点交集图Fig.2 Intersection graphs of drugs and disease targets
2.4 TLTT 治疗DPN 潜在靶点的PPI 网络图构建及核心靶点图
利用STRING 数据库构建PPI 网络图,见图3。通过Cytoscape 软件对网络节点的拓扑参数(度值和中介中心性)进行分析筛选,即度值≥16.4,中介 中 心 性≥3.07×10-3。经 筛 选 得 到 核 心 靶 点26 个,包括AKT1、TP53、肿瘤坏死因子(tumor necrosis factor,TNF)、表 皮 生 长 因 子 受 体(epidermal growth factor receptor,EGFR)和血管内皮生长因子A (vascular endothelial growth factor-A,VEGFA)等。见图4。

图3 药物与疾病共同靶点 PPI 网络图Fig.3 PPI network diagram of common targets of drugs and diseases
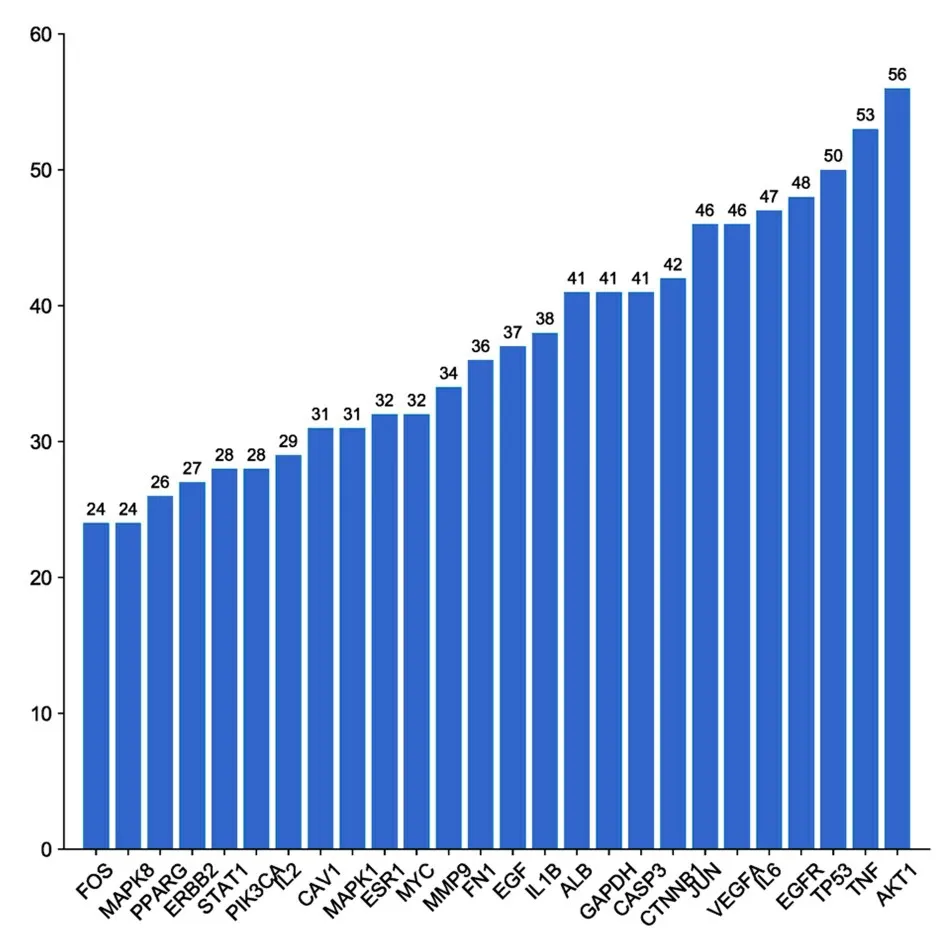
图4 药物与疾病共同靶点蛋白频数图Fig.4 Frequency graph of common target proteins of drugs and diseases
2.5 药物-成分-疾病-靶点图
合并成分-靶点网络和PPI 图,得到重叠部分即为药物-成分-疾病-靶点图(图5),可观察到前10 种作用最明显的活性成分,具体见表1。
2.6 GO 富集分析和KEGG 通路富集分析结果
将治疗靶点导入 Metascape 软件和KEGG Pathway 数据库分别进行 GO 三层面分析和 KEGG通路富集分析。结果显示:TLTT 主要通过调控细胞对无机物的反应、对激素刺激的反应、正向调节细胞迁移、调节激酶活性和对细胞外刺激的反应等生物学过程,以及癌症通路、脂质和动脉粥样硬化、磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B (protein kinase B,Akt)信号通路、晚期糖基化终末产物-糖基化终末产物受体信号通路和丝裂原活化蛋白激酶(mitosolysis-activated protein kinase,MAPK)等信号通路发挥治疗DPN 的作用。见图6 和7。
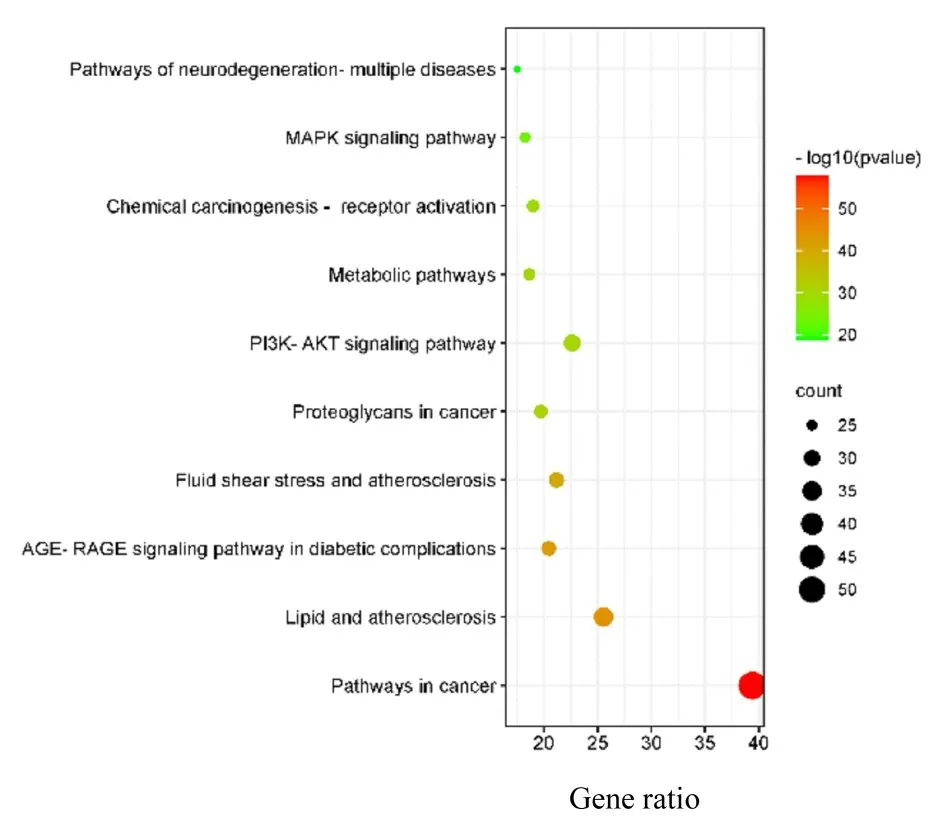
图6 潜在靶点的KEGG 富集分析图Fig.6 KEGG enrichment analysis diagram of potential targets
2.7 分子对接结果
根据表1 所示槲皮素、β-谷甾醇、豆甾醇、7-O-methylisomucronulatol、常春藤皂苷元、山柰酚、柳杉酚、刺芒柄花素、异鼠李素和黄芩素前10 个化合物分别与前5 个核心靶点进行分子对接,见图8,结合能均小于-6.5 kcal·mol-1,表明药物成分与靶蛋白结合稳定,对接活性较强。其中图9A为MOL008583 与 TP53、图9B 为 MOL000449 与EGFR、图9C 为MOL005460 与IL-6、图9D 为MOL008583与AKT1、图9E为MOL000098与TNF、图9F 为MOL000296 与AKT1。其 中MOL000296与AKT1结合力最强,为-10.3 kcal·mol-1,见图9F。图9 图左为整体视图,右为局部视图,图中浅橙色stick 为小分子,浅青色cartoon 为蛋白,灰色虚线表示疏水作用,图中可见其主要与蛋白周围K268、W80、L264、V270、T82、I84、Y272 和R273 氨基酸残基发生疏水作用。
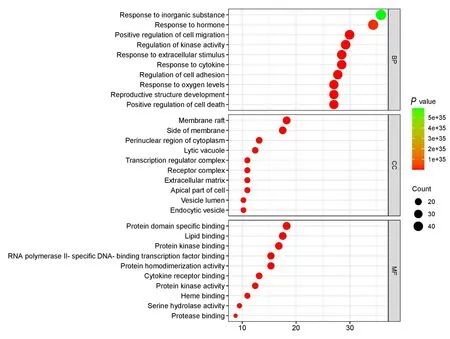
图7 潜在靶点的GO 富集分析图Fig.7 GO enrichment analysis diagram of potential targets
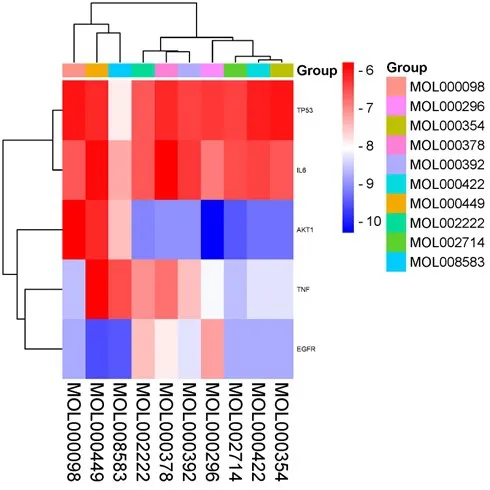
图8 分子对接结合能热图Fig.8 Heat map of molecular docking binding energy
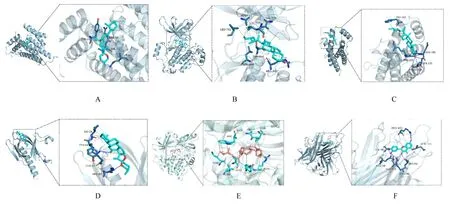
图9 核心成分和核心靶点分子对接结合能最佳结果示意图Fig.9 Schematic diagram of optimal binding energy results of core components and core target molecules
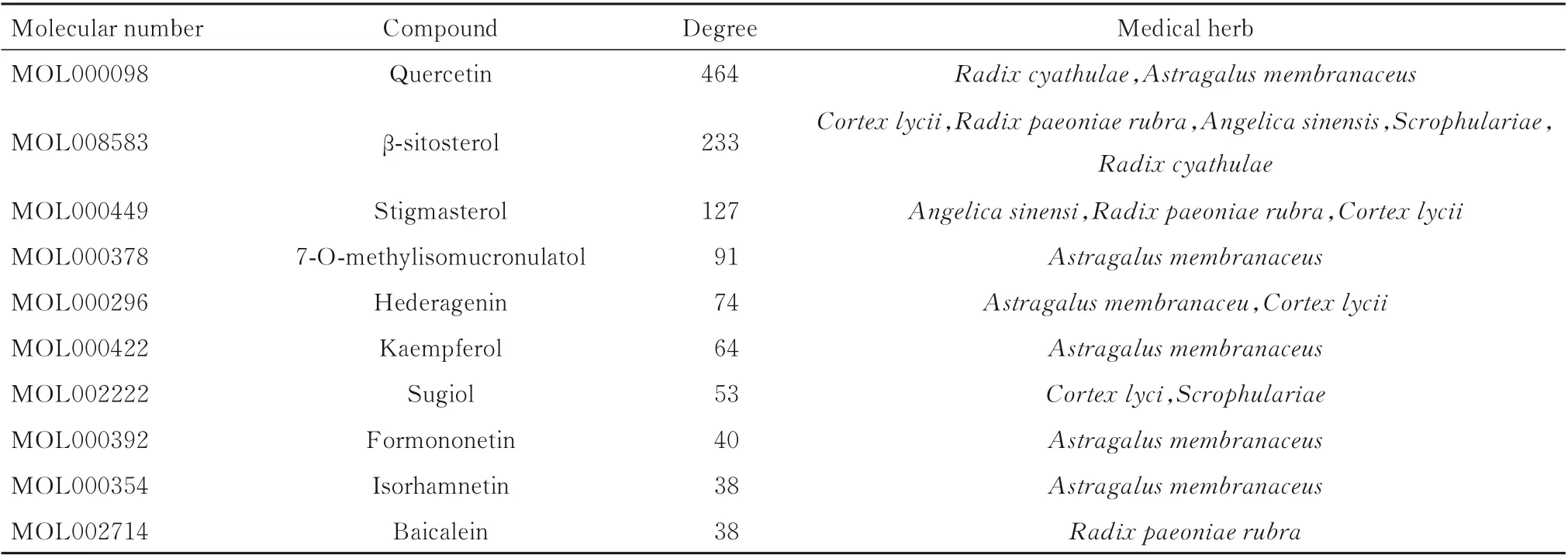
表1 药物主要活性成分Tab.1 Main active ingredients of drugs
2.8 细胞实验结果
2.8.1 各组雪旺细胞存活率 与对照组比较,高糖模型组雪旺细胞存活率明显降低(P<0.05);与高糖模型组比较,TLTT 组雪旺细胞存活率明显升高(P<0.05);弥可保组与TLTT 组雪旺细胞存活率比较差异无统计学意义(P>0.05)。见表2。
表2 各组雪旺细胞活性和存活率Tab.2 Activities and survival rates of Schwann cells in various groups (n=10,±s)
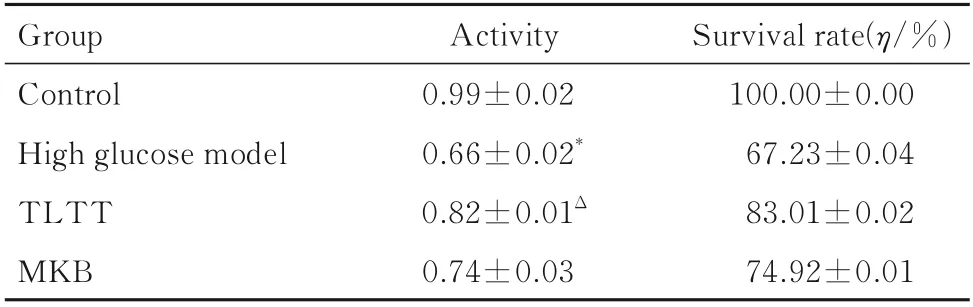
表2 各组雪旺细胞活性和存活率Tab.2 Activities and survival rates of Schwann cells in various groups (n=10,±s)
*P<0.05vscontrol group;ΔP<0.05vshigh glucose model group.
Group Control High glucose model TLTT MKB Activity 0.99±0.02 0.66±0.02*0.82±0.01Δ 0.74±0.03 Survival rate(η/%)100.00±0.00 67.23±0.04 83.01±0.02 74.92±0.01
2.8.2 各组雪旺细胞中AKT1 和TP53 蛋白表达水平 与对照组比较,高糖模型组AKT1 蛋白表达水平明显降低(P<0.05),TP53 蛋白表达水平明显升高(P<0.05);与高糖模型组比较,TLTT 组AKT1 蛋白表达水平明显升高(P<0.05),TP53 蛋白表达水平明显降低(P<0.05);TLTT 组与弥可保组雪旺细胞中AKT1 和TP53 蛋白表达水 平比较差异无统计学意义(P>0.05)。见图10。
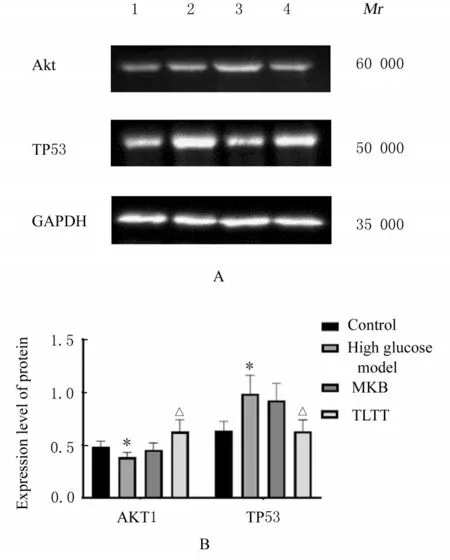
图10 各组雪旺细胞中AKT1 和TP53 蛋白表达电泳图(A)和直条图(B)Fig.10 Electrophoregram(A) and histogram(B) of expressions of AKT1 and TP53 proteins in Schwann cells in various groups
3 讨 论
DPN 是糖尿病常见并发症之一,主要累及感觉神经和运动神经,产生感觉及运动障碍,主要表现为双侧肢体疼痛、麻木和感觉异常等,严重者最终选择截肢[12]。2021 年12 月6 日,国际糖尿病联盟(international diabetes federation,IDF)官网发布了2021 年全球糖尿病地图,数据显示:2011—2021 年间中国糖尿病患者由0.9 亿增加至1.4 亿例,增幅达56%,其中约7 283 万例糖尿病患者尚未被确诊,另有约1.7 亿成人伴有糖耐量受损,约2 700 万名成人伴有空腹血糖受损。由于糖尿病的发病率迅速上升且病程逐步延长,糖尿病慢性并发症的发病率逐年升高[13]。DPN 不仅危害人们的健康,还给社会经济带来沉重的负担,美国2001 年数据调查显示其1 年内DPN 直接医疗费用为1 760 亿美元,高达 27%的糖尿病直接医疗费用归因于 DPN[14],给社会医疗体系和经济发展增添较大负担。因此,DPN 的防治工作意义重大。目前DPN 的治疗手段以控制血糖、饮食及生活方式干预、手术及对症治疗和病因治疗为主。强化血糖控制对1 型糖尿病周围神经病变患者有明显益处,但对于2 型糖尿病周围神经病变患者效果并不明显[15-16]。饮食及生活方式干预可有效预防 DPN,在糖耐量异常(impaired glucose tolerance,IGT)受试者中可增加表皮内神经纤维密度,改善神经性疼痛,但多数患者依从性较差,难以坚持[17]。手术松解腓总神经、腓深神经和胫神经对改善患者生活质量、降低糖尿病足及截肢发生率有所帮助,但并不是所有DPN 患者均适用,对于肢端对称性感觉障碍和血糖波动引起的急性痛性糖尿病神经病变手术治疗不能获益,且该方法为有创操作,故未能被推荐于临床应用[18]。对症止痛药和抗抑郁药物对 DPN 患者的临床症状有益,但此类药物不良反应较大,并且不会延缓神经病变的发展[19]。
虽然DPN 在中医学没有具体的病名,但根据DPN 临床表现,通常将其归属于中医学“痿证”“血痹”等范畴[20],其病机主要与病程日久所致阴阳气血亏虚、血行瘀滞和脉络痹阻等有关,临床可将DPN 分为气虚血瘀和阳虚寒凝等证型[21],与西医的单一效果比较,中药具有整体调节、多靶点和多途径等特点,采用中医药治疗DPN 疗效显著。本院谢春光教授总结前人经验并经过长期临床工作反复实践调整,研制出了具有益气活血、养阴润燥、开玄通络、祛瘀止痛和标本兼治的TLTT。该方组方包含生黄芪、水蛭、当归、玄参、川牛膝、地骨皮、赤芍和蚕砂等药物,作为临床制剂使用近30 年,前期临床研究显示出稳定的疗效。既往研究[22]证实:TLTT 可以降低患者血糖,调节血脂异常,改善感觉、运动神经传导速度和改善糖尿病患者感觉障碍和痛觉过敏等症状,能够改善DPN炎症状态。同时,还可以改善DPN 大鼠糖脂代谢、神经传导速度和降低血清炎症因子水平,能一定程度下调c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)和 磷 酸 化JNK (phosphorylated JNK,p-JNK)mRNA,抑制 JNK 信号通路的激活,改善高糖诱导的雪旺细胞凋亡从而治疗DPN[23-25]。
本研究采用网络药理学预测TLTT 治疗DPN的可能作用机制,结果显示:槲皮素、β-谷甾醇、豆甾醇、山奈酚、常春藤皂苷元、芒柄花素和异鼠李素是TLTT 治疗DPN 的主要化合物。现代研究[26-27]结果表明:谷甾醇和豆甾醇等植物类甾醇具有降低胆固醇、抗糖尿病及镇痛作用,能延缓2 型糖尿病的发病进程。槲皮素是一种具有降血脂、抗糖尿病并发症作用的黄酮类化合物,研究[28]显示:在糖尿病大鼠模型实验中,槲皮素对糖尿病周围神经病变具有较强的治疗作用。山奈酚作为一种类黄酮化合物,具有改善胰岛素抵抗和保护胰岛β 细胞功能的作用,山奈酚通过不同干预途径均对糖尿病并发症有一定的保护作用[29]。常春藤皂苷元是一种五环三萜类化合物,其质量分数达70% 以上的续断皂苷元可明显抑制α-糖苷酶活性[30]。芒柄花素属于异黄酮类化合物,长期使用芒柄花素能改善高血糖,增加神经组织中Sirtuin 蛋白和神经生长因子的表达,从而减轻热痛觉,提高神经传导速度,进而保护神经元[31]。异鼠李素是槲皮素的直接代谢物,对热痛觉具有明显镇痛效果[32]。但山奈酚和常春藤皂苷元对DPN 是否具有确切治疗作用尚需进一步研究。
对TLTT 与DPN 的共同靶点进行 PPI 映射,出现频次较高的关键靶点有26 个,前10 位分别为AKT1、TNF、TP53、EGFR、IL-6、VEGFA、JUN、CTNNB1、CASP3 和GADPH,可作为潜在治疗靶点。AKT1 是AKT 激酶之一,能够调节细胞存活、增殖、代谢和血管生成,具有诱导葡萄糖转运的功能,具有调节葡萄糖的摄取,调控糖尿病及并发症的作用。TP53 是一种抑癌蛋白和转录因子,在调节神经细胞凋亡相关基因中的平衡方面起重要作用,是调节细胞凋亡的核心,脂肪细胞和胰腺β 细胞的老化与TP53 有很强的关联性,其严重影响胰岛素分泌功能、胰岛素抵抗和葡萄糖稳态。
本研究中代谢通路富集分析表明:关键靶点富集在癌症通路、脂质和动脉粥样硬化、PI3K/Akt信号通路、晚期糖基化终末产物-糖基化终末产物受体信号通路和MAPK 等通路。本研究发现26 个核心靶点中有10 个基因(AKT1、FN1、IL-1B、IL-6、JUN、MAPK1、MAPK8、PIK3CA、TNF和VEGFA)富集在晚期糖基化终末产物-糖基化终末产物受体(AGE-RAGE)信号通路上。研究[33]显示:AGEs 与RAGE 结合造成神经病变是因血脑屏障被损伤,使毒性物质更多地通过,最终损害神经。从分子对接结果可知,槲皮素、β-谷甾醇、豆甾醇、7-O-甲基异芥糖醇、常春藤皂苷元、山柰酚、柳杉酚、刺芒柄花素、异鼠李素和黄芩素分别与AKT1、TP53、TNF、EGFR 和IL-6 结合能均小于-6.5 kcal·mol-1。本研究结果显示:TLTT能提高雪旺细胞存活率,具有上调AKT1 和下调TP53 的作用。
综上所述,本研究初步探索了TLTT 治疗DPN 的作用机制和物质基础,后续研究可针对本研究筛选的信号通路进行深入探索,进一步拓展TLTT 治疗DPN 的机制研究。本研究还存在以下不足之处:①药物成分和对应靶点来源于有限的数据库,未知成分有待深入研究;②中药复方虽由单味药物构成,但由于多味药物煎煮生成的最终化学成分与单味药物的有效成分并不完全相同,因此复方最终的成分与网络药理分析成分必然存在一定差异;③中药真正发挥效应的根本是药物在血中发挥作用的成分,主要涉及药物在体内的药代动力学和药物血清化学,因此以动物和药物为对象进行网络药理研究,得出的结果与临床患者数据存在一定的偏差。
