扶正化瘀片联合聚乙二醇干扰素α-2b治疗慢性乙型肝炎肝纤维化的疗效
2023-05-06袁媛杨阿妹
袁媛,杨阿妹
慢性乙型肝炎(CHB)是一种临床较常见的慢性坏死性炎症疾病,因持续感染乙型肝炎病毒(HBV)6个月以上,导致肝脏发生不同程度的炎症坏死或纤维化[1]。肝纤维化指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程[2]。有研究显示,在乙型肝炎肝硬化晚期,肝脏纤维化含量约为正常肝脏的6倍[3]。肝纤维化在CHB病毒感染过程中属中间阶段,如果不及早治疗,将发展为肝硬化,最终发展为肝癌。目前临床多采用抗肝炎病毒类药物治疗CHB肝纤维化。主要抗肝炎病毒类药物有干扰素(IFN)和核苷(酸)类似物(NAs)。聚乙二醇干扰素作为一种长效干扰素,具有治疗周期短、疗程固定、乙肝e抗原(HBeAg)转换率高等优点,对于希望短期完成治疗的患者或年轻患者可优先考虑使用[4],但是单纯的抗肝炎病毒类药物的治疗效果有限,无法满足临床治疗所需[5]。中医认为,造成肝纤维化主要原因是血瘀阻络,而正气亏虚是主要原因。研究表明,扶正化瘀片可明显改善CHB肝纤维化患者的临床症状和肝功能[6]。现观察扶正化瘀片联合聚乙二醇干扰素α-2b治疗CHB肝纤维化的疗效,报道如下。
1 资料与方法
1.1 临床资料 选取2020年6月—2021年6月中国人民解放军陆军第七十三集团军医院收治的105例CHB肝纤维化患者为研究对象,按照随机数字表法分为A组(n=52)与B组(n=53)。A组:男32例,女20例;年龄28~58(42.06±5.07)岁;病程2.5~10.0(8.65±2.17)年。B组:男34例,女19例;年龄29~57(41.98±5.11)岁;病程2.0~10.5(7.98±2.39)年。2组临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过。
1.2 病例选择标准 纳入标准:(1)符合《慢性乙型肝炎防治指南(2019年版)》[7]中CHB肝纤维化的相关诊断标准;(2)临床资料完整;(3)近6个月未进行抗纤维化治疗;(4)依从性强,能与医护人员进行良好沟通;(5)患者和家属签署知情同意书。排除标准:(1)患有全身感染的患者;(2)合并神经功能或其他系统异常的患者。
1.3 治疗方法 A组予以聚乙二醇干扰素α-2b注射液(厦门特宝生物工程股份有限公司生产)皮下注射,0.5 ml/次,1次/周,连续治疗24周。B组在A组基础上联合扶正化瘀片(上海黄海制药有限责任公司生产)1.6 g/次,口服,3次/d,连续治疗24周。
1.4 观察指标与方法 (1)肝功能指标:包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBil)。于治疗前、治疗24周后采用医用低速离心机分离血液血清后,采用全自动生化分析仪检测各项肝功能指标。(2)肝纤维化指标:包括Ⅲ型前胶原(PCⅢ)、透明质酸酶(HA)、Ⅳ型胶原(Ⅳ-C)、层粘连蛋白(LN)。于治疗前、治疗24周后分离血清后,采用放射免疫法测定肝纤维化指标。(3)血清炎性因子:包括白介素-6(IL-6)、白介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)。于治疗前、治疗24周后分离血清后,使用全自动生化分析仪采用酶联免疫吸附法检测其血清炎性因子水平。(4)细胞免疫功能指标:包括CD3+、CD4+、CD4+/CD8+。于治疗前、治疗24周后分离血液血清后使用贝尔曼流式细胞仪检测CD3+、CD4+、CD8+,并计算CD4+/CD8+。(5)不良反应:常见不良反应有恶心、失眠、轻度血小板减少、轻度白细胞减少等。
1.5 临床疗效判定标准 参考文献[8]中的疗效标准对治疗24周的所有患者进行评价。显效:临床症状和体征均消失,肝纤维化和肝功能指标均恢复至参考范围;有效:临床症状较治疗前减轻,肝纤维化和肝功能指标下降>50%;无效:临床症状以及肝纤维化、肝功能指标较治疗前均无明显改善。总有效率=(显效例数+有效例数)/病例总数×100%。

2 结 果
2.1 临床疗效比较 治疗24周后,A组中显效20例(38.46%),有效22例(42.31%),无效10例(19.23%),总有效率为80.77%。B组中显效28例(52.83%),有效22例(41.51%),无效3例(5.66%),总有效率为94.34%。B组总有效率高于A组(χ2=4.456,P=0.035)。
2.2 肝功能指标比较 2组治疗前血清ALT、AST、TBil水平比较,差异无统计学意义(P>0.05);2组治疗24周后血清ALT、AST、TBil水平低于治疗前,且B组低于A组(P<0.01),见表1。

表1 A组与B组治疗前后肝功能指标比较
2.3 肝纤维化指标比较 2组治疗前血清PCⅢ、HA、Ⅳ-C、LN水平比较,差异无统计学意义(P>0.05);2组治疗24周后血清PCⅢ、HA、Ⅳ-C、LN水平低于治疗前,且B组低于A组(P<0.01),见表2。
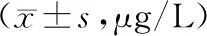
表2 A组与B组治疗前后肝纤维化指标比较
2.4 血清炎性因子水平比较 2组治疗前血清IL-6、IL-8、TNF-α水平比较,差异无统计学意义(P>0.05);2组治疗24周后血清IL-6、IL-8、TNF-α水平低于治疗前,且B组低于A组(P<0.01),见表3。
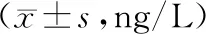
表3 A组与B组治疗前后血清炎性因子水平比较
2.5 细胞免疫功能比较 2组治疗前CD3+、CD4+、CD4+/CD8+比较,差异无统计学意义(P>0.05);2组治疗24周后CD3+、CD4+、CD4+/CD8+高于治疗前,且B组高于A组(P<0.01),见表4。

表4 A组与B组治疗前后细胞免疫功能指标比较
2.6 不良反应比较 在治疗期间,2组均无不良反应发生。
3 讨 论
CHB发病机制尚不明确,控制CHB病毒的感染,减轻肝细胞炎症坏死以及肝纤维组织增生,对CHB的治疗进展和减少并发症具有重要意义[9-10]。干扰素具有调节免疫活性、抗病毒的作用,在大部分恶性肿瘤和病毒感染的治疗中效果较好[11]。聚乙二醇干扰素α-2b在CHB患者抗病毒治疗中已取得明显进步,但仍有部分患者的疗效不持久或对此药无应答[12]。扶正化瘀片作为一种抗肝纤维化的中成药,能够减轻或消除肝脏炎症,减轻或去除肝纤维化,进而达到防治肝硬化的目的[13]。
本研究结果显示,治疗24周后,B组、A组总有效率分别为94.34%、80.77%,B组高于A组;2组治疗24周后肝功能指标(ALT、AST、TBil)以及肝纤维化指标(PCⅢ、HA、Ⅳ-C、LN)较治疗前明显降低,且B组治疗24周后上述指标低于A组,提示扶正化瘀片联合聚乙二醇干扰素α-2b能够有效减轻CHB肝纤维化程度,改善肝功能,加快病情恢复,疗效较好。贾瑞菡[14]研究结果显示,扶正化瘀胶囊联合干扰素治疗乙肝后肝纤维化患者效果明显,能抑制患者的肝纤维化,阻止肝炎病况恶化,改善患者预后,本研究结论与之相一致。分析原因发现,扶正化瘀片作为一种中成药,具有活血化瘀、益气养肝的作用,可有效保护肝功能[15-16]。
本研究结果显示,治疗24周后,2组血清IL-8、IL-6、TNF-α水平较治疗前降低,CD3+、CD4+、CD4+/CD8+较治疗前升高,且B组优于A组,提示扶正化瘀片联合聚乙二醇干扰素α-2b能够减轻CHB肝纤维化患者的炎性反应,提高其免疫功能。其原因可能是炎性反应参与了CHB肝纤维化的发生,扶正化瘀片和聚乙二醇干扰素α-2b在CHB肝纤维化的治疗中发挥着协同作用,能够降低炎性反应,改善患者病情以及降低其肝纤维化程度[17-18]。本研究中2组患者均未发生明显不良反应,表明联合用药不会增加不良反应的发生风险,且具有较高的安全性。本研究存在的不足是纳入的样本量有限,后续需要扩大研究范围,增加研究样本数量,展开进一步研究。
综上所述,扶正化瘀片联合聚乙二醇干扰素α-2b治疗CHB肝纤维化的疗效明显,能够缓解患者的肝纤维化程度和炎症状态,进而改善其肝功能,同时联合用药也无明显的不良反应,因此值得临床广泛应用。
利益冲突:所有作者声明无利益冲突。
