NADH 扰动对酿酒酵母葡萄糖效应的影响
2023-05-06徐亚英李志敏
徐亚英,李志敏
(华东理工大学生物反应器工程国家重点实验室, 上海 200237)
酿酒酵母是衣康酸生物合成的细胞工厂之一[1-2]。廉价易得的葡萄糖是衣康酸生产的主要碳源,但是酿酒酵母的葡萄糖效应是衣康酸生产的限制因素,不能进入三羧酸循环(TCA)途径的丙酮酸溢流使得培养基中积累乙醇和甘油,而TCA 途径和乙醛酸途径提供衣康酸合成的重要前体柠檬酸,在葡萄糖利用阶段被抑制[3-5]。有研究证明酿酒酵母的溢流现象是由于葡萄糖效应限制了呼吸能力,即葡萄糖效应使得酵母线粒体无力消化糖酵解途径(EMP)快速积累的还原型烟酰胺腺嘌呤二核苷酸(NADH),利用NADH 氧化酶(NOX)和可替代氧化酶(AOX1)可以减弱葡萄糖效应[6-7]和降低NADH 水平,从而减少了甘油和乙醇产量。但是在恒化培养条件下,葡萄糖仍然处于限制状态,因此需要了解分批培养高糖情况下NADH水平的扰动对酿酒酵母葡萄糖效应的影响。
酿酒酵母胞质中过量的NADH 一般会先被NADH脱氢酶NDE1 和NDE2 氧化,超出其氧化能力的NADH会被3-磷酸甘油脱氢酶(GPD)氧化[8-9]。GPD 催化NADH 依赖的磷酸二羟丙酮 (DHAP) 转化为 3-磷酸甘油,后者通过DL-3-磷酸甘油进一步转化为甘油[10-12]。两种同工酶 GPD1p 和 GPD2p 产生GPD 活性,GPD1p的表达受高渗透压甘油反应途径的调节,而 GPD2p的表达随着对胞质NADH 再氧化需要的增加而增加[10,13]。本文尝试利用不同拷贝质粒表达nox基因来减少甘油的积累,并且替换了酿酒酵母的gpd2基因,利用启动子Pgpd2控制nox基因 (来自Streptococcus pneumoniae)的表达[14-15]。理论上当胞质NADH 过量时启动子Pgpd2会上调nox的基因表达,以氧化胞质过量的NADH,避免碳源损失到甘油。另一方面,葡萄糖生产的丙酮酸大部分无法进入TCA 循环,导致其经丙酮酸脱羧酶(PDC)和乙醛脱氢酶(ALD)反应形成乙醛和乙醇。为减少葡萄糖生产衣康酸过程中乙醇副产物的积累,本文还在高、低拷贝质粒中外源表达了来自H.capsulatum的替代氧化酶AOX1(GenBank AF133236 )[16],并利用酿酒酵母线粒体定位信号与AOX1 融合表达,以减少AOX1 对胞质NADH氧化的影响。
1 材料与方法
1.1 材料
1.1.1菌株和质粒 背景菌株是酿酒酵母BY4741(下文简称BY4741),质粒构建实验在大肠杆菌中进行,利用DH5a作为感受态,pRS415、pRS413、pRS423、pRS425 作为穿梭质粒。本文所用的菌株和质粒分别详见表1、表2。

表2 本文所使用的质粒Table 2 Plasmids used in this paper
1.1.2试剂 DNA 聚合酶购自宝(大连)生物工程有限公司;限制性内切酶购自NEB(北京)有限公司;酵母基因组提取试剂盒和大肠杆菌质粒提取试剂盒购自天根生化科技有限公司;胶回收试剂盒购自生工生物工程(上海)股份有限公司;无缝克隆试剂盒购自汉恒生物科技(上海)有限公司;MitoTracker®GreenFM线粒体绿色荧光探针购自翌圣生物科技(上海)股份有限公司;引物合成由生工生物工程(上海)股份有限公司完成;序列测定由上海派森诺生物科技有限公司完成。酵母提取物(YeastExtract)购自安琪酵母股份有限公司;蛋白胨(Peptone)、无氨基酵母氮源(YNB)培养基购自生工生物工程(上海)股份有限公司;葡萄糖和培养基用无机盐购自国药集团化学试剂有限公司;各种氨基酸购自上海麦克林生化科技有限公司。文中所用试剂均为分析纯。
1.1.3培养基 大肠杆菌种子培养基(g/L):LB(Luria-Bertani)培养基(酵母提取物5、蛋白胨10 和NaCl10),用于大肠杆菌的生长,固体培养基则还需要添加琼脂粉1.5~1.6g/L;转化子筛选时需要添加氨苄青霉素至质量浓度100μg/mL。酿酒酵母种子培养基(g/L):YPD(YeastExtractPeptoneDextroseMedium)培养基(酵母提取物10、蛋白胨20 和葡萄糖20),固体培养基则还需要添加琼脂粉2g/L,利用CRISPR/Cas9 技术进行基因整合时还需要添加诺尔丝菌素和潮霉素分别至质量浓度100μg/mL 和500μg/mL。酿酒酵母发酵培养基(g/L):葡萄糖20,YNB1.7,(NH4)2SO45,氨基酸缺失补充剂dropout等[17]。葡萄糖单独灭菌,灭菌条件:115℃,30min。YNB(Yeast NitrogenBase)、(NH4)2SO4 和dropout 等配制成10×母液,0.22μm 无菌薄膜滤菌器过滤除菌。
1.1.4引物 文中所用引物详见表3。

表3 本文所使用的引物Table 3 Primers used in this paper
1.2 实验方法
1.2.1质粒构建和基因整合nox,mCherry基因为本实验室所有,aox1基因由金唯智公司合成,本文中使用的所有启动子和终止子都从酿酒酵母S288C 基因组扩增得到,aac2、bcs1p基因扩增自酿酒酵母S288C 基因组。本文中质粒大都使用无缝克隆试剂盒构建,以质粒pRS413-PGPD2-nox-TCYC1的构建为例:其以酿酒酵母S288C 基因组为模板扩增得到PGPD2启动子(引物zw-1F,zw-1R 扩展)和TCYC1(引物zw-3F,zw-3R 扩展),以肺炎链球菌基因组为模板扩增得到基因nox(引物zw-2F,zw-2R),限制性内切酶BamHI酶切质粒pRS413 得到线性化载体,无缝克隆酶一步连接后钙转涂板,对菌落进行PCR 得到阳性转化子。本文利用CRISPR/Cas9 基因编辑技术进行了基因整合实验,以GPD2△::nox为例:以pHYB 为模板,用引物zw-23F 和zw-23R 扩增得到线性化载
体,DpnI 内切酶酶切后钙转涂板,对菌落进行PCR 得到阳性转化子pHYB-sggpd2;以目的基因nox为模板,引物zw-24F 和zw-24R 扩增得到Donor DNA,将质粒pHYB-sggpd2和Donor DNA LiAC 转化进已经含有质粒pCAS9-NAT 的酵母菌,再进行菌落PCR 验证,消质粒后得到阳性菌。
1.2.2重组菌的培养 将LEU 营养缺陷型的YSC(YeastSyntheticCompleteMedium)平板上的重组菌XYY21-XYY31、Z1 和Z2 接种到YSC-LEU 培养基,在30℃培养20~24h,将活化后的种子液接种到酵母发酵培养基(含20g/L的葡萄糖)中,初始OD600值为0.1,在30℃、220r/min摇床中培养120h,每12~24h取样,摇瓶培养基装液量为50mL,为了增加摇瓶中的氧浓度,后期摇瓶培养基装液量为30mL。将YSC 平板上的重组菌L1~L3 和A1~A7 分别接种到YSC-LEU和YSC-HIS 培养基,将活化后的种子液接种到酵母发酵培养基(含20g/L的葡萄糖)中,初始OD600值为0.1,在30℃、220r/min 摇床中培养72h,14~20h取样,染色后采用激光共聚焦显微镜观察。
1.2.3分析方法 通过测量600nm处的吸光度来监测细胞生长。甘油、乙醇和衣康酸的浓度通过高效液相色谱仪(HPLC)分析,使用aminexHPX-87H离子色谱柱(Bio-Rad,Hercules,USA)、折光率检测器(RID-10A,ShimadzuCorporation,Kyoto,Japan)、UV检测器(SPD-10A,Shimadzu Corporation)和LC Solutions系统(ShimadzuCorporation)。流动相是流速为0.5mL/min的5mmol/LH2SO4 溶液。HPLC柱在 30 ℃ 下操作。
1.2.4荧光显微镜 A1~A7 和L1~L3 酵母细胞在摇瓶中培养14~20h 时取样,离心收集细胞,去除上清,再用磷酸盐缓冲液(PBS)或者培养基YSC 冲洗1 次;用30℃预热的PBS 缓冲液或者用培养基YSC 将细胞稀释至OD600值为0.1(1×106cells/mL),加入MitoTracker®GreenFM线粒体绿色荧光探针使其终浓度为400nmol/L,在30℃、220r/min避光条件下孵育50min;染色完成后低速离心收集细胞,加入300μL PBS 缓冲液冲洗菌体;离心收集菌体,加入100μL PBS 缓冲液重悬菌体用于激光共聚焦显微镜观察。与MitoTracker®GreenFM线粒体绿色荧光探针不同的是,DAPI(4,6-Diamidino-2-phenylindole)孵育15min,在缓冲液中终质量浓度0.1μg/mL,其他条件相同。
2 结果与分析
2.1 NADH 氧化酶NOX 对葡萄糖效应中甘油合成的影响
为利用NADH 氧化酶NOX 减少酿酒酵母生产甘油,本文构建了高低拷贝的nox基因表达载体(高拷贝表达载体PRS423-PGPD2-nox-TCYCI,低拷贝表达载体PRS413-PGPD2-nox-TCYCI来)减少胞质过量的NADH。摇瓶培养结果表明(图1(a)),利用低拷贝质粒过表达nox基因时,24 h 葡萄糖全部消耗,培养基中甘油和乙醇的积累没有受到明显影响,24 h时菌株XYY23(含低拷贝表达质粒)的甘油质量浓度达到1.17 g/L,比对照菌株(XYY21(含低拷贝表达质粒),1.39 g/L)减少了15.83%,衣康酸滴度比对照菌株也有一些减少。利用高拷贝质粒表达nox(nox过表达菌株(XYY24))在24 h 生产甘油0.74 g/L,比对照菌(XYY22,1.32g/L)减少43.94%,且0~120 h时乙醇、乙酸、衣康酸浓度和酵母生长都没有受到明显影响。
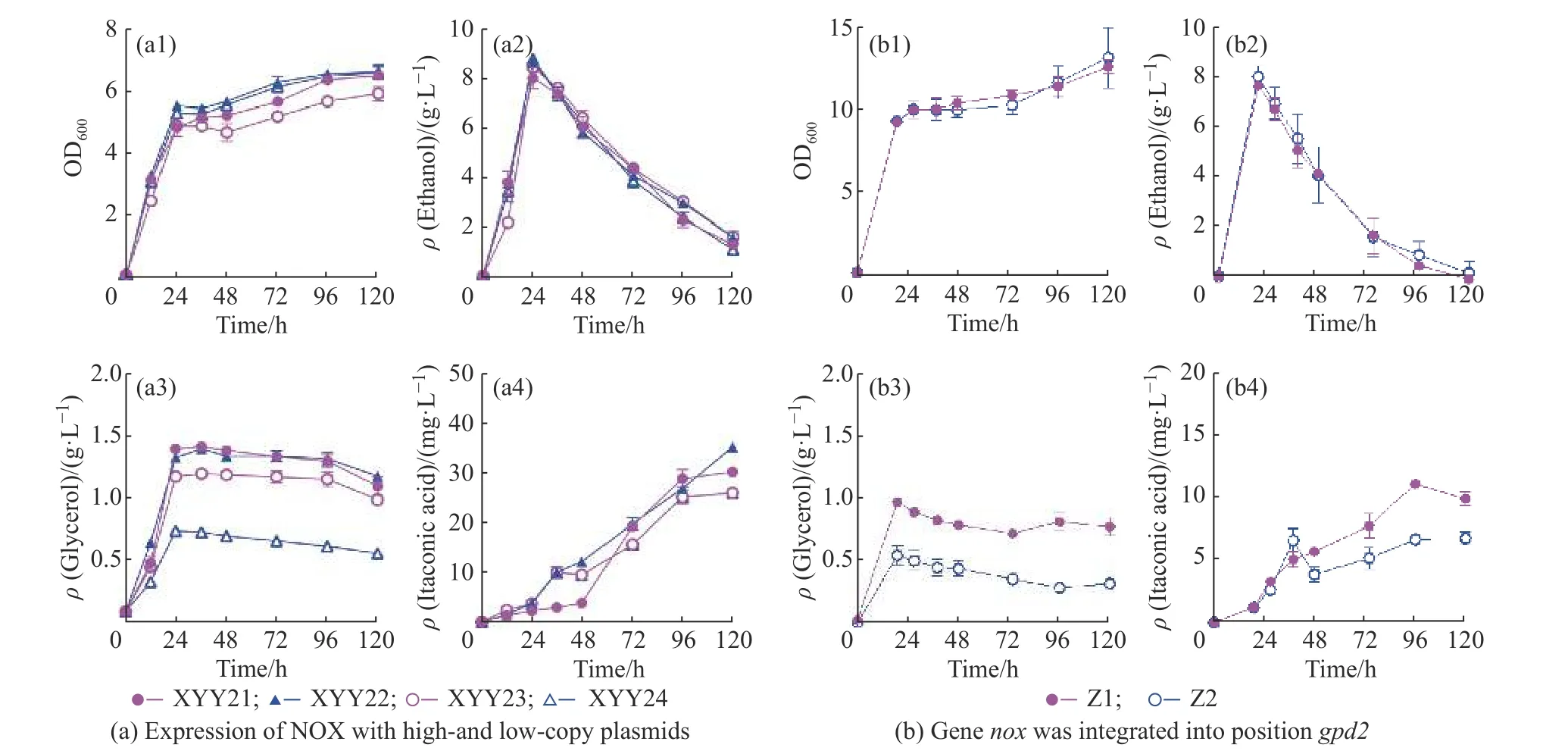
图1 利用NADH 氧化酶NOX 减少甘油生产Fig.1 Reducing glycerol production with NADH oxidase NOX
利用CRISPR/CAS9 基因编辑技术将PGPD-cadATCYC1整合到酿酒酵母基因组的HO 位点,nox基因直接替换酿酒酵母的gpd2基因。摇瓶实验结果显示基因nox替换gpd2成功减少了甘油的碳通量,培养基中的甘油积累从0.88 g/L 减少至0.49 g/L。菌株生长和乙醇产生没有受到明显影响,但是整合菌株Z2 的衣康酸产量比XYY24降低(图1(b))。
2.2 酿酒酵母表达外源替代氧化酶AOX1
本文构建了高、低拷贝的aox1基因表达载体并通过摇瓶实验尝试其干扰乙醇生产的效果,摇瓶培养结果显示低拷贝载体表达aox1(XYY25)对代谢没有明显影响,而高拷贝表达aox1的酵母菌XYY26 在葡萄糖初始质量浓度20 g/LYSC 培养基中的乙醇生产没有减少,而是形成与XYY24 相似的效果,培养基中甘油质量浓度由1.39 g/L 减少到0.91 g/L,减少了34.53%(图2),与已有研究结果不同[6]。文献报道NOX 定位在酵母细胞质[6],AOX1 定位在酿酒酵母的线粒体[15],我们猜测菌株XYY26 中的AOX1 蛋白在胞质有残留,所以形成与PGPD2-nox表达菌XYY24 相似的效果。为了验证我们的猜测,本文利用荧光蛋白和荧光探针共定位实验来观察NOX 和AOX1 在酿酒酵母中的定位。通过激光共聚焦显微镜观察(图3),发现nox在启动子PGPD2控制下成功表达并且定位在酿酒酵母细胞质,而AOX1 主要集中在酿酒酵母的线粒体,但胞质也有一些荧光残留,这可能是因为AOX1定位到线粒体的过程中在胞质中残留的原因,或者线粒体负载AOX1 过量的原因。
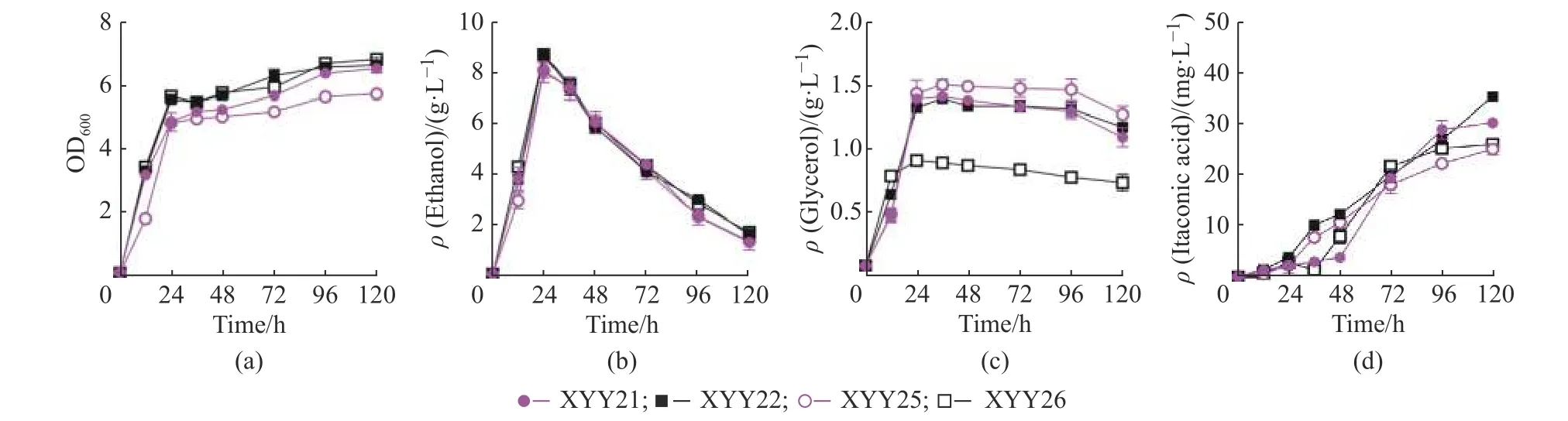
图2 利用替代氧化酶AOX1 减少乙醇生产Fig.2 Reducing ethanol production by overexpressing an alternative oxidase AOX1
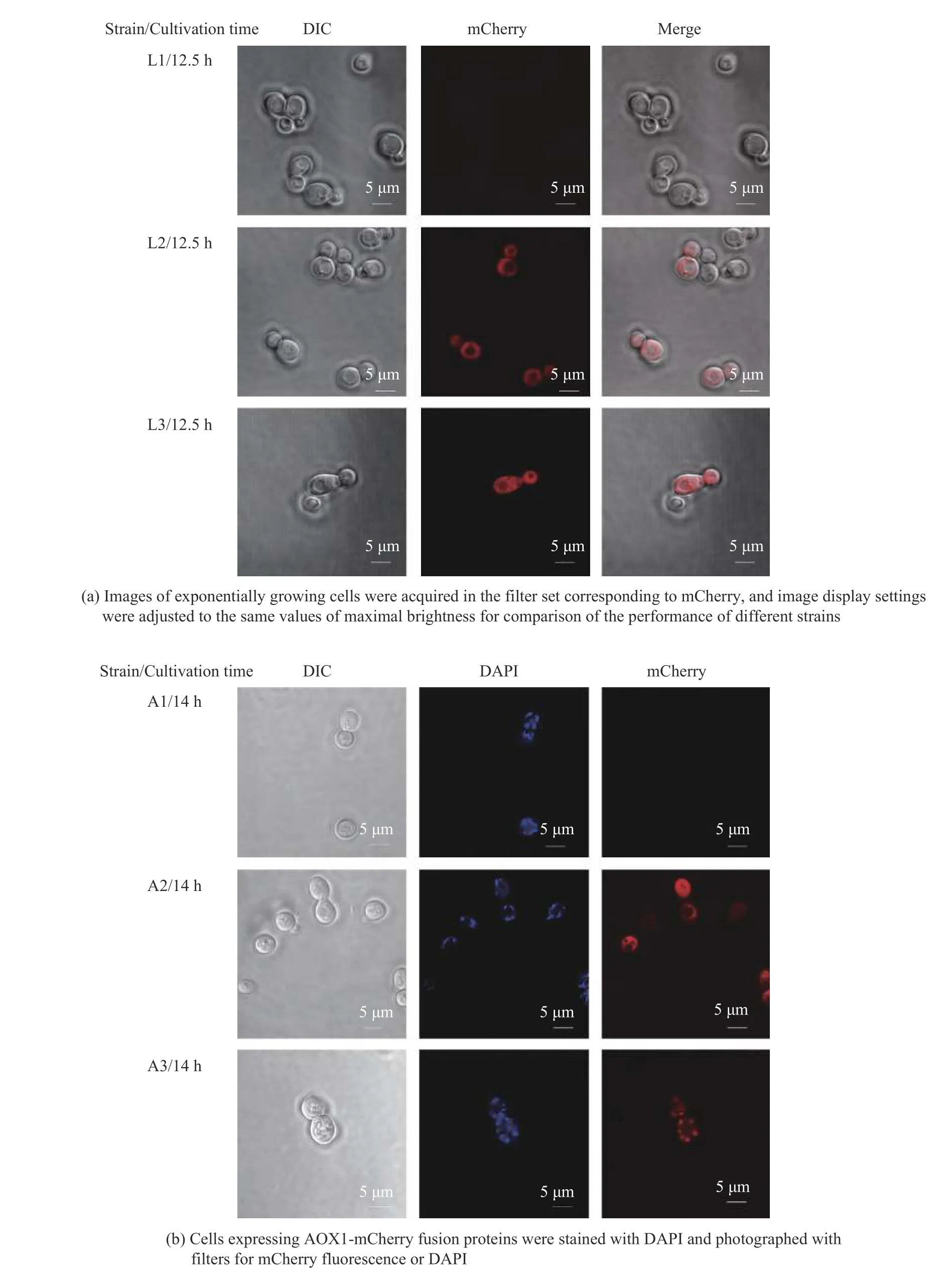
图3 NOX(a)和AOX1(b)在酿酒酵母中的定位Fig.3 Location of NOX(a) and AOX1(b) in Saccharomyces cerevisiae
2.3 替代氧化酶AOX1 强化定位线粒体的作用
为了使AOX1 更好地集中定位到酿酒酵母的线粒体内膜中,减少其对甘油生产的影响,本文找到了定位在线粒体内膜且面向线粒体膜间空间的蛋白PET9/AAC2 和面向线粒体基质的内膜蛋白BCS1 的前导序列蛋白BCS1p,作为将AOX1 定位至线粒体内膜的定位信号[19]。AAC2 是线粒体内膜的主要ADP/ATP载体,其主要作用是用胞质ADP 交换线粒体合成的ATP,但在某些条件下,如好氧指数生长在葡萄糖培养基中时,其作用方向相反。BCS1 是复合物 III 组装所需的蛋白质转位酶和分子伴侣,AAA ATPase 家族的成员。从激光共聚焦实验结果来看,AAC2 和BCS1p 都具有良好的线粒体定位效果(图4)。
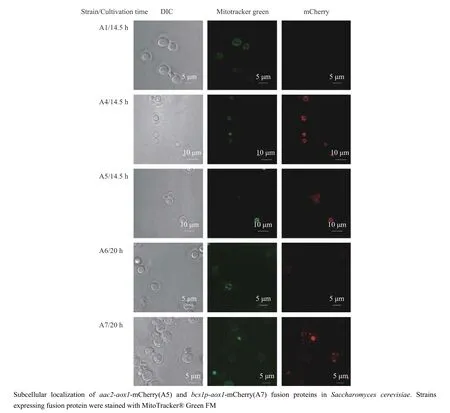
图4 利用线粒体定位信号将替代氧化酶AOX1 定位至线粒体Fig.4 Further location of AOX1 in mitochondria of Saccharomyces cerevisiae with mitochondrial localization signals
AAC2-AOX1 和BCS1p-AOX1 融合蛋白的摇瓶培养结果表明,24 h 时融合蛋白摇瓶培养的甘油产量相比AOX1 表达菌株没有受到影响,乙醇、柠檬酸、丙酮酸的质量浓度没有明显变化,36~72 h范围内衣康酸生产速度加快(图5),所以认为在AOX1的N 端添加线粒体内膜定位信号有助于减少AOX1 胞质定位,以减弱其对胞质NADH 的影响。但是在初始葡萄糖质量浓度20 g/L 的YSC 培养基中,aox1表达菌株依然受葡萄糖效应影响从而产生大量乙醇,即没能减缓高浓度初始葡萄糖培养基导致的葡萄糖效应。有趣的是,bcs1p-aox1的表达能够增加乙醇利用阶段衣康酸的产量,这可能是因为bcs1p-aox1增加了线粒体NADH 的代谢速度,部分解除了葡萄糖效应对衣康酸合成路径基因表达的抑制作用。

图5 AOX1 线粒体定位提高衣康酸滴度Fig.5 Mitochondrial localization of AOX1 increases the titer of itaconic acid
3 讨 论
利用酿酒酵母合成衣康酸面临着葡萄糖效应限制的问题,本文探讨了不同强度表达外源胞质NADH氧化酶NOX 和线粒体可替代氧化酶AOX1 对酿酒酵母分批发酵葡萄糖效应的影响。通过利用CRISPR/Cas9 将酿酒酵母的3-磷酸甘油脱氢酶GPD2替换为NADH 氧化酶NOX,减少了葡萄糖效应导致的甘油碳代谢流的增加。在aox1基因过表达菌株的摇瓶实验中,发现aox1基因过表达菌株没有减少乙醇的得率,反而会干扰胞质甘油的形成。所以本文利用线粒体内膜定位信号AOX1 融合蛋白为AAC2-AOX1 和BCS1p-AOX1,将AOX1 进一步定位至线粒体,减少了AOX1 对胞质NADH 氧化的影响,虽然没有改善葡萄糖效应副产物乙醇的积累,但是增加了发酵培养36 h 之后产生的衣康酸的质量浓度,120 h时衣康酸质量浓度增加至116.98 mg/L。本文结果表明表达外源NADH 氧化酶NOX 和可替代氧化酶AOX1 在高糖培养基分批发酵过程中对葡萄糖效应的影响,这有助于进一步提高酿酒酵母工程菌利用葡萄糖生产TCA 循环衍生物,但是需要进一步研究如何减少葡萄糖效应副产的乙醇积累问题。
全基因组复制事件是引起葡萄糖效应的主要驱动力,包括13 种糖酵解酶中的6 种重复酶和己糖转运体数量的增加,这导致糖酵解通量增加[20-22],而细胞的蛋白质含量有限,可以分配给新陈代谢的蛋白质组的比例受到限制,所以糖酵解通量的增加和相关蛋白水平的提高是以牺牲呼吸系统蛋白为代价的,糖酵解途径积累的NADH 只能通过快速生成副产物乙醇和甘油后再循环。调控细胞质和线粒体的NADH水平能够在一定程度上减轻葡萄糖效应的影响,但是在分批培养过程中该方法并不能从根本上解决葡萄糖效应,这可能是因为葡萄糖运输是糖酵解的主要通量控制步骤,是影响葡萄糖效应的主要因素之一[21]。NOX 和AOX 表达菌株在分批培养中,从结果上能减少葡萄糖效应形成的NADH,但是高葡萄糖运输这一主要因素不能控制,所以发酵途径的蛋白翻译不受影响,仍然有乙醇生产。葡萄糖效应以牺牲其他蛋白的比例来增加糖酵解酶的现象,使得控制糖酵解通量应该是解决葡萄糖效应的重要策略,有文献通过降低PYK 酶活性就达到了很好的葡萄糖效应抑制结果[23-24],但是大都以牺牲酿酒酵母生长为代价。
