施秉喀斯特遗产地常绿阔叶林土壤螨类群落结构及对环境因子的响应
2023-05-05周园园殷秀梅刘文俊贵州师范大学喀斯特研究院国家喀斯特石漠化防治工程技术研究中心贵州贵阳550001
周园园,陈 浒,魏 强,殷秀梅,刘文俊 (贵州师范大学喀斯特研究院/国家喀斯特石漠化防治工程技术研究中心,贵州 贵阳 550001)
土壤螨类是森林土壤环境的重要组成部分,是土壤有机质的重要分解者,在维持地下生态系统物质循环和能量流动中发挥着重要作用[1-2]。近年来,土壤螨类与地上植物群落的相互作用越来越受关注。一方面,土壤螨类可通过破碎凋落物[3-5]或调控微生物和原生动物的方式影响分解过程,提高土壤养分的矿化速率和无机养分供给来促进植物生长[6],并对地上植物群落物种组成、结构和演替起着重要调控作用[7-8]。另一方面,地上植物群落的变化直接影响着森林凋落物的组成和营养物质含量,改变土壤动物的食物质量和数量,进而对地下土壤螨类组成和群落结构产生影响[9];同时,植物群落还能通过影响土壤理化性质间接影响土壤螨类群落分布[10]。此外,土壤螨类对环境变化敏感,是指示植被演替、环境干扰及气候变化等的重要生物指标[11]。因此,研究土壤螨类群落结构及多样性与地上植被的相互关系,对理解地上、地下生态过程的时空变化有重要意义。
施秉喀斯特世界自然遗产地(以下简称“遗产地”)是中国南方喀斯特二期系列遗产地之一,在全球热带—亚热带地区白云岩喀斯特地貌分布上极具代表性,同时因其满足世界遗产标准(vii)与标准(viii),于2014年6月在第38届世界遗产大会上被列入《世界遗产名录》[12]。遗产地属于典型的过渡性质的亚热带山地森林生态系统,是中国南方喀斯特地区森林植被覆盖度高、动植物资源较为丰富的地区之一[12]。其特殊的自然环境使得该地区发育了独特的白云岩喀斯特地貌,保留了大面积的喀斯特原生植被,植被演替顶级为中亚热带常绿阔叶林和常绿落叶阔叶混交林,群落成层结构明显,在生物多样性方面集中体现了白云岩喀斯特峰丛峡谷所独有的生物和生态演化特征[13]。截至目前,国内外已有关于非喀斯特环境下世界自然遗产地森林土壤螨类群落结构的研究[14],但是对于喀斯特森林环境下,尤其是白云岩喀斯特森林生态系统中土壤螨类群落结构的研究较为匮乏。
相关研究表明,西南喀斯特地区的天然森林,特别是常绿阔叶林,是土壤螨类的“避难所”[14],而遗产地分布着大量的原生性亚热带常绿阔叶林[8]。基于此,以施秉白云岩喀斯特常绿阔叶林生态系统土壤螨类为研究对象,通过对常绿阔叶林不同植被类型下土壤螨类结构特征、多样性及其与环境因子的相关性进行对比分析,从生物生态学方面揭示遗产地土壤螨类生态价值,研究结果可为森林生态系统的健康监测与评估提供生物对比数据,同时为遗产地土壤生物多样性保护提供科学支撑。
1 材料与方法
1.1 研究区概况
遗产地位于贵州省黔东南施秉县境内(27°05′49″~27°13′59″ N,108°01′34″~108°09′32″ E),处于云贵高原向湖南低山丘陵过渡带的山前斜坡地带,同时也是我国第二阶梯与第三阶梯之间的地形阶梯过渡区边界,地势北高南低,平均海拔912 m。与云台山景区、杉木河景区、生态水源涵养区重合,遗产地总面积282.95 km2,其中核心区面积为102.80 km2,缓冲区面积为180.15 km2。遗产地属于中亚热带季风湿润气候区,气候温和,雨量充沛,年平均气温为16 ℃,年平均降水量达1 220 mm,年均相对湿度为80%。成土母岩为寒武系纯白云岩,土壤类型主要是白云岩风化的薄层石灰土。遗产地保存和发育了大面积的白云岩喀斯特原生森林生态系统,山体中下部形成原始的中亚热带常绿阔叶林生态系统,典型的地带性植被类型为常绿阔叶林,森林覆盖率达93.95%,是白云岩喀斯特森林植被自然演替的顶级阶段[15]。
1.2 研究方法
1.2.1样地选择与设置
根据遗产地的常绿阔叶林分布情况,以生态良好、地势相对平坦和采样的可操作性为原则,在遗产地常绿阔叶林生态系统中选取了典型的3个植物群落作为实验样地,其植被类型分别为黑壳楠+山胡椒群落(EBF1)、乌冈栎+大明松群落(EBF2)、香叶树+女贞群落(EBF3),样地面积约为20 m×30 m。同期记录各样地的经纬度、海拔、坡度和植被组成状况,样地详细情况见表1。

表1 研究区土壤螨类自然环境Table 1 Natural environment of soil mites in the study area
1.2.2样品采集与处理
2021年9月,在每个样地中沿对角线设置3个5 m × 5 m的样方,间隔5 m左右,每个样方随机设置2个采样点。拾取各样点表层的枯枝落叶后,进行腐殖质层切(刮)取,用500 cm3标准环刀量取一环刀腐殖质层土样,单个取样面积为15 cm × 15 cm;同时采用容积为500 cm3的土壤环刀在各样点进行0~5 cm(上层)和>5~10 cm(下层)土壤层连续采样,每个样点采集3个垂直剖面层,总样品数量为54个(3种植被类型 × 3个样方 × 2个采样点 × 3个土层)。
所有样品装入透气性良好的棉布袋,带回室内后采用Tullgren法连续烘烤48 h后,将分离出的螨类保存在φ=75%的酒精中进行清洗和固定,最后于盛有乳酸溶液的塑料试管中常温保存。将透明色的螨类制成临时标本,置于Olympus显微镜下观察,参照已有文献进行标本形态学鉴定[16]222-416,[17]124-564,[18-19],所有样品均鉴定到属,分类单元主要采用文献[17]124-232的分类系统。
1.2.3环境因子采集与测定
同期在各样方用铁铲按0~5和>5~10 cm分别采集500 g供化学性质分析的土壤,于塑料薄膜上剔除石块和植物根茎后混合均匀,共计9个样品(3个样地 × 3个样方 × 1个混合样)。采用100 cm3环刀在各样方内采集供物理分析的土壤,共计18个(3个样地 × 3个样方 × 2个垂直剖面层),将同一样点的上下层土壤物理性质数据取平均值作为1个重复。
土壤容重、饱和含水量、自然含水量的测定采用原位环刀法。总孔隙度计算方法为
P=93.947-32.995×DB。
(1)
式(1)中,P为总孔隙度,%;DB为容重,g·cm-3。
水解氮含量采用碱解扩散法测定;全磷含量采用硫酸-高氯酸消煮,钼锑抗比色法测定;速效磷含量采用碳酸氢钠浸提,钼锑抗比色法测定;全钾含量采用氢氟酸-高氯酸消煮,火焰光度计法测定;速效钾含量采用中性乙酸铵浸提,火焰光度计法测定。测定方法参照文献[20]。
1.2.4数据计算与分析
(1)群落优势度的划分[21]。个体数占总捕获量10%以上为优势类群(++++),个体数占总捕获量1%~10%为常见类群(+++),个体数占总捕获量0.5%~<1%为稀有类群(++),个体数占总捕获量0.5%以下为极稀有类群(+)。
(2)群落结构分析[22]。采用Shannon-Winner多样性指数(H)、Margalef丰富度指数(RS)和Pielou均匀度指数(J)表征群落结构。计算公式为
(2)
RS=(S-1)/lnN,
(3)
J=H/lnS。
(4)
式(2)~(4)中,Pi为第i属个体数量占总个体数的比例;S为类群(属)数;N为土壤螨类全部类群的个体总数。
(3)群落相似性分析[23]。Jaccard相似性系数(q)的计算公式为
q=c/(a+b-c)。
(5)
式(5)中,a为A群落类群数;b为B群落类群数;c为两群落共有类群数。q值判定阈值如下:0~<0.25 为极度不相似;0.25~<0.5为中等不相似;0.5~<0.75为中等相似;0.75~<1为极度相似。
(4)甲螨生态类群MGP分析。采用甲螨MGP分别计算各类群属数百分比和各类群个体数百分比[16]222-416,[24-25]。甲螨主要分为三大类群,分别为大孔低等甲螨群(Macropylina group,简称M)、无翅坚背甲螨群(Gymnonota group,简称G)和有翅孔背甲螨群(Poronota group,简称P)。分别以20%和50%为阈值,将甲螨类群划分为6种生态群落类型:M型(M>50%)、G型(G>50%)、P型(P>50%)、O型(20% (5)捕食性革螨生态类群。采用捕食性螨类成熟度指数(MI,IM)分析中气门螨类生态类群[26],计算公式为 (6) 式(6)中,s为土壤螨群落中气门螨类属数;Ki为第i属所属科的K值;ri为第i属所属科的r值。MI值<0.5,即为r选择;MI值=0.5,即为K和r选择;MI值>0.5,即为K选择。 采用Excel 2019软件进行基础数据整理,在 SPSS 20.0软件中进行不同生境土壤螨类群落多样性和土壤理化因子的单因素方差分析,使用LSD法进行多重比较。对不符合正态分布的数据采用Tamhane′s T2法检验,显著性水平取P<0.05,同时利用Origin 2021软件进行柱状图绘制。 将同一样方2个样点内收集的螨类群落属数、个体数量和多样性数据求平均值,作为1次重复,采用Spearman相关性分析螨类群落各参数与环境因子的相关性,所有数据进行ln (x+1)转换,以确保试验数据满足正态分布假设,减小量纲对分析结果的影响,同时利用TBtools软件进行双向聚类相关性热图的绘制。 为减少稀有类群对排序结果的影响,降低图形的复杂程度,选取优势度>1%的土壤螨类物种(共计26属,即土壤螨类优势属和常见属),采用Canoco 5.0软件绘制土壤螨类组成与土壤环境因子解释变量关系的二维排序图。首先,用除趋势对应分析(detrended correspondence analysisi,DCA)计算出排序轴的梯度长度(lengths of gradient,LGA),依据LGA值选择合适的排序方法,该研究中LGA值为1.2<3,因此采用线性模型冗余分析(redundancy analysis,RDA)和蒙特卡洛置换检验(Monte Carlo permutation test)定量评价环境因子对螨类群落分布的贡献率。 在研究区共捕获土壤螨类1 563头,隶属于3目55科91属,其中中气门目18科28属,绒螨目2科4属,疥螨目35科59属(表2)。从土壤螨类优势度来看,全菌甲螨属(Perscheloribates)为优势类群,占总捕获量的10.56%,新革螨属(Neogamasus)、厚厉螨属(Pachylaelaps)、丘疹甲螨属(Papillacarus)等25个属为常见类群,占捕获量的65.58%;枝厉螨属(Dendrolaelaps)、囊螨属(Asca)、混居甲螨属(Mixacarus)等20个属为稀有类群,占总捕获量的15.04%;糙尾螨属(Trachytes)、革板螨属(Gamasholaspis)、角单翼甲螨属(Rostrozetes)等45个属为极稀有类群,占总捕获量的8.83%。可见优势属和常见属是螨类个体数量增加的主要贡献者,而稀有属是螨类属数增加的主要贡献者。 表2 土壤螨类群落组成与数量分布Table 2 Community composition and quantity distribution of soil mites 续表2 Table 2 (Continued) EBF1、EBF2、EBF3这3种不同的常绿阔叶林的土壤螨类个体数量分别为660、522、381只,分别占总捕获量的42.2%、33.5%、24.4%;属数分别为75、65、53属,分别占总属数的82.4%、71.4%、58.2%。就各样地螨类优势属而言,全菌甲螨属(Perscheloribates)为EBF1生境下的优势类群,占总捕获量的10.61%;盖头甲螨属(Tectocepheus)和全菌甲螨属(Perscheloribates)为EBF2生境下的优势类群,分别占总捕获量的10.15%和10.34%;毛大翼甲螨属(Trichogalumna)和全菌甲螨属(Perscheloribates)为EBF3生境下的优势类群,分别占总捕获量的11.29%和10.76%。 就土层变化而言,在水平变化上,螨类属数和个体数量在各土层的排序均表现为EBF1 >EBF2 >EBF3;垂直变化上,螨类属数和个体数量在各生境均表现出枯枝落叶层>土壤上层>土壤下层的变化趋势,表聚性明显(图1)。 EBF1、EBF2、EBF3样地基本信息见表1。图1 研究区土壤螨类属数和个体数量的垂直分布Fig.1 Vertical distribution of genus and individual numbers of soil mites in the study area 土壤螨类群落Shannon多样性指数、Margalef丰富度指数和Pielou均匀度指数变化见图2。从水平方向来看,多样性指数、丰富度指数由高到低依次为EBF1、EBF2、EBF3样地,而均匀度指数在3个样地间不存在显著性差异。 EBF1、EBF2、EBF3样地基本信息见表1。同一组直方柱上方小写字母不同表示不同生境间某指标差异显著(P<0.05)。图2 研究区土壤螨类多样性指数(H)、丰富度指数(RS)和均匀度指数(J)的水平变化Fig.2 Horizontal distribution of soil mite diversity index (H), richness index (RS) and evenness index (J) in the study area 从垂直方向来看,3个样地腐殖质层的多样性指数和丰富度指数数值均高于土壤层,且EBF3与其他2个样地间存在显著性差异(P<0.05),EBF2和EBF3均匀度指数表现为腐殖质层略低于土壤层;多样性指数在腐殖质层和土壤层呈现出一致的变化规律,具体表现为EBF1>EBF2>EBF3;丰富度指数在腐殖质层表现为EBF2>EBF1>EBF3,土壤层出现和多样性指数一致的变化情形;各样地均匀度指数在腐殖质层不存在显著性差异,但在EBF1和EBF2样地的土壤层存在显著性差异(P<0.05,图3)。 EBF1、EBF2、EBF3样地基本信息见表1。同一幅图中同一组直方柱上方小写字母不同表示不同生境间某指标差异显著(P<0.05)。图3 研究区土壤螨类多样性指数(H)、丰富度指数(RS)和均匀度指数(J)的垂直变化Fig.3 Vertical distribution of soil mite diversity index (H), richness index (RS) and evenness index (J) in the study area 3个常绿阔叶林样地土壤螨类群落的相似性分析结果显示,EBF1分别与EBF2和EBF3之间为中等相似,相似性指数分别为0.653和0.756;EBF2与EBF3之间为极相似,相似性指数为0.865,表明遗产地常绿阔叶林存在微生境异质性的特点。 MGP分析结果(表3)显示,在类群数百分比上,3个生境均为O型,其中EBF1以无翅坚背类群(G群)占比最大,EBF2和EBF3以有翅孔背类群(P群)占比最大。在个体数百分比上,EBF1属于O型,其中以有翅孔背类群(P群)占比最大;EBF2和EBF3均属于P型。因此,遗产地常绿阔叶林甲螨生态类群以O选择型有翅孔背甲螨群(P群)为主要类群。 表3 不同样地甲螨群落结构Table 3 Community structure of soil mites (Oribatida) at different sample areas 采用MI指数研究遗产地常绿阔叶林的土壤中气门亚目螨类结构差异,捕食性螨类的K值和r值见表4,MI指数计算结果见表5。总体而言,遗产地常绿阔叶林捕食性土壤革螨成熟度指数以r选择为主。其中,EBF1和EBF2以r选择型为主,EBF3以K选择型为主;腐殖质层以r选择型为主,土壤层以K或r选择型为主。就各样地不同土层而言,EBF1腐殖质层和土壤层分别为r选择型和K选择型,EBF2呈现出与EBF1相异的情形,而EBF3均以r选择型为主。 表4 捕食性土壤革螨(中气门亚目螨类)的K值和r值Table 4 K or r values of predatory soil mites (Mesostigmata: Gamasina) 表5 捕食性土壤革螨(中气门亚目螨类)的成熟度指数(MI)Table 5 MI values of predatory soil mites (Mesostigmata: Gamasina) 各生境土壤理化因子见表6。结果显示,常绿阔叶林不同植被类型下土壤环境因子数据仅在土壤有机质、孔隙度、容重、饱和含水量间存在显著或极显著差异(P<0.05或P<0.01),其余各环境因子间均不存在显著性差异。其中EBF1生境下拥有更高的土壤有机质和水解氮含量,EBF2生境下土壤孔隙度、饱和含水量、自然含水量较大,而EBF3生境下土壤pH值和土壤容重较高。 表6 土壤环境因子数据Table 6 Content of environmental factors 由图4可知,土壤孔隙度和土壤饱和含水量分别与螨类属数、个体数量、多样性指数、丰富度指数呈现显著或极显著正相关关系(P<0.05或P<0.01)。土壤自然含水量分别与螨类个体数量和多样性指数呈现显著正相关关系(P<0.05)。土壤有机质含量分别与螨类属数、个体数量和丰富度指数呈显著正相关关系(P<0.05)。螨类均匀度指数与土壤全磷含量呈显著负相关关系(P<0.05),而与土壤pH值表现相反。相关性分析结果表明,土壤孔隙度、饱和含水量和有机质含量是影响土壤螨类群落各参数的主要环境因子。 G—属数;I—个体数量; RS—丰富度指数;J—均匀度指数;H—多样性指数;SOM—有机质含量;TN—全氮含量;TP—全磷含量;TK—全钾含量;AN—水解氮含量;AP—速效磷含量;AK—速效钾含量;P—孔隙度;DB—容重;SWC—饱和含水量;NWC—自然含水量。*表示P<0.05;**表示P<0.01。图4 土壤螨类群落各参数与土壤环境因子的相关性Fig.4 Correlation coefficients between each parameter of the soil mite community and soil environmental factors RDA排序图展示了环境变量(包括样地和土壤理化性质)对土壤螨类群落个体数量分布的响应(图5),排序分析反映前2个排序轴累计解释了49.83%的土壤螨类群落组成变异,其中第1排序轴和第2排序轴的解释率分别为28.85%和20.98%。结果显示,土壤有机质、速效氮、全氮含量和孔隙度沿着第1排序轴方向逐渐增大,与第1排序轴呈正相关,其中第1轴与有机质含量具有显著正相关性(P<0.01),解释了25.60%的螨类数据;而容重和pH值沿着第1排序轴方向逐渐减小,与第1排序轴呈负相关;第2轴与土壤饱和含水量、自然含水量和速效磷含量相关性较高。 BD—容重;P—孔隙度;SOM—有机质含量;MNC—饱和含水量;SWC—自然含水量。1—全菌甲螨属(Perscheloribates);2—毛大翼甲螨属(Trichogalumna);3—盖头甲螨属(Tectocepheus);4—三皱甲螨属(Rhysotritia);5—派伦螨属(Parholaspulus);6—厚厉螨属(Pachylaelaps);7—圆单翼甲螨属(Peloribates);8—直卷毛甲螨属(Hoplophthiracarus);9—丘疹甲螨属(Papillacarus);10—菌甲螨属(Scheloribates);11—寄螨属(Parasitus);12—尖棱甲螨属(Ceratozetes);13—殖厉螨属(Geolaelaps);14—小奥甲螨属(Oppiella);15—威单翼甲螨属(Vilhenabates);16—针单翼甲螨属(Setoxylobates);17—木单翼甲螨属(Xylobates);18—内特螨属(Nenteria);19—巨鳌螨属(Macrocheles);20—新肋甲螨属(Neoribates);21—大翼甲螨属(Galumna);22—新革螨属(Neogamasus);23—长单翼甲螨属(Protoribates);24—东缝甲螨属(Eohypochthonius);25—礼服甲螨属(Trhypochthonius);26—卡盾螨属(Krantzholaspis)。图5 土壤螨类与环境因子的冗余分析Fig.5 Redundancy analysis of soil mites and environmental factors 由图5还可知,各样方相对分散分布于不同的象限,而同一植被类型下不同采样点之间的螨类群落组成也存在较大差异,其中EBF2各样点间差异最为明显,表明土壤环境异质性高,不同植被类型间的土壤螨类群落组成差异明显。土壤环境因子对不同样地中土壤螨类群落的响应存在差异,在EBF1生境下螨类主要与土壤有机质、速效氮、全氮含量呈正相关,在EBF3生境下螨类主要与土壤容重呈正相关。 世界自然遗产地是生物多样性研究的热点地区之一,该研究捕获的土壤螨类隶属于55科91属,与亚热带常绿阔叶林世界遗产地梵净山(55科101属)的调查结果相近[27],表明施秉喀斯特世界自然遗产地拥有丰富的土壤螨类资源。土壤螨类作为森林生态系统的重要组成部分,其群落组成和分布特征对森林植被群落类型的变化有不同的响应[9,28],而优势类群对群落结构和群落环境的形成有明显控制作用[29]。该研究中全菌甲螨属(Perscheloribates)在3种不同植被类型样地中占比均很高,为绝对优势类群,与张燕等[14]对施秉喀斯特世界自然遗产地的研究结果一致,该属螨类的数量多且分布范围广,表明其对空间资源的利用能力较强,对常绿森林植被环境适应能力强,表现出对不同微生境的普适性,可以作为遗产地森林生态系统的指示螨类物种。此外,盖头甲螨属(Tectocepheus)和毛大翼甲螨属(Trichogalumna)分别为EBF2和EBF3生境下的另一优势类群,可能由于螨类不同类群的繁殖方式、适应环境的机制与定殖潜力存在差异[30],造成不同螨类优势类群对不同植被群落类型产生差异性响应。 土壤螨类属数、个体数量和群落多样性各指标存在空间上的差异性,一方面在各样地间呈现EBF1>EBF2>EBF3的变化情形。森林生态系统中不同植被群落组成的复杂程度会对土壤动物产生影响,一般而言,植物群落组成越复杂,其能给土壤动物提供的小生境就越多,类群数也会有所提高[31]。笔者对样地植被调查发现,EBF3生境下土层较薄且多砂石,土壤板结导致容重较大,灌木层和草本层植物种类较少,在土壤层所捕获的土壤螨类个体数量较少,一定程度上可以说明群落组成复杂程度和多样性对土壤动物群落具有积极影响。另一方面在土壤垂直剖面上呈现出腐殖质层远大于土壤层的情形,且两者存在显著差异,即螨类垂直分布存在明显的表聚性,这与其他学者的研究结果一致[32]。其主要原因可能与不同土壤剖面层微生境间资源数量与质量差异有关。研究表明,腐殖质层具有一定的保温保湿效果,能够维持和提高土壤肥力,改善土壤的通气性及蓄水性,提升土壤微生物活性,同时对植物生长有促进作用[33],为菌食性〔丽甲螨属(Liacarus)、盖头甲螨属(Tectocepheus)、角单翼甲螨属(Rostrozetes)等〕、植食性〔沙珠足甲螨(Eremobelba)、杆棱甲螨属(Mochlozetes)、尖棱甲螨属(Ceratozetes)等〕和杂食性〔懒甲螨属(Nothrus)、小奥甲螨属(Oppiella)、盾珠甲螨属(Suctobelba)等〕土壤螨类提供了直接的食物来源和更多可利用的优质资源[3],从而更加有利于土壤螨类的生长繁殖。此外,随着土层的加深,土壤孔隙度、含水量变小,土壤容重增加,不利于土壤螨类的下移与富集[34]。对土壤物理性质的监测发现,土壤上层孔隙度、含水量均大于下层,而容重则相反。相关性分析也明确显示,土壤物理环境因子与土壤螨类群落组成有显著相关性。综上所述,土壤螨类群落具有垂直分布的特点,其主要受土壤环境因子和营养状况的制约。 革螨(Mesostigmata)和甲螨(Oribatida)是土壤环境中的两大主要类群,捕食性革螨和甲螨的生态策略类型常被用作评价生态环境质量优良与稳定与否的重要指标。甲螨的群落组成已被证明对栖息地和土地利用的变化反应强烈,物种丰度、物种分布和群落结构在不同的层次上表现出空间变异。研究区的常绿阔叶林以全菌甲螨属(Perscheloribates)、菌甲螨属(Scheloribates)等构成的菌甲螨科为优势科。在与研究区相邻的梵净山常绿阔叶林内,以角单翼角螨属(Rostrozetes)、针单翼甲螨属(Setoxylobates)构成的单翼甲螨科和混居甲螨属(Mixacarus)、裂甲螨属(Meristacarus)等构成的洛甲螨科为优势科,两者表现出了一定的差异[27]。在欧洲不同类型森林环境中,尖棱甲螨属(Ceratozetes)、盾珠甲螨属(Suctobelba)、暗卷甲螨属(Atropacarus)等为主要的优势属[35];墨西哥格鲁吉亚米特拉国家公园的森林群落则以缰板鳃甲螨属(Chamobates)为优势类群[36]。尽管类群有差异,但是它们在土壤养分的分解过程中都起着直接和间接的作用,被认为是陆地生态系统的生物指示器。在研究区常绿阔叶林土壤甲螨结构组成中,少数属的种群数量占个体总数的绝大部分,甲螨群落以少数属为主,属更替率高,这是不稳定生态系统的典型模式[30],说明遗产地的常绿阔叶林具有不稳定性和脆弱性的特点。 土壤中的革螨很大一部分是捕食性,它们以捕食者的身份影响着其他土壤生物的种群生长,是土壤生态系统成长和稳定的重要影响因素。根据革螨的生长特点,可将其分为K选择类群和r选择类群,通常认为K选择型比例越高,环境所受扰动就越小,因此可以根据两者的比例变化来反映捕食性革螨的群落结构特征,从而评价环境变化[26]。研究区的捕食性革螨r选择型所占比例较大,说明遗产地的常绿阔叶林在一定程度上受到了干扰,这可能是因为遗产地的常绿阔叶林带多分布在山体较为陡峭的地区,土壤较为贫瘠且易受到水土流失的影响,因此环境的稳定性较差。 研究区的土壤螨类存在r选择和O型生态类群占优势的情形,这在一定程度上反映了螨类生态类群分布与生境梯度的不一致性和不协调性,该研究结果与陈浒等[30]的研究相似,这有待对遗产地山地森林环境的土壤螨类进行进一步探究。 土壤环境因子与土壤螨类的群落组成和分布有着密切的关系,一方面土壤理化因子是土壤螨类的生存条件,制约着其种群分布;另一方面土壤螨类通过其生命活动改变土壤环境,因此环境变化与土壤螨类之间存在协同适应关系,不同类群土壤螨群落多样性对环境因子有不同的响应[17,32,34]。该研究中土壤螨类群落各参数(属数、个体数量、多样性指数和丰富度指数)分别与土壤孔隙度、含水量和有机质含量存在显著正相关性(P<0.05),与全磷、全钾含量和土壤容重呈现负相关关系。这种变化情形与笔者对各样地土壤螨类群落和土壤环境因子的监测相互印证,EBF1和EBF2生境下土壤孔隙度、有机质含量、含水量均高于EBF3生境,土壤全钾含量和容重则呈现相异的变化,与之对应的是在EBF1和EBF2生境下捕获的螨类个体数量、属数以及群落多样性参数都比EBF3生境下大,表明土壤螨类对土壤环境因子变化的响应具有敏感性。 此外,土壤螨类各类群与环境因子的冗余分析进一步揭示了有机质对土壤螨类组成和分布有着显著影响(P<0.05)。其可能原因是土壤有机碳含量的增加会提高灌草层植被物种多样性,为土壤螨类提供丰富多样的食物资源和适宜的栖息环境,进而促使对环境因子偏好的螨类数量和多样性增加。有研究表明,降低土壤容重、改善土壤孔隙度和通气状况、提高土壤有机质含量有利于多种土壤螨类的生存和繁殖[37],同时也有研究发现土壤养分减少可能导致土壤动物群落密度降低[38]。相关研究表明,土壤容重、含水量以及有机碳含量等土壤理化指标受植被群落盖度、地上生物量以及物种多样性的影响[39]。由于此次研究没有对地上植被多样性、生物量以及凋落物等进行分析,今后还需要进一步开展更全面与深入的研究,来明晰土壤螨类在喀斯特森林生态系统的适应与响应机制。 施秉喀斯特世界自然遗产地的常绿阔叶林生态系统中土壤螨类资源丰富,且具有一定的独特性。研究期间共捕获土壤螨类1 563头,隶属于3目55科91属,全菌甲螨属(Perscheloribates)为不同植被群落下的共同优势类群,对区域内不同微生境具有广泛的适应性,可以作为遗产地森林生态系统的指示螨类物种。土壤螨类群落结构在不同植被群落间存在差异性,垂直分布上有明显的表聚性,其主要受土壤环境因子和营养状况的制约。遗产地常绿阔叶林土壤螨类结构组成中,少数属的种群数量占个体总数的绝大部分,说明遗产地的常绿阔叶林生境具有不稳定性和脆弱性的特点。土壤螨类群落结构及多样性的空间分布主要受土壤孔隙度、含水量和有机质含量的影响。2 结果与分析
2.1 土壤螨类群落组成与分布



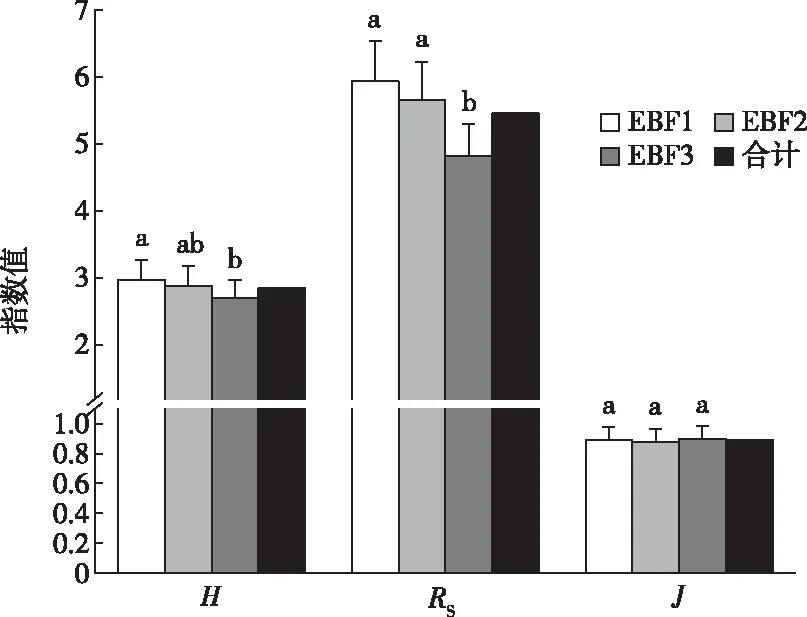
2.2 土壤螨类群落多样性与相似性

2.3 甲螨群落结构特征
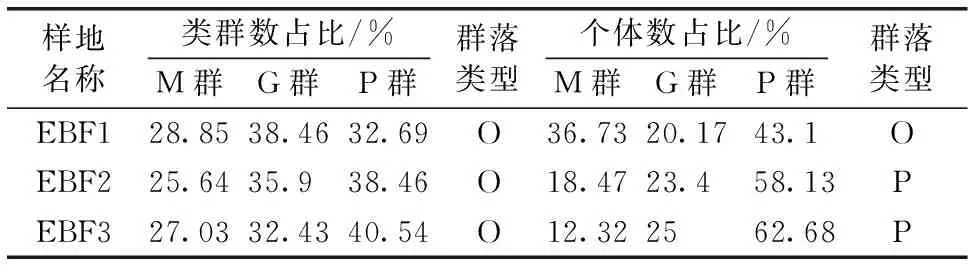
2.4 中气门螨类群落结构特征


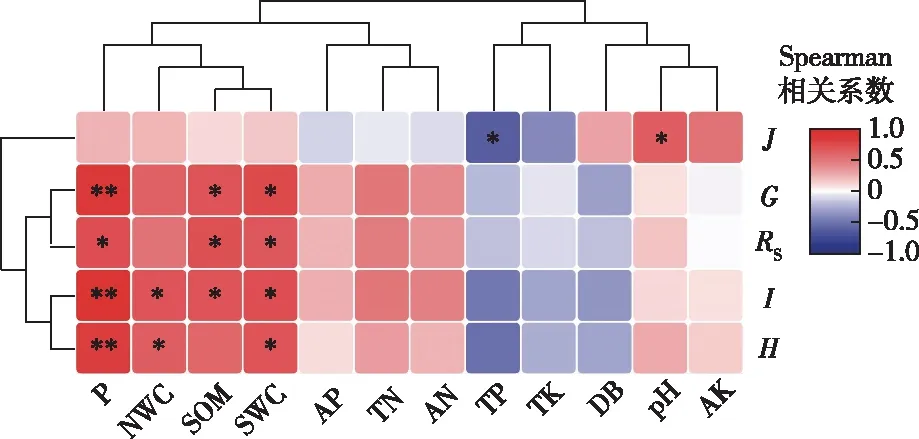
2.5 螨类群落与环境因子的相关性


3 讨论
3.1 不同生境土壤螨类群落结构的差异
3.2 森林土壤螨类的指示性作用
3.3 土壤螨类群落对土壤环境因子的响应
4 结论
