UVC紫外诱变对蝙蝠蛾拟青霉的影响及综合评价
2023-05-05李秀璋陈建博唐楚煜李玉玲
王 涛,李秀璋,2,陈建博,梁 静,唐楚煜,李玉玲,2
(1.青海大学畜牧兽医科学院,西宁 810016;2.青海省畜牧兽医科学院,西宁 810016)
【研究意义】冬虫夏草(Cordycepssinensis)是冬虫夏草菌(Ophiocordycepssinensis)侵染寄主蝙蝠蛾幼虫致死形成幼虫尸体(菌核)与真菌子座的复合体[1]。冬虫夏草是我国传统的名贵中药材,与人参、鹿茸并称‘中药三大宝’[2-3]。其营养价值和药用价值普遍受到消费者认可,需求量逐年增加[4],青藏高原冬虫夏草的蕴藏量逐年降低[5],供需矛盾促使冬虫夏草及其替代品成为研究热点。【前人研究进展】20世纪70年代始,学者们从冬虫夏草中分离出多种菌种,但国家卫生与健康委员会(原卫生部)公布的“从冬虫夏草中分离的可用于保健品的微生物名录只有蝙蝠蛾拟青霉和蝙蝠蛾被毛孢可用于保健食品”[6]。1982年,蝙蝠蛾拟青霉被戴如琴等[7]分离并鉴定命名,其人工发酵培养产生多种活性物质,含量与种类和天然冬虫夏草接近[8-11]。现代药理学研究发现,蝙蝠蛾拟青霉菌丝体多糖、虫草素、腺苷、甘露醇等具有抗炎、抗氧化、抗肿瘤、免疫调节、降血压及降血糖多方面生物活性和功效[12-15],使得该菌已成为人工虫草发酵生产制品的重要无性型菌株[16];但在其连续多代传代发酵培养过程中发现该菌种出现退化现象。退化菌株形态表现出菌丝生物量减少、菌丝生长速率缓慢、长势稀疏、子实体原基的产生减少、无性孢子的产能大幅度降低等[17-20];代谢产物如多糖、虫草素、腺苷、粗蛋白等具有药理活性物质的产能下降等。因此,为了获得具有优势性状的菌株,需要对菌种进行复壮。常用的复壮方法为启用该菌株的原始菌株多次转管活化、退化菌株的人工栽培分离子实体的单孢子、组织等,将菌株重新接种到寄主上进行侵染[21-22],刘小霞[23]、崔晓等[24]也尝试从真菌原生质体和改变培养基碳氮源的角度进行复壮,但仅延缓了菌种的退化。实践证明以上方法仍然面临以下问题:菌种保存困难导致原始菌株出现不同程度的退化[25],有些菌株的单孢子分离十分困难且耗费人力,如冬虫夏草菌是否为多菌复合体一直是学术界讨论的热点问题之一[26-27],由于侵染率较低(自然条件下仅有3%~5%),即使人工干预也难以得到理想的复壮菌株[28-29]。因此,结合物理学方法进行退化菌株的紫外诱变成为现代菌株复壮的新方法,物理诱变常用的诱变剂是紫外线(UV),原理是紫外线的光谱与核酸的吸收光谱一致,可以引起 DNA 结构的变化,如链的断裂、胞嘧啶和尿嘧啶的水合作用、胸腺嘧啶二聚体的形成等。紫外诱变中最常用且比较有效的诱变剂为UVB(280~315 nm)与UVC(200~280 nm)[30],蝙蝠蛾拟青霉在与青藏高原高紫外环境的相互适应中对紫外辐射有着较好的耐受性[31-32],因此需要选取更强的UVC才有可能诱变成功。【本研究切入点】本文对青海省畜牧兽医科学院草原研究所冬虫夏草研究室已有的蝙蝠蛾拟青霉菌株YS-01进行UVC紫外诱变,以期获得菌丝速率、生物量、产孢量、多糖、粗蛋白、腺苷、甘露醇等含量综合最优的菌株。【拟解决的关键问题】研究可为蝙蝠蛾拟青霉的人工利用提高优良菌株。
1 材料与方法
1.1 试验材料
1.1.1 出发菌株 出发菌株为是青海大学畜牧兽医科学院冬虫夏草研究室保存的蝙蝠蛾拟青霉YS-01,经中国科学院微生物研究所鉴定为Paecilomyceshepiali(图1)。

T为模式菌株,YS-01为下划线字体菌株。 T is the type strain,and YS-01 is an underlined font strain.图1 基于部分TEF1、RPB2、SSU、ITS及LSU序列的系统发育分析Fig.1 Phylogenetic analysis based on partial sequences of TEF1, RPB2, SSU, ITS and LSU
1.1.2 培养基 斜面、平板、液体培养基均为加富PDA培养基。1 L培养基含马铃薯200 g,葡萄糖20 g,蛋白胨10 g,磷酸二氢钾1.5 g,硫酸镁1 g,琼脂18 g(液体培养基不加)。
1.2 试验预处理
1.2.1 菌液稀释浓度的确定 将活化培养15 d的菌株用打孔器从平板取面积为0.25 cm2的菌量至装液量250 mL的500 mL摇瓶培养基中培养15 d(培养条件:恒温18 ℃,150 r/min),将培养15 d的液体培养菌丝体连同培养基放置在磁力搅拌器上充分搅拌,使菌丝体断裂,再用经无菌水润洗的4层无菌纱布将培养基等杂质过滤掉[33]。吸取50 mL菌丝体悬浊液,摇匀,浓度记为1,用无菌水依次稀释成10-1、10-2、10-3、10-4、10-5的菌液(体积均为10 mL),取各稀释度10 mL菌液涂布平板,每个平板3个重复,18 ℃培养10 d,观察培养皿上菌落的生长情况,以菌落密度铺满平板的80%确定最佳的菌丝体悬浮液,稀释浓度为10-3。
1.2.2 紫外强度与距离的确定 用功率为30 W紫外灯(λ=220 nm),预热20 min稳定波长,在13、27、39、50、62 cm处用HPL紫外辐射传感器测定紫外强度值,作紫外强度和距离的回归曲线(表1)。吸取10 mL稀释10-3的菌液放入灭菌培养皿底部,对菌丝体进行诱变。考虑到紫外灯管产热加速菌丝体悬浊液水分蒸发,因此选择距离紫外灯20、25、30、35、40、45 cm的距离辐射诱变30 s,每个水平做3次重复,各距离吸取10 mL涂布于培养基平板上,置恒温培养箱中18 ℃培养15 d,并以未经紫外线处理的10-3菌丝体悬浊液涂布培养基作对照,待对照平板上菌落铺满平板80%停止培养。

表1 UVC诱变与代谢物回归方程Table 1 UVC mutagenesis and regression equation of metabolites
致死率=[(未紫外诱变的菌落数-紫外诱变后的菌落数)/未紫外诱变的菌落数]×100%
(1)
正突变率=[紫外诱变后的菌落数/未紫外诱变的菌落数]×100%
(2)
从表2可知,在照射距离为30 cm处致死率和正突变率较好。
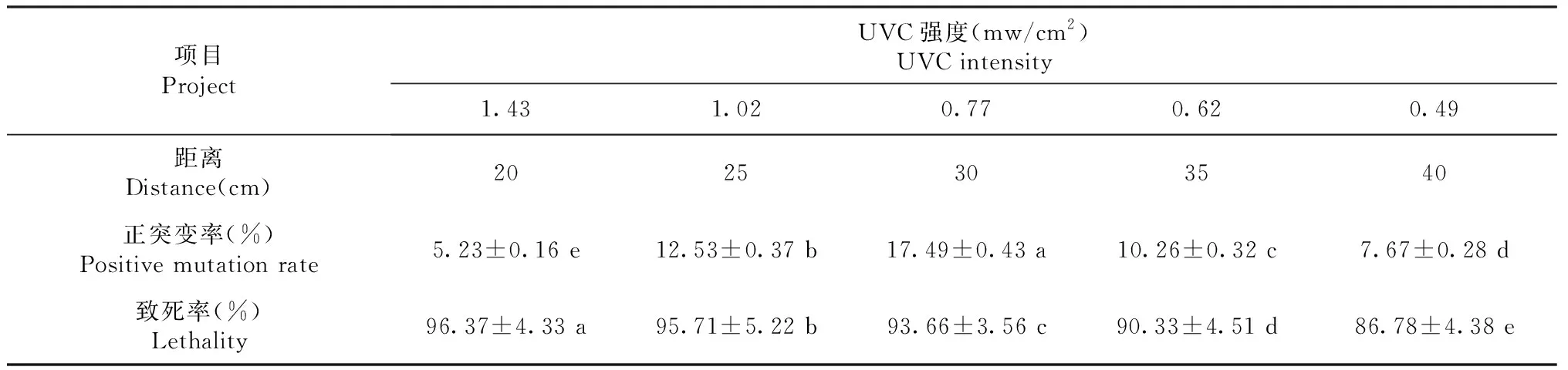
表2 诱变距离与正突变率和致死率Table 2 Mutation distance and positive mutation rate and mortality diameter
1.2.3 紫外诱变时间的确定 吸取10 mL稀释10-3的菌液放入到灭菌培养皿底部,对菌丝体进行诱变。分别于30 cm处照射20、40、60、80、100、120、140 s,每个水平3次重复,测定正突变率、致死率与辐射时间的回归曲线(表1)。各照射时间吸取10 mL涂布于培养基平板上,置恒温培养箱中18 ℃培养15 d,并以未经紫外处理的菌悬液涂布培养基作对照,待平板上长出一定菌落,计算致死率与正突变率。比较正突变变率和致死率,40 s时致死率和正突变率较好[34](表3)。

表3 照射时间与正突变率和致死率Table 3 Irradiation time and positive mutation rate and fatality rate
1.3 试验方法
1.3.1 菌株的筛选 从诱变菌株中初步选择表型较优20株菌株保种(表4),并依次命名为YS-A、YS-B、YS-C、YS-D、YS-E、YS-F、YS-G、YS-H、YS-I、YS-J、YS-K、YS-L、YS-M、YS-N、YS-O、YS-P、YS-Q、YS-R、YS-S、YS-T。首先,采用灰色关联度分析法分别对21株菌株的3个生物量指标(干重、鲜重、菌落生长速率)和4个代谢物质指标(多糖、粗蛋白、甘露醇、腺苷)进行评价,筛选出具有最优生物量产量的菌株和最优代谢物含量的菌株,最后将生物量、代谢物指标视为一个整体进行综合评价,筛选出生物量产量和代谢物产量综合最优的菌株[35]。各指标测定值相差较大,不易比较,须进行标准化处理[36]。采用均值化法先分析各指标之间的相关性(表6),正相关用各测定值除以参考数列相应的期望指标,负相关取其倒数得到均值化新数列Mi。选择干重、鲜重、菌落生长速率、多糖、粗蛋白、甘露醇、腺苷进行综合评价,不同菌株用N表示,指标用k表示,各菌株在指标处的值构成比较数列Nk,选择各指标最大值组成母序列N0。使用以下公式计算关联度系数、等权关联度、权重系数及加权关联度。ρ为分辨系数,一般取ρ=0.5。

表4 菌落表面质地Table 4 Surface texture of colonies
(3)
(4)
(5)
(6)
(7)
式中,xi(k)为原始数据,x0(k)为母序列,min(i)min|x0(k)-x1(k)|为2个层次的最小差;max(i)max|x0(k)-xi(k)|为2个层次的最大差;Mi为原始数据均值化后的数列值;ξi(k)为关联度系数;γi为等权关联度;ωi为权重系数;γi′为加权关联度。
1.3.2 鲜重、干重的测定 各菌株用固体培养基培养15 d将菌落带培养基一起取下,60 ℃热水洗去培养基得到干净完整的菌落,滤纸吸去菌落表面残留水分,称取菌落鲜重。50 ℃烘干20 min称量1次,直至质量不再变化为止,以最后一次记录结果为菌落干重。以上试验每组设置3个平行,记录鲜重、干重、菌落生长速率。
1.3.3 菌丝体代谢物测定 采用硫酸苯酚法测定多糖含量[37-39];采用Bradford蛋白浓度试剂盒法测定粗蛋白含量;采用高锰酸钾比色法测定甘露醇含量[40];采用高效液相色谱法测定腺苷含量[41-42],分别得到回归方程(表1)。
1.3.4 诱变菌株的综合评价与遗传特性分析 由于经过紫外诱变的菌株会在自身的修复作用下产生回复突变,需要分析菌株的遗传稳定性,对得到的选育菌株进行连续发酵10代的传代试验(135 r/min、18 ℃培养15 d,4000 r/min离心),评价选育菌株的遗传稳定性。
1.4 数据分析
采用Microsoft Office Excel 2019进行原始数据的录入及表格制作,采用SPSS 23.0对菌株各指标进行多重比较,结果以Mean±SE表示,显著性水平为P<0.05,最后分析各指标之间的相关性。
2 结果与分析
2.1 21株菌株生物量及代谢物含量的比较
YS-A菌株菌丝体干重、鲜重、菌落生长速率、腺苷均最优于其它菌株(P<0.05),其菌丝体干重、鲜重、菌落生长速率、腺苷产量较YS-01分别增长21.94%、30.36%、85.83%、51.57%;可用于以菌丝体干重、鲜重、菌落生长速率和腺苷产量为目的的菌株选育。YS-B菌株腺苷、粗蛋白和甘露醇含量均优于其它菌株(P<0.05),其腺苷、粗蛋白和甘露醇含量较YS-01分别增长52.61%、83.60%、48.52%;可用于以腺苷、粗蛋白和甘露醇产量为目的的菌株选育。YS-C的多糖含量最优(P<0.05),较YS-01增长53.61%,可用于以多糖产量为目的的菌株选育(表5)。

表5 菌株生物量及代谢物含量的比较Table 5 Comparison of biomass and metabolite content of strains
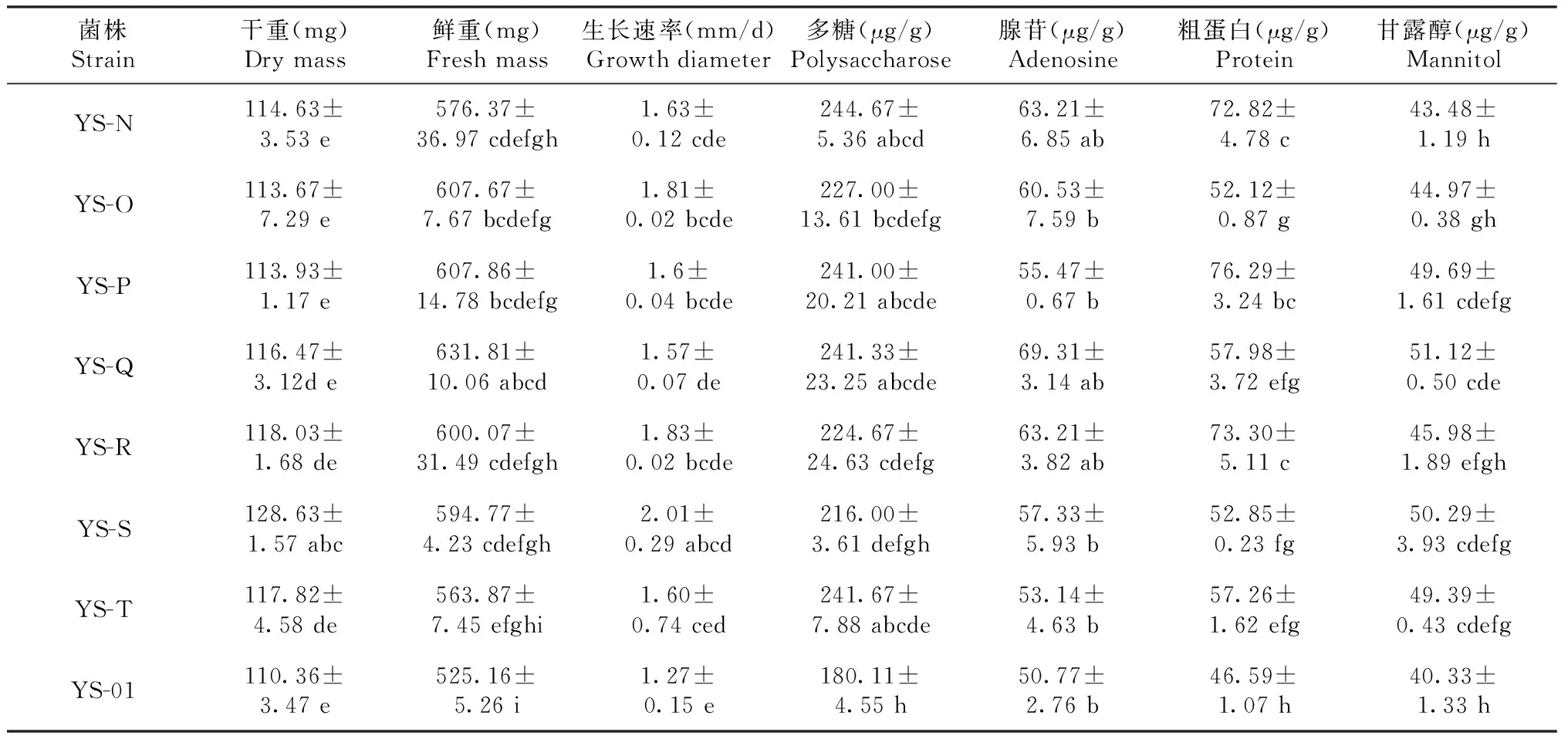
续表5 Continuedtable 5
2.2 21株菌株生物量及代谢产物的相关性分析
21株菌株的生长速率、鲜重、腺苷、甘露醇与干重呈极显著正相关(P<0.01),表明干重越重的菌株其生长速率、鲜重、腺苷和甘露醇含量越高;鲜重、腺苷、甘露醇与生长速率呈极显著正相关(P<0.01),表明生长速率越快的菌株其鲜重、腺苷和甘露醇含量越高;腺苷、甘露醇、粗蛋白与鲜重呈极显著正相关(P<0.01),表明鲜重越重的菌株其腺苷、甘露醇和粗蛋白含量越高;甘露醇与多糖呈极显著正相关(P<0.01),表明多糖越多的菌株其甘露醇含量越高;甘露醇、粗蛋白与腺苷呈极显著正相关(P<0.01),表明腺苷越多的菌株其甘露醇和粗蛋白含量越高;粗蛋白与甘露醇呈极显著正相关(P<0.01),表明甘露醇含量越高的菌株其粗蛋白含量也较高(表6)。

表6 各指标的相关性分析Table 6 Correlation analysis of each index
2.3 21株菌株生物量产量的灰色关联度评价
在灰色关联分析中,关联度大小反映了各因子重要性的差异,关联度越大该因子的作用越大。该关联度为等权关联度,即假定各种指标都同等重要,对指标重要性进行评价。但菌丝体中各指标对综合评价的贡献率不同,为了更准确地评价各菌株的优劣,需采用加权关联度,将求得的各关联系数应用公式(4)求出对应的权重,赋予各指标不同的权重,用公式(5)计算加权关联度。等权关联度排序和加权关联度排序结果一致,其结果更能真实反应各个菌株品质的优劣。YS-A菌株生物量综合评价最好(表7),表明YS-A具有最高的生物量产量,可用于以生物量产量为目的的菌株选育。
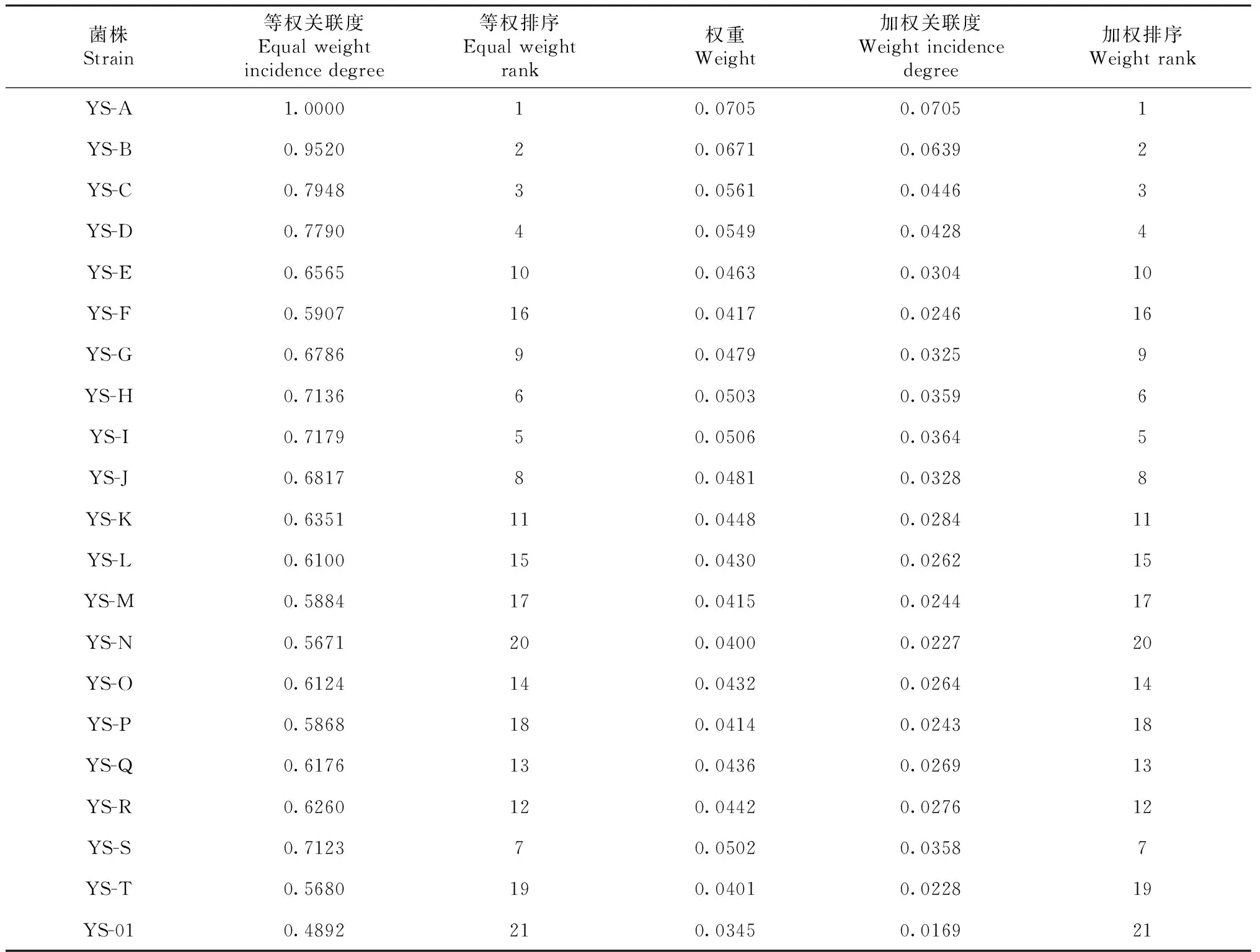
表7 各菌株生物量指标关联度及排序Table 7 Correlation and ranking of biomass indexes of strains
2.4 21株菌株代谢物产量的灰色关联度评价
21株菌株中,采用灰色关联度法对其代谢物含量综合评价发现,等权排序和加权排序结果基本相似,表明试验结果可信度高;其中YS-B菌株综合表现最优(表8),表明YS-B代谢物产量最高,可用于以代谢物产量为目的的菌株。

表8 各菌株代谢物指标关联度及排序Table 8 Correlation and ranking of metabolites indexes of strains

续表8 Continuedtable 8
2.5 21株菌株生物量及代谢物含量的灰色关联度综合评价
菌株指标综合关联度的大小顺序为:粗蛋白>多糖>干重>鲜重>腺苷>甘露醇>生长速率(表9)。YS-B菌株的综合评价最好,表明YS-B菌株的综合产量最高,可用于以综合产量为目的的菌株选育。YS-A、YS-C、YS-D、YS-H、YS-E综合评价较好,其余菌株诱变效果综合评价一般,但均优于YS-01(表10)。

表9 各指标关联系数及排序Table 9 Correlation coefficient and ranking of index
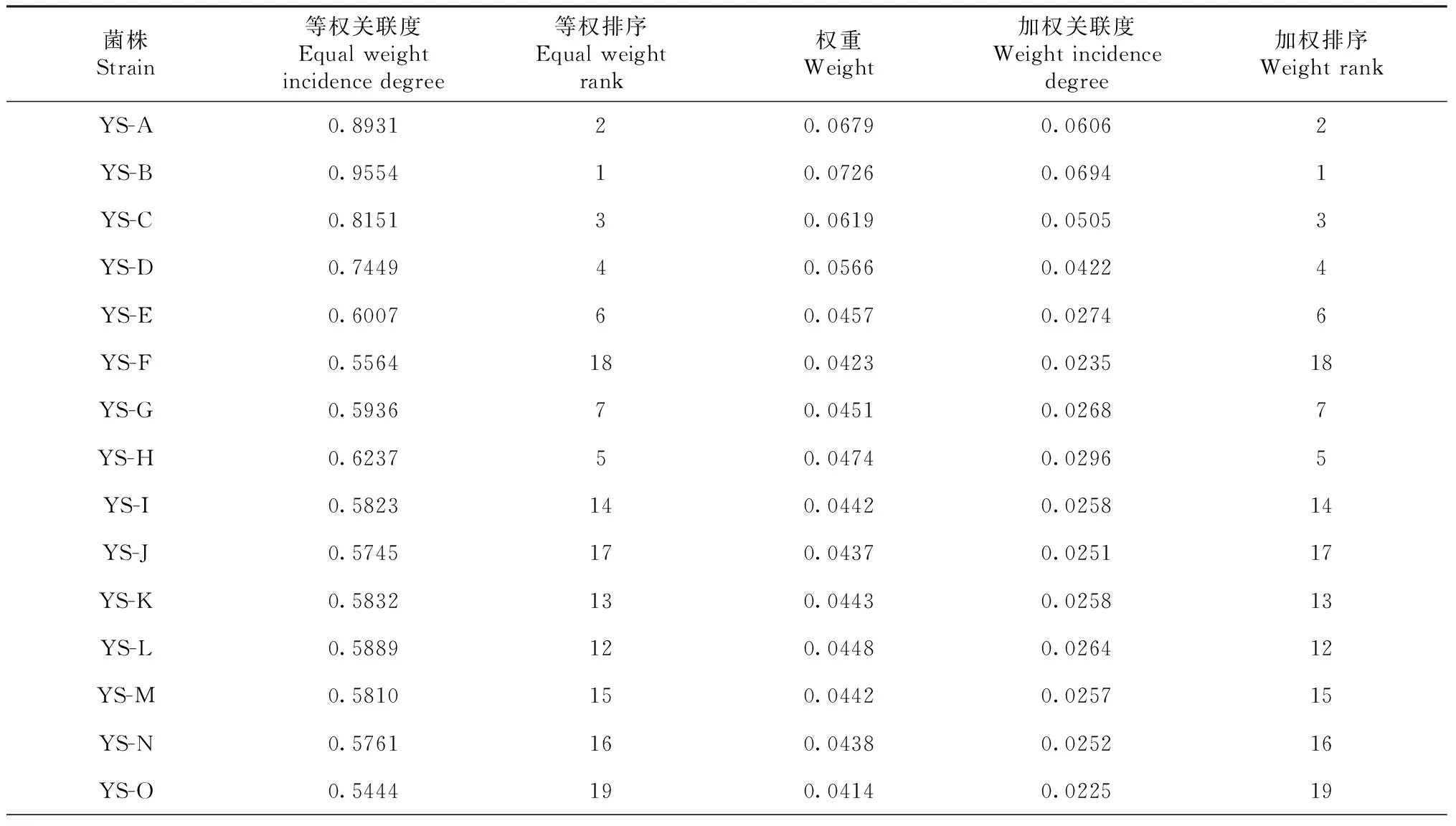
表10 各菌株关联系数及排序Table 10 Correlation coefficient and sequencing of strains

续表10 Continuedtable 10
2.6 YS-C、YS-A和YS-B的遗传稳定性分析
10代传代培养过程中YS-C菌株的多糖、YS-A菌株的干重、鲜重、菌丝体生长速率均无显著变化(P>0.05),且显著高于YS-01菌株(P<0.05),表明YS-C菌株10代内多糖产量遗传稳定性良好(表11),YS-A菌株10代内干重、鲜重、菌丝体生长速率遗传稳定性良好(表12)。

表11 YS-C多糖10代传代试验Table 11 Analysis of YS-C Polysaccharose 10 generations passage test
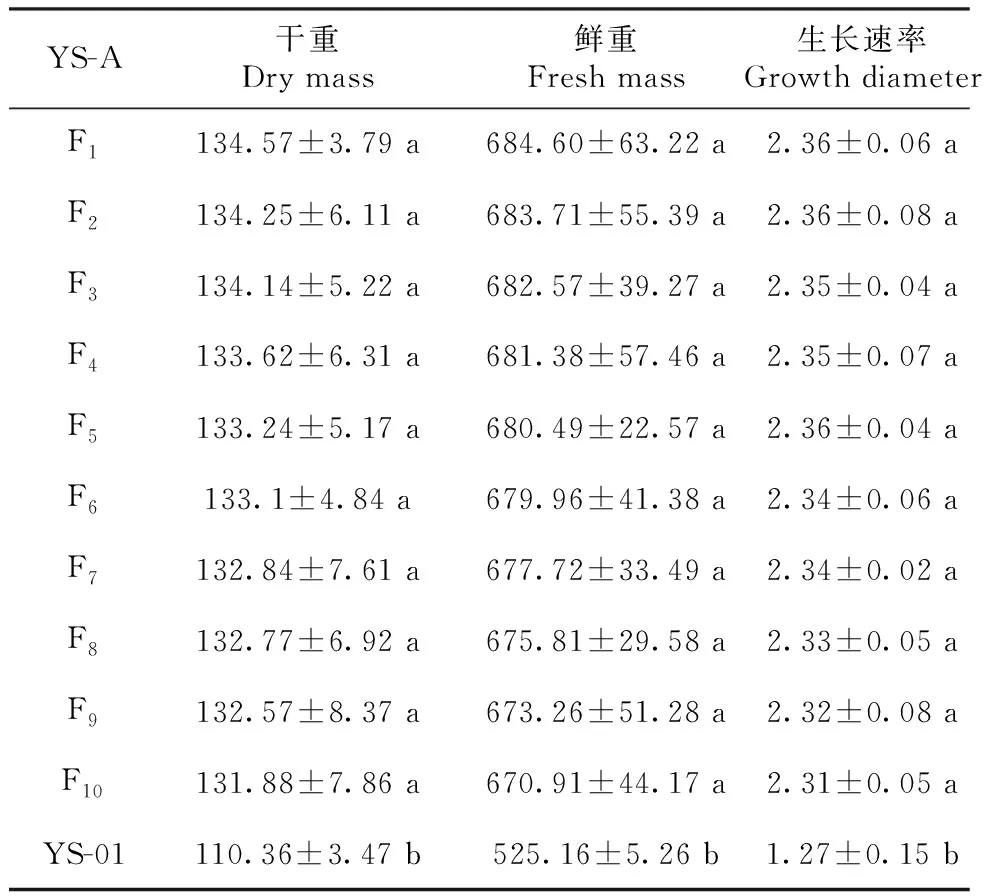
表12 YS-A生物量10代传代试验Table 12 Analysis of YS-A biomass 10 generations passage test
YS-B菌株10代传代培养过程中菌丝体生长速率和甘露醇无显著变化(P>0.05),且显著高于YS-01菌株(P<0.05),菌丝体生长速率和甘露醇产量遗传稳定性良好;干重、鲜重和腺苷在第10代显著降低(P<0.05),干重、鲜重和腺苷9代内遗传较稳定;多糖和粗蛋白在第9代显著降低(P<0.05),多糖和粗蛋白8代内遗传较为稳定(表13)。
3 讨 论
变异是一切生物的共有属性,蝙蝠蛾拟青霉也是如此,由于其全基因组相对较小,在人工保种和继代传代培养中,菌株发生变异的可能性更大[43]。当这种变异促使菌株的生物量产量、代谢物产量增加时,认为发生了正突变,而当菌株的表观属性、形态特征趋于变差时则是发生了负突变。菌株突变是由碱基变化引起,如碱基对的替换、缺失、基因漂移等,而碱基突变完全随机,试验中也发现正突变的概率远小于负突变[44],本试验从100个培养皿中也仅仅筛选出3株可以用于具有较好生产性能的菌株。因此,诱变条件是提高菌株正突变率的关键因素之一。紫外诱变是选育高产量真菌的有效途径之一,在绿僵菌、桑黄产业中一直被使用。韦云[45]对绿僵菌的紫外诱变试验发现,诱变时间为40 min时具有最高的代谢活性物产量;曲德辉[46]对桑黄进行紫外辐射时,在紫外灯功率15 W、照射距离20 cm、照射时间8 s条件下,桑黄的生物量、多糖和黄酮含量均显著增加。而本试验在之前研究的基础上进一步完善,分别对紫外种类、紫外灯光功率、照射距离、紫外强度进行了更多研究,结果显示蝙蝠蛾拟青霉最佳紫外诱变剂量为:紫外灯光功率30 W、照射距离30 cm、照射时间40 s、紫外线种类UVC。这也是由于青藏高原高紫外辐射的特殊地理位置,蝙蝠蛾拟青霉在与环境的协同进化中获得了更好的紫外抗性,因此本研究的紫外诱变剂量更高。在此剂量下诱变菌株YS-A较YS-01菌株的干重、鲜重、菌落生长速率、腺苷含量分别提升17.99%、23.29%、46.19%、34.18%,YS-B较YS-01菌株的腺苷、粗蛋白和甘露醇含量分别提升34.47%、45.53%、32.67%,YS-C的多糖含量提升34.9%。
本研究中,照射距离与菌落正突变率呈先增大后减小的关系,在30 cm处正突变率最大,诱变菌株菌落生长速率均优于出发菌株。与王宏民等[47]对玫烟色拟青霉 Pf9606 菌株的紫外诱变试验结果相似,照射距离在一定范围内,随着照射时间的延长,菌落生长速率明显降低。紫外照射时间也会显著影响菌落的诱变生长,李春丽等[34]对蛹虫草的紫外诱变显示,随着紫外照射时间增加,菌落致死率升高;本研究也发现,照射时间在40 s左右最佳,短时间处理正突变率偏低,较长时间处理菌落的死亡率偏高。照射时间在0~40 s,照射时间与蝙蝠蛾拟青霉死亡率曲线变化剧烈,表明蝙蝠蛾拟青霉对这一剂量范围较敏感,在这一范围内诱变处理可能使之发生较大变异,40 s后死亡率趋于平缓[48-50],周丽红等[51]研究也发现,食用菌致死率在50%时可保证菌体发生突变并偏向正向突变,而致死率在70%~80%时,菌体发生正向突变的几率高等类似结论。
4 结 论
菌丝体干重、鲜重、生长速率和腺苷最优菌株均为YS-A;多糖产量最高的菌株为YS-C;腺苷、粗蛋白、甘露醇产量最高的菌株均为YS-B。生物量产量最高的菌株为YS-A,代谢物产量和综合产量最高的菌株均为YS-B。YS-A菌株10代内的干重、鲜重、菌丝体生长速率遗传稳定性良好;YS-C菌株10代内的多糖产量遗传稳定性良好。因此,YS-A菌株可用于以菌丝体干重、鲜重、生长速率、腺苷和生物量产量为目的的菌株;YS-C可用于以多糖产量为目的的菌株;YS-B可用于以腺苷、粗蛋白、甘露醇、代谢物产量、综合产量为目的的菌株。
