木质化秋葵均一多糖的理化特性及结构表征研究
2023-05-05叶云芳王军辉
叶云芳, 丁 曼, 刘 咏, 王军辉
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
秋葵(Abelmoschusesculentus(L.)Moench)又名黄秋葵、羊角豆,是锦葵科秋葵属一年生草本开花植物,原产于非洲,现广泛种植于亚洲、中东和欧洲的东南部等地区[1]。秋葵入药历史悠久,早在我国明代时期,李时珍在《本草纲目》中记载了秋葵的形态特征和药用价值,言明秋葵的叶、花、根茎和种子都具有一定的药用价值,可用来治疗恶疮、痈疖、脾虚乏力和肠燥便秘等病症[2]。近些年对秋葵的研究发现秋葵嫩果荚富含多种营养物质,包括氨基酸、蛋白质、脂肪、碳水化合物、微量元素以及黄酮类化合物等,其中多糖的含量尤为丰富,是秋葵中主要的活性成分[3-4]。据报道,秋葵多糖具有降血糖、抗疲劳、调节机体免疫机能及抑制肿瘤细胞生长等多种生物活性[5]。其优良的生物活性吸引了国内外研究学者的广泛关注。20世纪60年代已经发现从秋葵嫩荚中获得的水提多糖是由鼠李糖、半乳糖和半乳糖醛酸组成的酸性多糖[6];秋葵水提多糖的结构被证明主要由(1→2)连接的α-Rhap和(1→4)连接的α-GalpA组成,其中(1→4)连接的β-Galp侧链部分连接到L-Rhap的O-4上[7]。目前,对秋葵嫩荚多糖的研究已逐渐趋于成熟,多集中在多糖的表征和功能特性等方面。
秋葵成熟后的果实逐渐木质化,无法食用。木质化秋葵是秋葵收获种子后留下的副产物,但其却占秋葵总质量的50%以上,还富含大量的细胞壁多糖。但由于国内外目前尚缺乏对木质化秋葵的系统研究,造成木质化秋葵的利用率较低,经常被当作废弃物扔掉。因此,为了寻找合适的处理方法,更好地利用木质化秋葵这一丰富的农作物资源,提取多糖是最佳的开发方法之一。本研究通过对木质化秋葵进行多糖的提取纯化,并对纯化后的均一多糖进行理化性质测定和结构表征,研究结果为木质化秋葵的开发利用提供可靠的数据及理论依据,以促进木质化秋葵的综合利用。
1 材料与方法
1.1 实验材料与试剂
收获了种子的木质化秋葵果荚于2017年9月收集于安徽省凤阳县,自然晒干后经高速中药粉碎机粉碎,于烘箱中进一步干燥至恒重。利用95%乙醇浸泡干燥的木质化秋葵果荚粗粉3 d以脱色脱脂,风干后保存备用。
DEAE-Cellulose阴离子交换树脂购于北京索来宝公司;单糖标准品和葡聚糖标准品购于美国Sigma公司;三氯乙酸(光谱级)购于Aladdin;其余试剂(分析纯)均购于中国国药集团化学试剂有限公司。
1.2 主要仪器
高速中药粉碎机(达微机械,济南);高速冷冻离心机(Thermo Fisher Scientific,美国);紫外可见分光光度计(菁华科技仪器,上海);傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪(Thermo公司,美国);高效液相色谱仪(high performance liquid chromatography,HPLC)(Waters公司,美国);气相色谱仪(gas chromatograph,GC)(Agilent 公司,美国);核磁共振仪(Agilent公司,美国)。
1.3 木质化秋葵多糖的分离纯化
称取脱色脱脂后的木质化秋葵粗粉100 g,以1∶30的料液比在100 ℃下提取2 h,提取2次。合并2次提取液,在60 ℃下减压蒸发,将提取液浓缩至原来体积的1/10,以8 000 r/min的转速离心10 min去除不溶物。利用Sevag试剂[8](V(三氯甲烷)∶V(正丁醇)=1∶4)对糖液进行脱蛋白处理,分液漏斗上层溶液减压浓缩去除未反应的三氯甲烷或正丁醇后,用自来水和蒸馏水分别透析72、48 h。透析液浓缩离心冻干即得木质化秋葵粗多糖。
称取木质化秋葵粗多糖500 mg溶解于500 mL蒸馏水中,在电动搅拌器快速搅拌的条件下缓慢加入95%乙醇,使得糖液的最终乙醇体积分数为40%。将其在4 ℃冰箱中冷藏过夜后,以8 000 r/min离心10 min,合并沉淀溶解于蒸馏水中,透析冷冻干燥后得到的组分即为40%醇沉组分AP1。
称取40%醇沉组分AP1(120 mg)溶解于10 mL超纯水中,以8 000 r/min离心后,吸取上清液缓慢加入到DEAE-Cellulose阴离子交换层析柱中(3.0 cm×40.0 cm),以0.2、0.3、0.4、0.5 mol/L的NaCl溶液依次对AP1进行洗脱,得到4个纯化组分,分别命名为AP1-a、AP1-b、AP1-c、AP1-d。
1.4 木质化秋葵均一多糖的理化性质测定
1.4.1 总糖、蛋白质和糖醛酸质量分数的测定
以D-Glc为标准品,用苯酚-硫酸法[9]测定总糖质量分数;以牛血清白蛋白为标准品,采用考马斯亮蓝法[10]测定蛋白质质量分数;用硫酸-咔唑法[11]测定糖醛酸质量分数,用半乳糖醛酸作标准曲线。
1.4.2 分子量和均一性的测定
用双蒸水配制质量浓度为1 mg/mL的多糖溶液,通过0.22 μm过滤器过滤后备用。使用高效液相色谱系统、2424蒸发光散射检测器以及TSK凝胶柱G4000PWXL(7.8 mm×300.0 mm)与G5000PWXL(7.8 mm×300.0 mm)的串联线性柱对多糖的均一性和分子量进行检测。将一系列标准葡聚糖(T-10、T-40、T-70、T-500)按峰时间和相对分子质量的对数绘制标准曲线。参照上述制备的标准曲线计算多糖分子量[12]。
1.4.3 紫外吸收光谱表征
将木质化秋葵均一多糖配制成1 mg/mL的溶液,于紫外可见光谱仪上在190~400 nm波长范围内进行扫描[13]。
1.5 木质化秋葵均一多糖的结构表征
1.5.1 单糖组成
采用GC对多糖的单糖组成进行分析[12]。纯化后的多糖组分(10 mg)在110 ℃下用2 mL三氟乙酸溶液(TFA)水聚4 h,水解产物在室温下用NaBH4还原3 h后,加入25%乙酸溶液终止反应。利用吡啶和乙酸酐对样品进行乙酰化处理,将样品转化为醛醇乙酸酯。采用HP-5毛细管柱(0.25 μm×320 μm×30 μm)和气相色谱系统(Agilent Technologies)对获得的醛醇乙酸酯进行分析。柱烘箱初始温度为150 ℃,升温过程设定为10 ℃/min升温至200 ℃,4 ℃/min升温至270 ℃。N2流速为20 mL/min,以鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、木糖(Xyl)、葡萄糖(Glc)、半乳糖(Gal)为单糖标准品分析样品的单糖组成。
1.5.2 FTIR表征
使用Perkin-Elmer分光光度计(Spectrum 100,Perkin-Elmer,Waltham,MA,USA)在4 000~500 cm-1的扫描范围内记录样品的FTIR光谱[14]。
1.5.3 部分酸水解分析
将50 mg多糖溶解于0.5 mol/L三氟乙酸溶液(8 mL),并在100 ℃下水解1 h。将水解产物在超纯水中透析48 h后浓缩冷冻干燥,即得到多糖的部分酸水解组分[14],利用GC对其进行进一步分析。
1.5.4 甲基化分析
将30 mg真空干燥的木质化秋葵多糖溶解于5 mL无水二甲基亚砜中,在N2保护下快速加入2 mL制备好的甲基亚磺酰甲基钠试剂并搅拌0.5 h,使其充分溶解。在避光和冰浴条件下,缓慢加入2 mL CH3I试剂,在50 ℃的油浴锅中搅拌1 h后室温下搅拌过夜。将反应物透析冷冻干燥即可得到甲基化的多糖。取少量多糖样品进行红外光谱检测,若3 500 cm-1处的羟基峰完全消失可证明多糖甲基化完全[15];反之,应对多糖进行重复甲基化处理,直至甲基化完全。根据文献[16]方法,利用88%甲酸在100 ℃对甲基化样品进行解聚处理,并参照上述单糖组成分析方法对解聚产物进行衍生化。采用配备有DB-5毛细管柱的气相色谱-质谱联用仪(gas chromatograph-mass spectrometer,GC-MS)进行分析。
1.5.5 核磁共振光谱表征
称取50 mg多糖,溶于99.9%的重水(D2O)中,于核磁共振仪中在60 ℃下进行核磁共振氢谱(1H nuclear magnetic resonance,1H-NMR)、核磁共振碳谱(13C nuclear magnetic resonance,13C-NMR)、异核单量子相干谱(heteronculear single quantum coherence,HSQC)和1H的异核多碳相关谱 (1H detected heteronuclear multiple bond correlation,HMBC)波谱分析[14]。
2 实验结果
2.1 木质化秋葵多糖的均一性分析
木质化秋葵粗多糖经40%乙醇醇沉后获得醇沉组分AP1,AP1经DEAE-Cellulose阴离子交换树脂分离纯化得到4个纯化组分,分别命名为AP1-a、AP1-b、AP1-c、AP1-d,如图1所示。

图1 多糖AP1-c的DEAE-Cellulose洗脱曲线
多糖AP1-c的HPLC分析结果如图2所示,从图2可以看出,均一性测定AP1-c为均一多糖组分,因此以下研究均集中研究多糖AP1-c,根据葡聚糖标准曲线计算出AP1-c的分子量为658 kDa。

图2 多糖AP1-c的HPLC谱图
2.2 木质化秋葵均一多糖的理化指标分析
通过苯酚硫酸法、咔唑硫酸法和考马斯亮蓝法测得AP1-c的总糖质量分数为95.36%,糖醛酸质量分数为24.83%,蛋白质质量分数为0.72%。
2.3 单糖组成分析
利用GC测定单糖、AP1-c及其部分水解产物的组成,结果如图3所示。
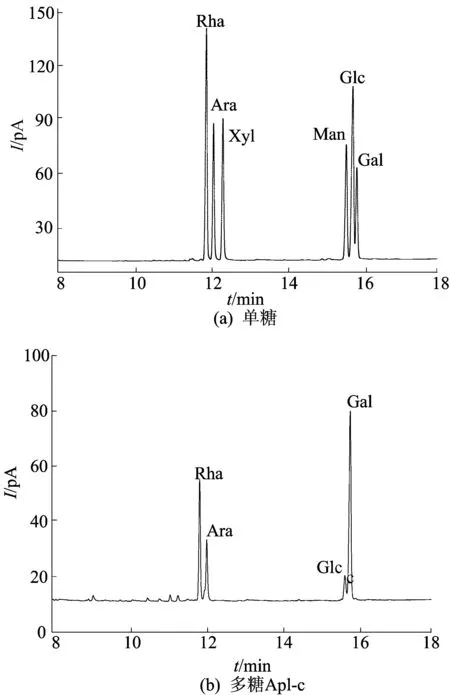
图3 单糖、AP1-c及其部分酸水解组分的GC谱图
通过与图3a的单糖标准品(Rha、Xyl、Ara、Man、Glc、Gal)进行对比,可以确定AP1-c组分主要由半乳糖(Gal)、鼠李糖(Rha)、阿拉伯糖(Ara)和葡萄糖(Glc)组成,其摩尔比为1.85∶1.00∶0.24∶0.67。
为了进一步了解多糖AP1-c的主链和支链组成,对其进行部分酸水解处理。AP1-c的部分酸水解产物的GC谱图如图3c所示,由图3c可知,其单糖组成为Gal、Rha、Glc、Ara,摩尔比为0.55∶1.00∶0.11∶0.04。与AP1-c相比,部分酸水解产物的Gal相对含量急速下降,Glc和Ara的相对含量下降至痕量,而Rha的相对含量基本保持不变。由于多糖经三氟乙酸水解时,位于支链的多糖残基更易被水解[14],因此部分酸水解后的AP1-c的支链被全部或部分去除。由此推测Rha和部分Gal残基可能位于主链上,而支链可能含有Glc、Ara和Gal。
2.4 紫外光谱表征结果分析
经TU-1901型紫外可见分光光度计测得AP1-c的紫外光谱,如图4所示。

图4 多糖AP1-c的紫外光谱图
从图4可以看出,在紫外光谱的260 nm或者280 nm处均没有吸收峰,说明AP1-c多糖中基本不含有核酸或者蛋白质[17]。与考马斯亮蓝法测得的结果一致。
2.5 FTIR表征结果分析
多糖AP1-c的FTIR谱图如图5所示。由图5可知,在3 418 cm-1处的强而宽的吸收峰主要是由于多糖分子间或分子内氢键中的O—H的拉伸振动引起的[18];2 937 cm-1的弱吸收峰归因于甲基或亚甲基的C—H的伸缩振动[17];大约在1 609 cm-1处的信号是由脱质子羧基(COO—)的拉伸振动引起的[19];1 426 cm-1附近出现的吸收峰是由C—H键的弯曲振动引起的[14];1 042 cm-1处的吸收峰表明多糖中存在吡喃糖环[20];而896 cm-1附近出现的吸收峰表明AP1-c中存在β型糖苷键[20]。

图5 多糖AP1-c的FTIR谱图
2.6 甲基化分析结果
多糖AP1-c经完全甲基化、水解、还原和乙酰化处理后经GC-MS分析,所得结果与GC-MS数据库中标准物质质谱图进行比对,结果见表1所列。GC-MS分析结果表明,组成AP1-c糖链的糖残基连接方式共有5种,分别为1,3,4-linked-Rhap、1-linked-Araf、1,4-linked-Galp、1-linked-Galp、1,6-linked-Glcp,对应的摩尔比为2.9∶1.6∶2.7∶2.3∶0.7。
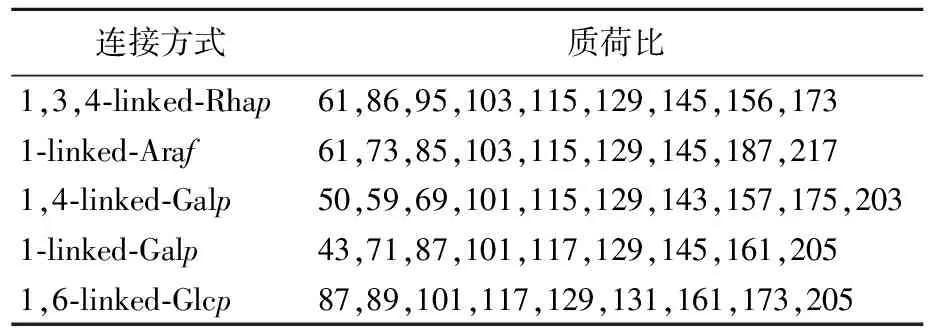
表1 AP1-c的甲基化分析
2.7 核磁共振光谱分析
核磁共振光谱是定性分析各种有机物、无机物的化学成分和结构的不可或缺的工具之一,其在多糖的结构解析中起着举足轻重的作用。多糖AP1-c的核磁共振光谱如图6所示。
从图6可以看出,多糖的1H-NMR主要用来鉴别多糖结构中的α或β构型。在1H-NMR中,异头氢的信号为4.8×10-6~5.5×10-6,其他C-2~C-6的质子信号[21]均集中在4.0×10-6~4.8×10-6。

图6 多糖AP1-c的核磁共振光谱
从图6a可以看出,AP1-c的异头氢范围内信号峰的化学位移δ位于5.13×10-6、 5.19×10-6、4.89×10-6、4.49×10-6、4.98×10-6,分别归属于→3,4)-α-D-Rhap-(1→(A)、α-L-Araf-(1→(B)、→4)-β-D-Galp-(1→(C)、β-D-Galp-(1→(D)、→6)-β-D-Glcp-(1→(E)糖残基的异头氢。13C-NMR的化学位移除了可以确定各类碳的位置,还能区别分子的构型和构象[22]。从图6b可以看出,δ位于98.32×10-6、98.31×10-6、97.41×10-6、103.36×10-6、97.69×10-6处的信号分别归属于→3,4)-α-D-Rhap-(1→、α-L-Araf-(1→、→4)-β-D-Galp-(1→、β-D-Galp-(1→、→6)-β-D-Glcp-(1→的异头碳。各糖残基的其他位的化学位移见表2所列。
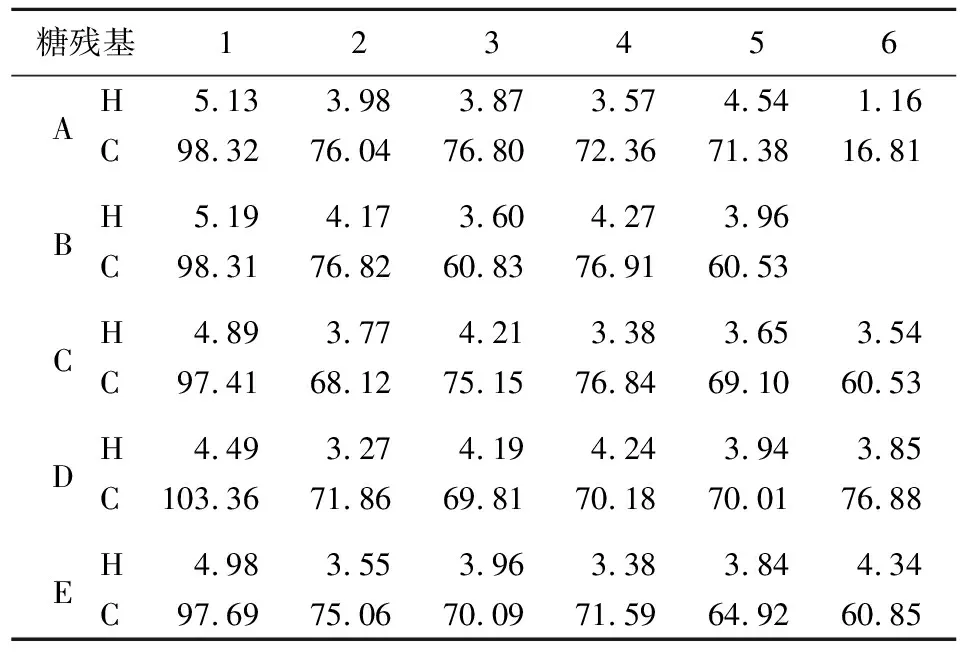
表2 AP1-c糖残基的化学位移 10-6
二维核磁共振图谱的分辨率高,包含大量信息,一般与一维图谱以及甲基化和部分酸水解等结合起来分析多糖中糖残基的连接方式。AP1-c的HSQC和HMBC图谱如图6c、图6d所示。从图6c可以看出,多糖AP1-c各糖残基的异头碳和异头氢之间的交叉峰的化学位移A1 (5.13/98.32)、B1(5.19/98.31)、C1(4.89/97.41)、D1(4.49/103.36)、E1(4.98/97.69)。从图6d可看出,糖残基连接顺序中碳氢远程耦合的相关峰[23]。结合AP1-c的甲基化和部分酸水解的分析结果以及参考文献推断,AP1-c的主链是由→3,4)-α-D-Rhap-(1→、→4)-β-D-Galp-(1→组成,而支链则是α-L-Araf-(1→、β-D-Glcp-(1→、→6)-β-D-Galp-(1→通过→4)-α-D-Rhap-(1→的O-3位连接在主链上。相应地,HMBC的交叉峰EH1/A C3 (4.98/76.80)表明E糖残基的1位连接在A糖残基的3位上,交叉峰AH1/CC4(5.13/76.84)表明残基A的H-1位连接在残基C的C-4位上,以及交叉峰BH1/AC3 (5.19/76.80)则表明B糖残基的H-1与A糖残基的C-3相连。
3 结 论
本文以木质化秋葵脱色、脱脂和脱蛋白纯化后获得的水提醇沉均一多糖AP1-c为对象,对其理化性质和结构特征进行研究。理化性质结果表明AP1-c的总糖、糖醛酸、蛋白质质量分数分别为95.36%、24.83%、0.72%。紫外光谱在260、280 nm处均没有吸收峰,表明AP1-c基本不含有核酸与蛋白质,与理化性质测定结果一致。运用甲基化、HPLC、GC、GC-MS及核磁共振光谱仪等化学和仪器方法共同表征AP1-c的结构,结果表明AP1-c的主链是由→3,4)-α-D-Rhap-(1→、→4)-β-D-Galp-(1→组成,而支链则是α-L-Araf-(1→、β-D-Glcp-(1→、→6)-β-D-Galp-(1→通过→4)-α-D-Rhap-(1→的O-3位连接在主链上。本文定性分析了木质化秋葵多糖的理化性质和结构特征,研究结果为开发木质化秋葵资源提供了数据基础和理论支持。
