H2O2协助铜基催化剂激发新污染物表面裂解性能与供电子机制
2023-05-05孙英涛林业泓蔡璇英张致泰张发根
孙英涛,林业泓,蔡璇英,张致泰,张发根,胡 春,吕 来, 2,*
(1. 广州大学 大湾区环境研究院 珠江三角洲水质安全与保护教育部重点实验室, 广东 广州 510006;2. 广州大学 乡村振兴研究院, 广东 广州 510006; 3. 广州大学 环境科学与工程学院, 广东 广州 510006)
0 引 言
工业化学品的大量生产和应用使微量的持久性有机物、内分泌干扰素、抗生素等新污染物(ECs)广泛存在于源头水中[1-7],由此导致的水体复合微污染成为关键环境问题之一。大量水处理技术被尝试用于去除源头水中的微量ECs,目前,高级氧化工艺(AOPs)尤其是芬顿技术[8-9]被认为是去除有机污染物的最有效的技术之一,尤其是在实验室中对于各种人工配制的较高浓度的污水具有明显的净化效果,但芬顿技术的实施必须要克服高能耗高成本这一瓶颈问题。经本团队前期研究表明[10-18],在通过在催化剂表面构建具有贫富电子微区的双反应中心(DRCs),可以有效调节反应体系界面电子转移过程。水中溶解氧和过氧化氢等氧化剂在富电子中心得到电子被活化产生活性氧物种(ROS)。有机污染物及其分解产物在缺电子中心发挥供电子效应,通过催化剂表面的化学键桥将电子转移到富电子中心,以维持整个体系的电子得失平衡。这一过程实现了界面电子的定向转移,有效突破了传统芬顿反应的速率限制步骤,并充分利用了污染物的能量,实现了芬顿反应的低能耗高效率。
在实际源头水水体中,往往还存在着大量的溶解性有机质(DOM),这些物质一般无毒无害[19-22],而高级氧化过程中产生的ROS具有无选择性攻击的特点,因此将消耗额外的能量在降解溶解性有机质上。本团队前期的研究同样表明,贱金属Al氧化物具有优异的稳定性以及大的比表面积,而贱金属Cu物种能够构建出多相类芬顿反应中重要的活性位点,同时两者具有不同的电负性,具备调控出表面贫富电子微区结构的重要前提。因而本文尝试将贱金属Cu、Al物种原位调控为具有表面贫富电子微区的DRCs催化剂(CA-CN),以实现微量过氧化氢驱动的优先去除水中有毒有害污染物的目的。研究表明,该催化剂对于多种微量ECs具有优异的去除性能,并且在实际水体中能够优先去除有毒有害有机物。此外,还利用XPS、XRD、EPR等技术研究和揭示了反应过程中催化剂/溶解氧/过氧化氢/污染物的界面相互作用机制。
1 材料和方法
1.1 实验材料
三水合硝酸铜[Cu(NO3)2·3H2O]、无水氯化铝(AlCl3)、尿素[CO(NH2)2]、过氧化氢(H2O2)、氨水(NH3·3H2O)、苯海拉明(Diphen Hydramine, DP)、磺胺甲恶唑(Sulfamethoxazole, SMZ)、双酚A(Bisphenol A, BPA)、氯化钠(NaCl)、硫酸钠(NaCl)、硝酸钠(Na NO3)、无水碳酸钠(Na2CO3)、磷酸二氢钠(NaH2PO4)、硝酸(HNO3)、N, N-二乙基对苯二胺硫酸盐(DPD)、过氧化物酶(POD)、2, 2, 6, 6-四甲基-4-哌啶醇(TEMP)、5-叔丁氧羰基-5-甲基-1-吡咯啉-N-氧化物(BMPO),所有化学试剂至少是分析纯,实验用水若无特殊说明,均为超纯水。
1.2 催化剂的制备
使用溶胶-凝胶法制备催化剂。称取724.8 mg三水合硝酸铜(Cu(NO3)2·3H2O)和2.66 g无水氯化铝(AlCl3)以及600 mg尿素[CO(NH2)2]溶于100 mL超纯水中,搅拌30 min使其混合均匀,而后加入浓氨水(NH3·3H2O)调节pH至11。转入烘箱在150 ℃下保持12 h,以蒸发其中的水分和可挥发物质,得到催化剂前体。将烘干的前体转入马弗炉中,在设定的温度下保持6 h。将得到的煅烧产物收集,用超纯水和无水乙醇交替洗涤3次,烘干后即制得目标催化剂CA-CN。
1.3 催化剂表征技术
采用场发射扫描电子显微镜(SEM, 捷克TESCAN MIRA LMS)观察催化剂的微观结构及其特征;采用X-射线粉末衍射仪(XRD, 日本Rigaku Smartlab 9KW)观察催化剂的晶型以及物相;采用X射线光电子能谱(XPS, 美国Thermo Scientific K-Alpha)研究催化剂表面元素存在价态以及反应过程催化剂与污染物进行界面作用引起的价态转换;采用电子顺磁共振波谱仪(EPR,布鲁克 A300-10/12)研究反应前后中催化剂表面未成对电子的变化情况以及反应过程中产生的活性氧物种。
1.4 实验方法
所有的实验都在一个玻璃烧杯(100 mL)中进行,其中含有50 mL 2 mg/L的污染物溶液(自然pH),整个过程保持在35 ℃(夏季室温,模拟实际污水处理厂净水过程的水温),根据污染物降解的最佳活性确定催化剂粉末(0.2 g/L)和H2O2(5 mmol/L)的最佳剂量,并在所有的实验中使用,除非另有说明。在一个典型的实验中,50 mL 5 mg/L的污染物水溶液和0.01 g的催化剂粉末被放置在一个烧杯中,搅拌10 min以建立吸附-解析平衡,然后在磁力搅拌下将25 μL H2O2(5 mmol/L加入到悬浮液中。在给定的时间间隔内(0、5、10、15、30、60 min)收集1 mL的试样,并通过微孔过滤器(孔径为0.22 μm)过滤进行分析。
1.5 分析方法
高效液相色谱分析(HPLC):所有污染物均使用配备紫外检测器和ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm)的1200系列HPLC(美国安捷伦)进行分析。流动相由体积比为70∶30的甲醇/水混合物或体积比为60∶40的乙腈/水混合物组成,流速为1 mL/min。
三维激发发射矩阵荧光分析(3D-EEM):首先将0.01 g催化剂粉末与50 mL目标水样(35 ℃)在适当体积的玻璃烧杯中混合。将悬浮液搅拌约10 min,然后加入H2O2(5 mmol/L)触发水净化反应。以一定的间隔,用注射器收集3 mL反应悬浮液并用过滤器(0.22 μm)过滤以进行后续分析。在带有氙激发源的F-7000光谱仪(日立)上获得了各种样品的三维激发发射矩阵(3D-EEM)荧光光谱,并将激发和发射的狭缝设置为5 nm。激发波长以5 nm的步长从200 nm增加到450 nm;对于每个激发波长,以5 nm步长检测280~550 nm的发射。
电子顺磁共振波谱分析(EPR):在相应样品的甲醇/水分散体中检测BMPO/TEMP捕获的EPR信号。中心场为3 500 G,扫描宽度为100 G,调制频率为100 kHz。为了检测·OH,将0.01 g制备的粉末样品加入到500 μL水中。然后,将100 μL上述悬浮液、20 μL BMPO(250 mmol/L)和50 μL H2O2(质量分数为30%)充分混合,静置后吸入毛细管进行检测。为了检测HO2·/O2·-,步骤与上述相同,只是水替换为甲醇。为了检测1O2,步骤与检测·OH的步骤相同,只是BMPO替换为TEMP。
2 结果与分析
2.1 表面电子极化分布的表征
CA-CN通过原位溶胶-凝胶法煅烧制备而成。其结构表现为粒径约为100~200 nm的小颗粒聚集形成粒径4 μm的大颗粒(如图1)。CA-CN的SEM元素映射图谱显示,Cu、Al、O为主要元素,并且在聚合颗粒中均匀分布,C元素主要分布在颗粒周围,N元素信号强度较为微弱。由此可见,在催化剂制备过程中使用的原位合成工艺能够使得所有元素均匀地分布在催化剂的颗粒体中,没有发生任何的元素团簇现象。
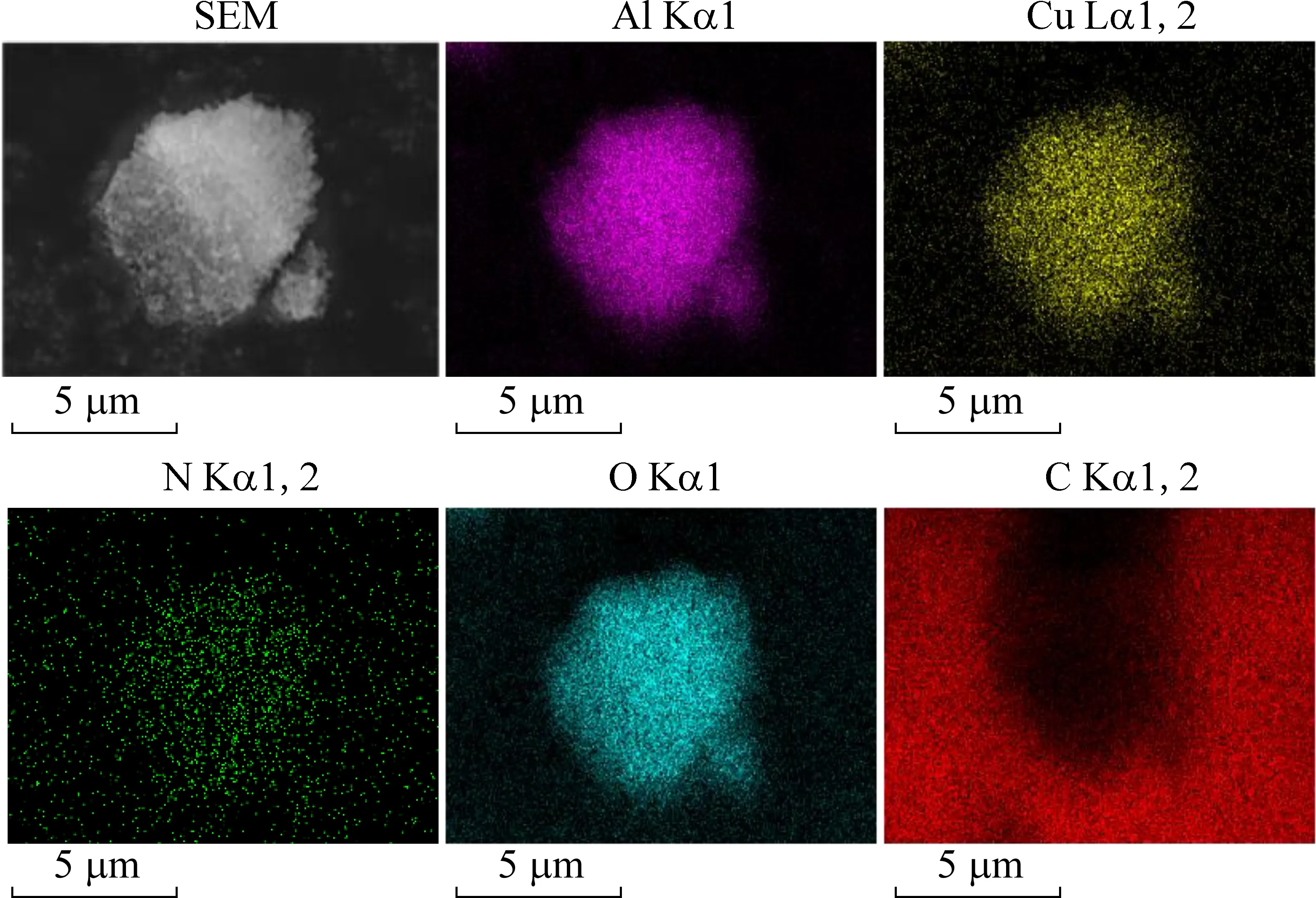
图1 CA-CN的SEM图谱及其元素能谱图Fig. 1 SEM spectra and elemental mapping of CA-CN
CA-CN的XRD图谱如图2(a)所示,其主要表现出氧化铝晶相(对应PDF#10-0425),并且在图谱中也并未显示出铜元素的特征峰,这对应了SEM图谱中的现象,表明了在催化剂制备过程中各元素均匀分布,并未出现团簇现象。此外,反应后的CA-CN晶相并未发生明显变化,这显示了该催化剂的优异稳定性。图2(b)为CA-CN的碳元素XPS图谱,其中结合能位于285.2 eV的峰位归因为C—O—M(M为金属物种)的特征峰[23],先前的研究表明[15],C—O—M键桥是催化剂表面形成双反应中心的关键。值得注意的是,反应过后在结合能位于291.3 eV的位置出现了一个新的特征峰,归因为污染物的芳香环与催化剂表面类石墨烯结构π-π相互作用的结果[24]。而反应后催化剂表面C—O—M键的峰位发生了偏移,峰强也发生了改变,这是由于在反应过程中,催化剂与污染物的芳香结构(π电子)发生了强烈的界面相互作用,由于该芳香结构与催化剂表面原有的类石墨烯结构不同,从而导致催化剂表面的C—O—M键桥特征峰的变化。图2(c)为CA-CN的铜元素XPS图谱,制备时仅使用Cu2+,而催化剂表面表现出Cu+和Cu2+共存,表明在制备过程中催化剂表面也存在着电子的转移,这直接导致了电子极化分布为贫富电子中心。而反应后的CA-CN表面低价态铜物种比例上升,证实了反应过程中污染物与催化剂表面存在界面作用并发挥着电子供体的作用。通过电子顺磁共振技术得到了催化剂的电子结构信息,如图2(d)所示,在g值为2.07处检测到了明显的EPR信号,表明催化剂表面存在未成对单电子,这是催化剂表面电子极化分布形成贫富电子微区的先决条件。此外,吸附了BPA过后的固体EPR信号发生了微弱的增强,添加了H2O2过后,这一信号的增强更加显著,表明在反应过程中污染物与CA-CN之间发生了界面相互作用,引起了BPA的供电子效应,而H2O2的引入增强了这一过程。
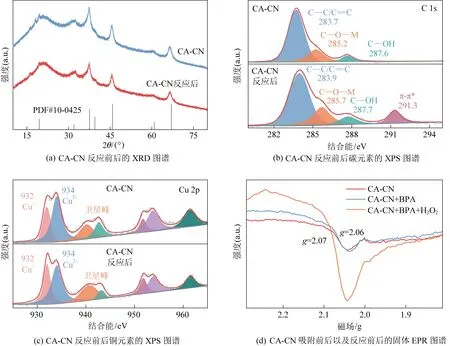
图2 CA-CN结构的不同表征手段Fig. 2 Different characterizations of CA-CN structures
以上表征结果证实,在制备过程中,催化剂表面电子发生了极化分布,形成了具有贫富电子微区的双反应中心这一特殊结构。并且结果表明在反应过程中污染物与催化剂通过表面的π-π结构进行界面相互作用,可能是双反应中心催化剂优异催化活性的关键结构之一。
2.2 对微量新污染物的高效去除
通过上述一系列的表征研究,证实成功地在CA-CN表面构建了具有贫富电子微区的双反应中心,并且污染物在双反应中心催化反应过程中与催化剂通过界面相互作用扮演着电子供体的角色,接下来将以此催化剂为基础构建双反应中心催化体系,用于水源水中新污染物的深度处理,探究该结构对于污染物的去除效率。以双酚A(BPA)、苯海拉明(DP)、磺胺甲恶唑(SMZ)为目标污染物,考察CA-CN在常温常压下的催化活性。如图3(a)所示,对于所选的3种新污染物,CA-CN均可以在极短的时间内实现去除降解,其中在5 min内就可以降解80%的BPA。对于SMZ以及DP,去除率也能在60 min内超过90%。如图3(b)所示,不同催化剂剂量的实验中看出,少量的催化剂剂量就能实现较高的污染物去除效率,即使仅使用了0.06 g/L的痕量催化剂,也能够在10 min内去除超过70%的BPA。使用经典芬顿法进行深度处理时,不可避免需要额外添加过量H2O2,但是令人意外的是,不同浓度过氧化氢实验结果如图3(c)所示,即使体系中仅仅存在1 mmol/L浓度的H2O2,CA-CN也能表现出极其优异的污染物去除速率,在15 min内均能达到超过80%的去除率。此外,体系中不存在H2O2时,CA-CN也能在60 min内去除超40%的BPA,可能和催化剂表面双反应中心对于水中溶解氧的活化产生活性氧物种攻击污染物有关,将在接下来的实验中进行验证与讨论。实际源头水中常常存在一些微量的无机阴离子(包括氯离子、硫酸根离子、硝酸根离子、碳酸根离子、磷酸根离子等),这些都可能对深度处理的效果产生促进或者抑制的影响。如图3(d)所示,在反应体系中投加不同种类的无机阴离子后,多数阴离子对污染物的去除没有显著影响,而其中的碳酸根离子和磷酸根离子对污染物的去除有较为明显的抑制作用,磷酸根的抑制作用尤为显著,根据之前的文献描述[25-26],磷酸根由于是与H2O2、污染物竞争吸附位点,从而削弱催化剂、H2O2、污染物之间的界面作用,导致污染物去除效率的降低。
本部分主要是以上一部分制备的双反应中心催化剂CA-CN为基础,在超纯水中构建出双反应中心催化体系,研究CA-CN的污染物去除催化性能,其表现出的高效率、低消耗的污染物去除性能离不开表面构建的贫富微电场。
2.3 对实际水源水中新污染物的优先去除
由于实际水体净化过程中并不会使用超纯水这种理想体系,因此,本小节中使用实际水源水构建双反应中心水净化体系以探究CA-CN的实用性。
实际水源水中常常含有大量溶解性有机物(DOM),这些有机物一般为低毒性低危害性有机物。然而在实际的高级氧化水处理过程中,产生的活性氧物种无选择性地攻击有机物,使得这些低毒性溶解性有机物与高毒性有机污染物被同时降解,造成了高额的能耗,这也是传统水处理技术成本居高不下的重要原因之一。因此,能选择性优先去除高毒性有机污染物是突破这一瓶颈的关键。
图4为源头水溶液经过CA-CN/H2O2体系净化前后的三维荧光图谱(3D-EEM)。根据之前的文献[27]将其图谱分为5个区域(区域Ⅰ和Ⅱ:络氨酸等简单芳香族蛋白;区域Ⅲ:富里酸类等小分子有机物;区域Ⅳ:可溶性微生物副产物;区域Ⅴ:类酸性有机物)。如图4(a)和(b)所示,湖水中主要含有的物质类似,均为简单芳香族蛋白以及富里酸等小分子有机质,这些都属于低毒性DOM。在经过双反应中心催化体系深度净化过后,其峰的强度显著降低,表明了CA-CN/H2O2体系对于源头水的深度处理具有优异的净化效果。除此之外,本节还以实际水体配制一定浓度有毒污染物(5 mg/L),以探究CA-CN/H2O2体系在实际源头水净化中能否实现优先降解有毒有害污染物的目标。如图4(c)和(d)所示,源头水配制有机污染物后,其荧光信号发生了显著的变化,出现了代表该污染物的新的特征峰,在CA-CN/H2O2体系净化60 min后,污染物已被完全去除(如图3(a)),而其荧光图谱中显示还主要剩下区域Ⅲ和区域Ⅴ的特征峰,即只剩下代表溶解性有机物的特征峰。此外,在超纯水配置有机污染物溶液的EEM图谱中(4(e)和(f)),BPA的峰位主要在区域Ⅱ和Ⅳ,并且在净化过后的峰位主要为区域Ⅱ、Ⅳ和Ⅴ,与净化过后的湖水体系中的峰位(区域Ⅲ与区域Ⅴ)不同,表明体系中剩余的物质不同,CA-CN/H2O2体系在源头水深度净化过程中能够实现对有毒有机污染物的优先降解,同时保留了低毒性DOM,这是该体系低在实际应用中实现低能耗的重要因素。
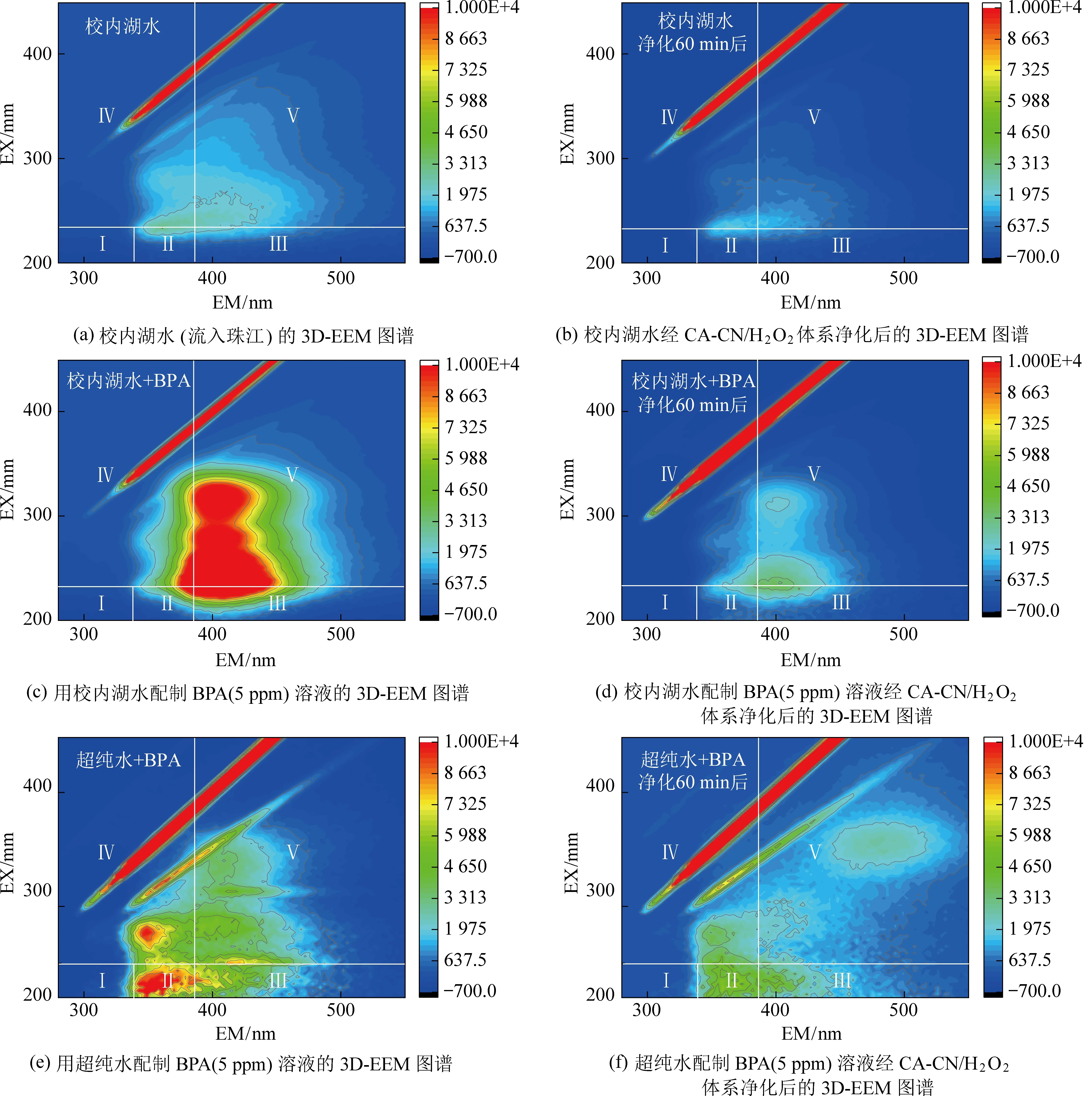
图4 CA-CN/H2O2体系对不同源头水溶液的净化效果三维荧光图谱(3D-EEM)Fig. 4 Three-dimensional fluorescence mapping (3D-EEM) of the purification effect of CA-CN/H2O2 system onthe aqueous solutions from different sources
在实际水体中构建双反应中心催化体系并探究其实际应用性,结果显示,CA-CN/H2O2体系在实际水体中不受天然DOM的影响,仍然具有优异的净化性能。令人震惊的是,当水体中同时存在DOM和毒性有机物时,该体系能够优先去除有毒有害的有机污染物,以此降低深度水体净化时的能耗。
2.4 双反应中心催化体系净水机制
根据上述实验现象,本节将对该双反应中心催化体系的净水机制展开探究,揭示CA-CN、水中溶解氧、污染物以及H2O2之间的界面相互作用和电子转移路径。本研究主要通过对CA-CN/H2O2体系净水过程中产生活性氧物种的检测推断其作用机制。
即使不添加H2O2时,在CA-CN悬浮液中也观测到了相对强度为1∶2∶2∶1的BMPO-·OH信号以及BMPO-O2·-信号的6个特征峰(图5(a)和(b)),证明水中的溶解氧能够在富电子中心(铜物种)处发生界面作用并且被活化产生活性氧物种。在加入污染物之后,BMPO-O2·-强度有明显上升(图5(c)和5(d)的红色线条),表明了随着污染物的引入,水中的溶解氧得到了更多的能量/电子,而在没有任何外加氧化剂的前提下,这些能量/电子只能来自于污染物。
体系中加入H2O2后,BMPO-·OH信号以及BMPO-O2·-信号都得到了极大的提升,如图5(a)和(b)所示,表明CA-CN对H2O2具有优异的活化能力。加入污染物之后,BMPO-·OH信号降低,BMPO-O2·-信号强度也明显降低,在常规的Fenton过程中,体系中的H2O2大部分会与催化剂表面的金属物种直接接触,从而被氧化为O2·-,导致H2O2的利用率低下,这也是传统净水过程中能耗居高不下的一个重要原因[28]。CA-CN避免了这一过程的发生,这表明在体系中引入污染物之后,H2O2的失电子作用被污染物取代,从而提高H2O2在水净化过程中的利用率,证实了污染物在体系中的供电子作用,这也是双反应中心催化体系能够实现低耗高效的重要原因之一。
为了进一步研究CA-CN对水中溶解氧的活化作用以及污染物的供电子效应,设计进行了检测反应过程中BMPO-O2·-信号变化的实验。如图5(c)所示,即使体系中不外加任何氧化剂和污染物的情况下,CA-CN对水中溶解氧具有良好的活化性能,在反应了8 min后,BMPO-O2·-信号强度增强到了初始强度的2.75倍,表明CA-CN能够对水中溶解氧持续的活化。当体系中外加了污染物过后,初始强度约为不添加污染物时的1.5倍,在反应了8 min后,强度也是增强到了初始强度的2.65倍,更证实了污染物的引入使水中的溶解氧获得了更多的能量/电子,这都得益于污染物的供电子效应。
通过以上的现象和结论,可以得出CA-CN/H2O2/O2/BPA之间的界面相互作用机制。污染物与CA-CN通过π-π结构进行界面相互作用,使污染物芳香环结构中的电子传递到催化剂表面的缺电子中心(类石墨烯结构)。接下来通过催化剂表面的C—O—M结构将捕获的电子传递至富电子中心(铜物种),水中的溶解氧与H2O2在此处得到电子被活化产生活性氧物种。在整个过程中,H2O2除了作为氧化剂,还担任着触发污染物去除链式反应的作用,因而能够实现高效-低耗的净水过程。
以上结果表明,利用原位晶格掺杂取代成功构建了表面双反应中心,并用于源头水深度净化过程。新污染物在CA-CN/H2O2/O2体系的供电子效应有效突破了传统深度净水过程中能耗过高、效率较低的瓶颈问题。此外,在实际水体净化过程中显示出优先去除有毒有害有机物的选择性降解,为源头水深度处理中降低能耗和提高效率提供了一个全新的视野。
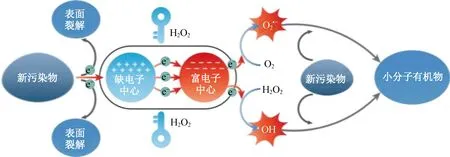
图6 CA-CN催化体系去除水中新污染物的机制示意图Fig. 6 Schematic of the mechanism of the CA-CN catalytic system for the removal of emerging contaminants from water
3 结 论
(1) 采用原位晶格掺杂的手段成功制备出具有表面贫富电子微区的双反应中心催化剂。通过XRD、XPS、SEM以及EPR等表征手段证实了其表面的贫富电子中心,并且证实污染物与催化体系通过π-π结构进行界面相互作用,从而能够发挥污染物的电子效应。
(2) 探究了该双反应中心催化体系在超纯水以及实际水体中的催化活性。结果表明:在超纯水体系中对多种微量新污染物具有高效低耗的去除性能;在微量ECs与DOM共存的实际水体中,能够优先去除有毒有害的污染物,降低了实际水处理中的能耗。
(3) 净水机制研究结果表明CA-CN对于水中的溶解氧具有优异且持续的活化效果,并且当污染物存在时,该活化效果得到了显著提升。证实了污染物在反应过程中作为电子供体,向催化体系提供源源不断的电子流和能量流,极大地节省了净水成本与能耗。
