温室气体四氟化碳处理技术研究进展
2023-05-05朱烨林陈世杰刘菀凝沈锋华向开松
朱烨林,郑 谐,陈世杰,刘菀凝,艾 曼,沈锋华, 2,向开松, 2,刘 恢, 2, *
(1. 中南大学 冶金与环境学院, 湖南 长沙 410083;2. 国家重金属污染防治工程技术研究中心, 湖南 长沙 410083)
0 引 言
全氟化碳(PFCs)具有超强的温室效应,其温室效应潜能值是CO2的6 500倍,在大气中的留存时间长达2 600~80 000 a,是《京都议定书》《巴黎协定》等国际公约重点监管的温室气体[1-3]。2014年我国PFCs排放1 600万t二氧化碳当量,是世界上PFCs排放量较多的国家[4]。工业活动是PFCs最主要的来源,主要来自金属冶炼过程(95.6%)、卤烃和六氟化硫的生产(0.3%)与消费(4.1%),其中铝电解是我国PFCs最大的排放行业[5]。我国作为铝电解生成第一大国与卤烃/六氟化硫的生产消费大国,面临的PFCs减排压力巨大。
PFCs主要包括CF4、C2F6、C3F8等气体,其中CF4占绝大部分,是PFCs气体控制的重点[6]。CF4在常温下是不溶于水的可压缩性气体,空间结构稳定,C—F键能为(543±4) kJ/mol[7],铝电解过程的阳极效应是CF4生成的主要来源[8]。当前,铝电解行业CF4的控制主要分为源头减排和末端处理两大类。源头减排主要依赖于生产设备、工艺优化等措施抑制阳极效应,并已取得了显著成效[9]。然而随着阳极效应优化逼近极限和非阳极效应CF4问题凸显,以及半导体等行业工业尾气CF4排放占比日益增加,CF4的末端处理日益成为研究的热点。
因此,根据CF4产排行业特点、尾气浓度与处理难度的差异,以是否破坏CF4分子结构可将处理技术分为物理回收与化学转化两大类别,系统地介绍物理处理技术中深冷分离法、物理吸附法、膜分离法以及化学处理技术中热力燃烧、热催化分解、等离子体高能分解、电化学催化分解领域的研究进展和技术机理。对未来CF4处理技术的发展与需求进行展望,为行业PFCs的减排提供技术参考。
1 CF4来源及源头减排
1.1 来 源
CF4的来源包括自然来源和人为来源。在人类进入工业化前,仅在某些岩石和矿物的受热、破碎和溶解后会产生并排放CF4,其通量低于0.01 Gg/yr[10]。自然界中排放的极少量CF4扩散至大气层,并保持在较恒定的浓度,其吸收辐射,是维持地球表面温度的重要保障之一。人类社会进入工业化时代后,工业活动产生大量CF4,其排放量远超自然排放,并造成大气CF4浓度迅速上升。统计显示,1955—2022年,CF4的大气丰度从40 ppt激增至近90 ppt,增加近1.2倍[11]。原铝生产、半导体制造和平板显示器制造、稀土金属冶炼是已知的最大CF4人为排放源,其中铝电解行业约为全球排放量的62%,半导体制造行业为36%,稀土金属冶炼行业约为2%[12-13]。
铝电解过程发生的阳极效应是CF4产生的主要来源。在铝电解过程,会间歇性发生阳极效应,电解槽电压从正常水平的4.2~5.0 V升高至25~50 V,当碳质阳极的电位超过冰晶石助溶剂的分解电压后,铝电解原料冰晶石在碳阳极表面直接反应生成CF4[14],其原理如图1所示。研究发现当电解槽中氧化铝浓度偏低时(低于2.78%),碳阳极将与冰晶石反应,以非阳极效应的形式排放一定量的CF4,非阳极效应吨铝CF4排放水平约为0.01 kg,为阳极效应时的十分之一[15-16]。半导体制造行业的刻蚀过程中会使用氟化物气体作为反应气,当反应未完全分解时将导致CF4的排放。据统计,我国半导体行业CF4排放量约为1.3 Gg/yr[17]。稀土金属冶炼行业是另一重要的CF4来源,其产生过程与铝工业类似,但该行业的CF4排放数据尚不确定。综上可见,有色金属行业和半导体制造行业面临着巨大的CF4减排压力。
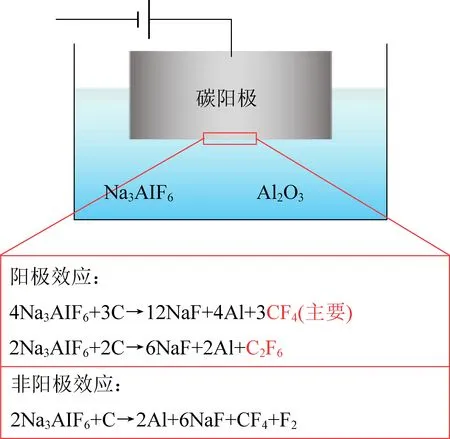
图1 铝电解过程PFCs生成过程Fig. 1 PFCs generation process in aluminum electrolysis
1.2 源头减排技术
CF4的源头减排主要集中在铝电解行业,现行的普遍做法是抑制阳极效应。目前主要通过优化电解工艺、改进电解槽设备等措施减少阳极效应影响,实现PFCs的源头减排。研究表明,氧化铝浓度偏低是导致阳极效应发生重要原因。降低效应次数和缩短平均效应时间是CF4主要减排策略,可通过下料系统和氧化铝输送系统方案、阳极效应熄灭方案优化、铝液量控制、极距控制、电解液温度和化学成分控制等来实现[18];此外,还可通过电解槽设计优化槽内磁场分布和补偿,均匀分布氧化铝,减少局部阳极效应造成的CF4排放。如中铝郑州有色金属研究院有限公司对氧化铝浓度参数进行调整,将阳极效应系数平均降低了近40%[19]。通过改进和提高铝电解过程的自动控制系统来优化电解槽性能,解决物料与能量平衡控制,已成为铝电解行业CF4减排的通行做法。
目前面向阳极效应的源头减排技术已接近极限,而非阳极效应带来的CF4排放尚未得到清晰的认识与高效治理,未来CF4排放控制的关键在于末端处理。
2 CF4处理技术发展现状
2.1 物理处理技术
物理处理技术是根据CF4固有的物理性质对其进行分离、纯化,以实现回收利用。目前,常用的CF4物理处理法有深冷分离法、吸附法、膜分离法,如图2所示。
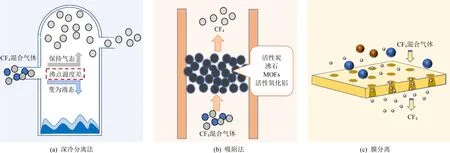
图2 CF4物理处理技术Fig. 2 The diagram of CF4 physical processing technology
2.1.1 深冷分离法(低温精馏法)
深冷分离技术通过对混合气体进行压缩、膨胀、降温(-100 ℃以下),利用液化后各组分沸点差异进行气体分离纯化,回收目标产品[20-21]。当CF4与其他气体组分的沸点温度差异较大时,该技术可对其进行有效的分离与纯化。刘伟等[22]利用SF6(-63.8 ℃)与CF4(-128.0 ℃)沸点温度差,在深冷条件下,SF6转化为固态,CF4保持气态,实现两相分离。该过程仅压缩和冷却降温两步,操作简单易行。然而实际含CF4尾气组分通常较为复杂,需要进行预处理,如使用碱石灰去除气体水分、分子筛去除酸性杂质(HF等)[23]。因此,在实际应用中,深冷分离技术常与分子筛分离连用,以实现更好的纯化效果。
深冷分离技术需要高抗压、低导热、高密封度的设备支撑,且目前设备体积普遍偏大且能耗高。同时,技术的实施效果与气体组分关系密切。半导体行业尾气组分简单,CF4的深冷分离回收技术可行;但铝电解行业烟气组分复杂,含有SO2、CO、CO2、C2F6、CF4、HF等多种组分,精准分离与CF4沸点相近的气体组分时该技术面临重大挑战。
2.1.2 吸附法
吸附法是常用于CF4分离回收的技术手段之一,其原理是基于吸附物和吸附剂之间的非特异性范德华力差异实现分离。吸附分离技术高度依赖吸附剂的开发[24]。目前各类高比表面积、微孔率、大孔容的吸附剂被不断创新并且应用在CF4的捕获分离。活性炭、沸石、活性氧化铝、金属有机框架材料(MOFs)等是CF4分离吸附剂的典型代表。为提高这些材料的分离效率,通常需要对其设计与处理以提高CF4的吸附容量和吸附选择性。
比表面积和孔隙结构是影响材料吸附容量的重要因素。Ahn等[25]对比了具有不同比表面积的沸石13X、沸石5A对纯CF4的吸附性能,相同条件下,具有更大比表面积为的沸石13X(670.4 m2/g)比沸石5A(552.0 m2/g)表现出更大CF4吸附量,当温度为303.15 K时,沸石13X最大吸附量为(3.609±0.350) mol/kg,而沸石5A的最大吸附量较沸石13X小近一倍,仅有(1.820±0.070)mol/kg。Xiang等[26]则利用活性炭对空隙结构的影响进行了研究。通过酸碱刻蚀合成微孔尺寸为0.8 nm的活性炭,其最大吸附量可达2.79 mol/kg,而未处理的活性炭表面孔隙较小且尺寸不一,对CF4的吸附能力较弱,说明内孔尺寸在吸附CF4过程中发挥关键作用。
路易斯酸、碱性位点也是决定吸附剂对CF4选择性的重要因素。MOFs材料是一类表面功能和孔径可控的多孔配位聚合物,易实现路易斯酸、碱位点的枝接,在CF4混合气体分离方面表现出巨大的潜力。Wang[27]的团队共同开发了Ni-MOF和NH2-Ni-MOF两种多孔配位聚合物材料,如图3(a)和(b)所示,两种多孔配位聚合物无论是在273 K还是298 K的条件下,均能对CF4保持良好的选择性和吸附性能,其理想溶液吸附理论选择性分别为34.7和46.3(273 K,1 bar)。机理研究表明,氨基官能团使得CF4分子更易被NH2-Ni-MOF的层间空间通过氢原子和氟原子之间的结合位点捕获,其微观捕捉过程如图3(c)所示。

图3 Ni-MOF和NH2-Ni-MOF在273 K和298 K的CF4、N2吸附等温曲线以及NH2-Ni-MOF吸附机理图[27]Fig. 3 CF4 and N2 adsorption isotherms of Ni-MOF and NH2-Ni-MOF at 273 K and 298 K and the adsorption mechanism diagram of NH2-Ni-MOF[27]
Wilson等[28]研究了活性氧化铝酸碱位点对CF4吸附选择性的影响。通过对比酸性氧化铝A和具有活性表面羟基和大量路易斯酸性位点的活性氧化铝AA-300看两种材料发现,活性氧化铝AA-300在低于60 ℃的温度下具有更高的亨利常数,低于-135 ℃温度下,亨利常数高于10 mmol·g-1·atm-1,对CF4具有显著的选择吸附能力,是低温下分离CF4的潜在吸附剂。
目前所开发的吸附材料中,活性炭、沸石、活性氧化铝稳定性高且价格低廉;MOFs作为新兴材料对CF4具有优异的吸附性能,但面临批量生产难与结构不稳定等实际问题。实际工业含CF4尾气通常为酸性,且含有大量细颗粒物,对材料的耐酸腐蚀性与抗毒化提出了更高的要求。
2.1.3 膜分离
膜分离技术是根据气体在膜中的扩散和吸附系数上的差异实现组分分离,主要受膜的材料特性的影响。膜气体分离无相变过程,无需大量的能量消耗,是工业烟气排放物中氟化气体分离的备选方案。膜分离技术要求膜对目标分离气体具有较高的选择性和渗透性。
CF4膜分离纯化多使用聚合物膜。Branken等[29]通过浇铸法制备了高性能玻璃态全氟聚合物膜Teflon AF和Hyflon AD60成功实现了CF4/NF3的分离,Hyflon AD60显示出最高的CF4/NF3纯气体和混合气体选择性,高达12。电力行业工业生产过程的废气包括大量的氟化气体,SF6和CF4混合气体最为常见。Lee等[30]使用商业聚砜中空纤维膜对显示器厂模拟烟气中的SF6和CF4混合气体(SF6平均为951.3 ppm,CF4平均为72.2 ppm)进行分离,CF4的渗透率可达4 GPU (Gas Permeation Unit),是SF6的2倍。气体膜分离技术可实现气体常温分离,能耗低,但分离膜的制备过程复杂且繁琐,目前对CF4的选择性仍较低,难以满足工业回用的气体纯度要求。开发高选择性膜并降低膜的制备成本将赋予该技术更高的工业应用潜力。
2.2 化学分解技术
化学分解技术是通过热、电等外源能量破坏C—F键以实现CF4的分解,其破坏了分子的原有结构,并将其转化为更无害或者更易分解的产物。化学分解包括热力燃烧、热催化、等离子分解等手段,是CF4的末端处理的重要保障技术,各项化学分解技术简图如图4所示。
2.2.1 热力燃烧

对于企业或工厂而言,CF4燃烧处理工艺可直接对产生的废气进行集中燃烧,无疑是最为简单的处理方式之一,处理时间短、处理量大。但所需的燃烧温度使得此技术处于两难境地,烃类化合物在低于1 200 ℃的燃烧温度下会生成有毒化合物二噁英,带来二次污染,而更高的燃烧温度对设备耐高温能力要求更高且能耗大幅增加。因此,热力燃烧已经逐步被其他高效、低耗能的工艺取代,尤其是在其基础上发展起来的热催化分解技术。
2.2.2 热催化分解

目前,大部分有水热催化反应催化剂的分解性能仍较低。增加催化剂的活性位数量是提高其分解性能和延长处理时间的有效途径,其中引入第二金属是较为常用的做法。Chen等[34]采用共沉淀法制备了由铁纳米粒子掺杂的介孔催化剂(MCM-41),添加5%的Fe后在1 120 K时对CF4的分解效率由32%提升至75%。Takita[35]发现在分解过程中,当AlPO4中引入10%的稀土元素Nb后,700 ℃时的分解效率由40%升至90%;引入10%的铈,则使得反应启动温度下降至500 ℃。有水热催化分解过程中产生腐蚀性HF,与催化剂反应使活性位点数量减少并最终导致催化剂失活,催化剂耐酸性腐蚀成为有水热催化分解技术的一大瓶颈。为解决催化剂酸腐蚀问题,引入其他元素,也可一定程度上缓解催化剂稳定性问题。磷酸盐催化剂引入锆、铝之后可有效保持活性,CF4分解效率保持在46%和40%[35]。异元素的引入不仅可有效提升催化剂的活性,同时可增强催化剂的耐腐蚀性,主要原因在于二元的磷酸盐提高了催化剂结晶性促进了催化稳定性的提升。
前期大量的研究表明,催化剂的水解活性与铝基材料的路易斯酸性位点密切相关。近期,关于活性位点的甄别有了新的认识。Zhang[36]通过水热法在不同温度下合成了γ-Al2O3纳米片,分析发现强酸位点的数量对分解效率的影响不大,但温度越高合成的材料中暴露的(110)上三配位Al(Al(III))越少,催化剂活性降低,如图5(a)所示,说明Al的配位环境对CF4的分解具有关键影响。图5(b)对比了CF4在不同配位的铝原子上的吸附能和C—F键长,发现Al(III)位点具有最低的CF4吸附能(-0.45 eV),更容易使得C—F键断裂。该项工作也较为系统地阐述了CF4的分解过程与机制(图5(c)~(d)):F原子吸附在Al(III)位点上,CF3自由基吸附在附近的氧位点上,水分子中的质子从CF3中夺取F原子形成HF,羟基与CF2结合形成CF2OH;然后解离出HF形成CFO中间体;最后,中间体与表面羟基结合生成最终产物HF和CO2。
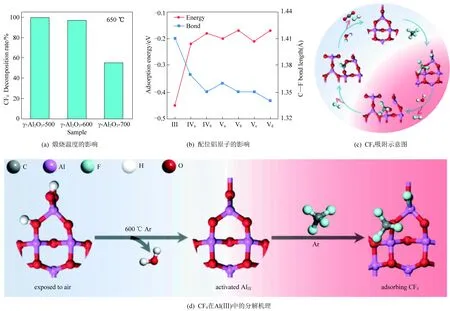
图5 不同煅烧温度的γ-Al2O3水解CF4的转化率和CF4在不同配位的铝原子上的吸附能和C—F键长,以及γ-Al2O3纳米片吸附CF4和CF4在γ-Al2O3活性中心分解途径示意图[36]Fig. 5 Conversion of CF4 over γ-Al2O3 catalyst generated at different calcination temperatures and adsorption energy and C—F bond length of CF4 on aluminum atoms with different coordination; The schematic diagram of CF4 adsorption on γ-Al2O3nanosheets and the decomposition pathway of CF4 at the active center (γ-Al2O3)[36]
CF4无水热催化分解过程中,无HF产生,但同样会在催化剂表面生成金属氟化物而造成失活。为解决这一问题,可加入第二组分优先结合氟,缓解催化剂的消耗。Araki等[37]利用发光沸石/氧化钙混合物(物理混合,质量百分比10/90)分解CF4,分解产物为CO2和CaF,并且在5 h内CF4分解率超过90%(923 K),其中光沸石作为催化剂,氧化钙充当高性能氟吸附剂,通过吸附过程进一步促进CF4分解反应的正向进行。
表1对比了典型催化剂分解CF4的性能,目前的最低分解温度仍高达650 ℃。有水热催化分解体系产生酸腐蚀性的HF,需对设备进行防腐处理;无水热催化分解CF4产物虽无腐蚀性气体产生,但同样造成催化剂表面氟化,即便可以通过加入碱金属氧化物予以缓解,但随着碱金属氧化物的消耗最终仍难以避免失活。
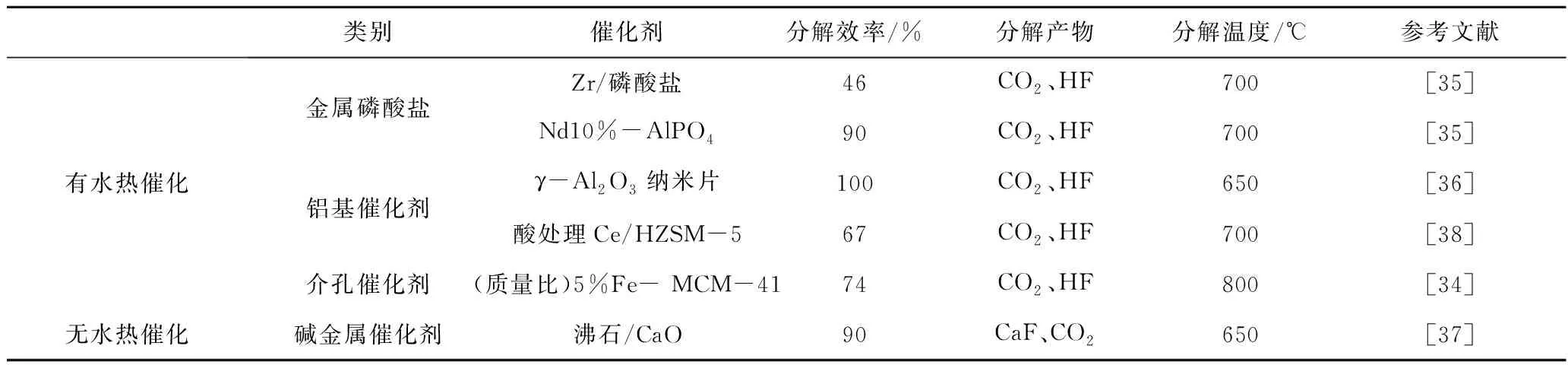
表1 不同催化剂催化分解CF4性能对比Table 1 Performance comparison of different catalysts for catalytic decomposition of CF4
2.2.3 等离子体高能分解
等离子体是超出固、液、气三相之外的一种物质形态,内部含有大量中性粒子、正负离子、高能电子[39]。可根据等离子体内部粒子温度将其分为高温等离子体和低温等离子体。高温等离子体系中电子温度(Te)与离子温度(Ti)相当,温度高达108~109K,其内部处于热平衡状态;低温等离子体中则Te高达上万K,而Ti一般只有几百K,系统中Te远远高于Ti,处于非热平衡状态[40]。等离子体通常采用微波、频射、介质阻挡等手段进行激发[41]。20世纪90年代,等离子体开始用于PFCs的分解。在CF4的分解过程中,首先发生的是皮秒级别的电子雪崩,产生高能电子,随后在纳秒级别发生碰撞,引发C—F键的分解,生成CFx,并产生自由基等活性离子,再发生微秒级别的链式反应,最后发生分子间热化学反应,生成最终产物,主要为CO2和F2[42]。
高温等离子体具有数千度的极高温度和丰富的自由基,可在不产生副产物的情况下分解CF4。Sooseok等[43]通过在空心电极等离子炬出口区域安装永磁体产生方位洛伦兹力来驱动弧根和热等离子体射流的旋转运动实现对CF4的高效分解,当CF4气流量分别为200、300、400 L/min,分解效率分别为96.9%、83.7%和45.4%。较小的气流量和旋转的射流可保证两者更高的混合程度,使分解更彻底。固定功率的高温等离子具有额定的气体处理量,对于大气量的CF4尾气,需要高功率和更大体积的高温等离子设备;而且,高温等离子体以火炬喷射燃料来提供高温环境,能耗较高。因此,开发低能耗、高效的低温等离子体技术成为研究热门。
低温等离子分解技术可在更低温度下对CF4的分解,根据其产生方式可分为射频放电等离子体(RFP)、微波放电等离子体(MWP)、介质阻挡放电等离子体(DBD)等。Kuroki[44]利用RFP对低气压(40 Pa)CF4进行分解,发现CF4分解效率与射频频率呈负相关关系,当输入频率由2 MHz提高至4 MHz时,CF4分解效率由96%下降至73%,分解产物中含有24%的COF2。频射放电等离子体在分解CF4的过程中高效且低耗,但通常在低压下进行分解,因此对设备和发生器的精密度要求更高,处理成本随之升高。Radoiu等[45-47]使用MWP分解四种PFCs气体(C2F6、CF4、SF6、CHF3),在相同的气体总流量和输入功率条件下(1 600 mL/min,1.9 kW),CF4的分解效率可达98%,其余三种气体均100%分解,同时,还在CHF3和C2F6的分解产物中发现了CF4,佐证了等离子体环境下发生的自由基链式反应;当气氛中引入水蒸气后,可避免逆反应的发生,分解产物中未检出CF4。微波放电等离子体可在10-5mbar~1 bar的压力范围内使用,输出功率大,但由于具有较低的平均电子能量,难以有效阻止分解过程中产生的CFx基团与F再次反应生成CF4。Park[48]在常压、23 kV的放电电压、2 000 mL/min的气体总流量条件下,对比研究了三种不同的介质阻挡放电器对CF4分解效率的影响。其中,介质微孔反应器产生的DBD分解率最高,达到了98%,而金属和针陈列式反应器分解率均低于25%,说明放电器的构型对CF4的分解影响十分显著,介质微孔反应器可保证等离子体与CF4更充分的接触。相比RFP、MWP两种等离子体需要在真空、低压条件下才能实现CF4的高效催化,DBD等离子实现了常压、非真空条件下CF4的分解,但只能在特定的介质阻挡放电器的类型下产生的平均能量更高的高能电子,且催化效率有待提高。
低温介质阻挡放电等离子体耦合催化剂分解目前是CF4分解的热门研究方向,一方面可利用等离子体打断C—F键,破坏CF4稳定结构,降低能耗,实现低温分解;另一方面,利用催化剂协同效应,进一步提高分解效率。Pan等[49]对比了CF4在热催化分解、DBD、DBD耦合γ-Al2O3催化剂三种体系中的分解效率,发现与单独通过DBD等离子进行分解相比,DBD等离子体耦合γ-Al2O3催化剂分解CF4效率由86%提升至100%。当应用等离子体催化系统时,γ-Al2O3孔内可能会产生流光放电,有效产生高能电子、离子、自由基等,从而实现更高的CF4转化率。催化剂在与等离子体耦合的形式一定程度上影响了分解效率。Chen[50]的团队将催化剂(CuO、ZnO、Al2O3、MgO混合颗粒)放置在DBD反应器中并构建填充床反应器(PBR),对CF4的分解率比单独使用DBD等离子体高出一倍(35%提升至60%)。由于PBR中填充颗粒和电极之间的距离较短,产生更强的电场,电子平均能量更高,因此PBR具有更高的CF4分解效率。对于强化学键的CF4,有时单个反应器破坏效率还不够高,需要将反应器串联。Lee[51]在不同填充介电材料的类型、施加电压、放电间隙和Ar添加剂条件下,使用串联填充床反应器分解CF4。研究发现,填充材料类型为影响CF4分解的重要因素,以介电常数最高的BaTiO3作为填充物时,CF4的分解率最高,约为25%,高介电常数会产生高电场并且还产生密集放电,对分解效率更加有利;反应器串联对CF4分解效率的影响更为显著,在最佳条件下单个填充床反应器对CF4的最大去除效率约为35%,而随着反应器串联数量的增加(5个),分解率可达90%,增加反应器串联数量相当于延长停留时间,可有效提高CF4的分解效率。
等离子体分解CF4的探索研究也在不断创新。为了克服等离子体能耗高的问题,等离子体耦合催化体系的开发成为新的发展趋势。未来,开发介电常数更高的催化剂、设计更高效的填充方式,将是CF4处理技术突破实用瓶颈的关键。
2.2.4 电催化分解
电化学催化分解是一类能常温、常压下在电极界面进行电子转移而实现污染物降解的技术[52],电催化分解CF4技术仍处于开发探索阶段。Muthuraman[53]通过电解Co2+(OH)2溶液生成Co1+均相中间活性体,联用洗涤塔捕集并降解气态CF4,实验装置如图6(a)所示。系统运行5 min即可达到99.25%的去除效率,并一直保持至60 min,其产物为乙醇和HF。该团队另开发了异质双金属络合物Cu2+[Ni2+(CN)4]催化剂,实现了类似的降解效果[54]。其原理如图6(b)所示,CF4在低价中间活性体(Co1+,Cu1+)的作用下加氢,并发生C—C耦合生成CF3—CH3中间体,与电解产生的羟基自由基反应得到产物CH3CH2OH。目前,电化学催化分解CF4的研究相对较少,但从其表现来看,可在短时间内达100%的CF4分解效率,且分解产物为清洁产品。目前报道的两种过渡金属络合物催化剂需在加高浓度的碱性电解质中稳定存在,含有酸性气体(如SO2,CO2)和CF4的烟气将对破坏电解体系稳定性。因此,开发新的催化剂体系是CF4电催化分解技术未来的重点。
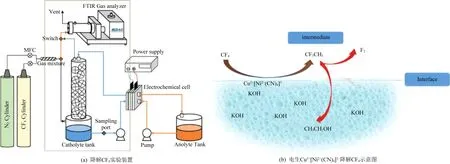
图6 电化学湿式洗涤器降解CF4实验装置图以及电生Cu1+[Ni2+(CN)4]1-降解CF4示意图[53-55]Fig. 6 Experimental setup diagram of electrochemical wet scrubber for CF4 degradation and the schematic diagram of electrochemically generated Cu1+[Ni2+(CN)4]1- used to degrade CF4[53-55]
3 总结与展望
无论是通过物理处理技术对CF4进行分离、循环、回收,还是通过化学处理技术将CF4分解为易处理、更清洁的产物都是实现CF4处理的有效途径。深冷分离法、吸附法、膜分离此类物理处理技术适用于含高浓度CF4的回收,以获更高的经济效益。热力燃烧、热催化分解、等离子体高能分解、电化学催化分解等化学处理技术则更适用于较低浓度的CF4处理。其中,DBD等离子体耦合催化技术和电化学催化分解技术,可在低温、常压条件下实现CF4的高效分解。尽管目前各项处理技术在实验条件下均取得了可观的性能,但未能经过实际烟气工况的验证。未来仍需要在以下方面取得突破:
(1)发展低温等离子体耦合催化剂分解技术。铝电解过程中产生的CF4烟气排放温度约为100~140 ℃,在冬季甚至可低至80 ℃[56]。若利用热力燃烧和热催化分解进行处理,则需要将烟气再次加热,增加了处理能耗。因此,低温、高效、低能耗的处理技术是铝电解行业CF4治理的迫切需求。通过DBD等离子体发生器产生的等离子体耦合催化剂分解技术,已阶段性突破低温降解的瓶颈,有望率先成为铝电解行业CF4末端治理的可行方案。
(2)开发长效稳定的催化剂。大部分CF4催化分解过程的产物为酸腐蚀性的HF,开发结构稳定和长寿命的催化剂是该技术能否实际应用的关键。可开发促进CF4分解反应的廉价碱金属氧化物助剂,原位消除分解产生的HF,减少HF对催化剂的破坏。
(3)开发大气量CF4烟气的处理技术,考虑实际烟气复杂组分的影响。可对实际烟气首先进行预处理,可通过除尘、碱液吸收等方式减少烟尘、二氧化硫、二氧化碳等与CF4的竞争反应,减少CF4处理系统的负荷。
