嘧菌酯在杨梅中的残留行为及膳食暴露风险评估
2023-05-04张春荣孔丽萍吴园园许振岚赵学平
张春荣,郭 钤,孔丽萍,吴园园,林 琴, 许振岚, 赵学平, 汤 涛
(浙江省农业科学院 农产品质量安全与营养研究所,农产品质量安全危害因子与风险防控国家重点实验室,农业农村部农药残留检测重点实验室,浙江 杭州 310021)
杨梅为我国南方特色水果,色泽鲜艳,果实香气怡人,酸甜多汁,在国内外享有盛誉。目前,我国杨梅种植面积约占世界总面积的99%,主产地包括浙江、江苏、福建、广东、江西、安徽、湖南、贵州、云南等省,其中浙江省是我国传统杨梅主产区[1-2]。近年来,随着杨梅栽培面积不断扩大,杨梅褐斑病等病虫害也呈日益加重趋势[3]。杨梅褐斑病是一种由真菌引起的病害,主要危害当年抽发的春、夏秋梢叶片,严重时引起大量落叶,花芽萎蔫,小枝枯死,树势衰弱,直至树体死亡,对杨梅产量和品质影响极大[4]。
嘧菌酯(azoxystrobin),化学名称为(E)2-{2-[6-(2-氰基苯氧基)嘧啶-4-基氧]苯基}-3-甲氧基丙烯酸甲酯,是通过仿生合成的甲氧基丙烯酸酯类杀菌农药,该杀菌剂高效、广谱,对几乎所有的真菌(子囊菌亚门、担子菌亚门、鞭毛菌亚门和半知菌亚门)病害如霜霉病、稻瘟病、锈病、白粉病等均有良好的活性。同时,该杀菌剂能够增强作物的抗病和抗逆性,延长作物收获期,增加作物的总产量,而且其在作物、土壤和水中均很快被降解,膳食风险和环境风险较低[5-6]。嘧菌酯对杨梅褐斑病也有较好的防治效果[4,7]。截至2022年2月14日,在杨梅上登记的 34条杀菌剂中有效成分为嘧菌酯的共21条[8],占比61.8%。
杨梅为没有果皮的鲜食水果,且一般情况下不经清洗直接食用,因而开展杨梅中农药残留行为和膳食风险评估研究十分必要。目前,关于嘧菌酯在水稻、小麦、大豆、茄子、甜菜、花生等作物上残留检测分析方法、残留行为及膳食风险评估方面已有一些研究报道[5-6,9-19]。王全胜等[16]建立了超高效液相色谱-串联质谱法测定杨梅中嘧菌酯残留的检测方法。赵慧宇等[17]以监测数据为基础,采用点评估方法对杨梅中嘧菌酯残留进行了膳食风险评估。然而,基于规范田间试验(GAP)条件下,嘧菌酯在杨梅中的残留消解动态、最终残留水平以及膳食风险评估国内外尚未见报道。
通常,样品需从不同时间段进行采集,样品采集后会在冰箱中冷冻存放一段时间再进行检测。因此,确定合理的储藏条件和储藏时间,确保样品储存期间待测物的含量不发生变化,是确保分析结果可靠性和科学性的重要措施[20-21]。本研究选择中国 6个杨梅主产区域开展了50%嘧菌酯水分散粒剂在杨梅上的田间规范残留试验,对嘧菌酯在杨梅中的残留储藏稳定性及残留特征进行了研究,并结合我国居民膳食结构数据[22]进行了嘧菌酯的膳食暴露风险评估,以期明确嘧菌酯在杨梅中的残留水平和降解规律,为嘧菌酯在杨梅上科学合理施用提供理论依据,同时也为嘧菌酯在杨梅上的登记提供数据支撑。
1 材料与方法
1.1 主要仪器与试剂
Waters UPLC/XEVO TQ-MS 液质联用仪(美国Waters公司);AB104-S电子天平(0.000 1 g,梅特勒-托利多称重设备有限公司);SPS 402F电子天平(0.01 g,梅特勒-托利多称重设备有限公司);W201B型数控恒温水浴锅及R-201旋转蒸发器(上海申胜生物技术有限公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市子华仪器责任公司);DHZ-DA全温型大容器恒温振荡器(太仓市实验设备厂)。
50%嘧菌酯水分散粒剂(浙江钱江生物化学股份有限公司);99.23%嘧菌酯标准品(德国Dr.Ehrenstorfer GmbH公司);色谱纯乙腈(美国Honywell公司);色谱纯甲酸(美国ACS恩科化学试剂公司);分析纯氯化钠及无水硫酸钠(兰溪市屹达化工试剂有限公司);分析纯丙酮及石油醚(上海凌峰化学试剂有限公司);碱性氧化铝(上海五四化学试剂有限公司);水为屈臣氏饮用水。
1.2 田间试验
根据田间规范残留试验相关要求[23-24]设计农药消解动态试验和最终残留试验。田间试验时间为2018年,供试药剂为50%嘧菌酯水分散粒剂,供试杨梅均为当地主栽品种,长势良好,均为露地种植。试验地信息见表1。

表1 试验地信息Table 1 The information of test sites
1.2.1 最终残留试验
田间试验设置一个处理小区和1个对照小区,在远离试验区选定不施药的杨梅树作为空白对照区,每小区不少于4株果树。施药剂量为300 mg·kg-1(制剂用药量:1 667倍液),根据各地杨梅成熟采收时间及推荐安全间隔期(20 d)往前推进确定的施药时间均匀喷雾施药2次,施药间隔期10 d,根据树冠大小确定用水量,以喷至树叶往下滴水为准。样品采集时间为末次施药后20、25、30 d,先对照后处理小区采样,每小区用随机的方法在杨梅树上、中、下及里外12个以上部位采集生长正常、无病害、成熟的杨梅果实,每小区每次采集杨梅样品2份,每份不少于1 kg。
1.2.2 残留消解试验
试验在浙江兰溪、贵州贵阳和湖南张家界3地的最终残留量小区内进行。末次施药后2 h、5、10、15、20、25、30 d采样。
1.3 样品制备
样品采集后8 h 内运回实验室,称量后立即用不锈钢刀具去掉杨梅核,再次称量果核质量并计算肉核比[1]。将杨梅果肉匀浆后分取150 g样品,装入封口样品容器,贴好标签。不高于-18 ℃冰柜中保存待测。
1.4 残留分析方法
1.4.1 样品前处理
提取:准确称取自然解冻后的杨梅果肉样品10 g(精确到0.01 g)于150 mL具塞锥形瓶中,加入40 mL乙腈,振荡30 min后抽滤,转出滤液至装有8 g氯化钠的具塞量筒中,剧烈振摇具塞量筒2 min后静置1 h分层。吸取10.0 mL上清液于平底烧瓶中,在40 ℃水浴中浓缩至近干,待净化。
净化:用15 mL石油醚预淋活化玻璃层析柱(5%水脱活碱性氧化铝约5 g,上下两端加约1 cm无水硫酸钠),用15 mL石油醚/丙酮(95∶5,V/V)分两次将平底烧瓶中的残留物转移上柱,弃去淋出液,然后用45 mL石油醚/丙酮(85∶15,V/V)洗脱柱子,收集洗脱液至100 mL平底烧瓶中,于40 ℃水浴中浓缩干后用色谱纯乙腈定容至5 mL,必要时用色谱纯乙腈将目标物稀释至0.001~0.05 mg·L-1范围后过0.22 μm有机滤膜,待测。
1.4.2 仪器分析
色谱条件:Waters acquity UPLC®BEH C18(1.7 μm,2.1×100 mm)色谱柱;柱温40 ℃;梯度洗脱程序见表2(A相为色谱纯乙腈,B相为 0.1%甲酸水溶液),进样量1 μL。

表2 梯度洗脱程序Table 2 Gradient elution procedure
质谱条件:毛细管电压3.0 kV,锥孔电压34 V;离子源温度150 ℃;脱溶剂温度400 ℃;脱溶剂气流量800 L·Hr-1;电喷雾正离子扫描(ESI+);定量定性离子对分别为404.1>372.0,404.1>329.0;保留时间1.87 min。
1.5 标准溶液配制及标准曲线绘制
准确称取99.23%的嘧菌酯标准品0.010 1 g于100 mL容量瓶中,用乙腈配成浓度为100 mg·L-1的标准储备液,然后分别用色谱纯乙腈及杨梅空白基质待测液逐级稀释成质量浓度为0.05、0.02、0.01、0.005、0.001 mg·L-1的标准工作溶液。采用1.4.2节中的色谱条件进行检测,每档浓度进样3次,获得色谱响应值,以浓度-峰面积绘制标准曲线并按以下公式(1)计算基质效应ME。ME绝对值在10%以内则基质效应较弱,ME绝对值大于10%则表明存在一定的基质效应[25]。
ME=(Kb-Ka)/Ka×100%。
(1)
式中:Kb—基质匹配曲线斜率,Ka—纯溶剂标准曲线斜率。
1.6 添加回收试验
在空白杨梅样品中添加0.01、0.5、30 mg·kg-1共3档浓度的嘧菌酯标准溶液,每个添加水平重复5次。按照1.4.1节方法进行前处理及1.4.2节的条件检测,计算添加回收率及相对标准偏差(RSD)。
1.7 储藏稳定性试验
称取空白杨梅果肉匀浆样品10.0 g于50 mL聚四氟乙烯离心管中,分别加入100 mg·L-1的嘧菌酯标样0.5 mL,摇匀,使杨梅中嘧菌酯的最终浓度均为5.0 mg·kg-1,作为储藏样品,储藏温度为≤-18℃。取样间隔为0、182、390、540、650 d,另设不加药的空白对照,用于检测质控样品(5.0 mg·kg-1)的制备。根据公式(2)计算样品储藏过程中嘧菌酯残留的降解率。
(2)
式中:D─降解率,%;C0─样品的初始浓度,mg·kg-1;Ct─样品的检测浓度,mg·kg-1。
1.8 膳食暴露风险评估
根据规范残留试验中值(STMR/STMR-P)或最大残留限量值(MRL),按式(3)和式(4)计算嘧菌酯国家估算每日摄入量(NEDI)及风险商(RQ)[26-28]。
VNEDI=Σ[VSTMRi×Fi];
(3)
VRQ=(VNEDI/VADI×m)×100%。
(4)
式中:VNEDI为国家估算每日摄入量(NEDI)的值;VSTMRi为嘧菌酯在相关农产品中的规范残留试验中值(STMRi)的值,mg·kg-1;Fi为一般人群对该农产品的消费量,kg;m为我国人均体重,按照63 kg计;VRQ为风险商的值;VADI为嘧菌酯每日允许摄入量(ADI)的值(单位mg·kg-1)。无STMR值情况下,在计算NEDI时采用相应的MRL值代入公式计算,当RQ≤1时,认为嘧菌酯残留对一般人群健康的影响为可接受的风险水平[27]。
2 结果与分析
2.1 检测方法和样品的有效性评价
在 0.001~0.05 mg·L-1范围内,嘧菌酯在有机溶剂(乙腈)和杨梅基质中质量浓度与其峰面积之间线性关系良好,回归方程分别为y=627 801x-31.255(R2=0.999 9)、y=688 575x+66.404(R2=0.999 1)。嘧菌酯在杨梅基质中的ME值为9.7%,基质效应较弱,表明使用碱性氧化铝对杨梅提取液有较好的净化效果,因而杨梅样品中的嘧菌酯含量采用溶剂标准曲线定量。
在0.01、0.5、30 mg·kg-1添加水平下,杨梅中嘧菌酯的平均回收率和RSD分别为90%~98%和1.8%~7.9%(表3)。嘧菌酯的检出限为1.0×10-12g,嘧菌酯在杨梅中的定量限(LOQ)为0.010 mg·kg-1。该方法的准确度与精密度符合农残精准检测的要求[23]。

表3 嘧菌酯在杨梅基质中的添加回收率及相对标准偏差Table 3 The recoveries and relative standard deviations of azoxystrobin in waxberry %
嘧菌酯在杨梅中的储藏稳定性试验结果见表4。由表4可以看出,空白杨梅样品中嘧菌酯的初始添加水平为5.0 mg·kg-1,在≤-18℃冷冻条件下,在0~650 d整个储藏过程中,嘧菌酯降解率为4.1%~14.3%,均小于30%,根据植物源性农产品中农药残留储藏稳定性判定标准[29],在≤-18℃冷冻条件下储藏650 d内,嘧菌酯在匀浆后的杨梅基质中较为稳定。本研究中田间采集样品匀浆后,在冷冻储藏285 d内完成检测,表明所有检测样品均为有效样品,分析结果可靠。
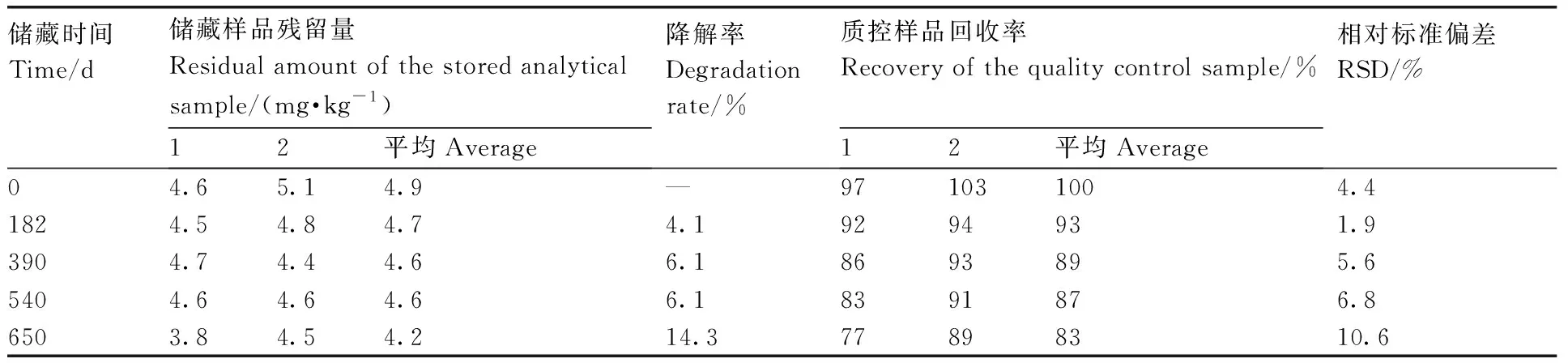
表4 嘧菌酯在杨梅添加样品中的储藏稳定性Table 4 Storage stability of azoxystrobin in waxberry
2.2 嘧菌酯在杨梅中的消解动态
50%嘧菌酯水分散粒剂在浙江、湖南和贵州1年3地杨梅中的消解试验结果(表5、图1)表明:嘧菌酯在杨梅中的原始沉积量为4.7~23.4mg·kg-1,3个试验点杨梅中嘧菌酯的消解规律均符合一级动力学方程,半衰期为2.2~5.0 d。3地杨梅中嘧菌酯的残留量均随着时间的延长而逐渐降低,0~10 d可能是农药本身的消解特性及杨梅果实增大的稀释效应,其消解较快,10 d时消解率为87.1%~99.3%,10 d后可能进入杨梅成熟期,消解变化量相对较小,20 d时消解率为96.7%~99.7%。
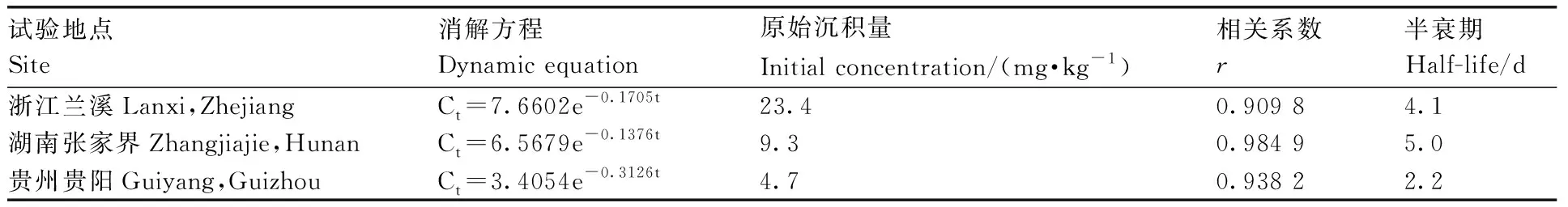
表5 嘧菌酯在杨梅中的消解动态Table 5 Dissipation dynamics of azoxystrobin in waxberry

图1 嘧菌酯在杨梅中的消解动态曲线Fig.1 Dissipation curve of azoxystrobin in waxberry
2.3 规范试验的最终残留量
我国制定嘧菌酯在草莓、浆果和其他小型水果(越橘、草莓除外)中的MRL值分别为10和5 mg·kg-1[30]。50%嘧菌酯水分散粒剂在浙江、贵州、湖南、云南、安徽、福建1年6地杨梅中的最终残留试验结果(表6)表明,最后1次施药后20、25、30 d,杨梅中嘧菌酯的残留量均≤0.57 mg·kg-1,均未超过我国规定的草莓、浆果和其他小型水果上的MRL值。

表6 嘧菌酯在杨梅中的残留量Table 6 The terminal residue of azoxystrobin in waxberry (n=2) mg·kg-1
2.4 膳食暴露风险评估
目前,嘧菌酯在我国43种可食作物上取得了登记[8],其ADI 值为0.2 mg·kg-1,我国已制定相应的包括哺乳动物肉类、禽肉类等可食动物源食品在内的最大残留限量标准(包括临时限量)80个[30]。依据风险最大化原则,以中国一般人群的膳食结构为基础[31],结合嘧菌酯在我国可食作物上登记使用情况[8]、中国[30]制定的最大残留限量(MRL)及本研究获得的嘧菌酯在杨梅上规范试验残留中值(0.28 mg·kg-1)计算NEDI和RQ,结果见表7。从表7可知,嘧菌酯的NEDI为 6.111 4 mg,RQ为48.5%,风险概率小于 1,处于可接受水平,表明按推荐剂量和推荐安全间隔期在杨梅上使用嘧菌酯,不会对一般人群的健康产生不可接受的风险。其中杨梅中嘧菌酯残留对膳食摄入风险的贡献率仅为0.10%,表明杨梅不是嘧菌酯的主要慢性风险来源。

表7 嘧菌酯风险评估计算表Table 7 Risk assessment for dietary residue intake of azoxystrobin
3 讨论
本研究建立了杨梅中嘧菌酯的UPLC-MS/MS残留分析方法。样品中嘧菌酯经乙腈提取,碱性氧化铝净化,基质效应<10%。嘧菌酯在仪器上的最小检出量为1.0×10-12g,定量限为0.010 mg·kg-1,添加平均回收率为90%~98%,RSD为1.8%~7.9%。该方法操作简单,重复性好,准确度、精密度及检出限均可满足农药残留分析要求。在空白杨梅基质中添加嘧菌酯标样,在650 d 冷冻(≤-18℃)储藏周期内,嘧菌酯降解率为4.1%~14.3%,均低于30%,表明嘧菌酯在杨梅基质中较稳定,该分析结果为嘧菌酯在杨梅上的残留登记试验提供了科学依据。
多种因素能够影响农药在作物上的残留行为,包括农药自身性质、植物体代谢、果实品种、果实生长过程中稀释因素以及当地气候等[32]。比较嘧菌酯在 3 地杨梅上的原始沉积量,发现嘧菌酯在3地杨梅上原始沉积量较高(4.7~23.4 mg·kg-1)且差异较大,浙江点杨梅上原始沉积量分别为湖南点和贵州点的2.5倍和5.0倍,分析可能与产地环境的气候条件、杨梅品种和果实的外部形态特征等有关[1,33]。根据梁亚杰等[32]和柳璇等[34]的研究,苹果和桃上农药原始沉积量与果实品种相关,单果体积大可能导致苹果和桃上较低的农药原始沉积量。杨梅则不同于苹果和桃,贵州点杨梅品种为荸荠,果型最小,成熟果实单果平均质量12 g,果实肉质致密、较硬,可能不利于药液渗透和果实对药液的吸收;浙江点杨梅品种为东魁,果型最大,成熟果实单果质量20~50 g,肉柱粗大,表面积较大,因而更易吸附药液,导致杨梅上嘧菌酯原始沉积量最高,王全胜等[33]和颜丽菊等[35]研究也认为,单果体积大的东魁杨梅更易吸附农药。此外,施药时的风速、杨梅树叶的茂密程度及树的高度等因素也会影响杨梅果实上农药的附着量。
嘧菌酯在杨梅中的消解半衰期为 2.2~5.0 d,与李瑞娟等[6]报道的嘧菌酯在小麦植株中的消解半衰期为3.3~4.3 d,高阳等[10]报道的嘧菌酯在水稻植株中消解半衰期为4.65~6.08 d,殷利单等[11]报道的嘧菌酯在大豆植株中消解半衰期为 0.8~3.6 d,王素琴等[14]报道的嘧菌酯在石榴中的消解半衰期为2.3~5.9 d相似,表明嘧菌酯属于消解较快的农药。
农药残留数据是进行农药残留膳食暴露评估的基础,其来源大致有两个方面,其一为农药登记残留试验,其二为残留监测数据[36]。本研究结果表明,最后1次施药后20~30 d,杨梅中嘧菌酯的检出率为86.1%,残留量为<0.010~0.57 mg·kg-1;最后1次施药后20 d,嘧菌酯在杨梅上残留中值和残留最大值分别为0.28 mg·kg-1和0.57 mg·kg-1。赵慧宇等[17]测定了来自市场流通和即将上市基地生产环节的 239个批次杨梅样品,嘧菌酯检出率为25%,残留量为<0.010~1.8 mg·kg-1,残留中值和残留最大值分别为0.01 mg·kg-1和1.8 mg·kg-1。嘧菌酯市场监测残留最大值为规范残留试验的3.2倍,分析原因,可能是杨梅生产中,种植户施药的随意不均匀性、大量多次用药或未过安全间隔期即采收上市,因而监管部门要加强杨梅上农药使用的监管,确保种植户使用登记农药并按标签规定使用。
我国、CAC、欧盟、美国、韩国、日本等均未制定杨梅中嘧菌酯MRL值,无法判定市场监测及本次试验后杨梅中嘧菌酯残留是否合格,相关部门也没有管理依据,无法控制对消费者潜在的健康风险,因此需要对杨梅中嘧菌酯残留进行膳食摄入评估。通常情况下,残留试验中值远低于相应的MRL值[36];因此,基于规范残留试验中值及我国制定的食品中MRL值估算的NEDI及RQ值较高(分别为6.111 4 mg和48.5%),且杨梅中嘧菌酯残留对膳食摄入风险的贡献率仅为0.10%,我们认为杨梅不是嘧菌酯的主要慢性风险膳食来源,嘧菌酯的长期膳食摄入慢性风险处于可接受水平。
4 结论
研究结果表明,50%嘧菌酯水分散粒剂在杨梅上按有效成分用药量300 mg·kg-1(1 667倍液)使用,施药2次,施药间隔 10 d,安全间隔期20 d,嘧菌酯在杨梅中的消解半衰期为 2.2~5.0 d,距最后1次施药后20、25和30 d,杨梅中嘧菌酯的残留中值分别为0.28、0.16和0.12 mg·kg-1。根据我国人群的膳食结构,嘧菌酯的NEDI为6.111 4 mg,RQ为48.5%,风险概率小于1,对一般人群健康风险较低。
