鰤诺卡氏菌灭活疫苗对大口黑鲈非特异性免疫指标的影响
2023-04-29杨星张美彦张效平赵振新商宝娣周勇
杨星 张美彦 张效平 赵振新 商宝娣 周勇
摘要:研究大口黑鲈(Micropterus salmoides)对鰤诺卡氏菌(Nocardia seriolae)灭活疫苗非特异性免疫应答的变化过程,为预防鰤诺卡氏菌病提供理论依据,可促进养殖业健康发展。大口黑鲈平均体长(10±2) cm、平均体重(30±2) g,鰤诺卡氏菌从患病大口黑鲈身上分离鉴定获得。600 尾大口黑鲈随机分为免疫组和对照组,每组300 尾,免疫组通过腹腔注射菌浓度为1.0×109 CFU/mL 的鰤诺卡氏菌灭活疫苗0.5 mL/尾,对照组注射同等剂量的磷酸盐缓冲液。免疫后的第1、7、14、21、28和35天采集血液样品,测定血细胞数量、吞噬细胞吞噬活性、溶菌酶活力、酸性磷酸酶活力以及超氧化物歧化酶活力等非特异性指标。免疫接种第35天后进行攻毒试验,计算相对免疫保护率。结果表明:免疫组血细胞数量显著增加,红细胞和白细胞数量均于第7天达峰值,分别为(4.49±0.23)×106 个/mm3和(3.88±0.24)×103 个/mm3;免疫组吞噬指数和吞噬百分比均在第7天达到最高值,分别为2.65和29.85%;血清中溶菌酶活力和酸性磷酸酶活力均于免疫后第7天达到峰值,分别为199.98 U/mL和29.88 U/mL,极显著高于对照组;超氧化物歧化酶活力于免疫后第14天达到峰值,为37.59 U/mL,极显著高于对照组;大口黑鲈的相对免疫保护率为61.54%。鰤诺卡氏菌灭活疫苗能显著诱导大口黑鲈产生非特异性免疫应答反应,主要通过增加血细胞数量,提高吞噬细胞活性和免疫相关酶活性等增强机体抵抗鰤诺卡氏菌的能力。
关键词:鰤诺卡氏菌;灭活疫苗;大口黑鲈;非特异性免疫
中图分类号:S966 文献标志码:A 文章编号:1674-3075(2023)03-0144-07
大口黑鲈(Micropterus salmoides) 原产美国,为肉食性鱼类,经驯化后可摄食人工配合饲料,具有生长快、适应性强和病害少等优点,目前已成为热门特种水产养殖品种之一,由于近几年大口黑鲈市场价格涨势较快,养殖效益显著,导致市场对大口黑鲈的需求越来越大(杨星等,2019)。随着大口黑鲈养殖规模的日益扩大及集约化程度的不断提高,大口黑鲈养殖水体环境日趋恶化,导致其病害频发,给大口黑鲈养殖业造成巨大的经济损失(刘梦梅和高贤涛,2022)。
诺卡氏菌(Nocardia) 是一类广泛分布在水体和土壤中的革兰氏阳性丝状杆菌,是人类和动物重要的条件致病菌(张建丽和刘志恒,2001)。近年来,诺卡氏菌病 给水产养殖业造成了严重的经济损失,尤其是在大口黑鲈的养殖过程中,当养殖环境恶化,鱼体免疫力低下时极易感染该致病菌(杜佳垠,2007)。鱼类诺卡氏菌病的致病菌主要有鰤诺卡氏菌(Nocardia seriolae)(何晟毓等,2020)和星状诺卡氏菌(N. asteroids)(林伟等,2012)。大口黑鲈诺卡氏菌病表现症状主要为体表溃烂出血,内脏和肌肉出现大量乳白色结节,肝和肾脏等器官充血并肿大等;该病发病持续时间较长,死亡率高,传染性强,严重威胁鲈鱼养殖业的健康可持续发展(何晟毓等,2020)。针对该病的主要预防措施有减少冰鲜鱼的投喂,防止污染水体,定期调节水质,维持稳定良好的水体环境,合理搭配养殖品种,定期使用保肝护胆药物一起拌料投喂,提高鱼体免疫力(朱志东等,2018)。
免疫防控被认为是预防鱼类疾病发生与流行较有效的途径(Sommerset et al,2005;Plant & LaPatra,2011)。本研究以鰤诺卡氏菌全菌灭活疫苗免疫健康大口黑鲈,对其血细胞数量、吞噬细胞吞噬活性、溶菌酶活力、酸性磷酸酶活力以及超氧化物歧化酶活力等非特异性免疫指标进行测定,分析大口黑鲈对鰤诺卡氏菌灭活疫苗非特异性免疫应答的变化过程,为大口黑鲈诺卡氏菌病的预防提供理论依据,促进大口黑鲈养殖业的健康发展。
1 材料与方法
1.1 试验材料
供试大口黑鲈取自贵州省水产研究所试验基地,个体健康,平均体长(10±2) cm,平均体重(30±2) g,暂养在直径60 cm、高80 cm的塑料养殖桶中,水温控制在(25±2)℃,每天投喂人工配合饲料,室内暂养1周后进行免疫试验。
1.2 试验菌株及其培养
鰤诺卡氏菌由贵州省农业科学院水产研究所微生物鉴定实验室从养殖场患病大口黑鲈身上分离鉴定获得。将菌株接种于脑心浸液培养基(Brian Heart Infusion,BHI)中,28 ℃恒温摇床振荡培养3~5 d后,离心收集菌体,稀释至一定浓度,置4 ℃冷藏备用。
1.3 疫苗制备和检验
在已培养好的鰤诺卡氏菌菌液中加入福尔马林溶液至终浓度为0.3%,恒温37 ℃灭活24 h,即得鰤诺卡氏菌全细胞灭活疫苗。无菌检验采用常规平板培养法,后离心沉淀菌体,采用麦氏比浊法经磷酸盐缓冲液(Phosphate Buffered Saline,PBS)稀释至终浓度为1.0×109 CFU/mL,置4 ℃冷藏备用(杨星等,2014)。
1.4 疫苗的安全性检验
鰤诺卡氏菌灭活疫苗通过腹腔注射接种30 尾健康大口黑鲈,每尾0.3 mL,对照组取30 尾健康大口黑鲈注射等量的PBS,观察7 d内2组鱼的健康状况及存活情况。
1.5 免疫与采血
600 尾试验鱼随机分为免疫组和对照组,每组300 尾,免疫组通过腹腔注射菌浓度为1.0×109 CFU/mL 的鰤诺卡氏菌灭活疫苗0.5 mL/尾,对照组注射同等剂量的PBS。分别于免疫接种后第1、7、14、21、28和35天,从各组中随机取试验鱼30 尾,尾静脉取血0.5 mL/尾,每尾血液单独分装。其中一半血液加肝素抗凝,用于血细胞计数和吞噬活性测定;另一半血液不加抗凝剂,室温静置2 h,于4 ℃静置5 h,4500 r/min 离心10 min,取上清,用于酸性磷酸酶活力和血清溶菌酶活力等免疫指标的检测。每份血样重复试验3次。
1.6 免疫指标检测
1.6.1 血细胞数量 取事先配制的Dacie 氏稀释液将抗凝血稀释 200 倍,通过血球计数板计算血细胞数量,重复计数3次(杨星等,2014)。
1.6.2 吞噬细胞吞噬活性 取0.4 mL抗凝血加入0.1 mL灭活的金黄色葡萄球菌,充分混匀后置于28 ℃恒温水浴锅中孵育60 min,1000 r/min离心5 min;弃上清后,取白细胞层制作3张涂片,利用瑞氏-吉姆萨(Wright-Giemsa)复合染色液染色,后油镜下观察并记录结果。以吞噬百分比(Phagocytic Percentage,PP)和吞噬指数(Phagocytic Index,PI)表示白细胞吞噬活性(杨星等,2014)。
1.6.3 血清溶菌酶活力 溶菌酶活力测定参考周勇等(2018)的方法。取 0.02 mL 血清,使用购于南京建城生物工程研究所研制的溶菌酶检测试剂盒进行测定,计算公式如下:
溶菌酶活力(μg/mL)=[(测定管 OD2 -测定管ODl)/(标准管 OD2-标准管ODl)]×标准管浓度(200 U/mL)× 样本测试前稀释倍数。
1.6.4 血清酸性磷酸酶活力 酸性磷酸酶(ACP)活力测定参考周勇等(2018)的方法。取 0.05 mL 血清,使用购于南京建城生物工程研究所研制的酸性磷酸酶检测试剂盒进行测定,计算公式如下:
酸性磷酸酶(U/100 mL)=(测定管OD值/标准管OD值)×标准管酚的含量(0.005 mg)×(100 mL/0.05 mL)
1.6.5 血清超氧化物歧化酶活力 超氧化物歧化酶(SOD)活力测定参考周伟东等(2017)的方法。使用购于南京建城生物工程研究所研制的超氧化物歧化酶检测试剂盒进行测定。
1.7 攻毒试验
免疫接种第35天后用鰤诺卡氏菌对试验鱼进行攻毒,从免疫组中随机取30 尾试验鱼,对照组随机选取30 尾,通过腹腔注射浓度为1×109 个/mL的鰤诺卡氏菌菌悬液0.3 mL,连续观察14 d,记录发病和死亡情况,并按下列公式计算相对免疫保护率。
相对免疫保护率=(1-免疫组死亡率/对照组死亡率)×100%
1.8 数据分析
数据通过SPSS17.0软件进行统计分析,采用t检验进行差异显著性检验。
2 结果与分析
2.1 无菌检验与安全性
BHI 固体培养基上均无菌落生长,表明鰤诺卡氏菌已全部灭活,无活菌存在。所有接种鱼均未出现死亡,其摄食、运动等无异常,表明所制备的疫苗安全性好,其对大口黑鲈是安全可靠的。
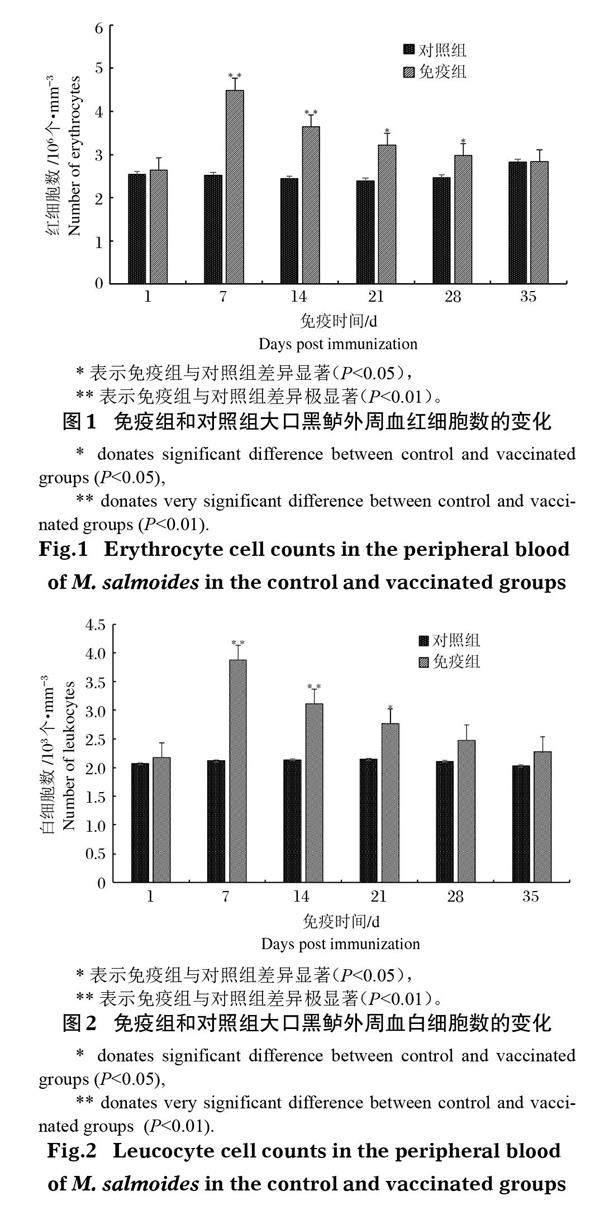
2.2 血细胞计数
大口黑鲈免疫接种鰤诺卡氏菌灭活疫苗后,其外周血红细胞和白细胞数量与对照组相比均显著提高,且二者变化趋势大致相同。其中红细胞数量于免疫后第7天达峰值(图 1),为(4.49±0.23)×106 个/mm3,极显著高于对照组(P<0.01),随后逐渐下降,但免疫后第14天仍极显著高于对照组(P<0.01),第21天和第28天显著高于对照组(P<0.05)。白细胞数量于免疫后第7天达最大值,为(3.88±0.24)×103 个/mm3 (图 2),极显著高于对照组(P<0.01),在接种后第14天与对照组存在极显著差异(P<0.01),且接种后第21天与对照组存在显著差异(P<0.05),其他时间与对照组差异不显著(P>0.05)。
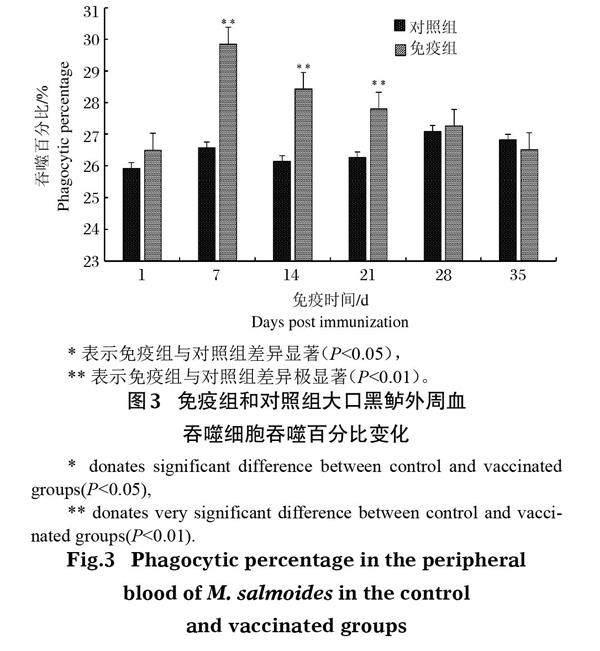
2.3 吞噬活性
大口黑鲈免疫接种鰤诺卡氏菌灭活疫苗后,其外周血吞噬细胞的吞噬百分率(PP)和吞噬指数(PI)与对照组相比均显著提高,且二者变化趋势大致相同。其中PP于免疫后第7天达峰值(图 3),为29.85%,极显著高于对照组(P<0.01),随后逐渐下降,但免疫后第14天和第21天仍极显著高于对照组(P<0.01)。PI于免疫后第7天达最大值,为2.65(图 4),极显著高于对照组(P<0.01),且免疫后第14天仍极显著高于对照组(P<0.01),免疫后第21天显著高于对照组(P<0.05),其他时间差异不显著(P>0.05)。
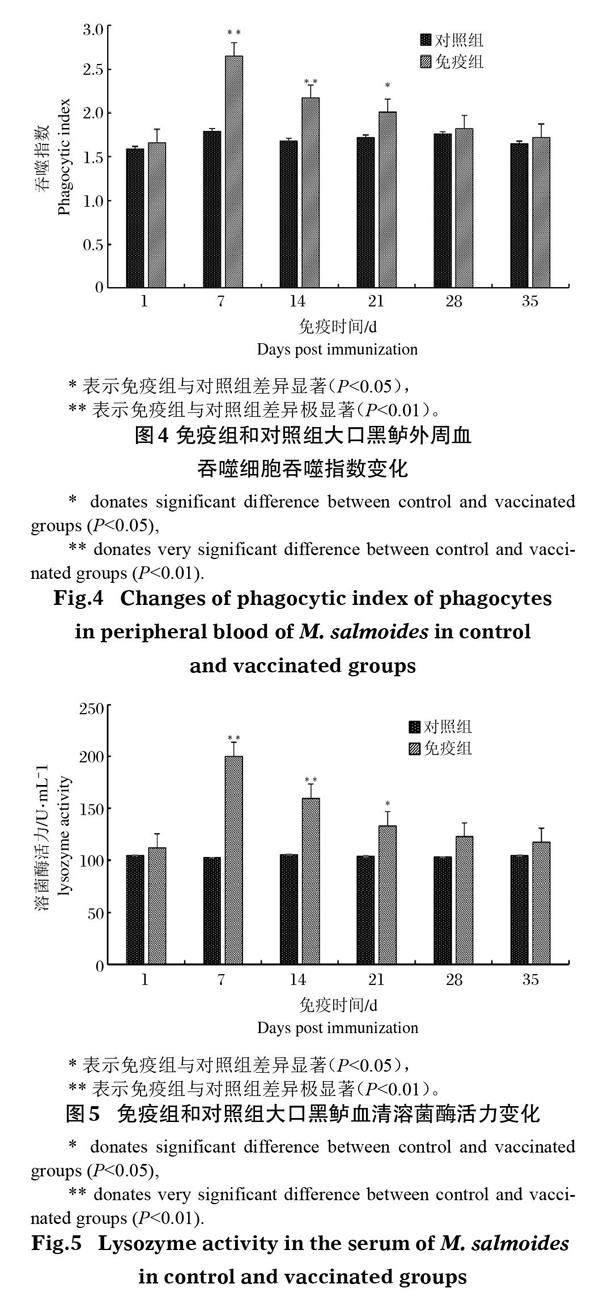
2.4 溶菌酶活力变化
大口黑鲈免疫接种鰤诺卡氏菌灭活疫苗后,其溶菌酶活力逐渐增强(图5),于免疫后第7天达到峰值199.98 U/mL,其中第7天和第14天免疫组溶菌酶活力极显著高于对照组(P<0.01),第21天显著高于对照组(P<0.05),随后逐渐下降,但整体水平一直高于对照组。
2.5 酸性磷酸酶活力变化
大口黑鲈在注射鰤诺卡氏菌灭活疫苗免疫后,其ACP活力逐渐增强(图6),于免疫后第7天达到峰值29.88 U/mL,随后逐渐下降,其中第7天和第14天免疫组ACP活力极显著高于对照组(P<0.01),第21天显著高于对照组(P<0.05),而对照组ACP活力一直保持在19.97 U/mL左右。
2.6 超氧化物歧化酶(SOD)活力变化
大口黑鲈在注射鰤诺卡氏菌灭活疫苗免疫后,其SOD活力逐渐增强(图7),于免疫后第14天达到峰值37.59 U/mL,随后逐渐下降,其中第7天和第14天免疫组SOD活力极显著高于对照组(P<0.01),而对照组SOD活力一直保持在19.99 U/mL左右。
2.7 相对免疫保护率
用鰤诺卡氏菌攻毒感染免疫组和对照组大口黑鲈后第14天,免疫组死亡率为33.33%,而对照组死亡率为86.67%,鰤诺卡氏菌灭活疫苗对免疫组大口黑鲈相对免疫保护率为61.54%,见表1。
3 讨论
目前关于诺卡氏菌的相关研究主要集中在病原菌的鉴定分析和抗药研究等方面(Kono et al, 2002; Itano & Kawakami, 2002; Itano et al, 2006; Ismail et al, 2011),而关于诺卡氏菌灭活疫苗免疫水产动物的相关研究鲜有报道。Shimahara 等(2010) 研究表明,用混有弗氏不完全佐剂的诺卡氏菌免疫大口黑鲈,其溶菌酶活性并未明显升高,且在多次免疫后攻毒感染死亡率并未降低。Nayak等(2014)研究表明诺卡氏菌灭活疫苗免疫鲫(Carassius auratus auratus)后可产生较好的免疫保护效果。鱼类免疫接种疫苗后,可刺激鱼体产生细胞免疫和体液免疫,同时也可增强相关免疫酶的活性,从而防御致病微生物的感染(Zhou et al,2015)。在本试验中,大口黑鲈在免疫鰤诺卡氏菌灭活疫苗后,其外周血中红、白细胞数量显著增加,均于免疫后第7天达峰值,这与青鱼(Mylopharyngodon piceus)免疫接种嗜水气单胞灭活疫苗后,其外周血红、白细胞数量变化趋势相似 (张波等,2012)。白细胞吞噬作用在水产动物非特异性免疫中发挥重要作用,可通过测定白细胞的吞噬活性来反映机体的免疫水平(Yakhnenko & Klimenlov,2009)。在本实验中,大口黑鲈免疫接种鰤诺卡氏菌灭活疫苗后,其外周血吞噬细胞的吞噬百分率(PP)和吞噬指数(PI)与对照组相比均显著提高,PP和PI于免疫后第7天均达峰值,且二者变化趋势大致相同,随后逐渐下降。该结果表明,大口黑鲈的早期免疫主要是通过白细胞的吞噬作用来抵抗病原微生物的入侵。这与气单胞菌免疫虹鳟(Oncorhynchus mykiss)(K?llner & Kotterba,2002)的研究结果相似。
溶菌酶是一种水解酶,主要存在于水产动物的血清、黏液和吞噬细胞中,其通过水解细菌细胞壁来杀灭,是机体非特异性免疫中较重要的防御因子,可通过测定其活性来反映吞噬细胞杀灭致病微生物的程度(Chen et al,1996)。李圆圆等(2008)研究得出,西伯利亚鲟(Acipenser baerii)在免疫接种嗜水气单胞菌灭活疫苗后,可显著增强其血清溶菌酶活力。嗜水气单胞菌灭活疫苗免疫银鲫(Carassius gibelio)后,血清溶菌酶活力增强(毛会丽等,2014)。在本实验中,大口黑鲈免疫鰤诺卡氏菌灭活疫苗后第7天,其溶菌酶活力达到峰值,表明鰤诺卡氏菌灭活疫苗可明显增强大口黑鲈溶菌酶活力。本研究还发现大口黑鲈在注射鰤诺卡氏菌灭活疫苗后,其血清中酸性磷酸酶活力逐渐增强,于免疫后第7天达最大值,随后逐渐下降。毛会丽等(2014)研究结果表明,嗜水气单胞菌灭活疫苗免疫银鲫后第 14天,其血清中酸性磷酸酶活力显著高于对照组。施氏鲟(Acipenser schrencki)免疫嗜水气单胞菌灭活疫苗后第14天,其血清中酸性磷酸酶活力达到峰值,表明酸性磷酸酶在水产动物非特异性免疫中发挥一定作用(Cheng,1978;周勇等,2018)。超氧化物歧化酶(SOD)在水产动物非特异性免疫中发挥重要作用,其可以通过去除机体内的超氧阴离子自由基来保护细胞,对机体的免疫功能有一定促进作用(李赫等,2010)。 本研究显示,大口黑鲈在注射鰤诺卡氏菌灭活疫苗后,其SOD活力逐渐增强,于免疫后第14天达到峰值,随后逐渐下降。免疫后第35天对大口黑鲈进行攻毒感染试验结果得出,鰤诺卡氏菌灭活疫苗对免疫组大口黑鲈相对免疫保护率为61.54%,高于鳗弧菌疫苗对大口黑鲈的相对免疫保护率(余俊红等,2001;肖慧等,2003),也进一步验证了鰤诺卡氏菌灭活疫苗能够对大口黑鲈产生有效的免疫保护。
综上,将鰤诺卡氏菌灭活疫苗接种大口黑鲈后,能够显著诱导大口黑鲈产生非特异性免疫应答反应,主要通过增加血细胞数量,提高吞噬细胞活性和免疫相关酶活性等方式增强机体抵抗病原微生物的能力。本研究结果也为深入研究大口黑鲈病害的免疫防控提供了理论支撑。
参考文献
杜佳垠, 2007. 鱼类诺卡氏菌病危害状况与研究进展[J]. 北京水产, (5):27-31.
何晟毓, 魏文燕, 刘韬, 等, 2020. 大口黑鲈致死性结节病病原的分离、鉴定及组织病理学观察[J]. 水产学报, 44(2): 253-265.
李赫, 宋文华, 于翔, 等, 2010. 几种免疫增强剂对草鱼 SOD、CAT及 AKP活性的影响[J]. 水产学杂志, 23(4):7-8.
李圆圆, 曹海鹏, 何珊, 等, 2008. 鲟源致病性嗜水气单胞菌 X1 的分离鉴定与药敏特性研究[J]. 微生物学通报, 35(8):1186-1191.
林伟, 彭新亮, 杨治国, 2012. 招财鱼红斑病病原-诺卡氏菌的分离与鉴定 [J]. 信阳农业高等专科学校学报, 22(2):99-101.
刘梦梅,高贤涛,2022. 加州鲈常见病害及防治建议[J]. 当代水产,(12):58-59.
毛会丽, 关建义, 贺文旭, 等,2014. 嗜水气单胞菌灭活疫苗对银鲫的免疫效果研究[J]. 中国免疫学杂志, 30(11):1499-1503, 1507.
肖慧, 李军, 王祥红, 等,2003. 鲈鱼鳗弧菌病疫苗的制备及免疫防治效果[J]. 青岛海洋大学学报, 33(2):226-232.
杨星, 刘文枝, 肖汉兵, 等,2014. 嗜水气单胞菌灭活疫苗免疫后大鲵外周血免疫指标的变化[J]. 中国水产科学, 21(3):621-628.
杨星, 张美彦, 赵飞, 等,2019. 贵州山区加州鲈池塘养殖试验[J]. 科学养鱼,(8):39-40.
余俊红, 沈继红, 王祥红, 等, 2001. 鳗弧菌口服微胶囊疫苗的制备及其对鲈鱼的免疫效果[J]. 中国水产科学, 8(2):76-79.
张波, 曾令兵, 罗晓松, 等, 2012. 嗜水气单胞菌3种疫苗免疫的青鱼外周血免疫指标的变化[J]. 华中农业大学学报, 31(1):100-105.
张建丽, 刘志恒,2001. 诺卡氏菌型放线菌的分类[J]. 微生物学报,41(4):513-517.
周伟东, 周勇, 刘奕, 等, 2017. DNA 疫苗浸泡免疫预防鳜鱼传染性脾肾坏死病毒[J]. 湖北农业科学, 56(14):2371-2375.
周勇, 史玉恒, 赵建青, 等, 2018. 嗜水气单胞菌灭活疫苗免疫施氏鲟后的免疫应答反应与保护效果[J]. 中国水产科学, 25(1):195-203.
朱志东, 吕莉, 邓剑壕, 等, 2018. 鱼类诺卡氏菌病的研究进展[J]. 水产养殖, 39(1):48-52.
Chen S C, Yoshida T, Adams A, et al, 1996. Immune response of rainbow trout to extracellular products of Mycobacterium spp.[J]. Journal of Aquatic Animal Health, 8(3):216-222.
Cheng T C, 1978. The role of lysosomal hydrolases in molluscan cellular response to immunologic challenge[J]. Comp Pathobiol,(4):59-71.
Ismail T F, Takeshita A, Umeda N, et al, 2011. Application of α-glucosidase activity and drug susceptibility tests to epidemiological studies on the fish pathogen Nocardia seriolae[J]. Fisheries Science, 77(1):113-118.
Itano T, Kawakami H, Kono T, et al, 2006. Detection of fish no-cardiosis by loop-mediated isothermal amplification [J]. Journalof applied microbiology, 100(6):1381-1387.
Itano T, Kawakami H, 2002. Drug susceptibility of recent isolates of Nocardia seriolae from cultured fish[J]. Fish Pathology, 37(3):152-154.
K?llner B, Kotterba G, 2002. Temperature dependent activation of leucocyte populations of rainbow trout, Oncorhynchus mykiss, after intraperitoneal immunisation with Aeromonas salmonicida[J]. Fish and Shellfish Immunology, 12(1):35-48.
Kono T, Ooyama T, Chen S C, et al, 2002. Sequencing of 16S-23S rRNA internal transcribed spacer and its application in the identification of Nocardia seriolae by polymerase chain reaction[J]. Aquaculture research, 33(14):1195-1197.
Nayak S K, Shibasaki Y, Nakanishi T, 2014. Immune responses to live and inactivated Nocardia seriolae and protective effect of recombinant interferon gamma (rIFN γ) against nocardiosis in ginbuna crucian carp, Carassius auratus langsdorfii[J]. Fish & Shellfish Immunology, 39(2):354-364.
Plant K P, LaPatra S E, 2011. Advances in fish vaccine delivery[J]. Developmental & Comparative Immunology, 35(12):1256-1262.
Shimahara Y, Huang Y, Tsai M, et al, 2010. Immune response of largemouth bass, Micropterus salmoides, to whole cells of different Nocardia seriolae strains[J]. Fisheries Science, 76(3):489-494.
Sommerset I, Kross?y B, Biering E, et al, 2005. Vaccines for fish aquaculture[J]. Expert Review of Vaccines, 4(1):89-101.
Yakhnenko V M, Klimenlov I V, 2009. Specific features of blood cell composition and structure in fishes from the pelagial and coastal zones of Lake Baikal[J]. Biology Bulletin, 36(1):37-44.
Zhou Y, Jiang N, Ma I, et al, 2015. Protective immunity in gibel carp, Carassius gibelio, of the truncated proteins of cyprinid herpesvirus 2 expressed in Pichia pastoris[J]. Fish and Shellfish Immunology, 47(2):1024-1031.
(责任编辑 张俊友 熊美华)
Effect of Formalin-inactivated Nocardia seriolae Vaccine on Non-specific
Immune indices of Micropterus salmoides
YANG Xing1, ZHANG Mei‐yan1, ZHANG Xiao‐ping1, ZHAO Zhen‐xin1, SHANG Bao‐di1, ZHOU Yong2
(1. Fisheries Research Institute of Guizhou Academy of Aquaculture Sciences,
Guiyang 550025, P.R. China;
2.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences,
Wuhan 430223, P.R. China)
Abstract:In this study, a whole cell vaccine of Nocardia seriolae, inactivated by formalin, was used to immunize healthy Micropterus salmoides by peritoneal injection. Development of the non-specific immune response of M. salmoides was then analyzed. We aimed to provide theoretical evidence for the prevention and control of pathogenic N. seriolae and promote the sustainable and healthy development of M. salmoides aquaculture. Six hundred healthy M. salmoides of body length (10±2)cm and body weight (30±2)g were acclimated for a week before testing and randomly divided into an immunized treatment group and a non-immunized control group. A N. seriolae strain was isolated from diseased M. salmoides for vaccine preparation. Each test fish in the vaccine group was dosed by abdominal injection with 0.5 mL of the vaccine at a strain concentration of 1.0×109 CFU/mL and fish in the control group were injected with 0.5 mL of phosphate buffered saline (PBS). Blood samples were drawn from test fish on day 1, 7, 14, 21, 28 and 35 post immunization and non-specific immune indices were measured, including blood cell count, phagocytic activity, lysozyme activity, acid phosphatase activity, and superoxide dismutase activity. The challenge infection test was initiated 35 days post immunization and the relative immunity protection rates were calculated. The number of blood cells increased significantly in the immunized group, and the number of erythrocytes and leucocytes both reached maximum values (4.49±0.23)×106 cells/mm3 and (3.88±0.24)×103 cells/mm3 on day 7 post immunization. The phagocytic index and phagocytic percentage also reached maximum values (2.65 and 29.85%) on day 7. The lysozyme and acid phosphatase activities reached maximum values (199.98 U/mL and 29.88 U/mL) on day 7, and the superoxide dismutase activity peaked (37.59 U/m) on day 14. All parameter values were significantly higher in the treatment group than in the control group (P<0.01). The challenge infection test gave a relative immunity protection rate of 61.54%. In summary, the inactivated N. seriolae vaccine induces a significant immune response in M. salmoides and enhances the immune response of fish by increasing blood cell counts and the activity of phagocytic cells and enzymes related to immunity.
Key words:Nocardia seriolae; inactivated vaccine; Micropterus salmoides; non-specific immune
收稿日期:2021-09-30 修回日期:2023-02-05
基金项目:贵州省农科院青年科技基金项目(黔农科院青年基金[2019]27号);国家特色淡水鱼产业技术体系项目(CARS-46);国家大宗淡水鱼产业技术体系项目(CARS-46-49);贵州省特色水产产业技术体系项目(GZCYTX2013-01102)。
作者简介:杨星,1987年生,男,助理研究员,主要从事水产动物病害防控研究。E-mail:xingy87@163.com
