不同洪水阶段对升金湖后生浮游动物群落结构特征的影响
2023-04-29陈晶雯郑旭东郭文莉周忠泽
陈晶雯 郑旭东 郭文莉 周忠泽

摘要:为了解不同洪水阶段对升金湖后生浮游动物群落结构特征的影响,2020年7月初(洪水前)、7月下旬(洪水形成期)、8月中旬(洪水中期)和9月下旬(洪水后)在升金湖湖区水域24个采样点进行后生浮游动物采样调查。研究期间共采集到后生浮游动物20科50属86种,其中轮虫11科29属55种,枝角类5科13属23种,桡足类4科8属8种。方差分析显示后生浮游动物密度在不同洪水阶段差异极显著(F=8.301,P<0.01)。4个阶段轮虫共同优势种为暗小异尾轮虫(Trichocerca pusilla)、广生多肢轮虫(Polyarthra vulgaris)、圆筒异尾轮虫(Trichocera cylindrica)、螺形龟甲轮虫(Keratella cochlearis)、裂痕龟纹轮虫(Anuraeopsis fissa),枝角类共同优势种为简弧象鼻溞(Bosmina coregoni)、颈沟基合溞(Bosminopsis deitersi)、脆弱象鼻溞(Bosmina fatalis),桡足类4个阶段没有共同优势种。后生浮游动物密度和生物量平均值分别为(2170.20±506.74)个/L和(7.79±2.04)mg/L。平均密度和平均生物量峰值均出现在洪水前,最低值分别出现在洪水中期和洪水形成期。Shannon-Wiener多样性指数、Margalef丰富度指数和Pielou均匀度指数的变化范围分别为2.37~4.50、2.19~6.50和0.83~1.21。Pearson相关性分析结果表明后生浮游动物密度与电导率、水深呈显著负相关,生物量与溶解氧、电导率、水深、浊度呈显著负相关,与总氮含量、硝氮含量呈显著正相关。研究揭示了不同洪水阶段对通江湖泊后生浮游动物的影响:洪水改变了湖泊后生浮游动物的物种组成及优势种,且显著影响后生浮游动物的密度及多样性。
关键词:后生浮游动物;群落结构;环境因素;洪水;升金湖
中图分类号:Q14 文献标志码:A 文章编号:1674-3075(2023)04-0061-09
安徽升金湖国家级自然保护区为永久性淡水湖泊湿地(Cheng et al,2020),位于安徽东至县境内,是水禽赖以生存的天然场所。升金湖保护区是中国重要的冬候鸟越冬地之一,也是世界上种群数量最多的白头鹤天然越冬地(贾艳艳等,2020),同时也是国际重要湿地,为洄游和半洄游鱼类提供了“三场一通道”,具有重要的保护意义。
浮游动物是水生生态系统的重要消费者,在水生生态系统的物质循环和能量流动过程中发挥着承上启下的作用(陈传曦等,2021)。浮游动物群落结构与水环境因子关系密切,其群落组成能反映水生态环境状况,因此常被作为指示生物(郑小燕等,2009)。同时,浮游动物群落结构也易受水温、营养盐、溶解氧和pH等环境因子的影响,环境因子的变化也会引起浮游动物群落结构的变化(Pérez et al,2010)。因此,浮游动物的种类组成、群落结构及物种多样性特征的变化对于了解湖泊生态系统的功能、状态变化等具有重要意义(胡艺等,2020)。洪水脉冲作为一种宏观生态因素,在栖息地之间提供动物、颗粒物和营养物质的交换,从而影响整个生态系统。洪水导致的水位变化可能会影响浮游动物的密度和种类组成(Donagh et al,2009),由于稀释效应,浮游动物的密度和生物量会减少(Geraldes & Boavida,2007)。2020年受强降雨的影响,长江流域内多站超警戒水位,主要分布在长江中下游干流、鄂东北水系、洞庭湖、鄱阳湖湖区及水系、雅砻江上游、大渡河上游、下游支流水阳江、巢湖等。受持续强降雨及长江上游来水的影响,升金湖水位超保证、超标准、超历史。
本研究在升金湖湖区选取24个典型采样点,在2020年不同洪水阶段对后生浮游动物进行系统调查,旨在了解不同洪水阶段对升金湖后生浮游动物的群落结构特征的影响;通过统计分析揭示影响升金湖水域后生浮游动物群落结构的主要环境因素;基于后生浮游动物多样性指数对升金湖水质进行评价。本研究的开展将为通江湖泊的管理及稳态机制的研究提供基础数据和理论参考。
1 材料与方法
1.1 区域概况
升金湖自然保护区位于安徽南部池州市东至县境内,濒临长江,地处30°15′~30°30′ N,116°55′~117°15′ E,坐落于东至县与贵池区交界处,全境以升金湖为中心,沿岸分别向外延伸2.5 km左右,总面积33 340 hm2,其中升金湖13 300 hm2。
1.2 采样点布设与样品采集处理
在升金湖布设24个具有代表性的点位(图1),于2020年7月初(洪水前)、7月下旬(洪水形成期)、8月中旬(洪水中期)和9月下旬(洪水后)4个不同洪水阶段进行湖泊水质和后生浮游动物的监测(图2)。
后生浮游动物样本采集、处理、种类鉴别和生物量测算参照文献(陈受忠,1955;王家楫,1961;Koste,1978;蒋燮治和堵南山等,1979;中国科学院动物研究所甲壳动物研究组,1979;沈韫芬等,1990)中的方法进行。水质监测指标包括水温(WT)、水深(WD)、透明度(SD)、浊度(Turb)、pH、电导率(Cond)、溶解氧(DO)、氨氮(NH4+-N)、总磷(TP)、总氮(TN)、硝氮(NO3--N)和叶绿素a(Chl-a),水样的采集和分析参照《地表水环境质量标准》(国家环境保护总局和国家质量监督检验检疫总局,2002)。
1.3 数据处理
1.3.1 后生浮游动物优势种 后生浮游动物优势种依据其优势度值(Y)确定:
Y = [niN] fi ①
式中:ni为第i种的个体总数;N为所有后生浮游动物总个数;fi为第i种出现的频率。Y>0.02的种类为优势种。
1.3.2 生物多样性指数 采用香农威纳Shannon-Wiener指数(H')、Margalef指数(D)和Pielou均匀度指数(J)对后生浮游动物进行多样性评价。
H' = -[i=1sniNlnniN] ②
D = [S-llnN] ③
J = [H'lnS] ④
其中:ni为第i种的个体总数;N为所有后生浮游动物总个数;S为样品中的物种种数。
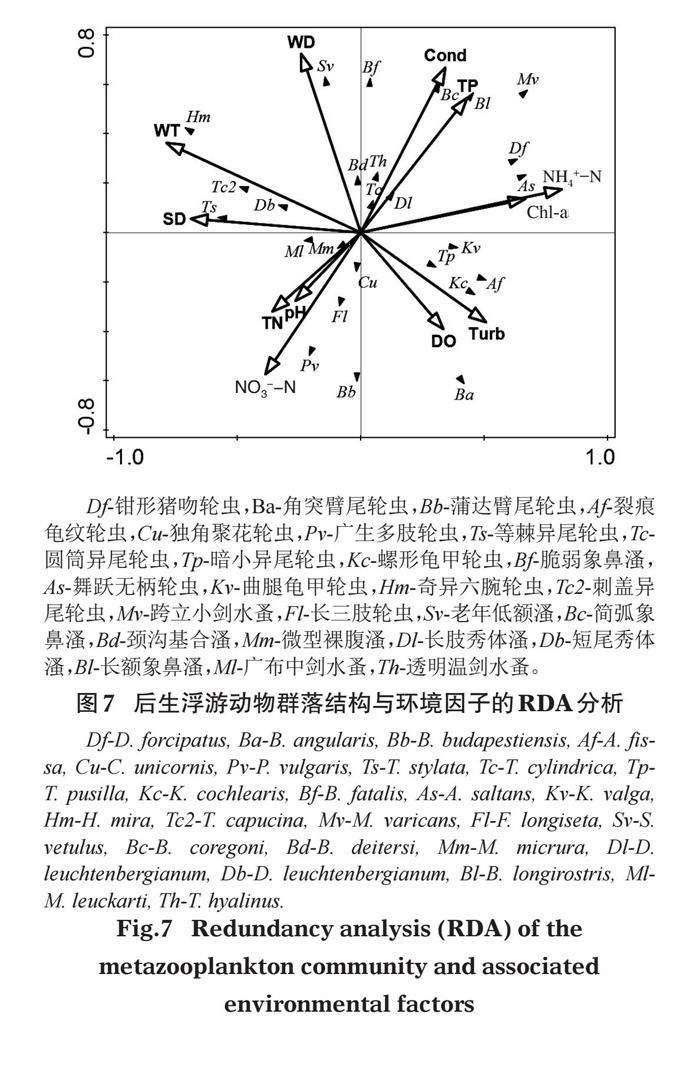
1.3.3 统计分析 使用SPSS 28.0软件对后生浮游动物密度、生物量与环境因子进行Pearson相关性分析、对不同洪水阶段的后生浮游动物密度、生物量、环境因子进行单因素方差分析。使用CANOCO for Windows 5.0软件对不同水文期浮游生物与环境因子进行排序分析,以4次调查中后生浮游动物主要优势种和环境因子作为变量,共选择26种后生浮游动物和12个环境因子进行分析,先进行去趋势对应分析(DCA),第一轴梯度长度为1.8,所以选用线性模型冗余分析(RDA)。
2 结果
2.1 环境因子
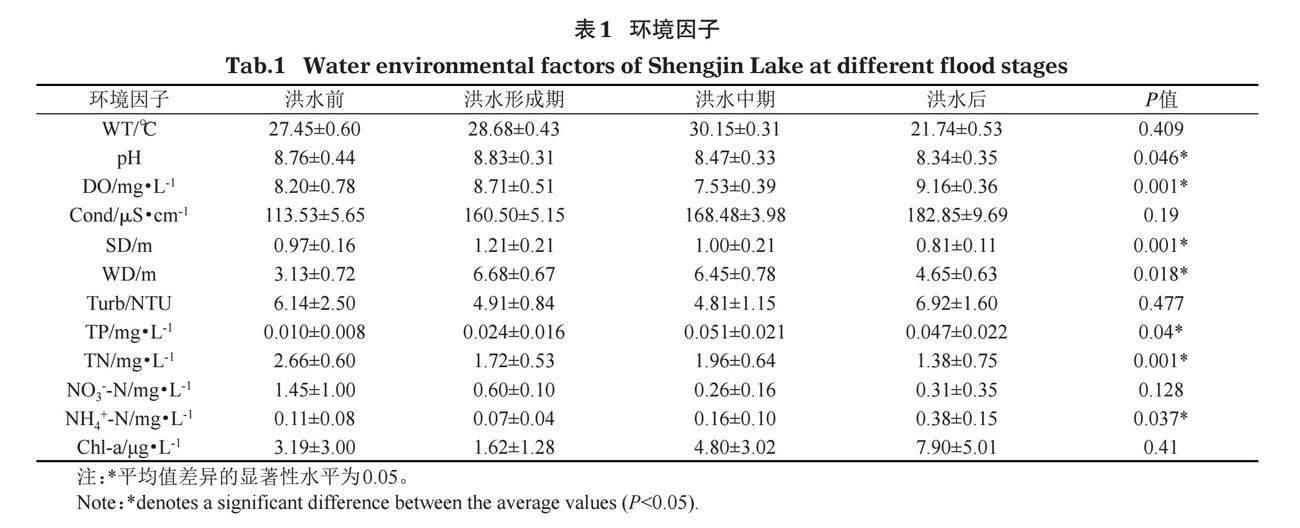
研究期间,升金湖最高水位17.01 m,最低水位12.24 m(图2)。水温20.80~30.90℃,pH值7.32~9.37,溶解氧5.15~9.71 mg/L,电导率101.10~199.80 [μ]S/cm,透明度0.55~1.80 m,水深1.90~7.90 m,浊度1.43~10.80 NTU,总磷浓度0.001~0.12 mg/L,总氮浓度0.38~4.42 mg/L,硝氮浓度0.06~3.41 mg/L,氨氮浓度0.11~0.65 mg/L,叶绿素a浓度0.03~19.85 μg/L(表1)。
单因素方差分析结果显示,溶解氧、透明度、水深、总磷浓度、总氮浓度、pH值、氨氮浓度在洪水不同阶段变化显著(P<0.05)。
2.2 后生浮游动物种类组成及优势种
洪水前检测到后生浮游动物3大类群80种,其中轮虫51种(63.8%),枝角类21种(26.2%),桡足类8种(10.0%)。轮虫优势种为暗小异尾轮虫(Trichocerca pusilla)、广生多肢轮虫(Polyarthra vulgaris)、圆筒异尾轮虫(T. cylindrica)、刺盖异尾轮虫(T. capucina)、角突臂尾轮虫(Brachionus angularis)、蒲达臂尾轮虫(B. budapestinensis)、螺形龟甲轮虫(Keratella cochlearis)、长三肢轮虫(Filinia longiseta)、裂痕龟纹轮虫(Anuraeopsis fissa)、独角聚花轮虫(Conochilus unicornis),桡足类优势种为广布中剑水蚤(Mesocyclops leuckarti),枝角类优势种为简弧象鼻溞(Bosmina coregoni)、颈沟基合溞(Bosminopsis deitersi)、微型裸腹溞(Moina micrura)、脆弱象鼻溞(B. fatalis)、长肢秀体溞(Diaphanosoma leuchtenbergianum)、短尾秀体溞(D. brachyurum)。洪水形成期检测到后生浮游动物3大类群62种,其中轮虫40种(64.5%),枝角类15种(24.2%),桡足类7种(11.3%)。轮虫优势种为暗小异尾轮虫、广生多肢轮虫、圆筒异尾轮虫、等棘异尾轮虫(T. similis)、蒲达臂尾轮虫(B. budapestinensis)、螺形龟甲轮虫、裂痕龟纹轮虫、奇异六腕轮虫(Hexarthra mira),桡足类优势种为广布中剑水蚤,枝角类优势种为简弧象鼻溞、颈沟基合溞、脆弱象鼻溞、短尾秀体溞。洪水中期检测到后生浮游动物3大类群65种,其中轮虫43种(66.2%),枝角类14种(21.5%),桡足类8种(12.3%)。轮虫优势种为钳形猪吻轮虫(Dicranophorus forcipatus)、暗小异尾轮虫、广生多肢轮虫、圆筒异尾轮虫、等棘异尾轮虫、刺盖异尾轮虫、曲腿龟甲轮虫(K. valga)、螺形龟甲轮虫、裂痕龟纹轮虫、舞跃无柄轮虫(Ascomorpha saltans)、奇异六腕轮虫、真翅多肢轮虫(P. euryptera),桡足类优势种为广布中剑水蚤、透明温剑水蚤(Thermocyclops hyalinus)、跨立小剑水蚤(Microcyclops varicans),枝角类优势种为老年低额溞(Simocephalus vetulus)、简弧象鼻溞、颈沟基合溞、脆弱象鼻溞、短尾秀体溞、长额象鼻溞(B. longirostris)。洪水后检测到后生浮游动物3大类群60种,其中轮虫37种(61.7%),枝角类16种(26.7%),桡足类7种(11.6%)。轮虫优势种为钳形猪吻轮虫、暗小异尾轮虫、广生多肢轮虫、圆筒异尾轮虫、角突臂尾轮虫、曲腿龟甲轮虫、蒲达臂尾轮虫、螺形龟甲轮虫、裂痕龟纹轮虫、舞跃无柄轮虫、真翅多肢轮虫,桡足类优势种为跨立小剑水蚤,枝角类优势种为简弧象鼻溞、颈沟基合溞、脆弱象鼻溞、长额象鼻溞(图3,表2)。各时期均有无节幼体存在。
2.3 后生浮游动物密度与生物量
洪水前后生浮游动物密度变化范围为652.10~5 375.80 个/L,平均值为(2 916.04±1 222.57) 个/L;洪水形成期后生浮游动物密度变化范围为725.70~4 266.40 个/L,平均值为(1 737.75±860.45) 个/L;洪水中期后生浮游动物密度变化范围为589.60~3 096.00 个/L,平均值为(1 670.92±614.38) 个/L;洪水后后生浮游动物密度变化范围为811.10~4 478.30 个/L,平均值为(2 356.10±909.56) 个/L。后生浮游动物密度在洪水前、洪水形成期、洪水中期逐渐下降,洪水后期上升,洪水前密度最高。轮虫密度在后生浮游动物密度占比呈下降趋势,桡足类呈上升趋势。通过方差分析,升金湖后生浮游动物密度在4个阶段差异极显著(F=8.301, P<0.01)(表3,图4)。
洪水前后生浮游动物生物量变化范围为2.30~37.28 mg/L,平均值为(10.32±8.45) mg/L;洪水形成期后生浮游动物生物量变化范围为0.49~22.15 mg/L,平均值为(5.32±5.51) mg/L;洪水中期后生浮游动物生物量变化范围为5.50~16.76 mg/L,平均值为(9.20±3.71) mg/L;洪水后后生浮游动物生物量变化范围为2.16~12.68 mg/L,平均值为(6.31±2.52) mg/L;轮虫生物量占后生浮游动物生物量的比例呈下降趋势。通过方差分析,升金湖后生浮游动物生物量在4个阶段无显著差异(P>0.05)(图5)。
2.4 升金湖不同洪水阶段后生浮游动物多样性指数
洪水前后生浮游动物香农威纳Shannon-Wiener多样性指数(H')为3.12~4.08,Margalef丰富度指数(D)值为3.74~6.17,Pielou均匀度指数(J)值为0.83~1.11。洪水形成期后生浮游动物Shannon-Wiener多样性指数(H')为2.37~3.67,Margalef丰富度指数(D)值为2.20~4.99,Pielou均匀度指数(J)值为0.83~1.06。洪水中期后生浮游动物Shannon-Wiener多样性指数(H')为3.60~4.51,Margalef丰富度指数(D)值为3.97~6.58,Pielou均匀度指数(J)值为1.03~1.21。洪水后后生浮游动物Shannon-Wiener多样性指数(H')为3.36~4.14,Margalef丰富度指数(D)值为3.81~5.86,Pielou均匀度指数(J)值为0.91~1.14(图6)。
后生浮游动物的多样性在洪水不同阶段呈现降低-升高-降低的趋势,其中洪水中期后生浮游动物多样性最高,洪水形成期最低。
2.5 环境因子对后生浮游动物群落结构的影响
如表4所示,升金湖后生浮游动物密度与水温、电导率呈显著负相关,与水深呈极显著负相关。升金湖后生浮游动物生物量与电导率呈显著负相关,与溶解氧、水深、浊度呈极显著负相关,与总氮浓度、硝氮浓度呈极显著正相关。
方差解释度为52.7%,排序轴1、2特征值分别为0.2185、0.1429。分析结果如图7所示,圆筒异尾轮虫、脆弱象鼻溞、老年低额溞、颈沟基合溞、透明温剑水蚤与电导率、总磷浓度、水深、水温呈正相关,与溶解氧、硝氮浓度、总氮浓度、pH值呈负相关;钳形猪吻轮虫、舞跃无柄轮虫、简弧象鼻溞、长肢秀体溞、长额象鼻溞、跨立小剑水蚤与水深、电导率、总磷浓度、叶绿素a、氨氮浓度、浊度呈正相关,与水温、透明度、pH值、总氮浓度、硝氮浓度呈负相关;曲腿龟甲轮虫、裂痕龟纹轮虫、螺形龟甲轮虫、暗小异尾轮虫、角突臂尾轮虫与叶绿素a、氨氮浓度、浊度、溶解氧、总磷浓度呈正相关,与水温、水深、透明度呈负相关;蒲达臂尾轮虫、独角聚花轮虫、广生多肢轮虫、长三肢轮虫与浊度、溶解氧、硝氮浓度、总氮浓度、pH值、透明度呈正相关,与水深、电导率、总磷浓度呈负相关;等棘异尾轮虫、刺盖异尾轮虫、奇异六腕轮虫、微型裸腹溞、短尾秀体溞、广布中剑水蚤与水深、水温、透明度、pH值、总氮浓度、硝氮浓度呈正相关,与电导率、总磷浓度、溶解氧、浊度、叶绿素a、氨氮浓度呈负相关。
3 讨论
3.1 升金湖后生浮游动物群落结构特征
在调查中,不同洪水阶段的后生浮游动物群落均以轮虫为主,这与国内已知江河、湖泊和水库浮游动物各类群的组成比例情况相似(林青等,2014;陈佳琪等,2020;付显婷等,2020;郭杰等,2020)。导致后生浮游动物群落结构如此的原因可能是:(1)一般轮虫个体小,且大多数个体具有龟甲,能够起到一定的保护作用,而且当水温达到20℃以上时,轮虫数量会出现峰值,而枝角类溞属的数量一般会处于低值(Schalau et al,2008)。(2)桡足类的体型较大,世代较长,因此繁殖速度比枝角类和轮虫慢。桡足类繁殖时间较长是因为必须进行有性繁殖,而轮虫和枝角类可通过周期性孤雌生殖繁殖(Gabaldon et al,2017)。轮虫的孤雌生殖方式,使其能在较短时间内大量繁殖,并且其适应能力强,在水生态系统中能够较快地占据优势(吴利等,2011a)。(3)鱼类的捕食也是影响浮游动物类群组成的原因之一,研究表明多数鱼类会优先捕食大型甲壳浮游动物,如枝角类等,这间接导致了轮虫数量较高(吴利等,2011b)。(4)浮游动物间的竞争和捕食关系也会对浮游动物群落结构产生影响,通常个体较大、竞争力较强的枝角类丰度较低时,轮虫类会占据优势(Vijverberg,2010)。生活在波动环境中的浮游动物物种的共同特征不仅是强大的定殖能力,还包括投资滞育卵的能力,因此无节幼体和桡足类幼体的密度迅速增加。这可能导致了轮虫密度、生物量占后生浮游动物密度、生物量的比例在洪水期间呈下降趋势,洪水后浮游动物密度回升。洪水期间,后生浮游动物的密度和生物量均低于洪水前,这可能是由于稀释效应所导致。一般情况下,浮游动物密度和生物量呈显著正相关,即密度越高,生物量也越高(陈亮等,2010)。在本研究中,洪水中期浮游动物密度较洪水形成期降低,生物量升高,这可能是由于洪水中期枝角类和桡足类占总密度的比例增加,枝角类和桡足类体型更大,个体生物量较轮虫大,整体生物量与密度的变化趋势相反。
水文变化是轮虫群落结构变化的主要影响因素(习丽红等,2015)。轮虫种类主要是广生性的,例如暗小异尾轮虫、螺形龟甲轮虫等。龟甲轮虫是轮虫分布最广泛的种类之一,它们的食性很广,有机碎屑、鞭毛虫和藻类都是螺形龟甲轮虫的食物来源(王庆等,2014)。本研究中,螺形龟甲轮虫为4个阶段的共同优势种,曲腿龟甲轮虫在洪水中期和洪水后成为优势种。胡艺等(2019)研究发现,降雨是引起等棘异尾轮虫、裂痕龟纹轮虫群落变化的主导因子。等棘异尾轮虫在洪水形成期和洪水中期成为优势种,这可能是受到降雨的影响。富营养型湖泊的指示种有臂尾轮虫、裂痕龟纹轮虫、圆筒异尾轮虫、暗小异尾轮虫、螺形龟甲轮虫、真翅多肢轮虫等,本研究中暗小异尾轮虫、圆筒异尾轮虫、螺形龟甲轮虫、裂痕龟纹轮虫在洪水期间成为优势种,真翅多肢轮虫在洪水中后期占据优势,这可能是由于洪水冲刷带入大量营养盐。已有不少研究表明象鼻溞喜爱富营养环境,且长额象鼻溞在指示湖泊富营养化中更敏感(De Kluijver et al, 2012)。本研究结果显示,长额象鼻溞在洪水中后期成为优势种。研究表明,流速快的水体中,轮虫和小型甲壳动物如微型裸腹溞、长额象鼻溞、无节幼体或桡足幼体等占优势,象鼻溞和剑水蚤在缓流水体和激流水体中均可占优势(刘宝贵等,2016)。这与本研究结果一致,象鼻溞和剑水蚤在洪水期间成为优势种。
3.2 不同洪水阶段环境因子对升金湖后生浮游动物群落结构的影响
水温是影响浮游动物生长发育、群落组成和数量变化等重要的环境因子之一,也是影响浮游动物时空分布的重要因素(杜明敏等,2013;杨亮杰等,2014)。水温不仅影响着浮游动物休眠卵的孵化以及生长和繁殖阶段,而且还影响着浮游动物的摄食效率(Holste & Peck,2006;汤长宽等,2021)。在食物充足的情况下,随着水温的升高,浮游动物的发育时间缩短,使浮游动物种群密度增加,进而影响浮游动物的群落结构。一般来说,浮游植物的光合作用是溶解氧的主要来源,水的扩散、混合和翻转过程会通过限制浮游植物的光合作用影响水中溶解氧的浓度。此前对长江相连湖泊的研究也证实,水下光穿透是影响浮游植物生长的关键因素(Liu et al,2017)。浮游植物的密度和生物量主要取决于温度、光渗透性和营养物质的可用性(?elik & Ongun,2008),高浊度可通过减少光渗透抑制浮游植物的生长。溶解氧、浊度、磷和氮也是影响浮游动物群落的关键因素。基于食物网结构,这些环境因素通常自下而上通过调节浮游植物生长来影响浮游动物(Vezi et al,2019)。本研究结果表明,溶解氧、浊度、硝氮浓度和总氮浓度与后生浮游动物生物量呈负相关,高浊度通过抑制浮游植物生长影响浮游动物的生物量,随着氮浓度升高,轮虫更喜欢高营养环境(沙婧婧等,2018),在群落中占据优势,浮游动物生物量降低。pH是调节浮游动物群落的关键因素,当水体pH值高于7时,轮虫通常是优势物种(庄德辉,1993)。
骤增的降雨会汇入流域土壤中丰富的营养盐,同时降雨带来的水位改变也会直接影响到水体透明度及叶绿素a浓度(温展明等,2017)。由于暴雨或支流流入,向水生生态系统输送更多沉积物和营养物质而导致的快速变化可能会影响浮游动物群落。雨季期间,长江洪水流入湖泊,造成极端水文干扰。水位上升过程通常会导致悬浮物浓度升高,这可能会影响生态系统的稳定性。沉积物悬浮,降低光照利用率和光合作用,并加速沉积物养分的释放,这可能进一步导致水生生物密度和生物量的变化。本研究结果显示,水深与浮游动物密度、生物量呈现负相关,降雨后密度和生物量都减少,主要是由于稀释效应,这一点得到了湖泊研究的广泛支持(Jones et al,2016;Cláudia et al,2021)。
参考文献
陈传曦,张建柏,王新萌,等,2021. 渤海莱州湾芙蓉岛人工鱼礁区浮游动物群落结构特征及其与环境因子的关系[J]. 中国水产科学,28(3):299-313.
陈佳琪,赵坤,曹玥,等,2020. 鄱阳湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报, 40(18):6644-6658.
陈亮,刘一,禹娜,等,2010. 分水江水库浮游动物群落结构的初步研究及水质评价[J]. 华东师范大学学报(自然科学版),(6):72-82.
陈受忠,1955. 淡水浮游生物的采集与计数方法[J]. 生物学通报,(6):52-55.
杜明敏,刘镇盛,王春生,等,2013. 中国近海浮游动物群落结构及季节变化[J]. 生态学报,33(17):5407-5418.
付显婷,杨薇,赵彦伟,等,2020. 白洋淀浮游动物群落结构与水环境因子的关系[J]. 农业环境科学学报,39(6):1271-1282.
国家环境保护总局,国家质量监督检验检疫总局,2002. 地表水环境质量标准: GB3838-2002[S].
郭杰,王珂,段辛斌,等,2020. 长江荆江段浮游生物群落结构特征及其与环境因子的关系[J]. 长江流域资源与环境,29(9):1954-1964.
胡艺,李秋华,何应,等,2020. 贵州高原水库浮游动物分布特征及影响因子:以阿哈水库为例[J]. 中国环境科学,40(1):227-236.
胡艺,李秋华,李钥,等,2019. 基于NMDS和RDA方法分析贵州百花水库后生浮游动物群落结构动态[J]. 环境科学研究,32(9):1510-1518.
贾艳艳,唐晓岚,唐芳林,等,2020. 基于人工景观格局变化的升金湖自然保护区空间近邻效应研究[J]. 山东农业大学学报(自然科学版),51(5):863-869.
蒋燮治,堵南山,1979. 中国动物志:节肢动物门:甲壳纲:淡水枝角类[M]. 北京:科学出版社.
林青,由文辉,徐凤洁,等,2014. 滴水湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报,34(23):6918-6929.
刘宝贵,刘霞,吴瑶,等,2016. 鄱阳湖浮游甲壳动物群落结构特征[J]. 生态学报,36(24):8205-8213.
沙婧婧,戴媛媛,潘玉龙,等,2018. 轮虫在生态毒理学中的研究进展[J]. 生态毒理学报,13(3):56-70.
沈韫芬,章宗涉,龚循矩,等,1990. 微型生物监测新技术[M]. 北京:中国建筑工业出版社.
汤长宽,杨宇峰,罗洪添,等,2021. 常德柳叶湖及其连通水体浮游甲壳动物群落结构与水环境特征[J]. 应用与环境生物学报,27(1):200-207.
王家楫,1961. 中国淡水轮虫志[M]. 北京:科学出版社.
王庆,侯磊,陈实,等,2014. 珠江口磨刀门轮虫群落结构特征与水质生态学评价[J]. 生态环境学报,23(5):824-833.
温展明,徐健荣,林秋奇,等,2017. 流溪河水库敞水区轮虫多样性与群落的动态特征[J]. 生态学报,37(4):1328-1338.
吴利,冯伟松,张堂林,等,2011a. 湖北省西凉湖浮游动物群落周年动态变化及其与环境因子的关系[J]. 湖泊科学,23(4):619-625.
吴利,冯伟松,张堂林,等,2011b. 春、秋季武湖浮游动物群落特征及其与环境因子的关系[J]. 水生态学杂志,32(2):31-37.
习丽红,李慧明,林秋奇,等,2015. 热带富营养水库敞水区浮游动物群落结构与季节变化:以广东大沙河水库为例[J]. 湖泊科学,27(6):1049-1058.
杨亮杰,吕光汉,竺俊全,等,2014. 横山水库浮游动物群落结构特征及水质评价[J]. 水生生物学报,38(4):720-728.
郑小燕,王丽卿,盖建军,等,2009. 淀山湖浮游动物的群落结构及动态[J]. 动物学杂志,44(5):78-85.
中国科学院动物研究所甲壳动物研究组,1979. 中国动物志:节肢动物门甲壳纲淡水桡足类[M]. 北京:科学出版社.
庄德辉,1993. 水质酸化和模拟酸雨对浮游动物影响的研究[J]. 应用生态学报,4(2):187-191.
?elik K, Ongun T, 2008. Spatial and temporal dynamics of the steady-state phytoplankton assemblages in a temperate shallow hypertrophic lake (Lake Manyas, Turkey)[J]. Limnology, 9(2): 115-123.
Cheng L, Xue B, Yao S, et al, 2020. Response of Cladocera fauna to environmental change based on sediments from Shengjin Lake, a Yangtze River-connected lake in China [J]. Quaternary International, 536(C): 52-59.
Cláudia G F, Miranda L T F, Costa B C, 2021. Response of the zooplankton community to extreme hydrological variations in a temporary lake in a neotropical floodplain system[J]. Limnologica, 86: 125834.
De Kluijver A, Yu J, Houtekamer M, et al, 2012. Cyanobacteria as a carbon source for zooplankton in eutrophic Lake Taihu, China, measured by13C labeling and fatty acid biomarkers[J]. Limnology and Oceanography, 57:1245-1254.
Donagh M, Casco M A, Claps M C, 2009. Plankton relationships under small water level fluctuations in a subtropical reservoir[J]. Aquatic Ecology, 43(2):371-381.
Gabaldon C, DeveTtter M, Hejzlar J, et al, 2017. Repeated flood disturbance enhances rotifer dominance and diversity in a zooplankton community of a small dammed mountain pond[J]. Journal of Limnology, 76(2): 292-304.
Geraldes A M, Boavida M J, 2007. Zooplankton assemblages in two reservoirs: one subjected to accentuated water level fluctuations, the other with more stable water levels[J]. Aquatic Ecology, 41(2):273-284.
Holste L, Peck M A, 2006. The effects of temperature and salinity on egg production and hatching success of Baltic Acartia tonsa (Copepoda: Calanoida): a laboratory investigation[J]. Marine Biology, 148(5): 1061-1070.
Jones M, Perissinotto R, Carrasco N K, et al, 2016. Impact of a flood event on the zooplankton of an estuarine lake[J]. Marine Biology Research, 12(2): 158-167.
Koste W, 1978. Rotatoria: Die R dertiere Mitteleuropas[M]. Berlin: Gebr der Borntraeger.
Liu X, Qian K, Chen Y, et al, 2017. A comparison of factors influencing the summer phytoplankton biomass in Chinas three largest freshwater lakes: Poyang, Dongting, and Taihu [J]. Hydrobiologia, 792(1): 283-302.
Pérez J R, Loureiro S, Menezes S, 2010. Assessment of water quality in the Alqueva Reservoir (Portugal) using bioassays[J]. Environmental Science and Pollution Research, 17(3): 688-702.
Schalau K, Rinke K, Straile D, et al, 2008. Temperature is the key factor explaining interannual variability of Daphnia development in spring: a modelling study[J]. Oecologia, 157(3): 531-543.
Vezi M, Downs C T, Wepener V, et al, 2019. Response of zooplankton communities to altered water quality and seasonal flow changes in selected river dominated estuaries in KwaZulu-Natal, South Africa[J]. Ecohydrology & Hydrobiology, 19(3): 393-406.
Vijverberg J, 2010. Effect of temperature in laboratory studies on development and growth of cladocera and copepoda from Tjeukemeer, the Netherlands[J]. Freshwater Biology, 10(4): 317-340.
(责任编辑 张俊友 熊美华)
Effects of Different Flood Stages on Metazooplankton
Community Structure in Shengjin Lake
CHEN Jing‐wen, ZHENG Xu‐dong, GUO Wen‐li, ZHOU Zhong‐ze
(School of Resources and Environmental Engineering, Anhui University, Hefei 230601, P. R. China)
Abstract: Shengjin Lake National Nature Reserve in Anhui Province is connected to Yangtze River. It is a typical freshwater lake-wetland system, but of international importance. In this study, we characterized the metazooplankton community structure in Shengjin Lake at the different flood stages dictated by Yangtze River flow, explored how the metazooplankton community was affected and identified the primary influencing environment factors. The aim of the study was to provide basic data and a theoretical reference for managing and researching the stabilization mechanism of lakes connected to Yangtze River. In 2020, metazooplankton and water quality were monitored at 24 sampling sites in Shengjin Lake during the four flood phases: In early July before flooding (Phase 1), late July as flooding began (Phase 2), middle August while flooded (Phase 3) and late September after flooding (Phase 4). During the study period, a total of 86 metazooplankton species belonging to 50 genera and 20 families were identified, including 55 rotifer species from 29 genera and 11 families, 23 cladoceran species from 13 genera and 5 families, and 8 copepod species from 8 genera and 4 families. The species number of identified rotifers, cladocerans and copepods were, respectively: 51, 21 and 8 in Phase 1; 40, 15 and 7 in Phase 2; 43, 14 and 8 in Phase 3; 37, 16 and 7 for Phase 4. The dominant species of rotifers common to all four stages were Trichocerca pusilla, Polyarthra vulgaris, Trichocerca cylindrica, Keratella cochlearis, Anuraeopsis fissa, the common dominant species of cladocerans were Bosmina coregoni, Bosminopsis deitersi and Bosmina fatalis, and there were no dominant copepod species common to all periods. Variance analysis shows that metazooplankton density varied significantly among the four flood stages (F=8.301, P<0.01). The average density and biomass of metazooplankton were (2 170.20 ± 506.74) ind/L and (7.79 ± 2.04) mg/L, with the peak values both occurring in Phase 1, the lowest density in Phase 3 and the lowest biomass in Phase 2. The ranges of Shannon-Wiener diversity, Margalef richness and Pielou evenness indices of metazooplankton community were 2.37-4.50, 2.19-6.50 and 0.83-1.21, respectively. Pearson correlation analysis showed that the metazooplankton density was significantly negatively correlated with conductivity and water depth, while biomass was significantly negatively correlated with dissolved oxygen, conductivity, water depth and turbidity, and significantly positively correlated with total nitrogen and nitrate nitrogen. In summary, this study revealed the effects of different flow stages on metazooplankton in lakes connected to the Yangtze River. Flooding changed the species composition and dominant species of metazooplankton, and significantly affected their density and diversity.
Key words: metazooplankton; community structure; environmental factors; flood; Shengjin Lake