一株耐盐Cr(Ⅵ)还原菌的分离鉴定和还原特性研究
2023-04-29杨晓宇靳宝林王熙宁白林含
杨晓宇 靳宝林 王熙宁 白林含
为解决高无机盐废水中的铬(Chromium,Cr)的六价铬Cr(Ⅵ)污染问题,从高盐环境中分离得到一株Cr(Ⅵ)还原菌,命名为KL01,经分子鉴定为墓画大洋芽孢杆菌(Oceanobacillus picturae),通过对KL01的生理特征分析发现其为一株中度嗜盐菌.以SEM、TEM结合能谱对Cr(Ⅵ)胁迫下的菌体进行了检测,发现KL01对Cr仅有少量的胞内吸附,无胞外吸附,且高浓度的Cr(Ⅵ)可使菌体长度增加.通过KL01在不同环境条件还原Cr(Ⅵ)能力的影响研究,发现其在有氧条件下,30 ℃,pH 7.5,NaCl浓度6%时,具有较好的还原Cr(Ⅵ)的效果;当Cr(Ⅵ)浓度为20 mg/L时,对其的还原率可达96%以上.这表明KL01对高盐环境中的Cr(Ⅵ)具有良好的去除效果,可用于处理高盐含Cr(Ⅵ)废水.
铬污染; 高盐环境; 墓画大洋芽孢杆菌; 生物还原
Q93A2023.016004
收稿日期: 2022-05-05
基金项目: 成都市科技项目(2021-YF05-01171-SN); 国家重点研发计划(2018YFC1802605)
作者简介: 杨晓宇(1997-), 女, 四川绵阳人, 硕士研究生, 研究方向为资源微生物. E-mail: 2019222040084@stu.scu.edu.cn
通讯作者: 白林含. E-mail: bailinhan@scu.edu.cn
Isolation, identification and reduction characteristics of a salt-tolerant Cr(Ⅵ) reducing strain
YANG Xiao-Yu, JIN Bao-Lin, WANG Xi-Ning, BAI Lin-Han
(Key Laboratory of Bio-Resources and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610064, China)
In order to solve the problem of hexavalent chromium Cr(Ⅵ) pollution in high inorganic salt wastewater, a strain of Cr(Ⅵ) reducing bacteria, named KL01, was isolated from the hypersaline environment and molecularly identified as Oceanobacillus picturae. The physiological characteristics of KL01 revealed that it is a moderately halophilic strain. The cells under Cr(Ⅵ) stress were examined by SEM and TEM combined with EDS, and it was found that KL01 showed only a small amount of intracellular adsorption of chromium, but no extracellular adsorption and the high concentration of Cr(Ⅵ) caused an increase in the length of the bacteria. Single-factor experiments were conducted to investigate the ability of different environmental conditions on the reduction of Cr(Ⅵ) by KL01. It was found that KL01 had a better Cr(Ⅵ) reduction effect under aerobic conditions, 30 ℃, pH 7.5 and 6% NaCl concentration, and the reduction rate for 20 mg/L Cr(Ⅵ) was above 96%. It was shown that KL01 has a good removal effect on Cr(Ⅵ) in hypersaline environment and can be used for the treatment of Cr(Ⅵ) in the hypersaline wastewater.
Chromium contamination; Hypersaline environment; Oceanobacillus picturae; Bioreduction
1 引 言
自工业化以来,重金属的污染一直持续影响着水体与土地,其中包括《污水综合排放标准》[1]中规定的第一类污染物——铬.铬常被用于工业生产中,如电镀厂[2],化工厂[3]和采矿厂[4]等,不当的排放则会导致铬污染.自然界中,铬离子的主要存在形式为六价铬(Cr(Ⅵ))和三价铬(Cr(Ⅲ)).Cr(Ⅲ)作为一种哺乳动物代谢所需的微量元素,具有一定毒性,但低浓度时不呈现,毒性仅为Cr(Ⅵ)的百分之一[5].且Cr(Ⅲ)化合物可被土壤吸附,形成溶解度极低的沉淀.相反,Cr(Ⅵ)因其极强的水溶性随废水排放或经土壤渗透进入地表水,影响到河流及沿岸的生态,甚至通过食物链进入人体.Cr(Ⅵ)可破坏生物体的生化代谢,引起氧化和非氧化形式的DNA损伤[5],引起突变.对人体还可诱发皮肤溃疡、肾衰竭甚至癌症等.工业上处理含Cr(Ⅵ)废水常用的物理及化学方法如吸附法[8]、絮凝沉淀法[9]和电化学法[10]等,具有运行成本高、再生工艺复杂及二次污染等不足.
使用微生物来去除Cr(Ⅵ)为含Cr(Ⅵ)废水的处理提供了一种低成本且环境友好的方法.但由于许多工业废水中含盐量较高,大部分除Cr(Ⅵ)菌在高盐环境下能力受限[11, 12],包括近年来分离出的多株能够除Cr(Ⅵ)的细菌,如希瓦氏菌(Shewanella oneidensis)[13]、铜绿假单胞杆菌(Pseudomonas aeruginosa)[14]和无色杆菌(Achromobacter)[15]等,均不能耐受高盐浓度,在处理时必须增加除盐工序,提高成本.因此,挖掘更多能在高盐环境中除Cr(Ⅵ)的细菌具有重要的意义.
本研究从高无机盐环境中分离得到一株Cr(Ⅵ)还原菌KL01,对其进行了分子生物学鉴定,研究了该菌对Cr(Ⅵ)的耐受及还原特性,为微生物治理无机高盐含Cr(Ⅵ)废水提供了理论依据及实体资源.
2 材料与方法
2.1 实验材料
2.1.1 菌株来源 实验室保存的一株耐盐菌KL01.
2.1.2 培养基 使用6% NaCl LB培养基,成分为蛋白胨10 g,酵母浸提粉5 g,NaCl 60 g,蒸馏水定容至1000 mL.调pH至7.0,固体培养基含1.5%琼脂.121 ℃高压蒸汽灭菌20 min.NaCl量及pH需根据实验所需盐浓度和pH微调.
2.2 实验方法
2.2.1 菌落形态观察 接种KL01菌株至含盐的固体LB培养基30 ℃培养2 d后,观察并记录菌落形态.
2.2.2 扫描电镜(SEM)观察 将KL01在含盐液体LB培养基中培养后,离心,取沉淀进行洗涤,经戊二醛固定、磷酸缓冲液漂洗、乙醇梯度脱水、临界点干燥及喷镀后,上机观察.
2.2.3 透射电镜(TEM)观察 将KL01在含盐液体LB培养基中培养后,离心,取沉淀使用戊二醛固定、丙酮逐级脱水、Epon812环氧树脂渗透、包埋、超薄切片及醋酸铀和枸橼酸铅染色后,上机观察.
2.2.4 16S rDNA鉴定 接种KL01菌株至含盐LB液体培养基中培养,以煮沸法提取DNA,使用16S rDNA通用引物:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′,PCR扩增该菌株的16S rDNA序列.将扩增产物送至擎科生物科技有限公司测序,并将结果在NCBI进行上blast比对,使用邻接法构建系统发育树.
2.2.5 KL01的最适生长条件和生长曲线 按1∶100接种KL01菌株至梯度pH、梯度盐浓度的LB培养基中,在不同温度条件下震荡培养2 d,平行3个样本.每12 h取样一次,使用酶标仪测定OD600 nm.按KL01的最适生长条件对其进行培养,每2 h取样使用酶标仪测定OD600 nm,绘制KL01的生长曲线.
2.2.6 KL01的耐盐能力 按1∶100接种KL01菌株至NaCl浓度梯度的LB培养基中,在最适生长温度下培养48 h,使用分光光度计测定OD600 nm值,检测菌株是否生长.
2.2.7 KL01的耐Cr(Ⅵ)能力 Cr(Ⅵ)以K2Cr2O7的形式提前配制成1 g/L Cr(Ⅵ)标准贮藏液,使用时稀释至10 mg/L.按1∶100接种KL01菌株培养基中,再加入Cr(Ⅵ)至梯度终浓度,于2.2.5所得的最适生长条件下培养24 h,使用分光光度计测定OD600 nm值,检测Cr(Ⅵ)对KL01的最小抑制浓度(MIC).
2.2.8 Cr(Ⅵ)胁迫后KL01的SEM -EDS检测 将KL01在含不同浓度的Cr(Ⅵ)培养基中在最适生长条件培养48 h后,制样方法同2.2.2,上机进行扫描电镜-X射线能谱(SEM-EDS)检测.
2.2.9 Cr(Ⅵ)胁迫后KL01的TEM-EDS Mapping检测 将KL01在含175 mg/L Cr(Ⅵ)培养基中在最适生长条件培养48 h后,制样方法同2.2.3,上机进行TEM-EDS Mapping检测.
2.2.10 KL01的驯化培养 将KL01菌株接种入初始浓度为100 mg/L Cr(Ⅵ)的含盐培养基中,每日加入Cr(Ⅵ)标液及新鲜培养基,逐步浓度增加至350 mg/L,驯化培养15 d.
2.2.11 KL01的除Cr(Ⅵ)能力 按1∶100接种KL01菌株培养基中,再加入Cr(Ⅵ)至终浓度为20、40、60、80和100 mg/L,于最适生长条件下培养48 h,体系中Cr(Ⅵ)的浓度按国标GB/T 7467-1987[16]中的二苯碳酰二肼法测定,计算Cr(Ⅵ)去除率.Cr(Ⅵ)去除率=(Cr(Ⅵ)初始浓度-测得的剩余Cr(Ⅵ)浓度)/ Cr(Ⅵ)初始浓度 × 100%.
2.2.12 温度对KL01去除Cr(Ⅵ)的影响 将KL01按1∶100接种入含20 mg/L Cr(Ⅵ)的最适生长条件下的培养基中,每个梯度设置3个重复,于25、30和35 ℃的温度下培养48 h,测定体系中Cr(Ⅵ)浓度,计算去除率.
2.2.13 pH对KL01去除Cr(Ⅵ)的影响 将KL01按1∶100接种入含20 mg/L Cr(Ⅵ)的,pH为6.5~9.0培养基中,每个梯度设置3个重复,于最适生长条件下培养48 h,测定体系中Cr(Ⅵ)浓度,计算去除率.
2.2.14 盐浓度对KL01去除Cr(Ⅵ)的影响 将KL01按1∶100接种入含20 mg/L Cr(Ⅵ)的,盐浓度为4%~14%培养基中,每个梯度设置3个重复,于最适生长条件下培养48 h,测定体系中Cr(Ⅵ)浓度,计算去除率.
3 结果与分析
3.1 形态特征
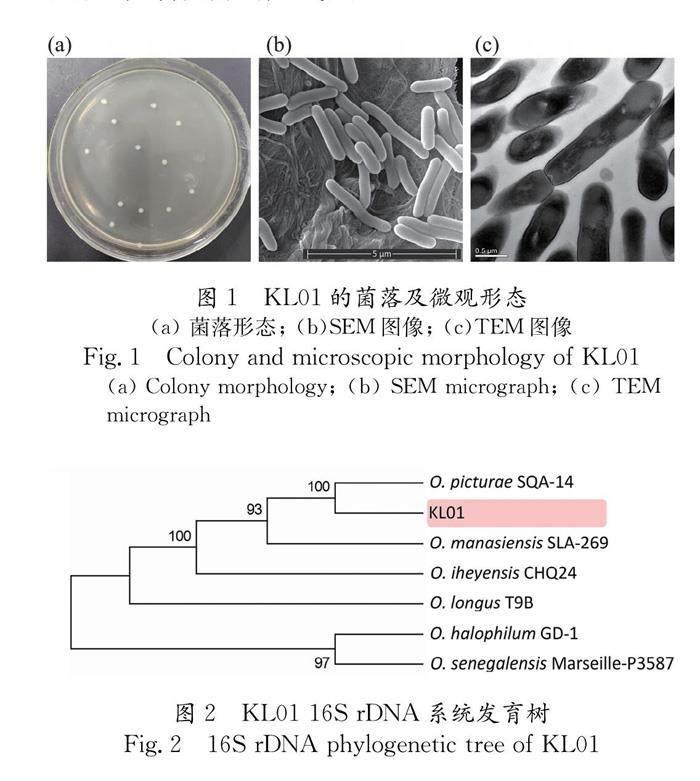
KL01菌落(图1a)在固体培养基上呈奶白色,圆形,直径约2 μm,边缘波纹状不整齐.由SEM观察到,菌体平均长度约为2.4 μm,表面光滑,呈杆状(图1b).由TEM观察到菌体质壁清晰分明,胞质较均匀(图1c).
3.2 分子鉴定结果
KL01的16S rDNA序列经NCBI网站BLAST工具比对后,使用ClustalW进行多序列比对,采用邻接法(Neighbor-Joining法)构建系统发育树(图2).可见KL01与Oceanobacillus picturae SQA-14(序列登录号:MT110647.1)在同一分支中,相似性为99.93%,鉴定为墓画大洋芽孢杆菌(Oceanobacillus picturae).其所属的大洋杆菌属(Oceanobacillus)曾被发现存在于韩国传统发酵食品辣酱中,芽孢杆菌可能产生抗生素抑制酵母菌的生长,控制发酵的产气量[17].
3.3 KL01的最适生长条件及生长曲线
KL01在不同温度、pH及盐浓度下的生长情况如图3a~3c所示.KL01在35 ℃和37 ℃下初始生长速度较快,但会快速进入衰退期.而在25 ℃下KL01虽能保持较长的生长期,但生长速度缓慢,故KL01的最适生长温度为30 ℃.KL01在pH为7.0时的生长状态最好,但在6.5 ~ 9.0的环境中都能生存.KL01在盐浓度过高(8%)或过低(0%~3%)时生长菌受到一定的抑制,而在4%~7%的盐浓度下的生长情况差异不大,在6%盐浓度时的生长状态最好,属于中度嗜盐菌.综上,KL01的最适生长条件为30 ℃,pH 7.0,盐浓度6%.
将KL01在最适生长条件下培养后,测定OD600 nm值并绘制了KL01的生长曲线,见图3 d.KL01菌株生长的前8 h为延迟期,8 h时进入对数生长期,14 h时为菌株生长最活跃的时期,至20 h时进入稳定期.
3.4 KL01的抗逆性分析
3.4.1 KL01的耐盐性 在高盐浓度下,KL01的生长情况如图4a所示.KL01在6%~16%的盐浓度下可以生长,但在14%盐浓度下的生长已受到强烈抑制,在18%盐浓度下则完全被抑制.
3.4.2 KL01的耐Cr(Ⅵ)能力 KL01在不同浓度的Cr(Ⅵ)下的生长情况如图4b所示,随Cr(Ⅵ)浓度增加,OD600 nm值逐渐降低,表明Cr(Ⅵ)抑制了细菌的生长.KL01在200 mg/L Cr(Ⅵ)浓度下OD600 nm为0.37,仍可生长,但在225 mg/L Cr(Ⅵ)下培养后OD600 nm为0.15(<0.2),说明已严重抑制了细菌的生长,继续提升浓度至250 mg/L后,KL01的生长几乎完全被抑制,即Cr(Ⅵ)对中度嗜盐菌KL01的MIC为225 mg/L.
3.5 Cr(Ⅵ)胁迫后KL01的SEM-EDS检测
受Cr(Ⅵ)胁迫后的KL01菌体的SEM显微图见图5,在扫描电镜观察区域中随机选择3个区域,每个区域随机选择5个统计菌体长度.发现在100 mg/L Cr(Ⅵ)下,少部分菌体长度达到5 μm;在125 mg/L Cr(Ⅵ)下,菌体长度普遍在3~5 μm;在175 mg/L Cr(Ⅵ)下,菌体的平均长度甚至可以达到5~7 μm.相较于胁迫前的菌体,在含Cr(Ⅵ)环境下生长的菌体长度明显变长.但KL01菌体表面始终保持光滑,未见吸附有块状物.结合EDS分析(图6),无论KL01在20 mg/L还是100 mg/L Cr(Ⅵ)下,菌体表面的铬原子百分比均小于0.05(表1),说明KL01表面不吸附Cr(Ⅵ).
3.6 Cr(Ⅵ)胁迫后KL01的TEM - EDS Mapping检测
在175 mg/L的Cr(Ⅵ)环境下培养后,对KL01进行了TEM观察及TEM-EDS Mapping检测.TEM观察图像见图7,高Cr(Ⅵ)胁迫后KL01部分菌体破裂,内容物流出.完整菌体内部胞质部分可见清晰黑点,分布较均匀,经TEM-EDS Mapping后据Cliff Lorimer进行定量分析,发现菌体内部含有少量铬(表2),据Mapping图像(图8)可见这些铬均匀分布于胞质中,未在胞壁或质膜上集中分布.
3.7 KL01去除Cr(Ⅵ)能力
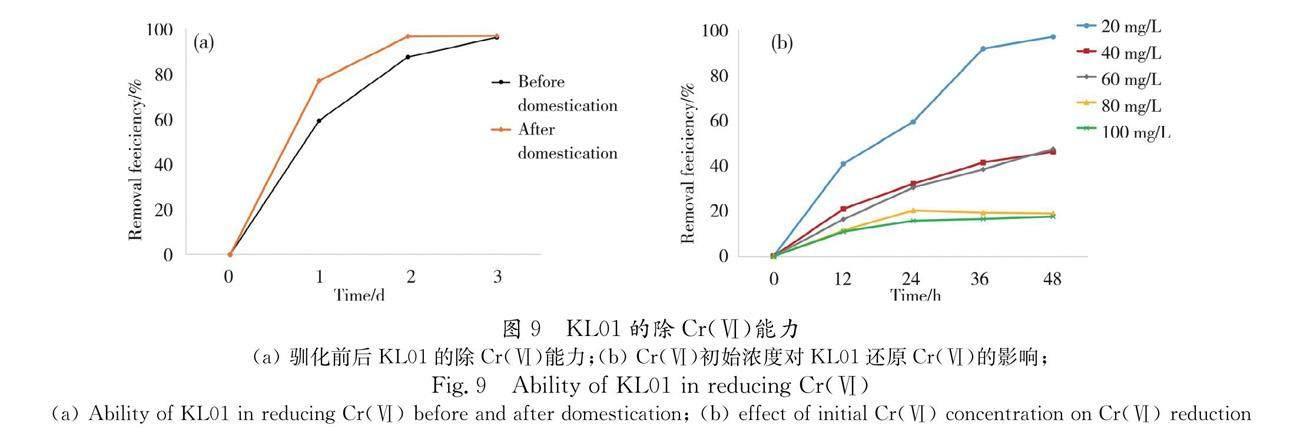
KL在驯化前后的除Cr(Ⅵ)能力如图所示图9a,在驯化前,KL01在2 d内对Cr(Ⅵ)的去除量为96.09%.经驯化后,KL01在2 d内对Cr(Ⅵ)的去除量为96.55%,除Cr(Ⅵ)效率有所提高.而KL01对于更高浓度的Cr(Ⅵ)时的处理效果并不理想,在40 mg/L时去除率仅有46%左右(图9b).
3.8 不同因素对KL01除Cr(Ⅵ)的影响
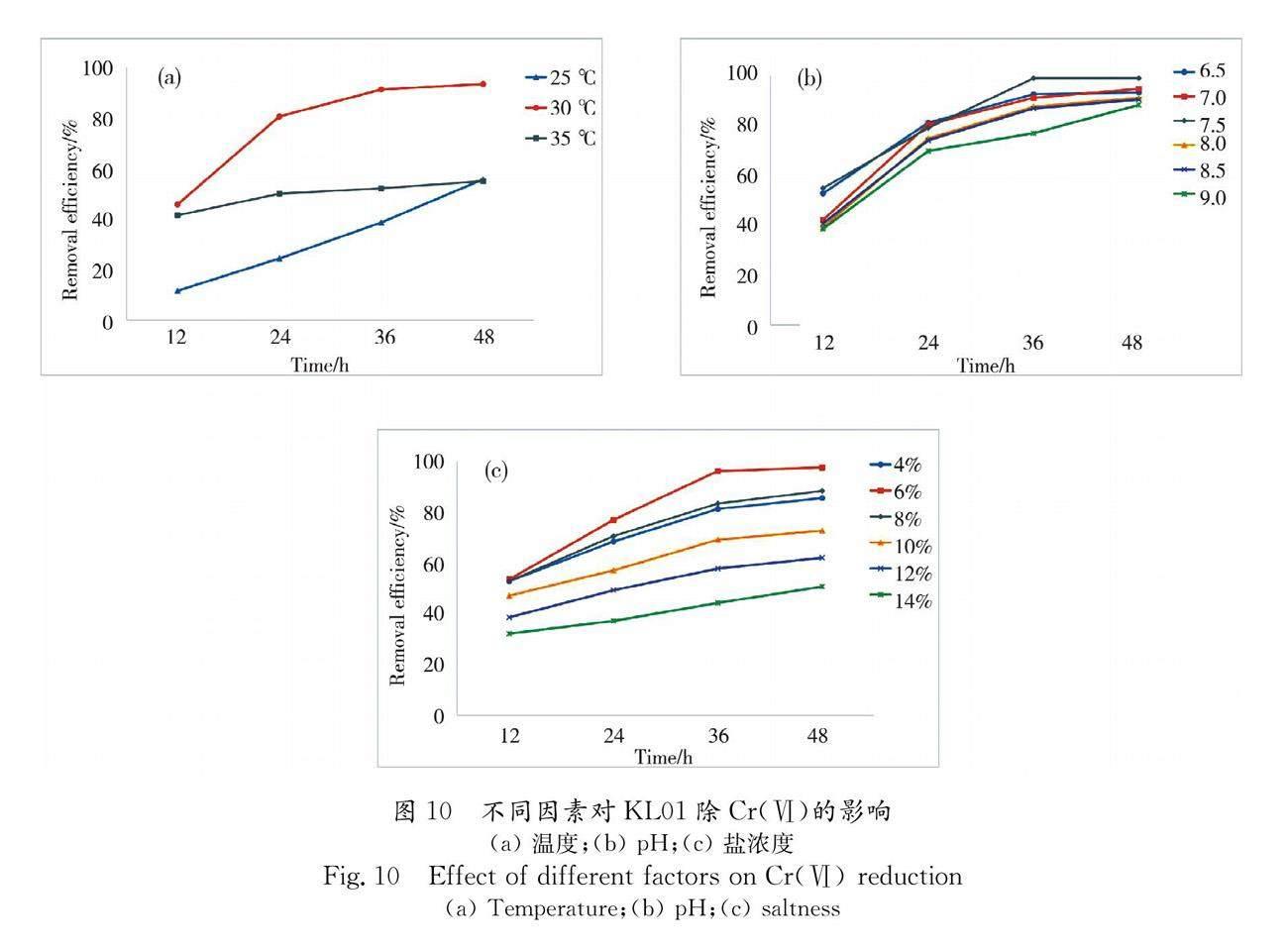
3.8.1 温度对KL01除Cr(Ⅵ)的影响 温度对KL01除Cr(Ⅵ)的影响如图10a,选择了与KL01最适生长温度30 ℃及附近的25 ℃和35 ℃进行实验.发现在30 ℃时KL01的除Cr(Ⅵ)效果最好,提高或降低培养温度至25 ℃和35 ℃时,KL01对Cr(Ⅵ)的去除效果均大幅降低.
3.8.2 pH对KL01除Cr(Ⅵ)的影响 如图10b所示,pH对于KL01除Cr(Ⅵ)的影响较小.在pH为7.5时除Cr(Ⅵ)效果最好,在pH小于等于7.0或大于等于8.0的情况下,KL01对Cr(Ⅵ)的去除效果稍差.在pH 9.0的环境下KL01对Cr(Ⅵ)的还原率仍可达88.28%,说明KL01具有在偏碱环境下除Cr(Ⅵ)的能力.
3.8.3 盐浓度对KL01除Cr(Ⅵ)的影响 以KL01能够生存的4%至14%的盐浓度设计了实验,盐浓度对于KL01还原Cr(Ⅵ)的影响见图10c.在KL01的最适生长盐浓度6%下,对Cr(Ⅵ)的去除效果最好,为97.51%.随体系内盐浓度增加,KL01的除Cr(Ⅵ)率逐渐降低,盐浓度在4%和8%时对Cr(Ⅵ)的去除率分别为85.44%和88.28%,说明KL01具有在高盐环境下仍然具有一定的除Cr(Ⅵ)的能力.但在更高的盐浓度下,KL01的除铬能力已低于80%,受到严重影响.
4 讨 论
本研究从实验室中分离到了一株耐盐Cr(Ⅵ)还原菌Oceanobacillus picturae KL01,其最高可耐受200 mg/L Cr(Ⅵ)和16%的盐浓度,具有良好的耐Cr(Ⅵ)及耐盐能力.驯化后的KL01能在48 h内其最适生长条件(6%盐浓度)下,对20 mg/L Cr(Ⅵ)的还原率在96%以上,能够在高NaCl浓度下的有氧环境中去除Cr(Ⅵ).使用SEM对KL01在高浓度Cr(Ⅵ)环境下胁迫后的菌体进行观察发现KL01菌体表面无块状吸附物,且菌体长度明显变长.在菌体长度增加这点上,与假单胞杆菌G1DM21(Pseudomonas sp.G1DM21)在Cr(Ⅵ)环境下培养后的观察到的变化一致[18],表现为阻滞细胞正常的生长周期,干扰了正常的细胞分裂[19],说明了高浓度Cr(Ⅵ)对于细胞的毒性.由SEM-EDS可检测到无论在高浓度还是低浓度的Cr(Ⅵ)环境下,KL01菌体表面均无铬的存在,不进行体外吸附.通过TEM观察了KL01胁迫后的内部情况,发现胞质部分可见均匀分布的黑点,经TEM-EDS Mapping进一步检测后确定为胞内吸附的少量铬.同时,还使用单因素法考察了不同环境因素对于KL01还原Cr(Ⅵ)的影响,发现其在30 ℃,pH 7.5,盐浓度6%时,具有较好的除Cr(Ⅵ)效果.温度对于其Cr(Ⅵ)还原能力影响较大,在25 ℃和35 ℃下的除Cr(Ⅵ)率较30℃时大幅降低.盐浓度在4%~8%时,KL01对Cr(Ⅵ)的去除率维持在85%以上,在高盐浓度下仍然能很好的去除体系中的Cr(Ⅵ).而这正好对应着目前很大一部分高盐含Cr(Ⅵ)废水的盐浓度[20, 21],体现了其应用在工业废水除Cr(Ⅵ)中的优势.pH对于KL01的Cr(Ⅵ)还原效果影响并无其他因素大,在pH 6.5~8.5下均有较好的效果,这意味着KL01在有氧条件下盐碱环境中也能很好地发挥其功能.
综上所述,本文分离得到了一株Cr(Ⅵ)还原菌KL01,对高无机盐及高Cr(Ⅵ)环境具有耐受性,能在有氧、高盐浓度、中性偏碱环境下对Cr(Ⅵ)进行还原,为微生物处理高盐含Cr(Ⅵ)废水的研究提供了理论依据.
参考文献:
[1] 北京市环境保护科学研究院. 污水综合排放标准: GB8978-1996[S]. 北京: 中国标准出版社, 1996: 24.
[2] 张诚, 陈远洪, 王庆森, 等. 连续电镀锡钝化六价铬废水的处理 [J]. 电镀与涂饰, 2020, 39: 875.
[3] 杨武, 郭琳, 陈明, 等. 某铬盐厂Cr(Ⅵ)污染土壤还原稳定化效果研究 [J]. 环境保护科学, 2018, 44: 114.
[4] Santos C, Rodriguez E. Review on some emerging endpoints of chromium (Ⅵ) and lead phytotoxicity [M]. Botany: National Reserch Council of Canada, 2012.
[5] Yao J, Lin T, Wang Y, et al. Microcalorimetric study the toxic effect of hexavalent chromium on microbial activity of Wuhan brown sandy soil: an in vitro approach [J]. Ecotox Environ Safe, 2008, 69: 289.
[6] Hessel E V S, Staal Y C M, Piersma A H, et al. Occupational exposure to hexavalent chromium. Part I. Hazard assessment of non-cancer health effects [J]. Regul Toxicol Pharm, 2021, 126: 105048.
[7] Yatera K, Morimoto Y, Ueno S, et al. Cancer risks of hexavalent chromium in the respiratory tract [J]. J Uoeh, 2018, 40: 157.
[8] Erabeea I K, Ahsan A, Imteaz M, Alomd M M. Adsorption of hexavalent chromium using activated carbon prepared from garden wastes [J]. Desalin Water Treat, 2019, 164: 293.
[9] Salimin Z, Satiyoaji F W, Prasetya D A, et al. Chemical treatment of liquid waste generated from leather tannery industry by using alum as coagulant material [J]. Mater Sci Forum, 2022, 991: 178.
[10] Peng H, Guo J. Removal of chromium from wastewater by membrane filtration, chemical precipitation, ion exchange, adsorption electrocoagulation, electrochemical reduction, electrodialysis, electrodeionization, photocatalysis and nanotechnology: a review [J]. Environ Chem Lett, 2020, 18: 2055.
[11] Ng K K, Shi X, Ong S L, et al. An innovative of aerobic bio-entrapped salt marsh sediment membrane reactor for the treatment of high-saline pharmaceutical wastewater [J]. Chem Eng J, 2016, 295: 317.
[12] Okeke B C, Laymon J, Crenshaw S, et al. Environmental and kinetic parameters for Cr(Ⅵ) bioreduction by a bacterial monoculture purified from Cr(Ⅵ)-resistant consortium [J]. Biol Trace Elem Res, 2008, 123: 229.
[13] Reardon C, Dohnalkova A, Nachimuthu P, et al. Role of outer-membrane cytochromes MtrC and OmcA in the biomineralization of ferrihydrite by Shewanella oneidensis MR-1 [J]. Geobiology, 2009, 8: 56.
[14] Noureddine N, Benhammadi S, Kara F, et al. Purification of contaminated water with chromium (Ⅵ) using Pseudomonas aeruginosa [J]. Key Eng Mat, 2017, 721: 143.
[15] Zhu W, Chai L, Ma Z, et al. Anaerobic reduction of hexavalent chromium by bacterial cells of Achromobacter sp. Strain Ch1 [J]. Microbiol Res, 2008, 163: 616.
[16] 北京市环保监测中心. 水质 六价铬的测定 二苯碳酰二肼分光光度法: GB/T 7467-1987[S]. 北京: 中国标准出版社, 1987: 8.
[17] Jang S J, Kim Y J, Park J M, et al. Analysis of microflora in gochujang, Korean traditional fermented food [J]. Food Sci Biotechnol, 2011, 20: 1435.
[18] Desai C, Jain K, Madamwar D. Hexavalent chromate reductase activity in cytosolic fractions of Pseudomonas sp. G1DM21 isolated from Cr(Ⅵ) contaminated industrial landfill [J]. Process Biochem, 2008, 43: 713.
[19] Chourey K, Thompson M R, Morrell-Falvey J, et al. Global molecular and morphological effects of 24-hour chromium(Ⅵ) exposure on Shewanella oneidensis MR-1 [J]. Appl Environ Microb, 2006, 72: 6331.
[20] Schoeman J J, Steyn A, Scurr P J. Treatment using reverse osmosis of an effluent from stainless steel manufacture [J]. Water Res, 1996, 30: 1979.
[21] 秦妮, 李健, 周振, 等. 铬盐废水零排放和资源化利用技术的工程应用研究 [J]. 化学工程与装备, 2020(5): 272.
